Застосування левоцетиризину при лікуванні алергічних захворювань у дітей
Підготувала д-р мед. наук Лариса Стрільчук
Епідеміологія алергічних захворювань загалом і в педіатричній практиці
Алергічні захворювання (АЗ) – це хронічні системні хвороби, спричинені розладами роботи імунної системи. Найпоширенішими АЗ є алергічний риніт (АР), алергічна астма, атопічний дерматит (АД), медикаментозна та харчова алергії. Всесвітня організація охорони здоров’я (ВООЗ) відносить АЗ до топ-3 хвороб, контролю яких слід досягти у ХХІ ст. (Wang J. et al., 2023).
Поширеність АЗ є дуже високою: лише на АД у світі страждають 171,17 млн осіб (Dong W.L. et al., 2021), а хоча б один випадок АД у житті переносить кожна п’ята людина (Weidinger S. et al., 2018). Загалом на одне чи більше АЗ страждає 8-10% населення світу (Loh W., Tang M.L., 2018). Слід зауважити, що АЗ є хворобами цивілізації, які частіше уражають мешканців міст, аніж сільської місцевості (Mazur M. et al., 2022). Враховуючи сучасну тенденцію до урбанізації, можна припустити подальше наростання поширеності АЗ.
У педіатрії спостерігається чіткий тренд до зростання кількості АЗ. Згідно з даними M. Mazur і співавт. (2022) алергічні симптоми відзначаються в 40% школярів Кракова, причому 45% із них не отримують жодного лікування. Аналіз великої бази даних (>2 млн пацієнтів) виявив, що найпоширенішими АЗ у дітей є ураження шкіри (38,9%), астма (34,8%) й АР (22,9% Алергічний кон’юнктивіт трапляється приблизно вдесятеро рідше (3,3%). Усі АЗ частіше уражали хлопців, аніж дівчат. Найпоширенішими АЗ у дітей віком від 1 до 4 років були астма та дерматити, а в дітей віком 4-7 років – АР і алергічний кон’юнктивіт (Qi Y. et al., 2021).
Патогенез і взаємозв’язки алергічних захворювань
Патогенез АЗ є складним і включає генетичні й епігенетичні чинники, вплив довкілля, мікросередовище й імунну функцію організму людини. АЗ притаманне часте рецидивування, що значно погіршує якість життя пацієнтів і супроводжується вагомим фінансовим тягарем (Wang J. et al., 2023). Симптоми АЗ (шкірні реакції, анафілаксію, риніт тощо) можуть спричиняти хімічні алергени (фарби, креми, парфуми, засоби для догляду за шкірою), харчові (горіхи, арахіс, яйця тощо) й аероалергени (кліщі домашнього пилу, спори, пилок) (Aldakheel F., 2021).
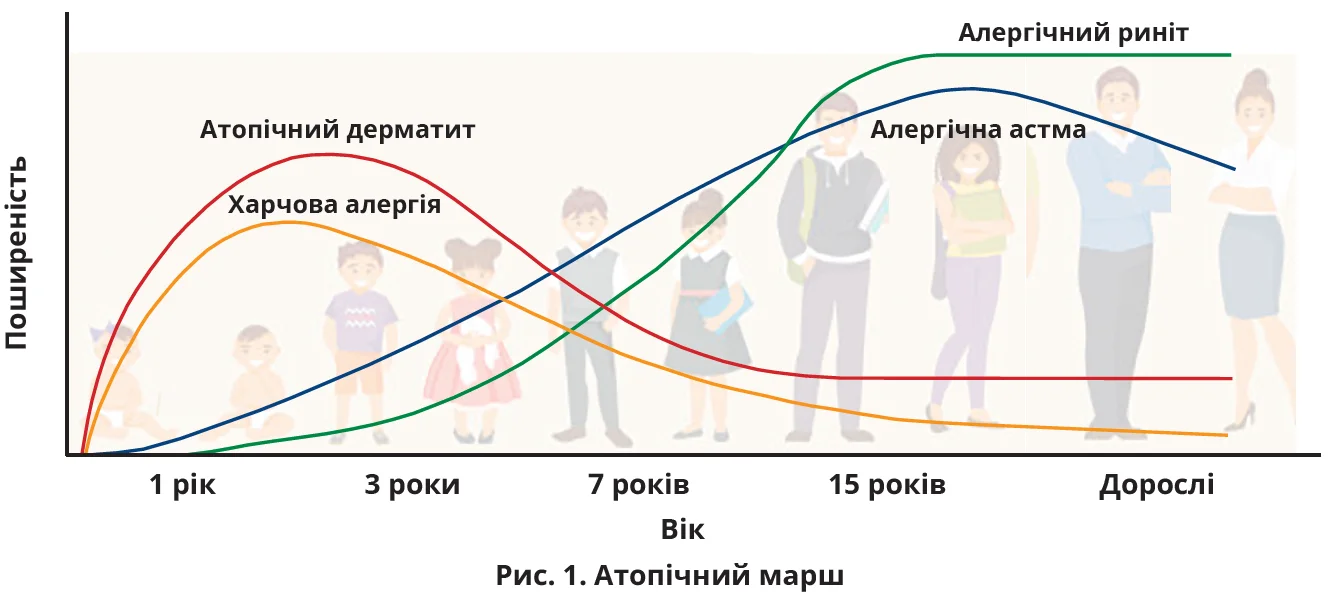
АЗ небезпечні не лише самі по собі, а і як складові так званого атопічного маршу – природної послідовності АЗ, які виникають у різних вікових групах. Зазвичай першим виникає АД, згодом – харчова алергія, ще пізніше – алергічна астма й АР (рис. 1) (Tsuge M. et al., 2021).
Місце гістаміноблокаторів у лікуванні алергічних захворювань
Провідним медіатором АЗ виступає гістамін – відомий біогенний амін, який виробляється низкою різних клітин організму, передусім опасистими клітинами, базофілами, ентерохромафіноподібними клітинами слизової оболонки шлунка та гістамінергічними нейронами. Гістамін опосередковує імунну й алергічну відповідь, запалення, а також секрецію соляної кислоти в шлунку, проліферацію клітин і загоєння ран, реалізовуючи свої ефекти через 4 типи рецепторів. Наразі H1-гістаміноблокатори (Н1ГБ) відіграють домінувальну роль у лікуванні АЗ. Н1ГБ є найефективнішими при гострих проявах алергічної реакції, риніті, кропив’янці та кон’юнктивіті (Tatarkiewicz J. et al., 2019).
Н1ГБ поділяють на І та ІІ покоління. До І покоління належать алімемазин, дифенгідрамін, клемастин, диметинден, прометазин, хлорфенірамін, гідроксизин, до ІІ – кетотифен, цетиризин, левоцетиризин, фексофенадин, лоратадин, дезлоратадин, ебастин, фексофенадин, рупатадин, біластин (Parisi G.F. et al., 2020).
Гістаміноблокатори І покоління: більше недоліків, аніж переваг
Препарати І покоління є ліпофільними й легко проникають крізь гематоенцефалічний бар’єр у центральну нервову систему, зв’язуючись із центральними рецепторами. Блокада Н1-рецепторів центральної нервової системи зумовлює седацію, сонливість, утомлюваність, підвищення апетиту, порушення циркадних ритмів сну, пригнічення когнітивних функцій (порушення пам’яті та процесів навчання) й може спричиняти агресивну поведінку та судомні напади. Н1ГБ І покоління також мають потенційну здатність спричиняти анти-α-адренергічні, антисеротонінергічні й антимускаринергічні побічні ефекти, в тому числі сухість у роті, світлобоязнь, мідріаз, тахікардію, закрепи, затримку сечі, збудження, сплутаність свідомості (Mandola A. et al., 2019). Седативний ефект Н1ГБ І покоління настільки потужний, що асоціюється з підвищенням травматизації на робочому місці, причому це підвищення є виразнішим, аніж після вживання заспокійливих снодійних або наркотичних засобів (Gilmore T.M. et al., 1996).
Перелічені недоліки Н1ГБ І покоління стали причиною суворого консенсусу проти їх використання в клінічній практиці, особливо в дітей, що знайшло відображення в останніх міжнародних настановах із лікування АЗ, як-от у рекомендаціях із лікування кропив’янки EAACI/GA2LEN/EuroGuiDerm/APAAACI (2021). Ці рекомендації вказують, що терапія кропив’янки передбачає щоденне застосування Н1ГБ II покоління, оскільки препаратам І покоління притаманні виразні антихолінергічний і седативний ефекти, взаємодія з іншими ліками (аналгетиками, снодійними та седативними засобами, антидепресантами) й негативний вплив на сон (фазу зі швидким рухом очей), здатність до навчання та працездатність. Несприятливі ефекти Н1ГБ особливо виражені при мультизадачній роботі та складній сенсомоторній діяльності, наприклад керуванні автомобілем. Повідомлено також про летальні наслідки при передозуванні Н1ГБ І покоління.
Ще одним вагомим недоліком Н1ГБ І покоління є коротка тривалість дії: до 6 годин (Farzam K. et al., 2023), що пояснюється коротким періодом напіврозпаду активної речовини та зумовлює потребу в частішому прийомі цих препаратів (Li L. et al., 2022), а це може мати негативний вплив на прихильність до лікування.
Позиційний документ Глобальної європейської мережі з питань астми й алергії (GA2LEN, 2010) чітко вказує, що Н1ГБ І покоління більше не мають використовуватися при алергії й у дорослих, й особливо в дітей. Цю позицію розділяють і спільні рекомендації ВООЗ та ініціативи ARIA (Алергічний риніт і його вплив на астму, 2008).
Гістаміноблокатори ІІ покоління: більша тривалість дії та відсутність седативного впливу
Н1ГБ ІІ покоління є гідрофільними, майже не проникають крізь гематоенцефалічний бар’єр і селективно зв’язуються виключно з периферичними рецепторами, що різко зменшує кількість побічних ефектів (Wise S.K. et al., 2023; Schaefer T.S. et al., 2023). Нові покоління антигістамінних засобів мають вищу селективність до Н1-рецепторів і, відповідно, їм притаманна менша кількість або повна відсутність холінергічних, адренергічних чи серотонінергічних побічних ефектів (Church M., 2011; Simons F., Akdis A., 2013).
Тривалість дії Н1ГБ ІІ покоління становить 12-24 години та перевищує показники препаратів І покоління у 2-4 рази (Farzam K. et al., 2023). Це робить застосування нових Н1ГБ зручнішим для пацієнта й, відповідно, покращує комплаєнс, а разом із тим і результати лікування.
Зазначені особливості Н1ГБ ІІ покоління сприяли тому, що при низці АЗ, як-от кропив’янка, вони фактично вважаються препаратами лікування І лінії (EAACI/GA2LEN/EuroGuiDerm/APAAACI, 2021). Проте серед препаратів ІІ покоління також існують помітні відмінності, які стосуються передусім особливостей їхньої фармакокінетики: швидкості дії, уявного об’єму розподілу та пов’язаної з ним присутності препарату біля Н1-гістамінових рецепторів, селективності щодо гістамінових рецепторів тощо.
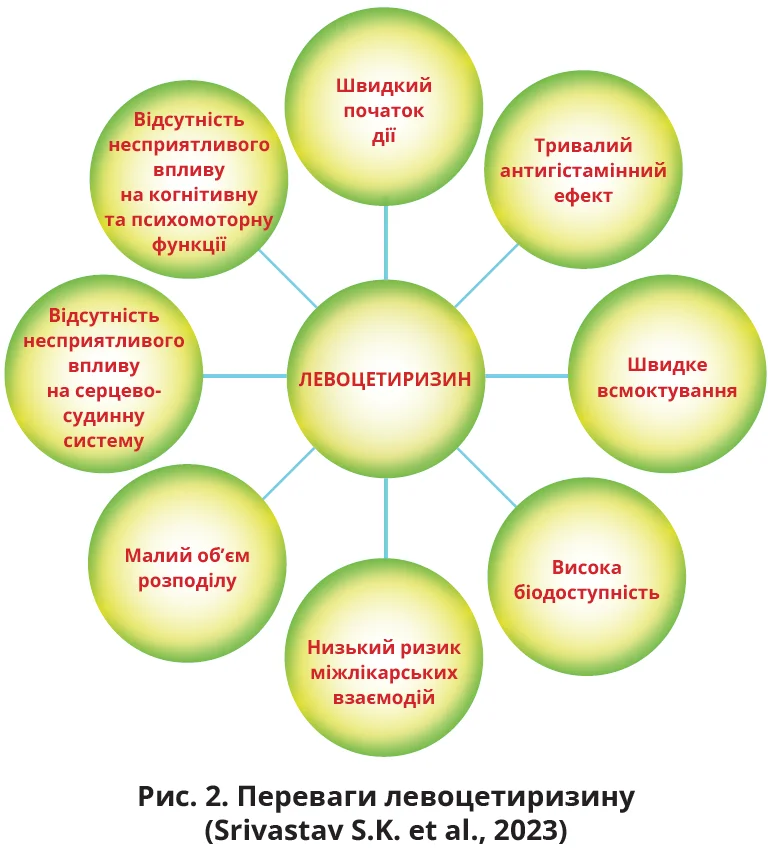
Фармакологічні особливості левоцетиризину: швидке всмоктування, висока біодоступність, низький ризик міжлікарських взаємодій
За переліченими вище критеріями позитивно виділяються такі Н1ГБ, як цетиризин і левоцетиризин. Варто зазначити, що фактично вони є препаратами-«близнюками», оскільки левоцетиризин являє собою активний R-енантіомер рацемічної суміші цетиризину, тому їхні фармакокінетичні показники майже не відрізняються. Наприклад, об’єм розподілу цетиризину становить 0,5 л/кг, левоцетиризину – 0,4 л/кг. Таке невелике значення цього показника є свідченням, що обидва препарати майже не потрапляють усередину клітин, залишаючись саме там, де присутні рецептори до гістаміну, а саме – зовні клітинних мембран.
Для порівняння: в біластину цей показник дорівнює 1,29 л/кг, фексофенадину – 11 л/кг, дезлоратадину – 49 л/кг, лоратадину – 119 л/кг (Карева Е.Н., 2016, Sadaba B., 2015).
Селективність щодо гістамінових рецепторів є важливим чинником, що впливає на ймовірність і ступінь виразності небажаних побічних реакцій, притаманних тому чи іншому Н1ГБ ІІ покоління. За цим показником цетиризин і левоцетиризин є найселективнішими: співвідношення ступеня їх зв’язування з гістаміновими рецепторами Н1 і мускариновими рецепторами М1 перевищує 25 000, тоді як у дезлоратадину воно становить лише 50, у лоратадину – 100 (Gillard M., 2003).
Початок дії в левоцетиризину відзначається на 12-й хвилині після прийому, а в цетиризину – на 20-й хвилині. Використовуючи інші Н1ГБ ІІ покоління, пацієнти мають довше чекати на полегшення симптомів алергії: в лоратадину та дезлоратадину воно відзначається через 30 хвилин, а в фексофенадину – лише через 60 хвилин після прийому (Карева Е.Н., 2016).
У дітей левоцетиризин швидко всмоктується та досягає максимальної концентрації в плазмі крові через 1,2 години. Період напіврозпаду препарату становить близько 5,7 години, а метаболізм його є мінімальним. Така фармакокінетика забезпечує левоцетиризину низький потенціал між лікарських взаємодій. Доказова база свідчить, що левоцетиризин є безпечним для дітей і добре ними переноситься. У Європі застосування цього препарату схвалено для дітей віком ≥2 роки (De Benedictis F.M. et al., 2008; Singh-Franco D. et al., 2009; Pampura A.N. et al., 2011).
Варто зазначити, що цетиризин і левоцетиризин не підлягають метаболізму в печінці та практично незміненими виводяться із сечею. На відміну від них більшість нових Н1ГБ активно метаболізуються системою цитохрому Р450, тому такі препарати, як кетоконазол, еритроміцин і азитроміцин, можуть спричиняти накопичення антигістамінних засобів, збільшуючи ризик розвитку побічних ефектів (Zhang M.Q., 1997; Holgate S. et al., 2003).
Розрахунки тривалості зв’язку левоцетиризину з Н1-рецепторами свідчать, що цей препарат швидко надходить до місця дії та довго там утримується. Левоцетиризину притаманна також відсутність несприятливого впливу на когнітивні та психомоторні функції (рис. 2; Walsh G.M. et al., 2008). Порівняння седативного потенціалу різних антигістамінних препаратів виявило, що левоцетиризину властива найменша виразність седативного ефекту порівняно з Н1ГБ І покоління та фексофенадином і дезлоратадином (McDonald K. et al., 2008). Дослідження in vitro й in vivo демонструють, що левоцетиризину притаманна також і протизапальна дія (Walsh G., 2009).
Левоцетиризин у клінічних дослідженнях і міжнародних рекомендаціях
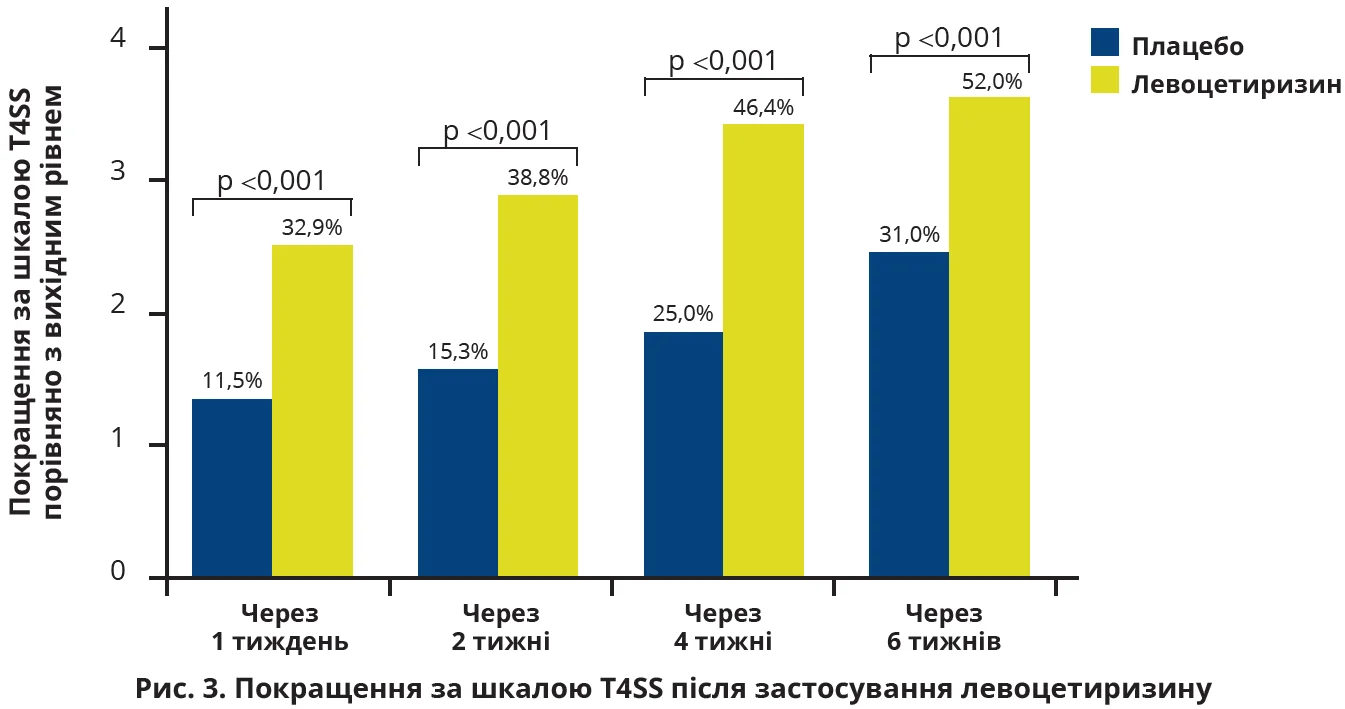
Відповідно до Міжнародного консенсусу з АР (ICAR, 2023) левоцетиризин може застосовуватися в лікуванні дітей від 6 місяців. У подвійному сліпому рандомізованому плацебо-контрольованому дослідженні J. de Blic і співавт. (2005) узяли участь 177 осіб із задокументованим сезонним АР, яким призначали 5 мг левоцетиризину або плацебо 1 раз на добу. Симптоми оцінювали в балах за шкалою чотирьох основних симптомів (T4SS; чхання, нежить, свербіж носа й очей). Уже через 2 тижні лікування левоцетиризин продемонстрував у 1,29 раза кращий показник за шкалою Т4SS, аніж плацебо, а відносне покращення на тлі прийому левоцетиризину перевищувало аналогічний параметр для плацебо майже вдвічі (на 94,1%; рис. 3).
Застосування левоцетиризину також покращувало якість життя дітей з АР. Кількість побічних ефектів достовірно не відрізнялася; жодна дитина групи левоцетиризину не покинула лікування у зв’язку з небажано реакцією.
Подібне дослідження було проведено і для дітей із цілорічним АР віком 6-12 років (n=306). Через 2 та через 4 тижні лікування в групі левоцетиризину фіксувалося зменшення показника T4SS порівняно з вихідним рівнем, яке мало достовірну перевагу над плацебо. Профіль безпеки досліджуваного препарату не відрізнявся від такого плацебо (Potter P.C. et al., 2005).
Рандомізоване подвійне сліпе плацебо-контрольоване дослідження ранньої профілактики астми в дітей з атопією (Early Prevention of Asthma in Atopic Children Study) включало 510 дітей з АД віком 12- 24 місяці, яких було рандомізовано в групи левоцетиризину (0,125 мг/кг) або плацебо. Препарати приймали 2 рази на добу протягом 18 місяців. За період лікування кропив’янка виникла у 27,5% дітей групи левоцетиризину й у 41,6% дітей групи плацебо (р<0,001). Середня кількість епізодів кропив’янки за цей період становила, відповідно, 0,71±0,11 та 1,71±0,25, а середня тривалість – 4,43±1,57 та 5,36±1,27 дня (обидва р<0,001). На думку авторів, кропив’янка є важливою складовою атопічного маршу, яка виникає на ранніх етапах життя, а левоцетиризин дає змогу ефективно лікувати кропив’янку та запобігати її розвитку (Simons F.E. et al., 2007).
У разі хронічної кропив’янки в дітей більшість наявних консенсусів категорично не рекомендують застосовувати Н1ГБ І покоління. За цього АЗ перевагу слід віддавати цетиризину, левоцетиризину, лоратадину, дезлоратадину та фексофенадину, які добре вивчені в дітей і мають установлені показники довгострокової безпеки в педіатричній популяції (Godse K. et al., 2018).
Порівняно з дезлоратадином левоцетиризин швидше всмоктується та досягає рівноважної концентрації в плазмі крові, а також меншою мірою метаболізується й має вищу селективність до рецепторів 1 типу. Метааналіз 8 досліджень, які безпосередньо порівнювали левоцетиризин і дезлоратадин, виявив, що левоцетиризин починав діяти швидше й давав більш прогнозований і стабільний ефект (Passalacqua G., Canonica G., 2005).
Висновки
В умовах погіршення стану екології та посилених процесів урбанізації поширеність АЗ залишається стабільно високою. Базисним методом лікування різнопланових АЗ виступають Н1ГБ, причому перевагу потрібно віддавати препаратам ІІ покоління, котрі не проходять крізь гематоенцефалічний бар’єр і не спричиняють седативного ефекту та сонливості. Серед Н1ГБ увагу привертає левоцетиризин, якому притаманні швидкий початок дії, присутність біля рецепторів до гістаміну, висока біодоступність, тривалий антигістамінний ефект, відсутність несприятливого впливу на когнітивну та психомоторну функції, низький потенціал міжлікарських взаємодій.