Відкриваючи нове обличчя хронічної кропив’янки: фокус на коагуляційний каскад і терапевтичний потенціал рупатадину
Підготувала канд. мед. наук Тетяна Можина
Хронічна кропив’янка (ХК) – одне з найпоширеніших дерматологічних захворювань, яке має дуже характерну клінічну картину через раптове виникнення сверблячих пухирців, що нагадують опіки від кропиви. Нині у світі відзначають значне поширення ХК з переважним ураженням жінок, дітей і підлітків [16]. В Україні 15-20% населення протягом життя стикаються з кропив’янкою, а близько 2% страждають на ХК [1]. Захворюваність на ХК в нашій країні є однією з найвищих у світі: 2317 випадків на 100 тисяч населення, що вказує на значне навантаження на систему охорони здоров’я [19]. Це означає, що сотні тисяч українців живуть із цим захворюванням, відчуваючи постійний свербіж, проблеми зі сном, зниження працездатності та психологічний дискомфорт.
Сучасні міжнародні настанови, зокрема рекомендації EAACI/GA2LEN/EDF/WAO (2018) [29], EAACI/GA2LEN/EuroGuiDerm/APAAACI (2022) [28] та Британської асоціації дерматологів (2021) [23], рекомендують використовувати чіткі алгоритми діагностики й терапії ХК. Вони передбачають послідовне застосування антигістамінних препаратів (АГП) II покоління та за потреби біологічних засобів [23, 28, 29]. Попри дотримання положень перелічених міжнародних рекомендацій, значній частині пацієнтів не вдається повністю позбавитися симптомів хвороби [9]. У 25-50% хворих на хронічну спонтанну кропив’янку (ХСК) збільшення дозування АГП у 4 рази не дає змоги досягти адекватного контролю над перебігом хвороби, особливо за умови тяжкого перебігу ХК, підвищення рівня D-димеру [8].
Ці дані розкривають нове обличчя ХК, вказуючи на те, що крім класичних IgE-опосередкованих механізмів значну роль у патогенезі хвороби відіграють порушення коагуляції/фібринолізу, які підтримують хронічне запалення та зумовлюють резистентність до стандартної терапії.
Новий погляд на патогенез ХК
Традиційно ХК розглядають як захворювання, патогенез якого опосередкований IgE та дегрануляцією тучних клітин, формуванням автоантитіл і синтезом прозапальних цитокінів. Останнім часом активно обговорюється інша ланка патогенезу ХК, пов’язана з порушенням коагуляції й фібринолізу [8]. Особливе місце в цій теорії займають D-димер, фактор VIIa та фрагмент протромбіну F1+2 (рис. 1).
Згідно із сучасною теорією виникнення ХСК погляд на перший етап розвитку хвороби залишається незмінним. Під впливом автоалергенів (інтерлейкіну-24 (ІЛ-24), тиреопероксидази, тканинного фактора) тучні клітини вивільняють гістамін та інші ефекторні молекули. Далі відбувається активація еозинофілів, після чого вони вивільняють основний білок еозинофілів та експресують тканинний фактор, який, своєю чергою, активує каскад зсідання крові (фактори VII, X, VIII, V і протромбін), що призводить до утворення тромбіну. Фактор VIIa являє собою активовану форму фактора VII, який запускає зовнішній шлях зсідання, а його підвищення свідчить про передчасний запуск коагуляційного каскаду. Утворення тромбіну демонструється наявністю фрагмента протромбіну F1+2, який є центральним ферментом зсідання крові. Тромбін, своєю чергою, додатково індукує дегрануляцію тучних клітин, а також підвищує проникність судин. Нарешті, деградація фібрину супроводжується підвищенням умісту D-димеру – продукту розпаду фібрину, котрий відображає активацію тромбоутворення та наступного фібринолізу.
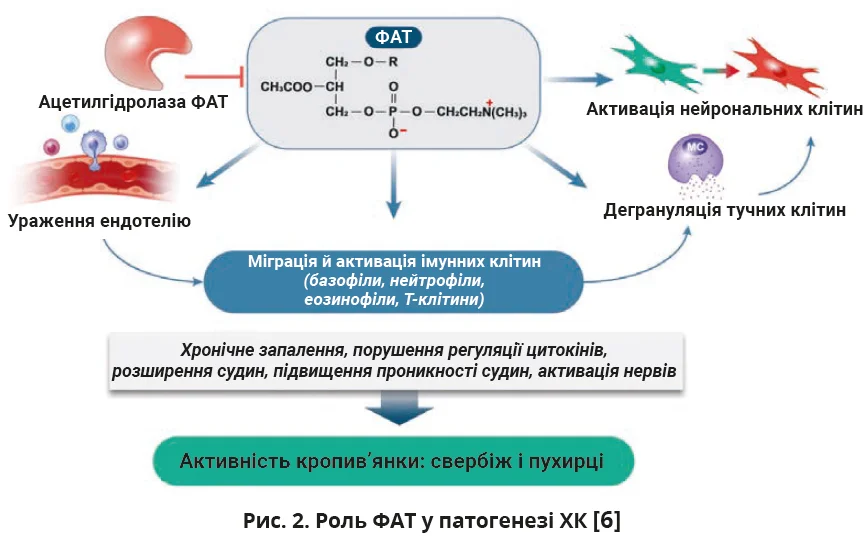
Крім цього, важливу роль у патогенезі відіграє фактор, що активує тромбоцити (ФАТ). Він індукує дегрануляцію тучних клітин, сприяє вивільненню гістаміну й інших прозапальних медіаторів, тобто посилює такі клінічні прояви ХК, як свербіж, набряк і висипання (рис. 2).
ФАТ активує не тільки імунні клітини, але і тромбоцити й ендотеліальні клітини, що призводить до активації коагуляційної системи. Таким чином ФАТ спричиняє підвищення рівня D-димеру та створює умови для розвитку ендотеліальної дисфункції [6]. Ендотеліальна дисфункція при ХК здатна посилювати клінічні прояви та впливати на перебіг хвороби: підвищена проникність судин зумовлює набряк шкіри та слизових оболонок, а активація коагуляційного каскаду підтримує хронічне запалення й може створювати умови для мікросудинних тромбозів [22]. Перелічені ефекти формують патологічний базис для хронізації запального процесу та розвитку стійких клінічних проявів ХК [6].
Лабораторні та прогностичні аспекти активації коагуляції/фібринолізу при ХК
Активація системи коагуляції та фібринолізу на тлі ХК є не лише особливістю патогенезу, вона має вагомі клінічні наслідки. Ще 2015 року доведено, що перебіг ХК асоціюється з підвищенням умісту D-димеру, фактора VIIa та фрагмента протромбіну F1+2, причому рівень зростання їх концентрацій корелює з тяжкістю хвороби [26]. В іншому дослідженні також відзначили тісний зв’язок між активністю запального процесу й активацією коагуляції/фібринолізу, що проявлялося одночасним підвищенням С-реактивного білка, ІЛ-6 і D-димеру [12]. Сучасні узагальнювальні огляди, які охоплюють десятки досліджень, не лише підтвердили ці ранні знахідки, але й довели їх системність і вагоме клінічне значення. Зокрема, в роботі Н. Qin і співавт., заснованій на огляді 71 клінічного дослідження, доведено, що підвищення рівнів D-димеру та фрагмента протромбіну F1+2 є найчастішими й найвідтворюванішими лабораторними змінами, які корелюють із клінічною активністю ХК [21]. Метааналіз, виконаний цією групою дослідників, продемонстрував, що зведена середня різниця значень D-димеру становила 628 нг/мл (95% довірчий інтервал (ДІ) 437,67-819,08 нг/мл), причому більш ніж у половини випадків (≈56%) його значення перевищували 500 нг/мл.
Ба більше, показано, що рівень D-димеру знижується на тлі ефективної терапії АГП, тоді як у хворих, які не відповідають на призначення цих засобів, уміст D-димеру залишається високим (0,30 проти 0,60 мг/л відповідно; р<0,001) [4]. До схожого висновку дійшли інші дослідники: досягнення повної ремісії ХК супроводжується достовірним зниженням рівнів D-димеру та фактора VIIa [11]. Отримані факти дали науковцям змогу стверджувати, що активність процесів коагуляції свідчить про тяжкість перебігу ХК.
Нині, зважаючи на накопичені дані доказової медицини, провідні експерти-алергологи пропонують розглядати D-димер як перспективний біомаркер активності та тяжкості перебігу ХК, а також застосовувати його як прогностичний показник ефективності терапії [21].
Не менше клінічне значення має підвищення рівня ФАТ: доведено, що його високий уміст не тільки корелює з тяжкістю ХК, але й навіть зумовлює виникнення резистентності до деяких АГП [25]. Причому рівень ФАТ ≥5000 пг/мл визнано вірогідним предиктором поганої відповіді на лікування АГП (відношення шансів 1,409; p<0,001) [25].
Клінічні спроби подолання наслідків активації коагуляції/фібринолізу при ХК
Безперечно, отримання переконливих доказів порушення коагуляції/фібринолізу на тлі ХК призвело до практичних спроб вплинути на цю патогенетичну ланку хвороби. Лікарі обговорюють доцільність і можливість призначення антикоагулянтів/антиагрегантів хворим на ХК для нормалізації гемостазу та зменшення активації тромбоцитів відповідно, очікуючи покращення перебігу хвороби. Справді, в деяких дослідженнях продемонстровано потенційну ефективність антикоагулянтів у полегшенні симптомів кропив’янки, особливо в пацієнтів з тяжкою ХК/ХСК, які не відповідають на стандартну терапію АГП або омалізумабом [2, 18]. Отримано повідомлення про позитивний вплив ад’ювантної терапії з використанням варфарину [18], гепарину [2], дипіридамолу [20] та транексамової кислоти [10] на стан хворих з різними формами кропив’янки, включно з ХК, ХСК й індукованою прийманням нестероїдних протизапальних препаратів [3]. Разом з тим в інших дослідженнях наводяться приклади, що застосування антикоагулянтів у хворих на тяжку ХК, резистентну до омалізумабу, не вплинуло на вміст D-димеру та не дало змоги досягти вагомого клінічного ефекту [5].
Оскільки антикоагулянти мають обмежений потенціал у сучасній терапії ХК, особливий інтерес викликають препарати, що впливають на інші ключові ланки патогенезу, зокрема блокування ФАТ [6]. Цей напрям розглядають як перспективну стратегію покращення ефективності лікування ХК, особливо в пацієнтів з тяжким перебігом хвороби, підвищенням рівня D-димеру, а також в осіб, які не відповідають на стандартну терапію АГП [6].
Терапевтичний потенціал блокування ФАТ у разі ХК: фокус на рупатадин
Одним з перспективних методів лікування ХК вважають застосування засобів, які здатні блокувати ФАТ. Цього ефекту можна досягти за допомогою рупатадину – сучасного неседативного АГП, який, окрім антагоністичної дії на H1-рецептори, здатний впливати на рецептори ФАТ [17, 24]. Дослідження Munoz-Cano та співавт. довело, що рупатадин інгібує ФАТ-індуковану дегрануляцію тучних клітин у концентраціях 1-10 μM; це підтверджує його прямий вплив на ФАТ-опосередковані процеси [17]. Така особливість робить рупатадин унікальним АГП, оскільки він впливає одночасно на два ключові механізми розвитку ХК: традиційну H1-залежну дегрануляцію тучних клітин і ФАТ-опосередковану активацію тромбоцитів та ендотелію. Вважають, що призначення рупатадину не лише зменшує дегрануляцію тучних клітин, інгібує вивільнення гістаміну, але й, імовірно, опосередковано сприяє зниженню рівня D-димеру та корекції ендотеліальної дисфункції [15, 17].
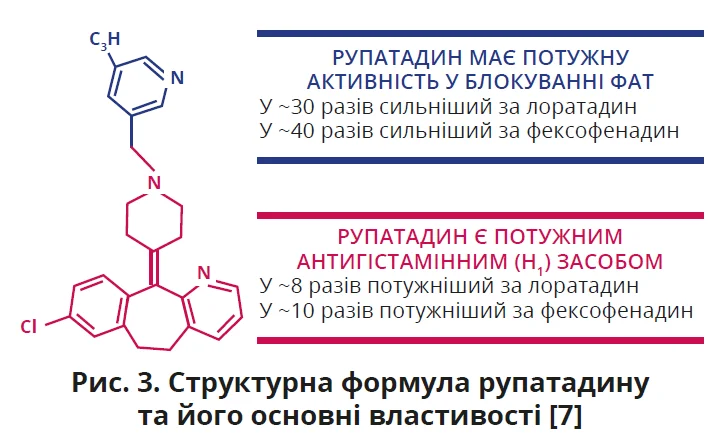
Клінічні дослідження підтвердили ефективність рупатадину в зниженні активності хвороби та маркерів коагуляційної активації. Зокрема, одноразове приймання 40 мг рупатадину зменшувало ФАТ-індуковані загострення ХК на 87%, а також інгібувало агрегацію тромбоцитів на 82% протягом 2 годин [24]. У пацієнтів з ХК, які приймали рупатадин протягом 4-12 тижнів, відзначали зменшення клінічної активності хвороби та зниження рівня D-димеру, що розцінили як пригнічення небажаної активації коагуляційної системи й вірогідне покращення функції ендотеліоцитів [8]. Слід підкреслити, що рупатадин має надзвичайно високий потенціал інгібування ФАТ- і Н1-рецепторів порівняно з іншими АГП (рис. 3). Його здатність блокувати активність ФАТ у 30-40 разів перевищує таку лоратадину та фексофенадину відповідно [7].
Призначення рупатадину при ХК має додаткові клінічні переваги. По-перше, завдяки добрій переносимості та мінімальній седативній активності сучасні рекомендації передбачають застосування рупатадину у високих добових дозах, що дає змогу контролювати симптоми хвороби навіть у пацієнтів з резистентними формами ХК [17, 24]. Наприклад, японські дослідники продемонстрували ефективність і безпеку тривалого приймання високих доз (20 мг/добу) рупатадину. Хворим на ХСК рекомендували приймати рупатадин протягом 52 тижнів. Тривала терапія рупатадином добре переносилася, сприяла стійкому зменшенню свербежу та покращенню якості життя пацієнтів, не супроводжувалася виникненням серйозних побічних дій [13]. Метааналіз 13 рандомізованих контрольованих досліджень підтвердив, що застосування високих доз неседативних АГП II покоління, в тому числі рупатадину, дає змогу досягти більш значущого клінічного ефекту порівняно зі стандартними дозами (відносний ризик 1,13; 95% ДІ 1,02-1,26; р=0,02) [27]. Безпеку й ефективність високих доз рупатадину підтверджують інші метааналізи [14].
Іншим важливим аспектом є відповідність призначення рупатадину сучасним міжнародним настановам з лікування ХК [23]. Сучасні рекомендації EAACI/GA2LEN/EDF/WAO [28, 29] й інші наукові документи підтверджують використання АГП II покоління як терапії першої лінії та передбачають можливість підвищення дози в разі недостатньої відповіді [8, 15]. У нещодавньому огляді, в якому обговорюються підстави для застосування рупатадину поза показаннями, тобто використання високих доз препарату, наведено цікаві дані [15]. Підкреслюється, що використання високих доз рупатадину може бути обґрунтованим у пацієнтів з підвищеним рівнем D-димеру, котрий указує на активацію коагуляційно-фібринолітичної системи, а також у тих хворих, які мають ознаки підвищеної активності ФАТ або демонструють резистентність до інших АГП. У таких ситуаціях рупатадин не тільки пригнічує гістамінозалежні прояви ХК, але й знижує інтенсивність ФАТ-опосередкованого запалення, асоційованого з тяжчим перебігом і недостатньою відповіддю на класичну терапію [15].
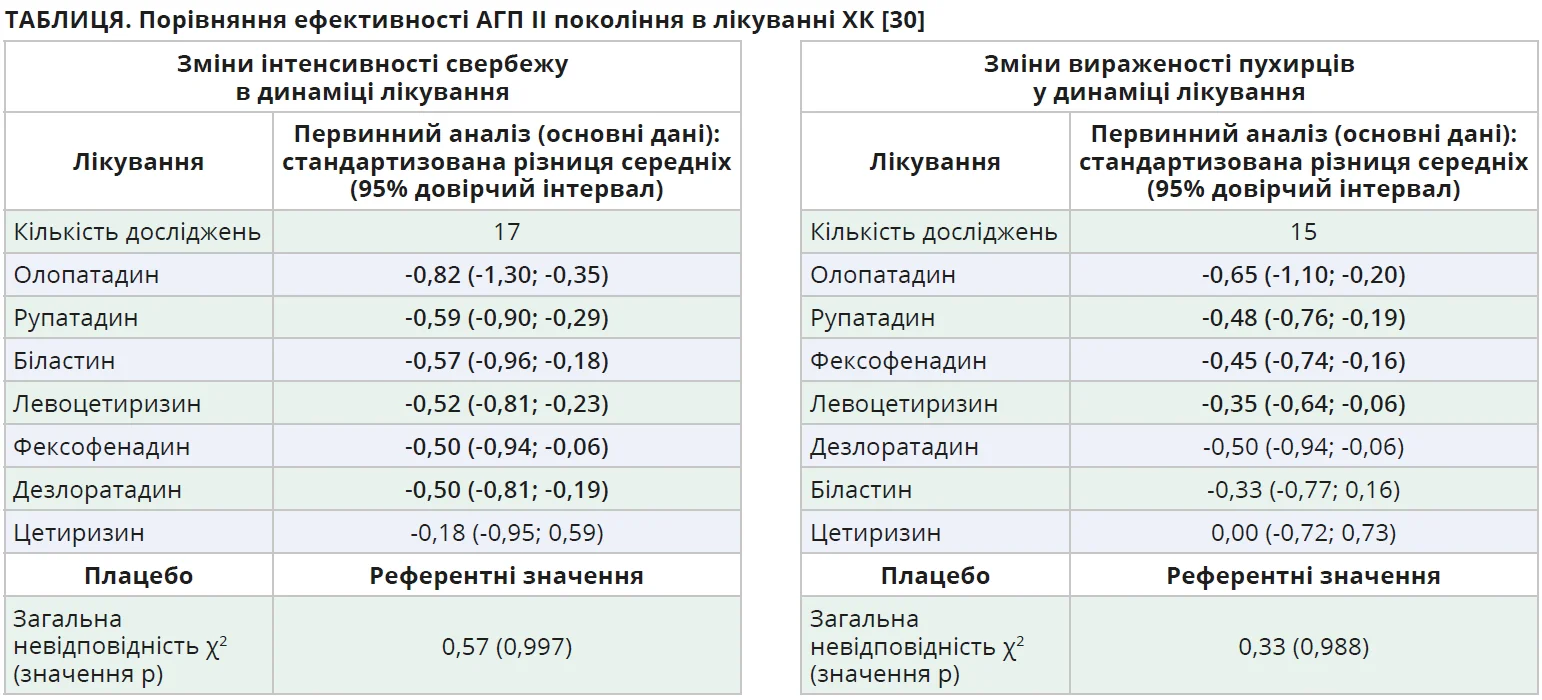
Клінічну значущість подвійного механізму дії рупатадину розкривають результати великого мережевого метааналізу, заснованого на даних 22 рандомізованих контрольованих досліджень, які проведені за участю 3943 хворих на ХСК [30]. У цьому метааналізі порівнювали ефективність ліцензованих доз різноманітних АГП II покоління для контролю двох основних симптомів ХК: свербежу та пухирців. Найвищу результативність продемонстрував олопатадин. Водночас його клінічне використання значно обмежене, адже цей препарат зареєстрований виключно в Японії та недоступний у країнах Європейського Союзу й Україні. Другу позицію в рейтингу впевнено посів рупатадин (табл.). Він довів свою здатність достовірно зменшувати свербіж (-0,59; 95% ДІ від -0,90 до -0,29) і кількість пухирців (-0,48; 95% ДІ від -0,76 до -0,19). Серед АГП II покоління, реально доступних на вітчизняному ринку, саме рупатадин визнано найпотужнішим засобом для купіювання провідних симптомів ХК. Автори метааналізу підкреслили клінічно значущі факти: ефективність цетиризину в зменшенні свербежу та кількості пухирців не відрізняється від такої плацебо, а здатність біластину нівелювати пухирці виявилася найнижчою серед усіх сучасних АГП II покоління [30].
Висновки
Сучасні дослідження відкривають нове обличчя ХК: поряд із класичною IgE-опосередкованою дегрануляцією тучних клітин значущу роль у прогресуванні хвороби відіграють активація коагуляційного каскаду та ФАТ, які підтримують хронічне запалення й ендотеліальну дисфункцію. Підвищені рівні D-димеру та ФАТ корелюють, відповідно, з тяжкістю перебігу ХК і резистентністю до АГП.
Рупатадин, сучасний неседативний АГП II покоління, здатний одночасно блокувати H1– і ФАТ-рецептори, посередковано знижувати D-димер і зменшувати ендотеліальну дисфункцію. Клінічні дослідження демонструють його ефективність у зменшенні активності та полегшенні симптомів ХК, що пов’язано з додатковим інгібуванням ФАТ-опосередкованого запалення. Призначення високих доз рупатадину є безпечним і відповідає положенням сучасних настанов, які передбачають підвищення добової дози АГП у разі недостатньої відповіді на стандартне дозування.
В Україні рупатадин представлено під торговою назвою Рупафін. Цьому препарату властиві всі клінічно значущі властивості рупатадину: неседативний ефект, подвійний механізм дії (антагонізм H1-рецепторів і блокування ФАТ-рецепторів), здатність зменшувати дегрануляцію тучних клітин, опосередковано знижувати рівень D-димеру та покращувати функцію ендотелію. Це робить Рупафін доступним і ефективним терапевтичним засобом для лікування ХК, особливо в пацієнтів з тяжким перебігом або резистентністю до інших АГП.
Література
- Богомолов А.Є. Хронічна кропив’янка: сучасні погляди на питання класифікації, діагностики й алгоритми ведення пацієнтів з позицій доказової медицини. Фармакотерапія в дерматовенерології. 2018; 1. doi: 10.30978/UJDVK2018-1-81.
- Asero R., Tedeschi A., Cugno M. Heparin and tranexamic acid therapy may be effective in treatment-resistant chronic urticaria with elevated D-dimer: a pilot study. Int. Arch. Allergy Immunol. 2010; 152 (4): 384-389. doi: 10.1159/000292947.
- Asero R. Oral anticoagulants may prevent NSAID-induced urticaria. Clin. Exp. Dermatol. 2006; 31 (4): 589-590. doi: 10.1111/j.1365-2230.2006.02118.x.
- Atik Ö., Tepetam F.M., Özden Ş., et al. Eosinophilic cationic protein and D-dimer are potential biomarkers to predict response to antihistamines but not to omalizumab in chronic spontaneous urticaria. Libyan J. Med. 2024; 19 (1): 2420483. doi: 10.1080/19932820.2024.2420483.
- Baskurt D., Sarac E., Asero R., et al. D-dimer levels decline after immunosuppressive treatment rather than anticoagulant treatment in severe autoimmune chronic spontaneous urticaria. Eur. Ann. Allergy Clin. Immunol. 2024; 56 (1): 42-44. doi: 10.23822/EurAnnACI.1764-1489.272.
- Choi B.Y., Ye Y.M. Role of platelet-activating factor in the pathogenesis of chronic spontaneous urticaria. Int. J. Mol. Sci. 2024; 25 (22): 12143. doi: 10.3390/ijms252212143.
- Church M.K., Máspero J.F., Maurer M., et al. The scope of pharmacological and clinical effects of modern antihistamines, with a special focus on rupatadine: proceedings from a satellite symposium held at the 21st World Allergy Congress, Buenos Aires, December 8, 2009. World Allergy Organ. J. 2010; 3 (4 Suppl.): S1-S16. doi: 10.1097/WOX.0b013e3181dcf50d.
- Criado P.R., Criado R.F.J., Miot H., et al. Chronic spontaneous urticaria: update on pathogenesis and therapeutic implications. An. Bras. Dermatol. 2025; 100 (5): 501198. doi: 10.1016/j.abd.2025.501198.
- Cugno M., Borghi A., Garcovich S., et al. Coagulation and skin autoimmunity. Frontiers in Immunology. 2019; 10. doi: 10.3389/fimmu.2019.01407.
- Dabas G., Thakur V., Bishnoi A., et al. Causal relationship between D-dimers and disease status in chronic spontaneous urticaria and adjuvant effect of oral tranexamic acid. Indian Dermatol. Online J. 2021; 12 (5): 726-730. doi: 10.4103/idoj.IDOJ_106_21.
- Farres M.N., Refaat M., Melek N., et al. Activation of coagulation in chronic urticaria in relation to disease severity and activity. Allergol. Immunopathol. (Madr.). 2015; 43 (2): 162-167. doi: 10.1016/j.aller.2014.04.002.
- Grzanka R., Damasiewicz-Bodzek A., Kasperska-Zajac A. Interplay between acute phase response and coagulation/fibrinolysis in chronic spontaneous urticaria. Allergy Asthma Clin. Immunol. 2018; 14: 27. doi: 10.1186/s13223-018-0255-8.
- Hide M., Suzuki T., Tanaka A., Aoki H. Long-term safety and efficacy of rupatadine in Japanese patients with itching due to chronic spontaneous urticaria, dermatitis, or pruritus: a 12-month, multicenter, open-label clinical trial. J. Dermatol. Sci. 2019; 94 (3): 339-345. doi: 10.1016/j.jdermsci.2019.05.008.
- Iriarte Sotés P., Armisén M., Usero-Bárcena T., et al. Efficacy and safety of up-dosing antihistamines in chronic spontaneous urticaria: a systematic review of the literature. J. Investig. Allergol. Clin. Immunol. 2021; 31 (4): 282-291. doi: 10.18176/jiaci.0649.
- Izquierdo I., Casas L., Cabrera S., et al. How to handle off-label prescriptions of rupatadine, a second-generation antihistamine and PAF antagonist: a review. Drugs Context. 2024; 13: 2023-9-5. doi: 10.7573/dic.2023-9-5.
- Liu X., Cao Y., Wang W. Burden of and trends in urticaria globally, regionally, and nationally from 1990 to 2019: systematic analysis. JMIR Public Health Surveill. 2023; 9: e50114. doi: 10.2196/50114.
- Muñoz-Cano R.M., Casas-Saucedo R., Valero Santiago A., et al. Platelet-activating factor (PAF) in allergic rhinitis: clinical and therapeutic implications. J. Clin. Med. 2019; 8 (9): 1338. doi: 10.3390/jcm8091338.
- Parslew R., Pryce D., Ashworth J., et al. Warfarin treatment of chronic idiopathic urticaria and angio-oedema. Clin. Exp. Allergy. 2000; 30 (8): 1161-1165. doi: 10.1046/j.1365-2222.2000.00857.
- Peck G., Hashim M.J., Shaughnessy C., et al. Global epidemiology of urticaria: increasing burden among children, females and low-income regions. Acta Derm. Venereol. 2021; 101 (4): adv00433. doi: 10.2340/00015555-3796.
- Prasertcharoensuk A., Chongpison Y., Thantiworasit P., et al. Combining dipyridamole and cilostazol with up-dosing antihistamines improves outcomes in chronic spontaneous urticaria with high D-dimer levels: a randomized controlled trial. Exp. Dermatol. 2024; 33 (8): e15168. doi: 10.1111/exd.15168.
- Qin H.Y., Xiao X.J., Xue P., et al. The role of coagulation/fibrinolysis biomarkers in pathophysiology, disease severity, and treatment response in patients with urticaria: a scoping review. Clin. Rev. Allergy Immunol. 2025; 68 (1): 25. doi: 10.1007/s12016-025-09036-3.
- Ridge K., Fogarty H., Doherty D., et al. Enhanced thrombin generation potential and endothelial dysfunction in chronic spontaneous urticaria. Clin. Transl. Allergy. 2023; 13 (7): e12285. doi: 10.1002/clt2.12285.
- Sabroe R.A., Lawlor F., Grattan C., et al. British Association of Dermatologists guidelines for the management of people with chronic urticaria 2021. Br. J. Dermatol. 2022; 186 (3): 398-413. doi: 10.1111/bjd.20892.
- Shamizadeh S., Brockow K., Ring J. Rupatadine: efficacy and safety of a non-sedating antihistamine with PAF-antagonist effects. Allergo J. Int. 2014; 23 (3): 87-95. doi: 10.1007/s40629-014-0011-7.
- Ulambayar B., Yang E.M., Cha H., et al. Increased platelet activating factor levels in chronic spontaneous urticaria predicts refractoriness to antihistamine treatment: an observational study. Clin. Transl. Allergy. 2019; 9: 33. doi: 10.1186/s13601-019-0275-6.
- Wang D., Tang H., Shen Y., et al. Activation of the blood coagulation system in patients with chronic spontaneous urticaria. Clin. Lab. 2015; 61 (9): 1283-1288. doi: 10.7754/clin.lab.2015.150226.
- Xiao X., Xue P., Shi Y., et al. The efficacy and safety of high-dose nonsedating antihistamines in chronic spontaneous urticaria: a systematic review and meta-analysis of randomized clinical trials. BMC Pharmacol. Toxicol. 2023; 24 (1): 23. doi: 10.1186/s40360-023-00665-y.
- Zuberbier T., Abdul Latiff A.H., Abuzakouk M., et al. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022; 77 (3): 734-766. doi: 10.1111/all.15090.
- Zuberbier T., Aberer W., Asero R., et al. The EAACI/GA²LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018; 73 (7): 1393-1414. doi: 10.1111/all.13397.
- Phinyo P., Koompawichit P., Nochaiwong S., et al. Comparative efficacy and acceptability of licensed dose second-generation antihistamines in chronic spontaneous urticaria: a network meta-analysis. J. Allergy Clin. Immunol. Pract. 2021; 9 (2): 956-970.e57. doi: 10.1016/j.jaip.2020.08.055.