Транскриптомні зміни, пов’язані з пероральною імунотерапією харчової алергії
Переклала й адаптувала лікарка-алерголог Ірина Калікіна
IgE-опосередкована харчова алергія поширена серед 10% немовлят і 8% дітей у західних країнах.
Це означає, що в кожному шкільному класі є хоча б одна дитина з харчовою алергією.
Нещодавнє схвалення Національним інститутом здоров’я та вдосконалення медичної допомоги (NICE) Palforzia – першого ліцензованого продукту для оральної імунотерапії (ОІТ) арахісом у Сполученому Королівстві – забезпечує пацієнтам тимчасовий захист від випадкового вживання невеликої кількості арахісу, однак до недоліків терапії можна віднести необхідність постійного підтримувального приймання разом з уникненням алергену, часті алергічні реакції, пов’язані з лікуванням, і відсутність покращення якості життя.
Зусилля щодо розроблення методів лікування харчової алергії, які можуть перевести імунну систему з алергічного стану до ремісії та зрештою толерантності, стикаються з труднощами через обмежене розуміння ключових імунних змін під час терапії.
Обмеженнями наявних досліджень є невеликі розміри вибірок, варіабельні схеми лікування з різними підтримувальними дозами та тривалістю приймання, а також значні розбіжності у визначенні клінічних кінцевих точок. Окрім того, більшість досліджень зосереджувалися на кінцевих результатах лікування, не враховуючи варіації клінічних результатів у межах груп, що ускладнює розуміння механізмів короткострокових і довгострокових змін*. Імунні зміни, пов’язані з довгостроковими клінічними результатами після припинення лікування, майже не досліджувалися.
Висновки з наявних досліджень, що стосуються ОІТ харчової алергії
Дослідження, зосереджені лише на диференційованій експресії генів (ДЕГ), мають обмеження, оскільки не враховують зміни в структурі генних мереж, що можуть відігравати важливу роль у розвитку алергії.
Оскільки гени діють спільно, варто досліджувати не лише їхню експресію, а й мережі коекспресії, що допоможе краще розкрити динаміку молекулярних процесів і алергічних реакцій (особливо таких, як харчова алергія, котрі опосередковуються кількома клітинними та молекулярними шляхами, що діють разом для формування відповіді).
Систематичні дослідження використовують секвенування РНК для вивчення імунних механізмів харчової алергії та наслідків після ОІТ, охоплюючи весь геном. Це дає змогу зрозуміти процеси глибше, ніж традиційні методи, що вивчають кілька генів або шляхів одночасно.
Аналіз генних мереж дає змогу групувати гени в модулі та визначати ключові регулятори, що координують імунну відповідь. Це допомагає зрозуміти молекулярні основи хвороб і виділити механізми, що зумовлюють ремісію або відсутність її після ОІТ.
Завдяки секвенуванню РНК однієї клітини можна досліджувати механізми хвороби на рівні окремих клітин, що дає змогу вивчати міжклітинні взаємодії та реакції, зокрема взаємодії ліганд – рецептор.
Хоча застосування цієї технології в осіб, які отримують ОІТ, лише починається, вже було досліджено зміни в CD4+ Т-клітинах, які реагують на алергени, що відкриває нові можливості для розуміння механізмів ОІТ.
Імунне ремоделювання під час ОІТ харчової алергії
Секвенування клітин цільної крові або мононуклеарних клітин периферичної крові (МнКПК) для виявлення біомаркерів алергії й успіху лікування є привабливим через простоту збору зразків, і надалі маркер, виміряний безпосередньо, без необхідності культивування клітин, було би легко впровадити в клінічну практику.
Однак цей метод має обмеження через низьку концентрацію алергенореактивних клітин у зразках крові та їх тимчасове перебування в периферичному кровообігу. Друга проблема полягає в тому, що існує варіабельність клітинного складу серед різних людей і різних вікових груп, що обмежує можливість знайти універсальні біомаркери.
Попри це транскрипційні дослідження виявили імунні зміни в цільній крові та МнКПК після лікування харчової алергії на яйця. Зокрема, через 8 місяців ОІТ спостерігалося зниження експресії генів, пов’язаних із сигнальною системою TREM1, IL-6 та IL-17. Зміни були асоційовані з регуляцією вродженого імунітету й запалення: Toll-подібні рецептори, інтерферони (ІФН), хемокіни, цитокіни й молекули адгезії, а також регуляція генів Т-клітин, включаючи Th17, регуляторні Т-клітини та Th2.
Пацієнти, які не досягли цільової дози (частково десенсибілізовані), мали затримку в імунологічному ремоделюванні порівняно з тими, хто досяг цільової дози. Вони також демонстрували стійку Th2-відповідь і відсутність залучення висхідних регуляторів. Через відсутність довготривалих клінічних оцінок неможливо точно сказати, чи були ці молекулярні зміни пов’язані з ремісією, чи з десенсибілізацією без ремісії.
Під час аналізу декількох досліджень з ОІТ + омалізумаб та ОІТ з арахісом було ідентифіковано 108 спільних ДЕГ, які частково збігаються з генами, пов’язаними з гострими алергічними реакціями на арахіс, але з протилежним напрямком дії; це вказує на те, що ефекти лікування частково опосередковані модуляцією подій, які відбуваються під час гострої алергічної реакції.
Не було виявлено чітких транскрипційних змін, асоційованих із застосуванням лише омалізумабу перед ОІТ. Однак імунні зміни не були прямо пов’язані з успішністю лікування, радше із самим процесом лікування.
При порівнянні транскрипційних досліджень ДЕГ між випробуваннями під час ОІТ яйцем і арахісом було виявлено незначне перекриття генів. Ці розбіжності можна пояснити різницею в тривалості лікування, фіксацією різних фаз імунологічної активності й іншими чинниками, як-от генетика, режим терапії та вік пацієнтів. Гени, які узгоджувалися між двома дослідженнями, були не імунними, а пов’язаними з клітинними процесами, як-от транспортні білки, синтез білка, функція мітохондрій.
ОІТ не модифікувала популяцію фолікулярних Тh2, але їхня кількість була пов’язана з рівнями sIgE до арахісу. Інші дослідження показують, що зміни в γδ-регуляторних Т-клітинах (γδ-Tregs) можуть бути важливими для імунологічних механізмів ОІТ.
Профілювання може допомогти краще зрозуміти механізми алергічної реакції. Дослідження показали, що кілька генів (LTB4R, PADI4, IL1R2, PPP1R3D, KLHL2 та ECHDC3) є важливими чинниками для розвитку алергії на арахіс й ідентифікувалися після алергічної реакції. Інша група дослідників ідентифікувала три гени-драйвери алергії на арахіс: IFIH1, DRAM1 і ZNF512B.
Модуль генів, багатий на гени ІФН 1-го типу (ІФН1), включаючи інтерферон-індукований білок-1, був найбільш позитивно пов’язаний з алергією на горіхи, що робить його потенційно важливим маркером алергії.
Механізми десенсибілізації під час ОІТ
Виявлено специфічну підгрупу Th2A-клітин (або Th2 патогенного резервуара), рівень яких підвищений у людей з алергією на арахіс. Вони є відмінними від звичайних Th2-клітин і виробляють високі рівні ефекторних цитокінів Th2.
Ці клітини термінально диференційовані, не мають CD27, продукують дуже високі рівні ефекторних цитокінів Th2, а їхні маркери включають CRTH2, CD49d та CD161. Вони відповідають за патогенну імунну відповідь на алергени.
Профілювання Т-клітин показало, що частота Th2A-клітин знижується в пацієнтів, які досягли десенсибілізації після ОІТ. Використання технології секвенування РНК для аналізу клітин показало, що пригнічення активності Th2 у Th2A-подібних клітинах пов’язане з десенсибілізацією, але не обов’язково з ремісією алергії. Десенсибілізація не забезпечує повної елімінації Th2A-клітин; це може свідчити про те, що вони здатні зумовлювати відсутність тривалого імунного захисту.
Механізми ремісії під час ОІТ
ІФН1 можуть бути важливими регуляторами в зміні алергічної відповіді та сприяти ремісії після ОІТ, зокрема в CD4+ Т-клітинах. Вони можуть пригнічувати алергічну відповідь під час і після лікування.
Дослідження коекспресії генів у CD4+ Т-клітинах показали, що в дітей, які досягли ремісії після ОІТ, відбулася зміна в антигеноспецифічній відповіді на арахіс – втрата зв’язку генів, керованих Th2, і заміна їх інтегрованими мережами ІФН1. На противагу цьому в дітей, які отримували плацебо, зберігався домінувальний модуль Th2-клітин.
Подібна роль ІФН1 була виявлена й в інших дослідженнях, зокрема при підшкірній імунотерапії алергічного риніту в дорослих. Це підтверджує універсальність цього механізму для досягнення тривалої ремісії після різних видів алергеноспецифічної імунотерапії.
Аналіз клітин пам’яті (CD4+ Т-клітин) виявив нові підмножини Т-хелперів і Т-регуляторних клітин, пов’язаних з ІФН1 у здорових людей; це дає змогу припустити, що вони можуть відігравати роль у послабленні алергічних реакцій.
Точний механізм взаємодії між ІФН1 та Th2-відповіддю в імунотерапії алергенами поки що невідомий. ІФН1 пригнічують продукцію Th2-цитокінів, експресію IgE-рецепторів і GATA3 під час і після диференціації CD4+ Т-клітин у Th2-клітини.
ІФН1 сприяють епігенетичному пригніченню некодувальних ділянок геному, що контролюють експресію Th2-цитокінів. Гени ІФН (1-го та 2-го типів) регулюють кластер генів, пов’язаних з рівнями sIgG4 та sIgA, що спостерігалося після ОІТ яйцем.
Іншим регуляторним механізмом, про який повідомлялося при ОІТ, є Т-клітинна анергія. У пацієнтів з ремісією після ОІТ збільшувалася кількість анергічних Т-лімфоцитів, тоді як у десенсибілізованих осіб без ремісії Т-клітини були розподілені між кількома фенотипами.
Хоча частота анергічних Т-клітин знижувалася в процесі ОІТ, цей показник не був специфічним для успішного лікування (не відтворювався в інших дослідженнях). Водночас приглушення ознак Th2 та Th1 в ефекторних клітинах було пов’язане з ремісією. І навпаки, підвищені запальні сигнали в ефекторних клітинах Th1 і Th17 асоціювалися з гіршими результатами після ОІТ.
Виявлене ж транзиторне збільшення клітин, що продукують TGF-β, через рік після початку лікування може бути пов’язане як з ремісією, так і з десенсибілізацією без ремісії.
T-регуляторні клітини (Treg) відіграють важливу роль у розвитку та підтримці пероральної толерантності, що передбачає їх можливу участь у ремісії алергії після ОІТ. Однак докази щодо їхньої ключової ролі в цьому процесі в людей обмежені.
Індукція експресії гена FOXP3 через деметилювання локусу FOXP3 пов’язана з ремісією алергії. Пацієнти, які досягли ремісії, мали зниження метилювання FOXP3, тоді як у тих, хто втратив захист після ОІТ, метилювання відновилося. Деметилювання Treg-специфічної ділянки є показником тривалої ремісії. У дітей, що переросли алергію на коров’яче молоко, рівень деметилювання був вищим, аніж у тих, хто мав активну алергію. Ці дані свідчать про те, що персистивна активація FOXP3 може бути критично важливою для тривалої ремісії алергії.
Підходи системної біології забезпечують ширше та набагато глибше розуміння механізмів ОІТ і можуть сприяти розробленню більш цілеспрямованих та ефективних підходів до лікування. Існує також потреба в масштабніших дослідженнях, що дадуть змогу виявити нові біомаркери відповіді на лікування та пов’язані з ними терапевтичні мішені, які можуть бути використані для розроблення ефективніших методів лікування.
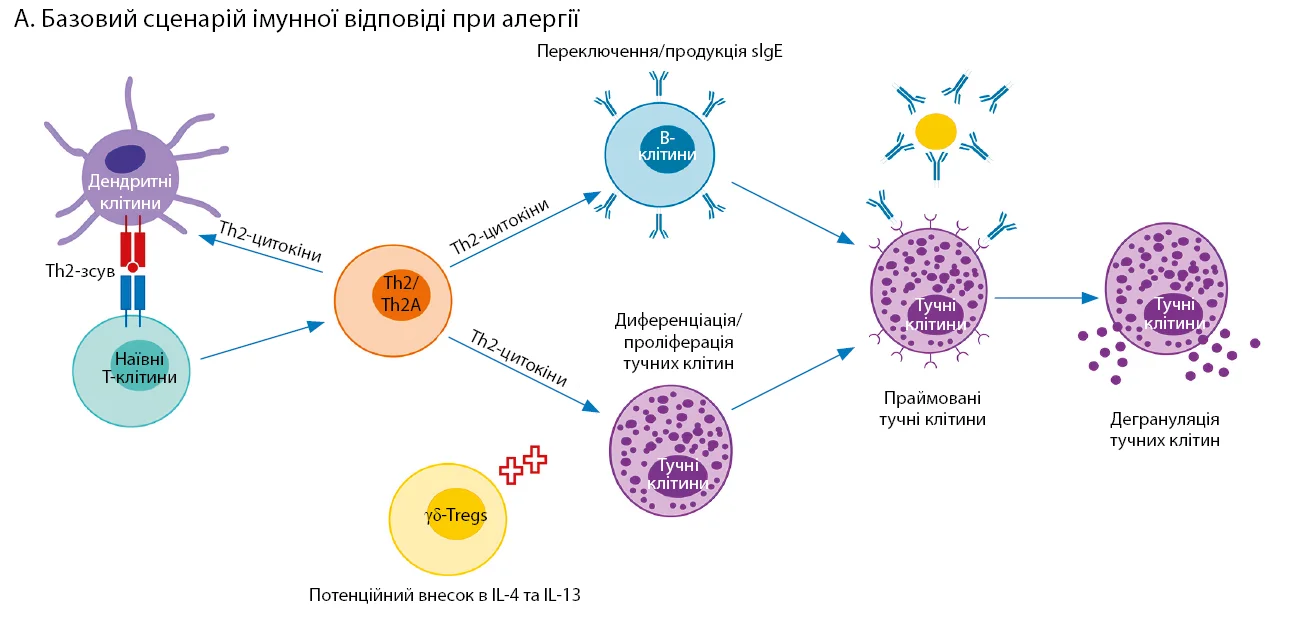
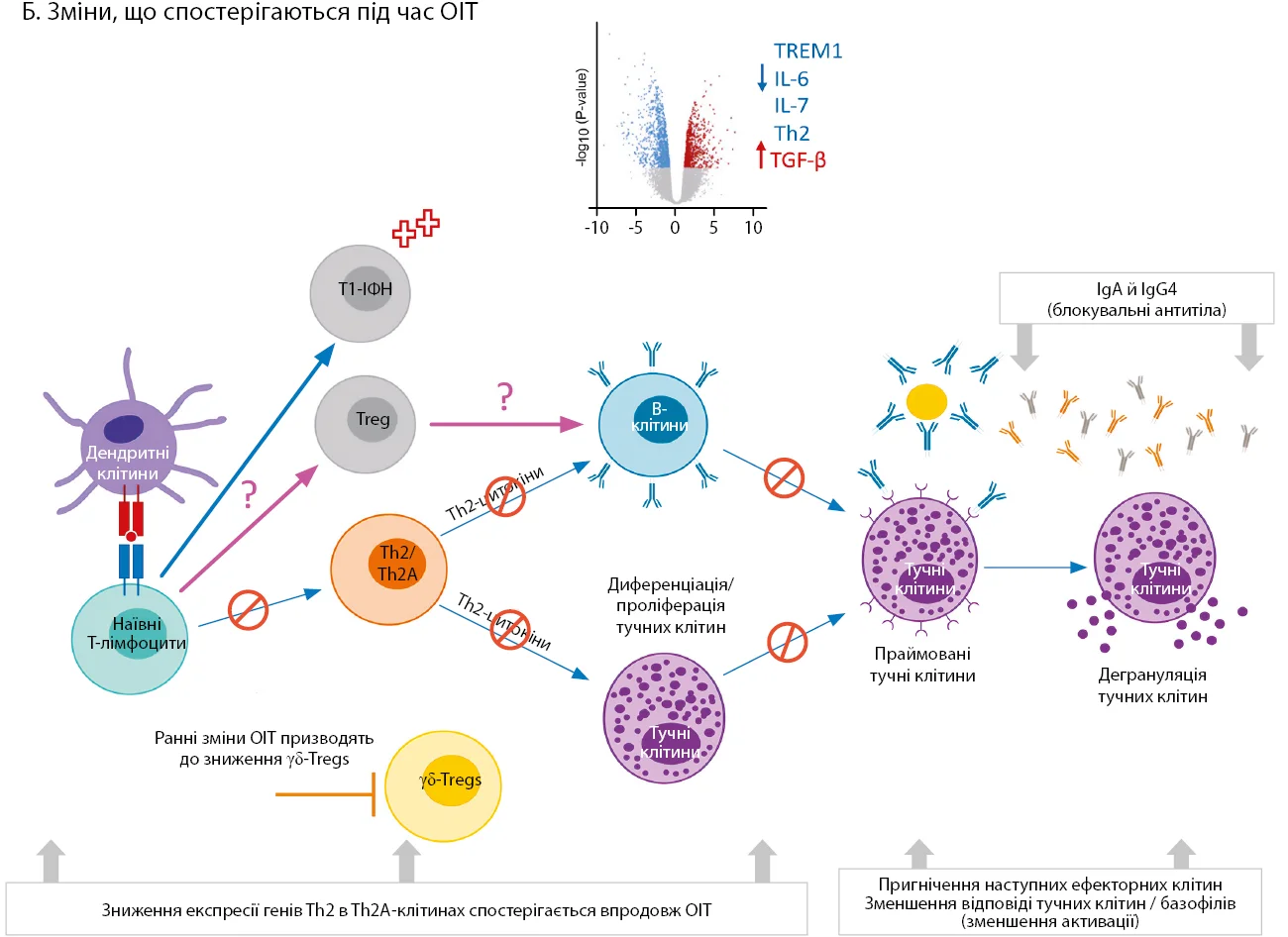
Рис. Транскриптомні зміни, пов’язані з ОІТ харчової алергії
А. Базовий сценарій імунної відповіді при алергії. Цитокіни Th2 сприяють стимуляції плазматичних клітин і виробленню IgE, а також подальшій диференціації в бік Th2. Вироблення IgE-антитіл, специфічних до алергену, та їх адсорбція на поверхні тучних клітин під час зв’язування з алергеном призводять до дегрануляції й алергічного запалення. Т-фолікулярні хелпери та γδ-регуляторні Т-клітини можуть сприяти зміщенню в бік Th2 і виробленню IL-13 та IL-4 (характерних цитокінів Th2).
Б. Зміни, що спостерігаються під час ОІТ, включають клональну анергію Т-клітин з Th2-фенотипом, зниження експресії генів Th2 в людей з алергією на арахіс і зниження продукції антигеноспецифічних IgE-антитіл. Паралельно збільшується продукція sIgG4, який конкурує за зв’язування sIgE. Продемонстровано деметилювання локусу FOXP3 у Т-регуляторних клітинах, що корелює з результатами лікування. Зниження частоти γδ-Т-лімфоцитів спостерігається на ранніх стадіях ОІТ, що може сприяти втраті домінування Th2-лімфоцитів. Кілька досліджень CD4+ Т-клітин виявили нову підгрупу Т-хелперів, які експресують ІФН-стимульовані гени 1-го типу (T1-ІФН). Хоча функція цих клітин до кінця не з’ясована, T1-ІФН відіграють важливу роль у диференціюванні Т-клітин і регуляції Т-фолікулярних клітин-хелперів, а отже, можуть регулювати Th2 і вироблення антитіл.
Література
Ashley S.E., Bosco A., Tang M.L.K. Transcriptomic changes associated with oral immunotherapy for food allergy. Pediatr. Allergy Immunol. 2024. https://onlinelibrary.wiley.com/doi/10.1111/pai.14106
* Примітка: в огляді під короткостроковими змінами мається на увазі десенсибілізація (підвищення порогу переносимості), під довгостроковими – ремісія, толерантність (стійка відсутність реакції після припинення лікування на певний період часу).