Реферативний огляд настанов ААААІ/ACAAI JTFPP (2023) щодо лікування атопічного дерматиту (екземи)
Підготувала канд. мед. наук Ольга Королюк
Настанови Спільної робочої групи з практичних рекомендацій Американської академії алергії, астми й імунології / Американського коледжу алергії, астми й імунології (ААААІ/ACAAI JTFPP, 2023) створено мультидисциплінарною комісією за участю пацієнтів, опікунів, експертів у галузі дерматології, алергології/імунології, лікарів первинної ланки та суміжних медичних фахівців (психологів, фармакологів, медичних сестер).
Комісія погодила 25 рекомендацій, які ґрунтуються на доказах, щодо досягнення контролю атопічного дерматиту (АД) та його підтримки для пацієнтів із легкою, помірною й тяжкою формами хвороби. Рекомендації стосуються оптимального використання: 1) топічних засобів (бар’єрні зволожувальні засоби, кортикостероїди, інгібітори кальциневрину, інгібітори фосфодіестерази-4 (іФДЕ-4), інгібітори Янус-кіназ (iJAK), оклюзійна терапія, протимікробні засоби); 2) ванн із розведеним відбілювачем; 3) елімінаційної дієти; 4) імунотерапії; 5) системної терапії (біопрепарати, низькомолекулярні імунодепресанти, фототерапія ультрафіолетом).
Цілі настанов: надання рекомендацій, які ґрунтуються на доказах, щодо оптимального лікування екземи/АД у немовлят, дітей і дорослих з огляду на п’ять ключових запитань:
- Які місцеві методи лікування слід застосовувати для досягнення оптимальних результатів у пацієнтів з АД?
- Чи слід застосовувати елімінаційні дієти (дієтичні стратегії уникнення) при АД?
- Чи слід використовувати ванни з розведеним відбілювачем при АД?
- Чи слід використовувати імунотерапію при АД?
- Які системні методи лікування, включно з фототерапією, слід застосовувати в пацієнтів з АД для досягнення оптимальних результатів?
Цільовою аудиторією є пацієнти, спеціалісти з АД (алергологи, імунологи, дерматологи), сімейні лікарі, педіатри й інші особи, які приймають рішення. Документ може слугувати основою для прийняття або адаптації місцевими робочими групами для створення регіональних або національних настанов.
Що нового в настановах?
- Рекомендації щодо спільного прийняття рішень; чинники, на які варто зважати, для кожної рекомендації.
- Рекомендується використання топічних кортикостероїдів (ТКС) або топічних інгібіторів кальциневрину (ТІК) у разі АД, стійкого до зволоження.
- Підкреслюється безпека ТІК за типового використання 1-2 рази на день.
- Розглядаються дози топічних засобів 1 раз на день.
- Пропонується використання кризаборолу 2% у вигляді мазі для лікування легкого-помірного АД.
- Пропонується не додавати руксолітиніб для пацієнтів із легким-помірним АД, стійким до зволоження.
- Пропонується не використовувати топічні протимікробні засоби за відсутності інфекції.
- Рекомендується проактивна терапія ТКС або ТІК для пацієнтів із рецидивним перебігом.
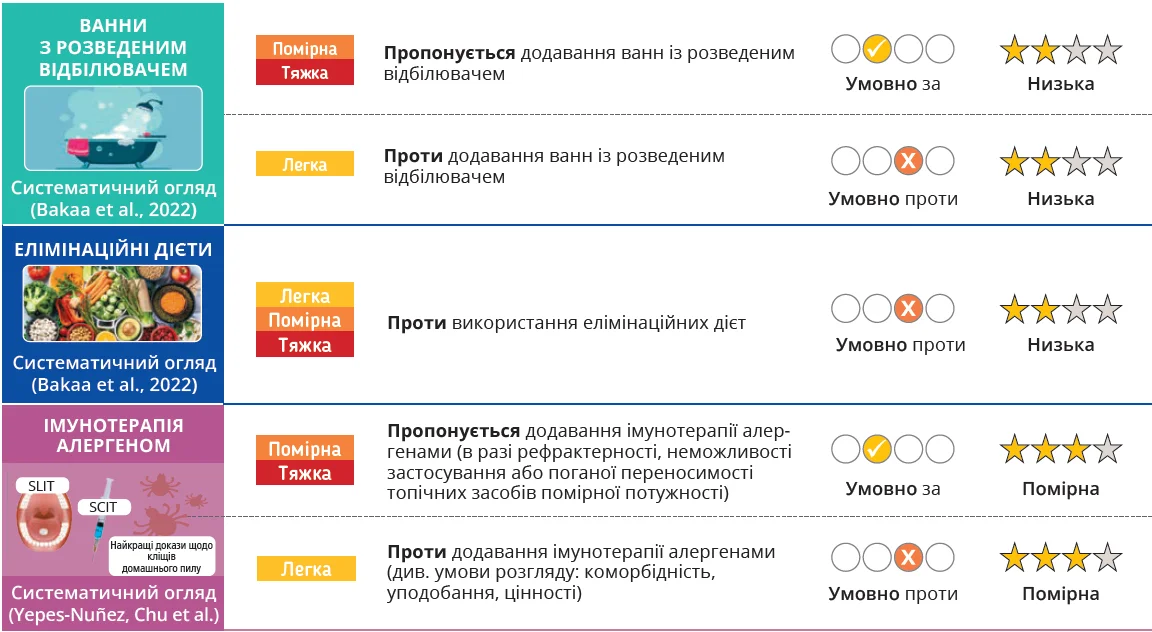
- Пропонуються ванни з відбілювачем як додаткова терапія для пацієнтів із помірним-тяжким АД; цей вид терапії пропонується не застосовувати для пацієнтів із легким АД.
- Пропонується не використовувати елімінаційних дієт при АД.
- Пропонується алергенна імунотерапія для помірного-тяжкого АД.
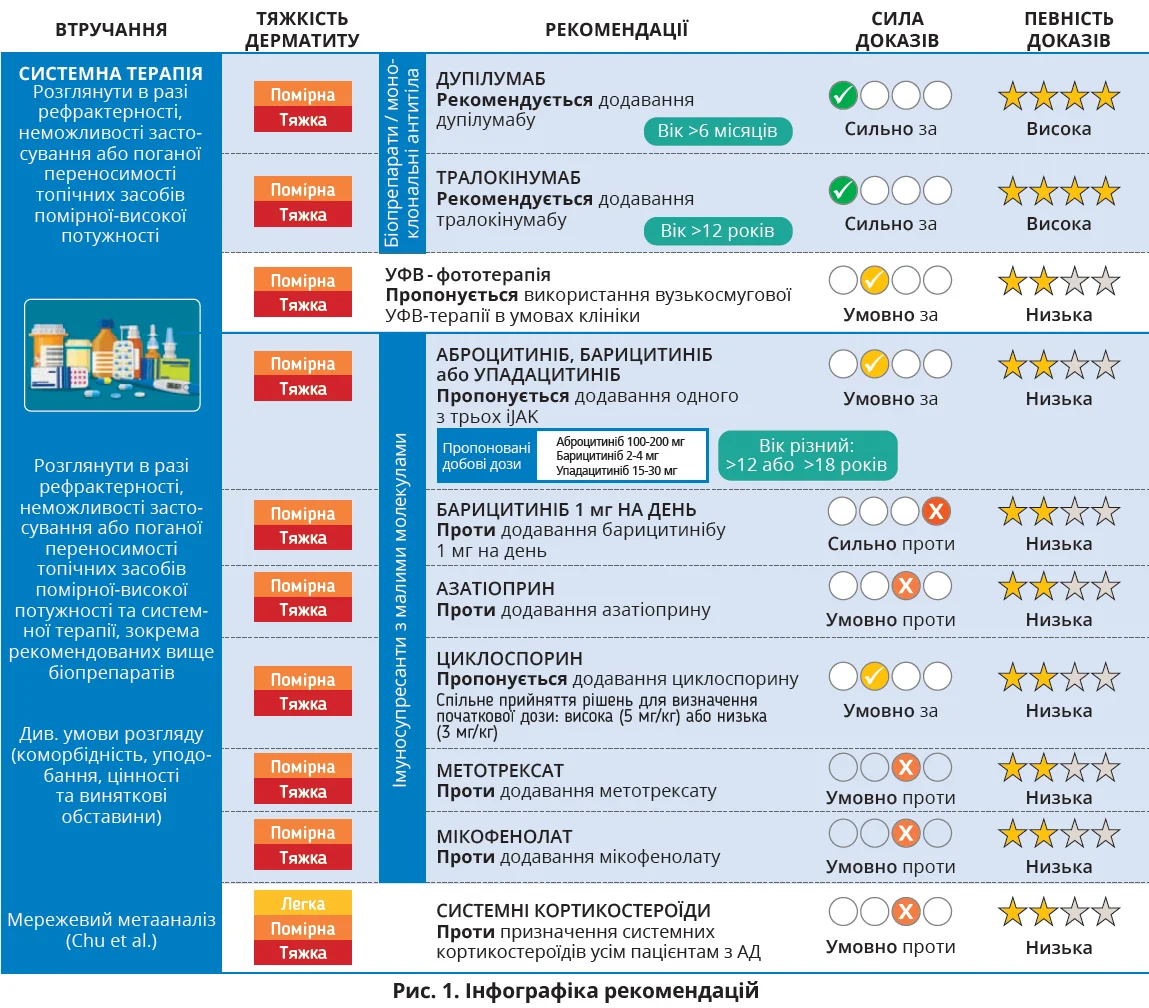
- Рекомендується дупілумаб для пацієнтів віком від 6 місяців або тралокінумаб для пацієнтів віком від 12 років із помірним-тяжким АД, рефрактерним до місцевого лікування, або за поганої переносимості / відсутності ефекту від топічних засобів.
- Пропонується використання пероральних iJAK після ретельного розгляду ризиків і можливої користі в дорослих і підлітків із помірним-тяжким АД, рефрактерним до топічного лікування, чи за поганої переносимості / відсутності ефекту від топічних засобів або системної терапії, включаючи рекомендовані біопрепарати.
- Рекомендується не використовувати барицитиніб 1 мг, а також азатіоприн, метотрексат і мікофенолату мофетил.
- Пропонується розглянути застосування циклоспорину в дорослих і підлітків із помірним-тяжким АД, рефрактерним до топічних засобів, чи за поганої переносимості / відсутності ефекту від топічних
або біологічних засобів. - Пропонується не використовувати системні кортикостероїди.
- Електронний додаток містить зручні для пацієнта короткі роздаткові матеріали для полегшення навчання, обговорення, практичних міркувань і спільного прийняття рішень.
Основні характеристики та клінічна значущість АД
AД є найпоширенішим хронічним запальним захворюванням шкіри, яке вражає близько 13% дітей і 7% дорослих у світі. Зазвичай симптоми виникають у дитинстві: в 45% пацієнтів – у віці до 6 місяців, у 60% – до 12 місяців, у 85% – до 5 років. До підліткового віку ремісія виникає в 70% пацієнтів; 16-37% пацієнтів повідомляють про АД у дорослому віці. Деякі рідкісні синдроми, як-от синдром Віскотта – Олдріча, співіснують з АД. Симптоми АД, асоційоване порушення сну, атопічні й неатопічні супутні хвороби суттєво погіршують якість життя та повсякденну активність пацієнтів і членів їхньої родини, які здійснюють догляд.
Термін «екзема» – сверблячі, запалені та лускаті папули чи бляшки – це морфологічна характеристика, притаманна багатьом хворобам, як-от атопічний, радіаційний або контактний дерматит. Термін «АД» точніше описує конкретне захворювання. Узгодженого еталонного стандарту діагностики АД не існує. Найперевіренішими критеріями діагнозу, які широко використовуються в клінічній практиці, є критерії Ханіфіна та Райка, а також модифікація робочої групи з Великої Британії – UKWP (табл. 1).
Існують різні морфологічні форми АД: папульозна, ліхеноїдна, нумулярна та фолікулярна, а також ураження поверхні розгиначів, повік і дорсальних згинальних поверхонь. Класичною ознакою АД є еритема, яка виникає внаслідок посиленого припливу крові до поверхневих капілярів і може відрізнятися залежно від тону шкіри пацієнта. Еритема включає тимчасові зміни шкіри, характерні для активного запалення при АД: почервоніння, відтінки коричневого, фіолетового або сірого кольору. Після запалення можлива зміна пігментації (гіпо- або гіперпігментація), що триває від місяців до років і часто становить проблему для пацієнта.
Найобтяжливішим симптомом АД є інтенсивний свербіж, який важко контролювати. Понад 85% пацієнтів із помірним-тяжким АД повідомляють про щоденний свербіж, 42% відчувають свербіж ≥18 годин щодня. Понад 40% дітей і 60% дорослих з АД повідомляють про біль у шкірі внаслідок свербіння, подряпин або розчухів, тріщин шкіри, можливо, невропатичного компонента.
Діти (47-80%) і дорослі (33-87%) повідомляють про порушення сну, гіршу якість сну при тяжкій активній хворобі з негативним впливом на денний настрій, поведінку та продуктивність. Суб’єктивні проблеми зі сном включають труднощі із засинанням, часті нічні прокидання й надмірну денну сонливість. Об’єктивні ознаки включають тривалу затримку настання сну, зниження ефективності сну та збільшення часу неспання. Порушення сну, ймовірно, спричинене свербінням і розчухами, які посилюються вночі.
Пацієнти з АД часто повідомляють про обмеження активності та комплекси через зовнішній вигляд шкіри, що спонукає уникати соціальних взаємодій. Батьки/опікуни дітей з АД повідомляють про часті порушення сну, спільний сон, виснаження, занепокоєння та соціальну ізоляцію, пов’язану з АД дитини, збільшення сімейного навантаження внаслідок тяжкої хвороби. Крім того, АД асоціюється зі значними фінансовими збитками для пацієнта та членів його родини через витрати, пов’язані з доплатою
за відвідування медичних закладів і рецепти, витрати на ліки, які не покриваються страхуванням, нерецептурні пом’якшувальні засоби та ліки, а також непрямі фінансові наслідки через непрацездатність або зниження продуктивності.
Патофізіологія та механізми АД
Патогенез АД складний і багатофакторний, що зумовлює гетерогенні клінічні фенотипи. Хвороба включає дефекти шкірного бар’єра, порушення імунної регуляції та взаємодії зовнішніх чинників
(мікробний дисбактеріоз, подразники й алергени). Генетичні чинники, зокрема мутації втрати функції в гені, що кодує філагрин, а також набуті дефекти епідермального бар’єра (філагрин, ліпіди й комплекси щільного з’єднання, як-от клаудин-1) посилюють трансепідермальну втрату води та сухість шкіри.
Порушення бар’єрної функції шкіри призводить до проникнення алергенів або токсинів, які спричиняють імунну відповідь і сенсибілізацію до алергену. Активовані кератиноцити вивільняють тимусний стромальний лімфопоетин (TSLP), інтерлейкін-33 (ІЛ-33) й ІЛ-25, які активують уроджені лімфоїдні клітини 2-го типу, дендритні клітини та базофіли, що призводить до активації клітин TH2. Нові варіанти системної терапії, спрямовані на цитокіни, розкривають важливість основних цитокінів 2-го типу IЛ-4 й IЛ-13 у патофізіології АД. Продукція асоційованого з типом 2 цитокіну ІЛ-31 спричиняє свербіння.
При хронічних формах АД виявлено інші типи запальних клітин: TH17/22 та TH1. Однак їхня точна патофізіологічна роль іще не вивчена.
Дефекти шкірного бар’єра та пригнічення вродженого місцевого імунітету цитокінами 2-го типу зумовлюють дисбактеріоз мікробіому шкіри, що посилює ризик шкірних інфекцій, насамперед спричинених Staphylococcus aureus і вірусами простого герпесу або контагіозного молюска. Хоча існує сильний зв’язок між S. aureus і тяжкістю АД, а токсини та протеази S. aureus здатні загострювати запалення, точна патофізіологічна роль цього збудника при АД не з’ясована. Зростає інтерес до розуміння ролі інших коменсальних шкірних бактерій, зокрема коагулазонегативних стафілококів (S. epidimidis, S. hominis).
Коморбідність і ускладнення АД
У пацієнтів з АД часто виникають певні коморбідні стани: атопічні (харчова алергія, астма, алергічний риніт) і неатопічні (депресія, тривога, нейрокогнітивні порушення, шкірні інфекції, побічні ефекти лікування). Тяжкість АД асоціюється з виникненням коморбідності внаслідок відсутності контролю хвороби, системного запалення або порушення сну.
Ускладнення внаслідок травматизації шкіри включають бактеріальну, вірусну та грибкову інфекції, простий лишай і вузликовий свербіж (prurigo nodularis). У разі тяжких загострень АД можлива поява еритродермії або очних ускладнень (рецидивний кератокон’юнктивіт, кератоконус, передня субкапсулярна катаракта). Кон’юнктивіт може також бути наслідком застосування дупілумабу, тралокінумабу або лебрикізумабу.
Через зниження фізичної активності, системне запалення та надмірне використання потужних місцевих або системних кортикостероїдів AД асоціюється з вищим ризиком переломів. Спільні механізми пояснюють зв’язок АД з такими серцево-судинними та метаболічними хворобами, як ожиріння, артеріальна гіпертензія, інфаркт міокарда, інсульт і серцева недостатність.
Розуміння рекомендацій
Сила рекомендації виражається як сильна («рекомендується») або умовна («пропонується») (табл. 2).
АТОПІЧНИЙ ДЕРМАТИТ
Настанови AAAAI/ACAAI JTFPP (2023)
Клініцисти, які лікують АД усіх ступенів тяжкості, перед призначенням будь-якої нової терапії повинні звернути увагу на:
У розробленні настанов брали участь:
- пацієнти й особи, які забезпечують догляд
- клінічні експерти: алергологи та дерматологи
- методисти
- суміжні медичні фахівці: психологи, медичні сестри, фармацевти
- передові клініцисти: сімейна медицина, педіатрія, внутрішня медицина
Докладніша інформація: https://www.allergyparameters.org Повна версія настанов: Ann. Allergy Asthma Immunol. 2023
РЕКОМЕНДАЦІЇ
Рекомендація 1
Положення про належну практику
Перед призначенням будь-якої нової терапії клініцисти, що лікують АД будь-якого ступеня тяжкості, повинні: 1) переконатися в правильності діагнозу та виявити діагнози, які ускладнюють АД; 2) забезпечити навчання, наприклад інформаційний посібник про хворобу, план дій; 3) намагатися уникати тригерів; 4) забезпечити належне використання / дотримання режиму прийому ліків; 5) заохочувати застосування м’якого зволожувального крему з титруванням до симптоматичної користі (принаймні один, часто декілька разів на день).
Важливо виключити схожі хвороби й діагностувати розлади, що ускладнюють AД, зокрема алергічний контактний дерматит, псоріаз, себорейний дерматит, фотодерматози, вроджені порушення імунітету (первинні імунодефіцитні стани), інвазії (короста), а також місцеві та системні інфекції (стрептококові, стафілококові, грибкові, сифіліс). Первинні імунодефіцити та рідкісні синдроми поширеніші в немовлят і дітей раннього віку; в цих випадках спостерігаються симптоми й ознаки поліорганного ураження з тяжкими рецидивними інфекціями, порушення імунної регуляції. У дорослих частіше трапляються дерматит унаслідок венозного стазу та лімфома шкіри.
Рекомендація стосовно зволожувальних засобів ґрунтується на систематичних оглядах і нещодавно отриманих доказах. Проведений у 2017 р. систематичний огляд включав 77 рандомізованих контрольованих досліджень (РКД), які використовували зволожувальні засоби на основі вівса, керамідів, гліцерину та сечовини. Встановлено, що зволожувальні засоби загалом покращують важливі для пацієнта результати АД. Подібні результати при застосуванні будь-якого зволожувального засобу у формі лосьйону, крему, гелю або мазі отримано в РКД, опублікованому у 2022 р., за участю 555 дітей із переважно легким АД. Отже, найкращим зволожувальним засобом є той, яким пацієнт користуватиметься регулярно. Оптимально, щоб засіб був м’яким (гіпоалергенним). Спільне прийняття рішень полягає в потенційних компромісах між вартістю, прийнятністю для пацієнта та перевагами. Наприклад, у тяжких випадках більшої користі можна досягнути, якщо зволожувальний засіб буде у вигляді мазі. Освітні заходи, як-от план дій при екземі/АД, покращують контроль хвороби, сприяють самоконтролю та самоефективності, підвищують упевненість пацієнта/опікуна. Більше інформації щодо вибору засобу для зволоження можна знайти за посиланням https://www.bmj.com/content/367/bmj.l5882/infographic.
Місцева терапія (топічні засоби). Оскільки AД є імунним захворюванням, важливу роль відіграватиме протизапальна терапія. Зволоження досить ефективне за легких форм АД; за помірних-тяжких форм АД зволоження допомагає зменшити тяжкість симптомів і тривалість загострення, але здебільшого такі випадки потребують призначення певних рецептурних протизапальних засобів: рецептурні зволожувальні засоби (продаються як медичні пристрої), ТКС, ТІК, топічні іФДЕ-4, топічні іJAK, топічні протимікробні засоби. Спосіб їх застосування може змінюватися залежно від частоти застосувань і супутнього використання оклюзії. Після досягнення початкового контролю хвороби подальша підтримка контролю залежить від частоти застосування топічних засобів, локалізації (шкіра голови, обличчя, складки шкіри) та віку пацієнта.
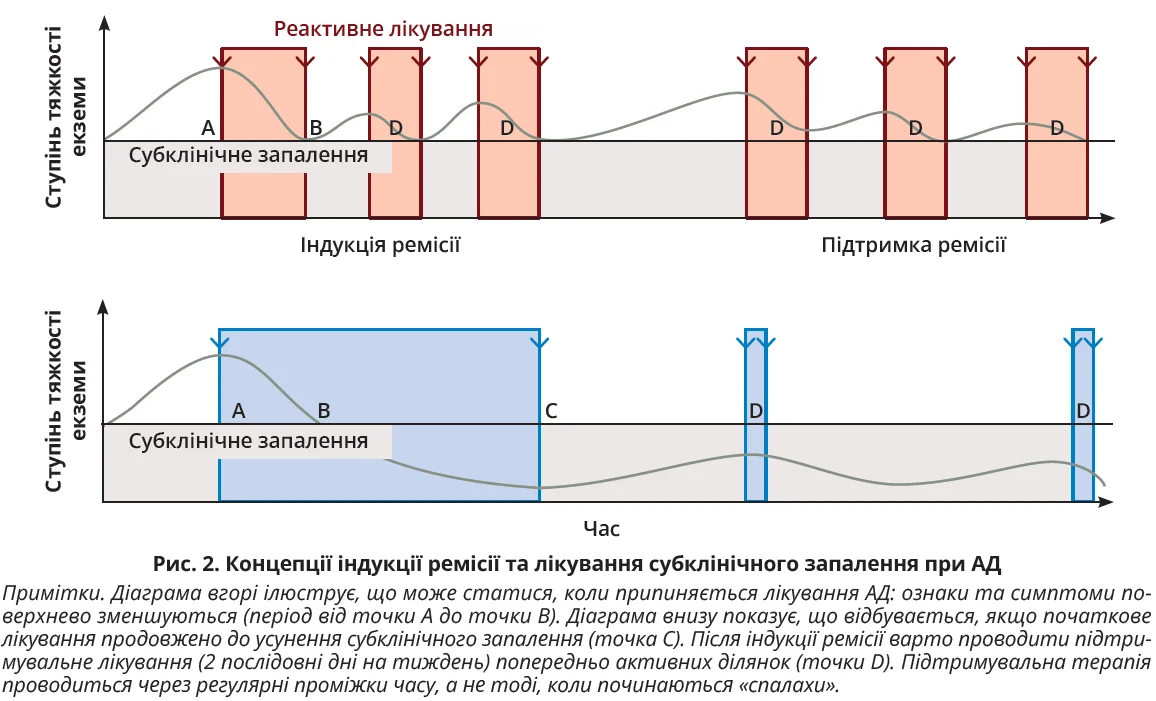
Використання топічних засобів для лікування АД можна концептуально розділити на дві фази (рис. 2):
1) індукція ремісії або проактивна терапія – лікування неконтрольованої хвороби (активної фази або спалаху);
2) підтримка ремісії – періодична терапія для лікування субклінічного запалення та запобігання майбутнім спалахам.
Лікування неконтрольованого АД (індукція ремісії)
Рекомендації щодо топічних засобів для індукції ремісії АД
Рецептурні зволожувальні засоби
Запитання 1а. Яке місцеве лікування слід використовувати за активної фази АД (індукції ремісії)?
Рекомендація 2
Пацієнтам з АД пропонується використовувати стандартний м’який (без ароматизаторів та інших потенційних контактних алергенів) нерецептурний зволожувальний крем замість рецептурного зволожувального крему (Atopiclair, Eletone, Epiceram, MimyX, Neosalus, Zenieva, PruMyx) (умовна рекомендація, певність доказів низька).
Обґрунтування: більшість добре поінформованих пацієнтів з АД воліють уникати потенційних незручностей і високої вартості рецептурних зволожувальних засобів, незважаючи на помірну впевненість щодо їхніх незначних переваг (більший відсоток покращення тяжкості АД та менший відсоток спалахів); упевненість щодо покращення свербіння низька, дані щодо впливу на якість життя відсутні. Отже, більшість пацієнтів з АД спочатку воліють спробувати нерецептурні зволожувальні засоби. Пацієнти, які надають більшого значення невеликим потенційним перевагам рецептурних зволожувачів над їхньою вартістю та меншою доступністю, здатні легко покрити витрати або мають страхове покриття, можуть віддавати перевагу рецептурним зволожувальним засобам. Докази з низьким рівнем достовірності та тісний баланс користі/незручності роблять цю рекомендацію умовною.
Топічні кортикостероїди
Рекомендація 3
Пацієнтам із неконтрольованим АД, стійким до зволоження, рекомендується додавання ТКС порівняно з їх непризначенням (сильна рекомендація, певність доказів висока).
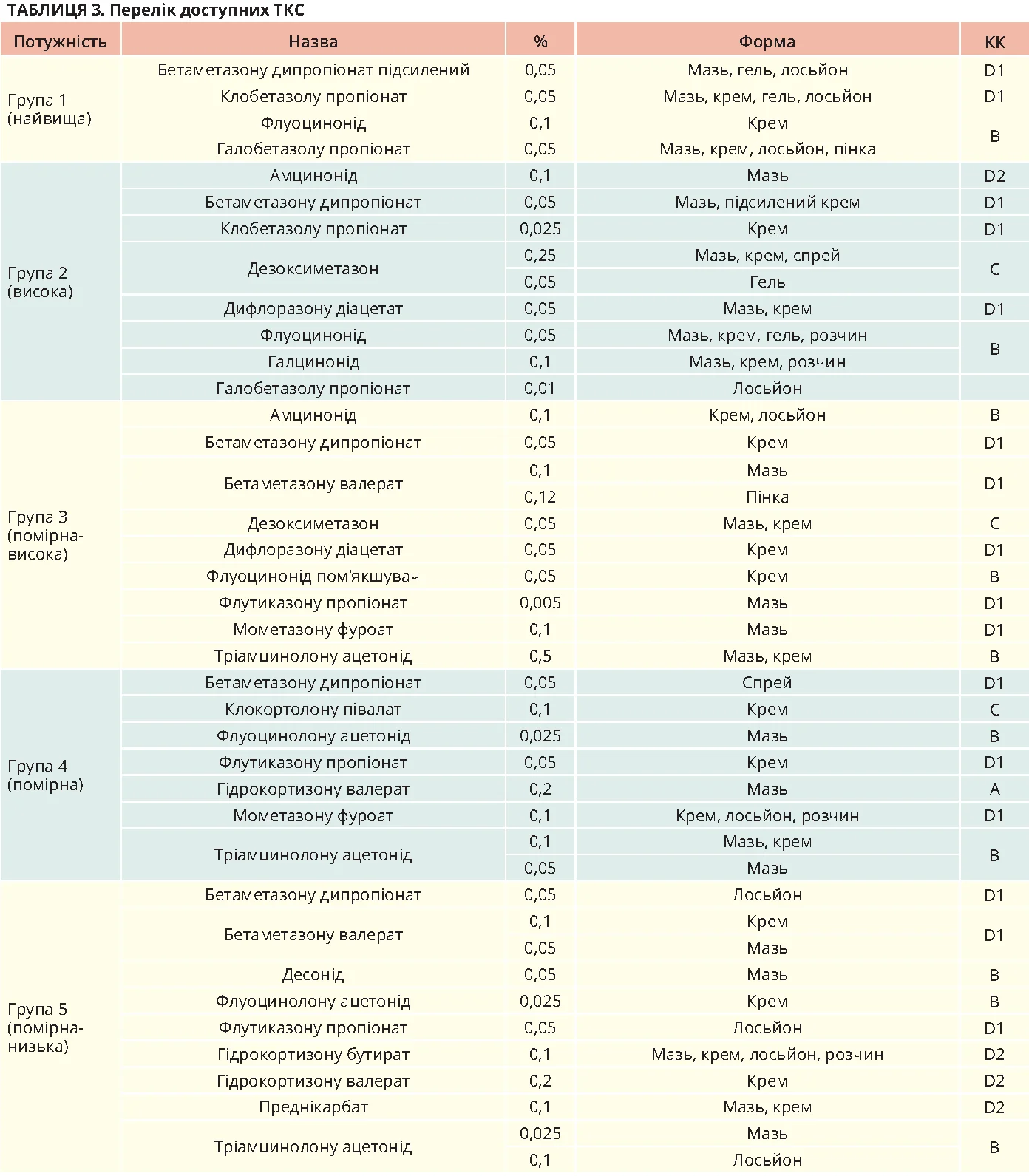
Обґрунтування: більшість добре поінформованих пацієнтів оцінюють певні переваги та шкоду різних класів ТКС. За потужністю ТКС класифікують за системою США від 1 до 7 (табл. 3).
Використання ТКС протягом 2-6 тижнів зазвичай не посилює таких побічних ефектів, як шкірні інфекції, місцеві зміни / атрофія шкіри. Вибір ТКС залежить від попереднього лікування пацієнта, місця застосування, вартості, доступності, цінностей і вподобань. Варто уникати застосування потужних ТКС (класи 1-2) впродовж >4 тижнів безперервно; доцільно обмежити їх використання на чутливих ділянках (обличчя, складки, пах). Такі застереження мінімізують ризик атрофії, телеангіоектазій і стрий. Безперервне та тривале використання менш потужних ТКС на чутливих ділянках також може спричиняти зазначені вище небажані ефекти. В електронному додатку докладно описано моніторинг відповіді на терапію. Призначення ТКС різної потужності на різних ділянках тіла чи залежно від тяжкості АД має бути збалансованим із можливістю поліпрагмазії, що посилює плутанину, вартість лікування, навантаження на пацієнта та членів його родини. Після лікування активної фази АД («встановлення контролю» або «індукція ремісії») настійно рекомендується продовжувати періодичну терапію ТКС для запобігання майбутнім загостренням («утримання контролю» або «проактивна терапія»).
Запитання 1b. Чи ТІК ефективні та безпечні при АД порівняно з ТКС?
ТІК (пімекролімус і такролімус для місцевого застосування)
Рекомендація 4
Пацієнтам віком від 3 місяців із неконтрольованим АД, стійким до зволоження, рекомендується додавання ТІК (пімекролімус, такролімус) порівняно з їх непризначенням (сильна рекомендація, певність доказів висока).
Обґрунтування: ефективність пімекролімусу щодо кількох наслідків АД є проміжною між ефективністю ТКС класу 5 і класів 6-7. Ефективність такролімусу 0,03% подібна до такої ТКС класу 5. Ефективність такролімусу 0,1% подібна до такої ТКС класу 4. Крім того, ТІК можна використовувати після досягнення ремісії як проактивної терапії.
Вибірковий огляд досліджень тварин, які піддавалися супрафізіологічним дозам системних інгібіторів кальциневрину, екстраполяція результатів системного застосування серед пацієнтів після трансплантації органів, а також дані неконтрольованих добровільних систем звітності змусили Управління з контролю за продовольством і медикаментами США (FDA) додати попередження, що ТІК асоціюються з раком. Натомість систематичний огляд усіх рандомізованих та обсерваційних доказів (понад 3,4 мільйона пацієнтів, спостереження до 10 років) не виявив достовірного збільшення випадків раку, незважаючи на використання в немовлят, дітей і дорослих (4,56 на 1000 захворюваності в усіх вікових групах без ТІК проти 4,70 на 1000 з ТІК). Небажані ефекти ТІК включають місцеве подразнення/печіння.
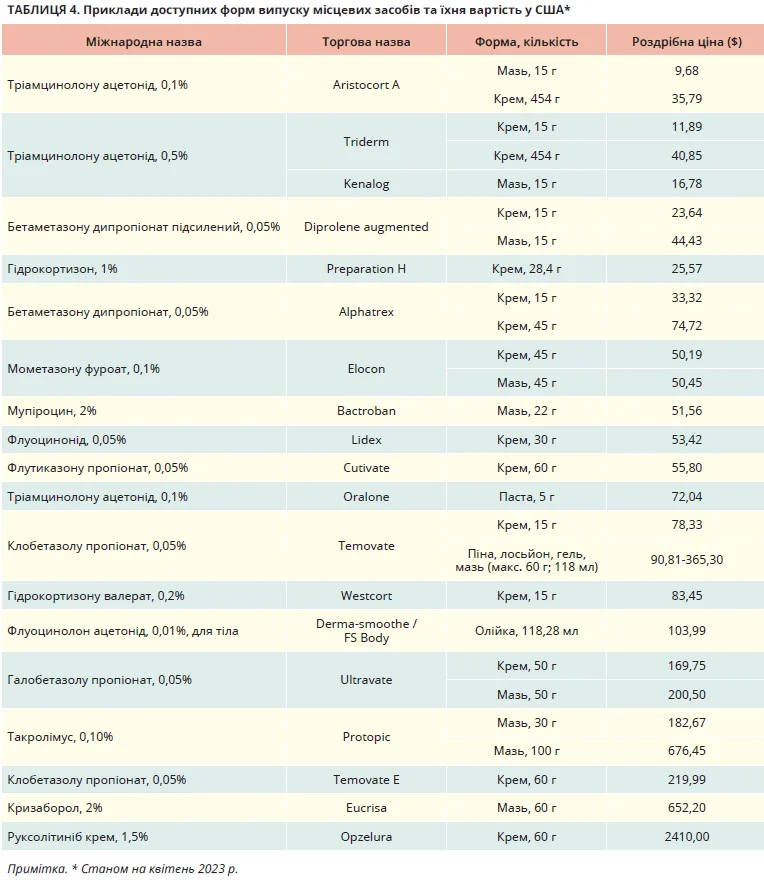
Клініцисти можуть використовувати ТКС і ТІК для різних ділянок тіла. Наприклад, TКС – для всього тіла, ТІК – для чутливіших зон (обличчя, складки). Зазвичай форми випуску ТКС містять більші об’єми порівняно з ТІК, що може бути зручнішим та економічно вигіднішим для пацієнтів (табл. 4).
Далі буде.
Література – в редакції.