Оцінка ефективності та переносимості оригінального й генеричних препаратів мометазону фуроату (спрей назальний) у базисній терапії пацієнтів з персистивним алергічним ринітом
Автори: С.В. Зайков, доктор медичних наук, професор, Національний університет охорони здоров’я України ім. П.Л. Шупика (м. Київ). І.В. Гогунська, докторка медичних наук, професорка, ДУ «Інститут отоларингології ім. проф. О.С. Коломійченка НАМН України» (м. Київ)
Алергічний риніт (АР) являє собою опосередковану імуноглобуліном Е (IgE) реакцію гіперчутливості 1-го типу слизової оболонки носа, що виникає внаслідок впливу алергену на сенсибілізовану до нього людину [14], та є одним з найпоширеніших алергічних захворювань.
Ведення пацієнтів з АР продовжує залишатися актуальною проблемою для систем охорони здоров’я багатьох країн світу, оскільки поширеність його значно зросла від 1990-х рр. разом з урбанізацією, змінами клімату та забрудненням довкілля. АР уражає приблизно 25% дітей і 40% дорослих у всьому світі, часто ігнорується й невчасно діагностується. Він нерідко як пацієнтами, так і медичними працівниками помилково вважається легкою патологією, тоді як насправді це клінічно важливий стан і суттєвий чинник ризику супутніх бронхіальної астми, синуситу, отиту, кон’юнктивіту, синдрому обструктивного апное сну тощо. Також варто звернути увагу на той факт, що нові тютюнові вироби, як-от електронні сигарети та системи нагрівання тютюну, підвищують ризик виникнення АР у підлітків більше, ніж традиційне куріння [5, 14].
АР є імуноопосередкованим запаленням слизової оболонки носа та починається з алергічної імунної відповіді на інгаляційні алергени, джерелами яких є кліщі домашнього пилу, рослинний пилок, продукти життєдіяльності домашніх тварин, комах, пліснява, побутова хімія тощо. Дендритні клітини слизової оболонки носа діють як антигенпрезентувальні клітини та зв’язують указані алергени зі специфічними молекулами головного комплексу гістосумісності класу II. Цей імунний комплекс розпізнається Th0-лімфоцитами, які за допомогою костимуляторних молекул диференціюються в Th2 CD4+-лімфоцити.
Ці клітини виробляють цитокіни, як-от інтерлейкін-4 (IL-4), IL-5 й IL-13, що спричиняє опосередковану IgE запальну реакцію та стимуляцію рецепторів B-клітин, яка призводить до диференціації B-клітин у плазматичні клітини, продуценти антитіл. Під впливом IL-4 B-лімфоцити перемикаються з вироблення IgM на IgE. Під час наступного впливу алергену антигенспецифічний IgE зв’язується з високоафінними рецепторами IgE на тучних клітинах і базофілах, що запускає вивільнення медіаторів (гістаміну, лейкотрієнів, простагландину) й ферментів, які активують матриксні металопротеїнази та призводять до подальшого пошкодження тканин [6].
АР характеризується наявністю назальних і неназальних симптомів. Назальні симптоми охоплюють передню або задню ринорею, чхання, закладеність носа та/або свербіж у носі й іноді зниження нюху (гіпосмію). Ці симптоми можуть зберігатися протягом кількох годин після впливу алергенів, що спричиняють запалення слизової оболонки. Як наслідок, остання стає чутливішою до дії алергенів і неалергічних подразників (як-от сильні запахи, забруднювачі повітря тощо). Неназальні прояви представлені очними симптомами (свербіж, почервоніння очей і сльозотеча), інші симптоми охоплюють свербіж піднебіння, вух, постназальне затікання та кашель. Понад 30% пацієнтів з АР страждають від виснажливих алергічних симптомів, які можуть призвести до тяжкої інвалідності та станів, що загрожують життю, як-от анафілаксія. У складних випадках реакцій гіперчутливості у хворих на АР можуть виникнути тяжкий бронхоспазм, набряк гортані, гіпотензія та шок [8].
За тяжкістю АР класифікується на легкий і помірний/тяжкий. Оцінка ґрунтується на чотирьох критеріях: порушення сну, порушення повсякденної діяльності, погіршення успішності в школі або на роботі та тривожні симптоми. Пацієнти без вищезгаданих проблем вважаються такими, що мають легкий АР, тоді як пацієнти, котрі страждають від одного або кількох із цих симптомів, мають помірний/тяжкий перебіг АР [5, 14].
Метою лікування АР є насамперед полегшення симптомів хвороби й контроль над запаленням слизової оболонки носа та приносових пазух.
Терапевтичні варіанти, доступні для досягнення цієї мети, охоплюють елімінацію алергенів, промивання носа сольовим розчином, пероральні антигістамінні препарати, інтраназальні кортикостероїди (ІнКС), комбіновані інтраназальні спреї, антагоністи лейкотрієнових рецепторів (АЛТР) і алергенспецифічну імунотерапію (АСІТ) [7, 9]. Інші методи лікування, котрі можуть бути призначені за окремими показаннями, охоплюють назальні деконгестанти, пероральні кортикостероїди, біологічну терапію тощо [7].
На будь-якому етапі лікування слід розглянути направлення пацієнта до алерголога для підтвердження діагнозу та перегляду лікування [10].
При АР майже неможливо досягти повного уникнення контакту з причинно значущими алергенами, тому фармакологічне лікування є невід’ємною частиною ведення пацієнтів. Місцева терапія має багато переваг перед системною, оскільки доставляє більшу концентрацію ліків до рецепторів у джерелі запалення та знижує ризик розвитку системних побічних ефектів. Терапією першої лінії для пацієнтів з АР (особливо персистивним) є ІнКС. Більшість пацієнтів з АР, які звертаються до свого сімейного лікаря, мають симптоми середнього та тяжкого ступенів і, безумовно, потребують патогенетичної терапії ІнКС. За регулярного та правильного застосування ІнКС ефективно зменшують запалення слизової оболонки носа й покращують перебіг АР. Результати численних досліджень і метааналізів показали, що ІнКС перевершують антигістамінні препарати й АЛТР у контролі симптомів АР, включно із закладеністю носа та ринореєю. Також було показано, що вони покращують очні симптоми та зменшують інтенсивність симптомів з боку нижніх дихальних шляхів у пацієнтів із супутньою астмою [10].
Механізм, за допомогою якого ІнКС здійснюють свій протизапальний ефект, складний.
Глюкокортикостероїди (ГКС) зв’язуються зі специфічними ГКС-рецепторами, присутніми в цитоплазмі. Утворений комплекс переміщується до ядра клітини, де зв’язується зі специфічними послідовностями ДНК, відомими як елементи глюкокортикоїдної відповіді цільових генів, що призводить до модуляції транскрипції генів, підвищення або зниження їх експресії [12]. Мометазону фуроат, який є сучасним представником групи ІнКС, має хімічну структуру, подібну до такої кортизолу. Наявність подвійного зв’язку в положенні 1, 2 на кільці А й етерифікованого фуроатного фрагмента в положенні 17α призводить до високої глюкокортикоїдної активності та великої спорідненості до ГКС-рецептора відповідно. Займаючи ліпофільну кишеню в ГКС-рецепторі, фуроатний фрагмент посилює зв’язування й активацію рецептора. Спорідненість зв’язування синтетичних ГКС є вищою, ніж у ендогенного кортизолу, та корелює з декількома параметрами фармакологічної активності, як-от місцева протизапальна активність, індукована ГКС активність, інгібування продукції цитокінів Т-клітинами, інгібування рівнів гістаміну та молекул адгезії судинних клітин-1. Порівняно з більш ранніми представниками ІнКС (флутиказоном пропіонатом і будесонідом) мометазону фуроат має найвищу відносну спорідненість до ГКС-рецепторів. Ця важлива характеристика свідчить, що препарат з вищою спорідненістю займатиме таку саму кількість рецепторів за нижчої концентрації, ніж препарат з нижчою спорідненістю [4].
Одним з основних ефектів мометазону фуроату є пригнічення експресії та транскрипції генів, що кодують прозапальні цитокіни, хемокіни, молекули адгезії та ферменти, як-от циклооксигеназа-2 й індуцибельна синтаза оксиду азоту. Ці молекули відіграють вирішальну роль у ініціації та підтриманні запальних реакцій. Завдяки блокуванню їх експресії мометазону фуроат ефективно зменшує запальну реакцію. Він позитивно впливає на імунну систему пацієнтів з АР, оскільки знижує активність і проліферацію Т-лімфоцитів, В-лімфоцитів, макрофагів і тучних клітин. Таким чином зменшуються вивільнення гістаміну й інших медіаторів алергічної реакції та прояви запалення [3].
Мометазону фуроат сприяє синтезу протизапальних білків, як-от ліпокортин-1, який інгібує фосфоліпазу А2. Цей фермент забезпечує синтез арахідонової кислоти, попередника прозапальних ейкозаноїдів простагландинів і лейкотрієнів. Із пригніченням фосфоліпази А2 мометазону фуроат знижує рівні цих прозапальних медіаторів і чинить протизапальну дію. Препарат також стабілізує лізосомальні мембрани, завдяки чому запобігає вивільненню протеолітичних ферментів, які можуть пошкоджувати тканини та спричиняти запалення. Крім того, він знижує проникність капілярів і зменшує набряк [3].
Інтраназальне введення ГКС забезпечує повільне поглинання крізь слизову оболонку носа з великим часом контакту між молекулою стероїду та слизовою носа. Подовжений час перебування в носі залежить від наявності повільно розчинних частинок препарату. Висока ліпофільність мометазону забезпечує більшу спорідненість до тканин, причому найбільш ліпофільні та потужні ІнКС мають найвищу спорідненість зв’язування й утримання в тканинах носа, а також подовжену тривалість дії [4].
Крім ефективності кортикостероїду, потрібно враховувати питання безпеки. Для місцевих ГКС висока локальна протизапальна активність має супроводжуватися низьким системним впливом. Тому тривалий перерозподіл із тканин у системний кровообіг, швидкий і повний печінковий метаболізм сполук до неактивних похідних є сприятливими [13].
Системна біодоступність ІнКС залежить від системної абсорбції через носовий і шлунково-кишковий тракти. 30% інтраназальної дози ГКС залишається в носі. Препарати, що вводяться у вигляді суспензії (ліпофільні препарати), як-от мометазону фуроат, повільно розчиняються після тривалого контакту зі слизовою оболонкою носа, а мукоциліарний кліренс видаляє тверді частинки препарату зі слизової оболонки. Отже, лише невелика частка доставленої дози потрапляє крізь тканини носа в кровотік, тоді як кількість мометазону фуроату, що залишається в носових порожнинах, достатня для отримання терапевтичного ефекту. Близько 70% інтраназальної дози проковтується. Ця фракція ІнКС усмоктується шлунково-кишковим трактом і ефективно метаболізується печінкою з високими значеннями кліренсу. Системна активність ІнКС залежить від системної біодоступності, зв’язування з білками плазми, системного кліренсу та фармакологічної активності. Системна біодоступність мометазону фуроату становить <1,0% та є дуже низькою порівняно з будесонідом (31%) і беклометазоном (44%) [4].
Для мометазону фуроату системні побічні ефекти не притаманні. Якщо повідомлялося про пригнічення функції надниркових залоз і затримку росту в дітей при застосуванні ІнКС беклометазону, то жодного впливу на швидкість росту та/або функцію надниркових залоз не спостерігалося при використанні назального спрею мометазону фуроату в терапевтичних дозах [4].
Застосування ІнКС може потенційно збільшити ризик подразнення носа, сухості, носової кровотечі, перфорації перегородки, чхання та кашлю. Проте дані біопсії слизової оболонки носа до та після 1 року застосування мометазону фуроату в дорослих показали покращення зовнішнього вигляду епітелію та зменшення інфільтрації слизової оболонки носа запальними клітинами (еозинофіли, базофіли, тучні клітини), відсутність ознак її атрофії [4].
Для оптимальної клінічної відповіді на ІнКС необхідним є правильне застосування назального спрею, тому пацієнтів треба консультувати щодо належного використання інтраназальних пристроїв. Найпоширенішими побічними ефектами ІнКС, особливо при їх неправильному використанні, є подразнення слизової оболонки носа та печіння. Цим побічним ефектам зазвичай можна запобігти, спрямовуючи спрей трохи далі від носової перегородки [10].
Отже, мометазону фуроат здійснює свій терапевтичний ефект через багатогранний механізм, що включає модуляцію транскрипції генів, зниження активності імунних клітин і стабілізацію клітинних структур. Потужні протизапальні властивості роблять його ефективним засобом лікування різних запальних і алергічних станів. Сполука мометазону фуроат як потужний місцевий ГКС з успіхом застосовується для місцевого лікування астми, АР і хвороб шкіри [13].
Доведено, що мометазону фуроат за його топічного використання проявляє виражені протизапальні, протисвербіжні та вазоконстрикторні властивості. Серед інших ІнКС препарат вирізняє безпека. Ефективність мометазону фуроату в лікуванні АР було доведено багатьма дослідженнями та практикою клінічного застосування. Застосування мометазону фуроату забезпечує значне зниження назальних симптомів, як-от закладеність, ринорея, чхання та свербіж у носі, а також значне полегшення неназальних симптомів з боку очей, глотки, вуха. Дослідження надають докази рівня Ia щодо ефективності мометазону фуроату в терапії АР порівняно з плацебо. Нарешті, ІнКС, у тому числі мометазону фуроат, також ефективні для запобігання появі симптомів у пацієнтів як з цілорічним, так і з сезонним фенотипом АР. Різні дослідження показали, що ІнКС починають контролювати симптоми в більшості пацієнтів уже з 1-го дня терапії. Наразі ІнКС є рекомендованими препаратами першого ряду терапії помірно тяжких і тяжких випадків інтермітивного та персистивного АР [4], але при цьому їхні ефективність і безпечність можуть залежати від низки таких факторів: 1) яка саме молекула ІнКС використовується; 2) за допомогою якого доставкового пристрою вона впорскується в порожнину носа;
3) з метою лікування застосовується оригінальний чи генеричний лікарський засіб [1].
Саме тому метою нашого дослідження стало оцінювання ефективності й переносимості оригінального та двох генеричних препаратів мометазону фуроату, спрей назальний 50 мкг/дозу, в пацієнтів з персистивним АР протягом 1 місяця спостереження. Для досягнення цієї мети використано такі методи дослідження:
- Вираженість назальних та очних симптомів оцінювалася за загальноприйнятими шкалами TNSS (Total Nasal Symptom Score) і TOSS (Total Ocular Symptom Score) у таких контрольних точках: до початку лікування (1-й день), 7-й, 14-й, 21-й, 28-й дні терапії.
- Для контролю п’ятьох основних симптомів АР (ринорея, закладеність носа, свербіж у носі, чхання, порушення сну) до та в процесі лікування використовували шкалу ТNSS. Симптоми оцінювали за допомогою 4-рівневої шкали зі значеннями від 0 до 3, де 0 – відсутність симптому, 1 – слабо виражений симптом, 2 – помірний, 3 – тяжкі прояви. Симптоми оцінювалися пацієнтом за минулі 24 години. Потім обчислювали суму балів для кожного пацієнта, а в групі обстежених – середнє значення цього показника. Що вищим був бал, то менш контрольованими були симптоми АР у пацієнта.
- Для контролю трьох основних очних симптомів (свербіж, почервоніння очей і сльозотеча) при супутньому алергічному кон’юнктивіті до та в процесі лікування використовували шкалу TOSS. Симптоми також оцінювали за допомогою 4-рівневої шкали: 0 – відсутність симптому, 1 – слабо виражений симптом, 2 – помірний, 3 – тяжкі прояви. Симптоми оцінювалися пацієнтом за минулі 24 години. Потім обчислювали суму балів
для кожного пацієнта, а в групі обстежених – середнє значення цього показника.
- Оцінювання якості життя:
- Показники якості життя пацієнтів оцінювалися за валідованим опитувальником RQLQ (Rhinoconjunctivitis Quality of Life Questionnaire) до початку (день 1-й) і наприкінці спостереження (день 28-й) [14].
- RQLQ являє собою анкету для самостійного заповнення з конкретних захворювань і містить 23 пункти в 5 сферах: носові симптоми (RS), очні симптоми (ES), практичні проблеми (PF), обмеження активності (RL) та інші симптоми (OS). Кожному домену надається 1 бал за 7-бальною шкалою (від 0 – без проблем, до 6 – дуже проблематично). Загальний бал отримується сумацією середніх балів за всіма пунктами.
- Відповідно до RQLQ не визначено спеціальної одиниці для системи підрахунку балів, оскільки за допомогою SPSS аналізуються лише бали, вказані в цифрах.
- Оцінювання профілю безпечності та переносимості препаратів:
- Для цього будь-які небажані явища, що виникали під час приймання лікарських засобів, було зафіксовано, оцінено їхній зв’язок із прийманням препаратів, ступінь тяжкості та вплив на переносимість лікування.
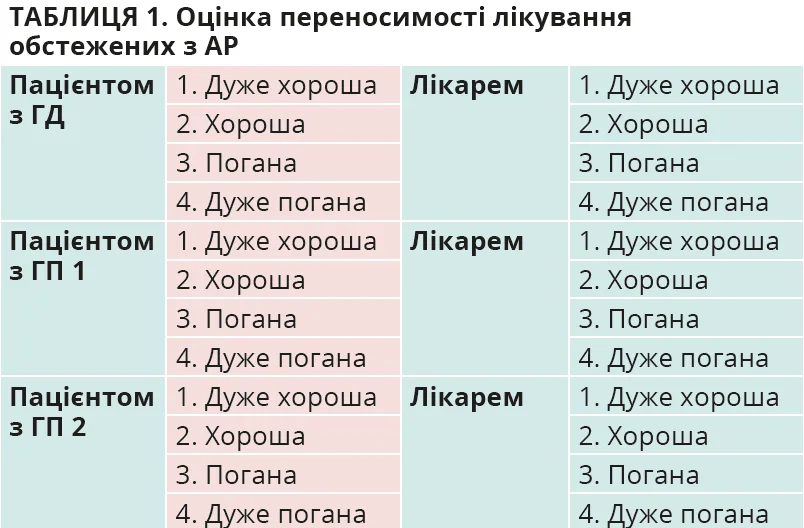
- Комплексна оцінка переносимості оригінального та генеричних препаратів мометазону фуроату визначалася наприкінці лікування на підставі аналізу випадків небажаних проявів побічної дії препаратів і можливих змін у зв’язку з цим режиму терапії з огляду на оцінку переносимості лікування пацієнтом і лікарем. Відповідна методика оцінювання переносимості препаратів мометазону фуроату наведена в таблиці 1.
- Контрольованість перебігу АР оцінювалася наприкінці спостереження за допомогою стандартизованої візуальної аналогової шкали (ВАШ) [11], версії якої для лікаря та пацієнта наведено на рисунках 1 і 2.
Слід зазначити, що поліпшення стану пацієнтів за ВАШ, зумовлене проведеним лікуванням, добре корелює з показниками якості життя пацієнтів з ринокон’юнктивітом, які оцінюються за вищевказаним валідованим опитувальником RQLQ.
Об’єкти дослідження
Це було спостережне одноцентрове відкрите проспективне дослідження тривалістю 1 місяць, до якого увійшли 90 пацієнтів з персистивним АР. Усі пацієнти отримали консультацію й амбулаторне лікування на клінічній базі кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика, що розташована в ДУ «Національний науковий центр фтизіатрії, пульмонології та алергології ім. Ф.Г. Яновського НАМН України» (м. Київ).
Дизайн дослідження
- Група пацієнтів з персистивним АР середньої тяжкості (n=30), які отримували оригінальний мометазону фуроат (Назонекс), назальний спрей 50 мкг/дозу по 2 впорскування в кожну ніздрю 1 раз на день (ранковий прийом) (група дослідження – ГД).
- Група пацієнтів з персистивним АР середньої тяжкості (n=30), які отримували генеричний мометазону фуроат європейського виробника, назальний спрей 50 мкг/дозу по 2 впорскування в кожну ніздрю 1 раз на день (ранковий прийом) (група порівняння 1 – ГП 1).
- Група пацієнтів з персистивним АР середньої тяжкості (n=30), які отримували генеричний мометазону фуроат вітчизняного виробника, назальний спрей 50 мкг/дозу по 2 впорскування в кожну ніздрю 1 раз на день (ранковий прийом) (група порівняння 2 – ГП 2).
Контрольні точки спостереження: до початку лікування, 7 днів, 14 днів, 21 день, 28 днів терапії.
Критерії залучення в дослідження:
1) ознайомлення пацієнта з протоколом дослідження та підписання ним форми поінформованої згоди на участь;
2) вік пацієнта – 18-60 років;
3) діагноз АР середнього ступеня тяжкості, встановлений відповідно до рекомендацій ARIA (2020) та ICAR (2023);
4) вираженість назальних симптомів на момент призначення препаратів – мінімум 6 балів (максимум 15 балів);
5) відсутність приймання інших ІнКС, пероральних та інтраназальних антигістамінних препаратів, АЛТР, назальних деконгестантів за останній тиждень
до початку дослідження;
6) відсутність на момент початку дослідження гострих респіраторних інфекцій верхніх дихальних шляхів;
7) прихильність пацієнта до лікування.
Критерії вилучення з дослідження:
1) вагітність, період лактації;
2) вік до 18 та понад 60 років;
3) тяжка супутня патологія (запальні хвороби, імунодефіцитні стани) або інші стани, які можуть давати симптоматику з боку носа/очей (анатомічні дефекти перегородки носа тощо);
4) тяжкі неконтрольовані супутні хвороби серцево-судинної системи, печінки, нирок, неврологічні, психіатричні, алкоголізм, наркоманія;
5) непереносимість мометазону фуроату, підтверджена документально;
6) медикаментозна алергія на препарат, що досліджується, або його складові частини;
7) відмова від участі в дослідженні;
8) порушення режиму лікування;
9) приймання системних кортикостероїдів, інших протизапальних препаратів, противірусних засобів в останній місяць перед початком дослідження;
10) використання АСІТ, біологічної терапії в процесі дослідження;
11) розвиток серйозної непередбачуваної побічної дії препаратів, що досліджуються.
Отже, відповідно до мети дослідження пацієнти були розподілені на три репрезентативні групи, діагноз АР у яких установлювався за загальноприйнятими критеріями згідно з європейськими рекомендаціями [5, 14].
Серед обстежених усіх груп переважали жінки (66,7 проти 33,3% у ГД, 60,0 проти 40,0% у ГП 1 та 56,7 проти 43,3% у ГП 2). Середній вік пацієнтів становив 36,34±6,56; 40,87±7,37 та 41,47±7,81 року відповідно. Тривалість періоду від моменту встановлення діагнозу АР становила 4,75±1,09 року в ГД, 5,13±1,98 року в ГП 1 та 4,32±1,39 року в ГП 2. Серед коморбідних захворювань у обстежених переважали хронічний риносинусит з/без носових поліпів (у 33,3% осіб у ГД, у 30,0% – у ГП 1, у 36,7% – у ГП 2) й алергічний кон’юнктивіт (у 46,7; 43,3 та 53,3% випадків відповідно). Крім досліджуваних препаратів мометазону фуроату, пацієнти отримували назальні іригації сольовими розчинами. Отже, за статево-віковим складом, тяжкістю перебігу, характером лікування до початку дослідження, рівнем контролю астми, індексом курця людини, супутньою патологією, тривалістю періоду від установлення діагнозу АР групи обстежених осіб були репрезентативними (p>0,05 для всіх випадків). Результати лікування пацієнтів усіх груп оцінювали за динамікою даних клініко-функціонального й лабораторного обстежень. Було враховано верифіковані діагнози та дані консультацій суміжних спеціалістів, наявні результати загальноклінічних, функціональних і лабораторних обстежень. Дослідження проведені за згодою хворих, а методика їх виконання відповідала перегляду Гельсінської декларації 1983 р. Протокол дослідження було схвалено локальною етичною комісією, учасники були ознайомлені з погоджувальним листом і підписали його при залученні в дослідження, структура якого відповідала офіційно прийнятій. Статистична обробка отриманих результатів здійснювалася методами параметричної описової статистики з використанням статистичного пакета IBM SRSS Statistics 27.0. Довірчі інтервали обчислювалися при заданому рівні значущості р<0,05 [2].
Результати та їх обговорення
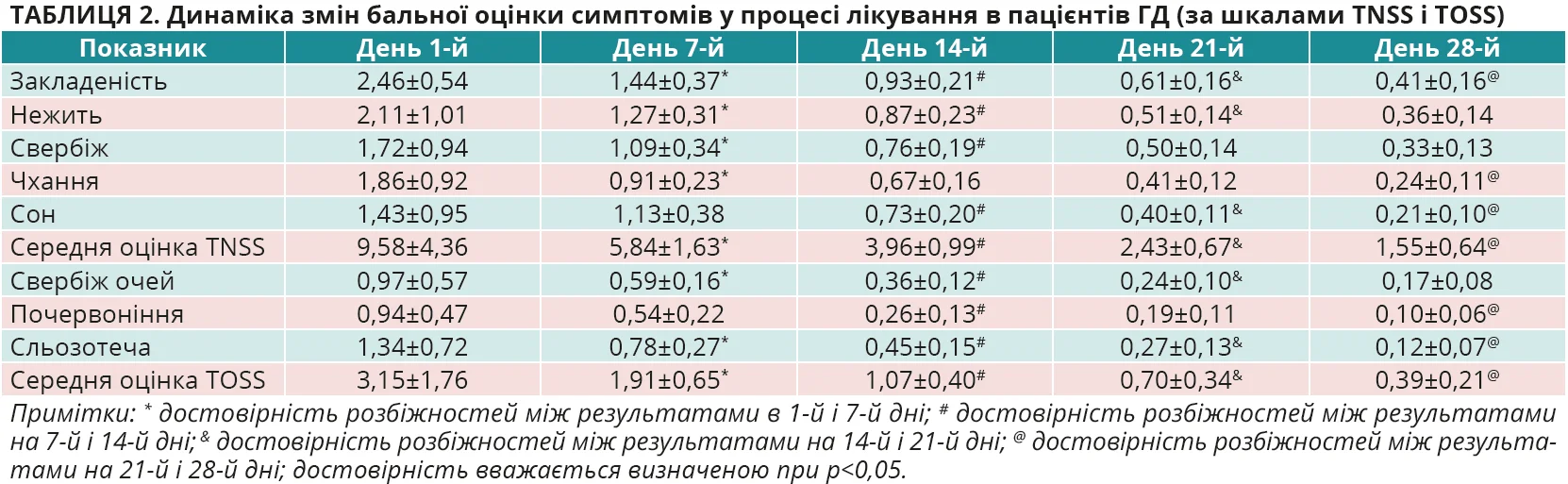
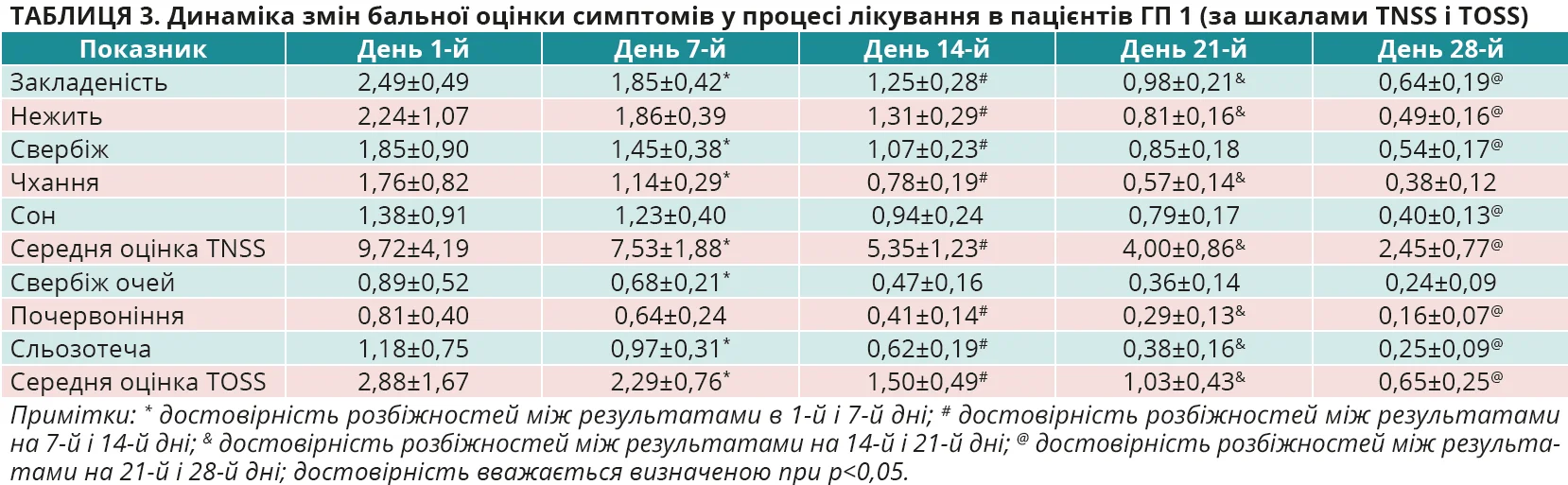
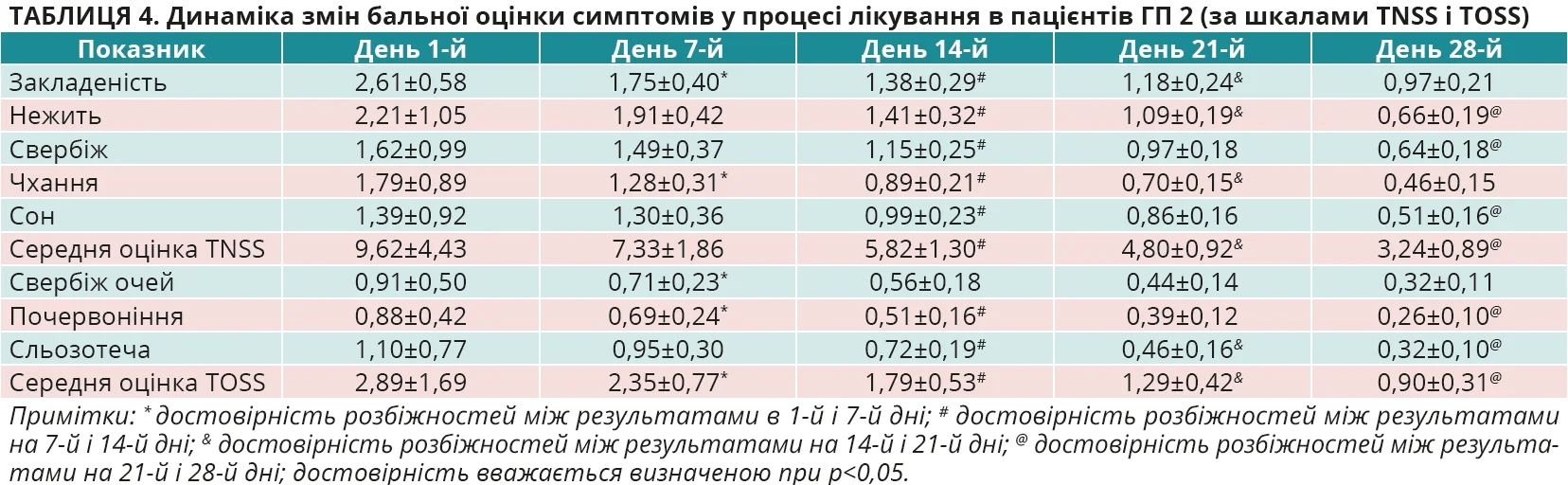
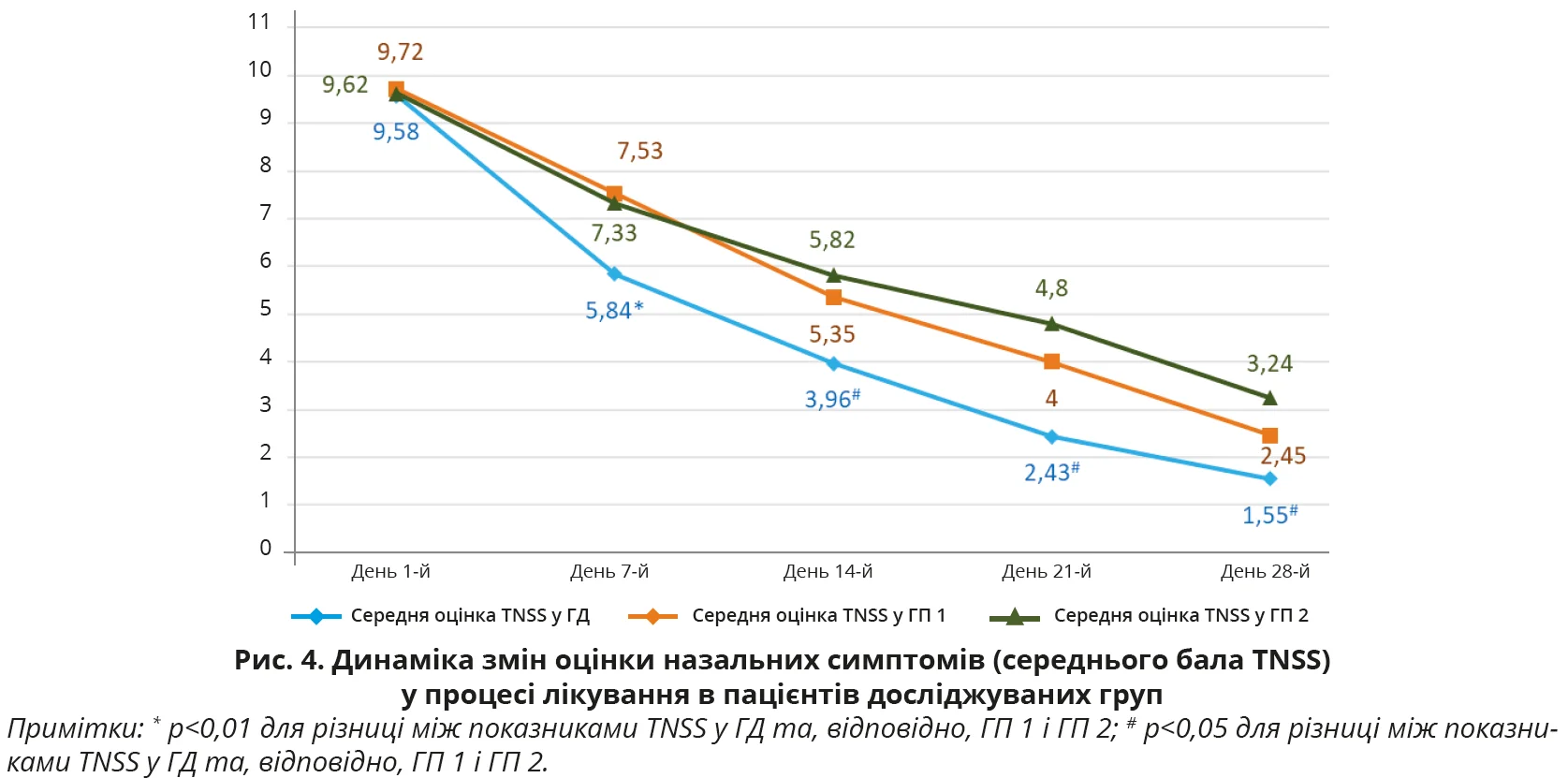
На момент первинного обстеження осіб з ГД середня оцінка за шкалою TNSS становила 9,58±4,36 бала, за шкалою TOSS – 2,95±1,76 бала, в ГП 1 – 9,72±4,19 та 2,88±1,67 бала, а в ГП 2 – 9,62±4,43 та 2,89±1,69 бала відповідно. Різниця показників між групами не є достовірною, р>0,05 для всіх випадків. Динаміка змін бальної оцінки симптомів у процесі лікування в пацієнтів з ГД, ГП 1 і ГП 2 в кожній з контрольних точок оцінювання ефективності лікування наведена в таблицях 2-4 та на рисунках 3-6.
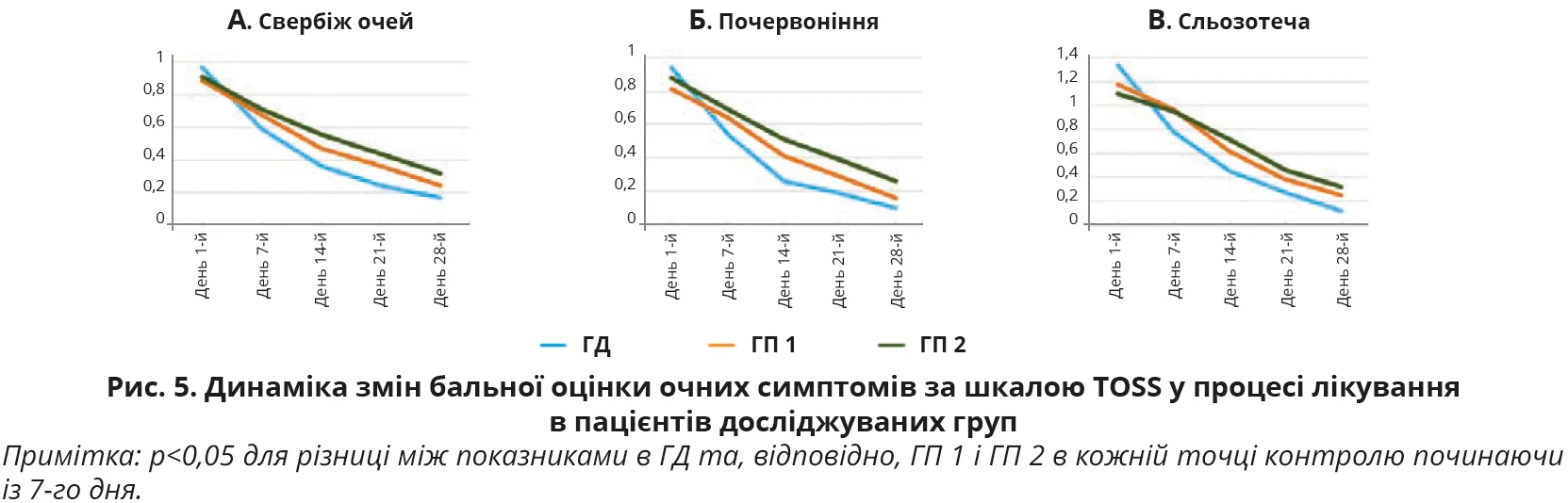
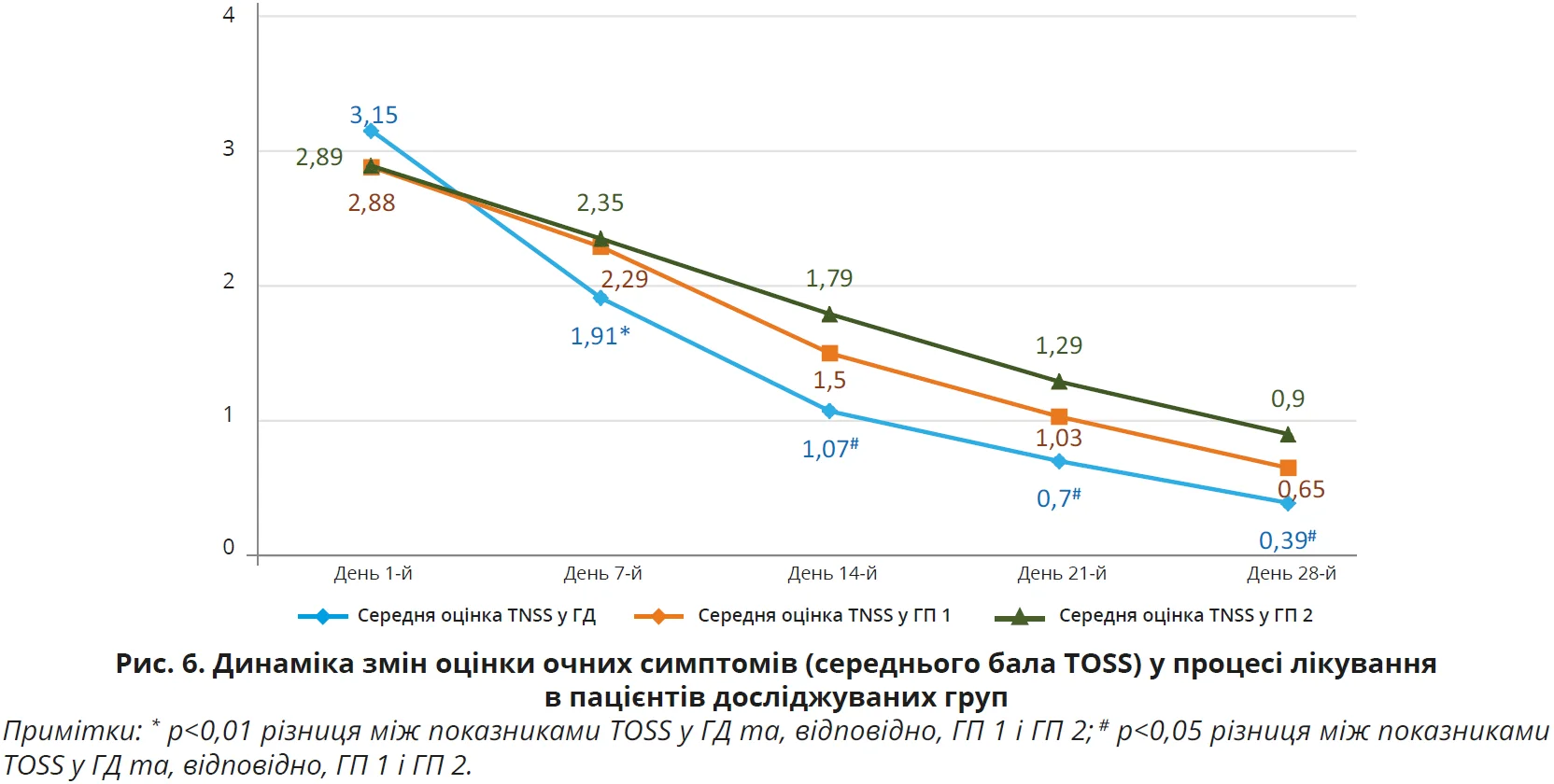
З наведених даних видно, що на початку дослідження (день 1-й) вираженість окремих назальних та очних симптомів, а також їх середня оцінка в балах за шкалами TNSS і TOSS були майже однаковими в ГД, ГП 1 і ГП 2, р>0,05 для всіх випадків. У процесі лікування було відзначено статистично достовірне покращення назальних симптомів (шкала TNSS) за окремими симптомами та середньою оцінкою балів, на якій логічно більшою мірою акцентувати увагу, в усіх групах обстежених. Покращення було найбільш швидким і вираженим (рис. 3, 4), причому вже на 7-й день лікування, саме в пацієнтів ГД, показник TNSS якої становив 5,84±1,63 бала проти 7,53±1,88 бала в ГП 1 та 7,33±1,86 бала в ГП 2. Різниця між показниками TNSS у ГД та ГП 1 і ГП 2 достовірна, р<0,01 для всіх випадків. А різниця між показниками в ГП 1 і ГП 2 виявилася недостовірною, р>0,05. Аналогічно достовірне покращення відзначено і з боку очних симптомів (шкала TOSS) у всіх групах обстежених, але швидша й вираженіша (рис. 5, 6) їх позитивна динаміка за середньою оцінкою балів спостерігалася вже на 7-й день лікування саме в пацієнтів ГД. Середня оцінка TOSS у ГД становила 1,91±0,65 бала проти 2,29±0,76 бала в ГП 1 та 2,35±0,77 бала в ГП 2. Різниця між показниками TOSS у ГД та ГП 1 і ГП 2 достовірна, р<0,01 для всіх випадків. А різниця між показниками в ГП 1 і ГП 2 виявилася недостовірною, р>0,05. Щодо динаміки покращення окремих назальних та очних симптомів в обстежених, то слід зазначити, що на початку лікування пацієнтів з АР у всіх групах найбільше турбували закладеність носа (2,46±0,54 у ГД, 2,49±0,49 у ГП 1 та 2,61±0,58 у ГП 2), нежить (2,11±1,01; 2,24±1,07 та 2,21±1,05 бала відповідно), чхання (1,86±0,92; 1,76±0,82; 1,79±0,89 бала відповідно) та сльозотеча (1,34±0,72; 1,18±0,75; 1,10±0,77 бала відповідно).
У процесі спостереження (рис. 3 та 5) відзначалося статистично достовірне зниження бальної оцінки кожного із симптомів у всіх групах, але вираженіше – в ГД (p<0,05 для всіх випадків), а в кінцевій контрольній точці на 28-й день лікування симптомом, що найбільше турбував пацієнтів, лишилася закладеність носа (0,41±0,16 у ГД, 0,64±0,19 у ГП 1 та 0,97±0,21 у ГП 2), яка, втім, істотно знизилася від значення в первинній контрольній точці на початку лікування в усіх групах спостереження, але найістотніше – в ГД (p<0,05 для всіх випадків). Слід також підкреслити, що вказані тенденції позитивної динаміки назальних та очних симптомів АР на 7-й день лікування зберігалися до кінця спостереження за пацієнтами та наприкінці дослідження ефективність лікування осіб у ГД виявилася достовірно вищою проти груп порівняння (р<0,05 для всіх випадків) як за назальними (рис. 4) (1,55±0,64 проти 2,45±0,77 та 3,24±0,89 бала відповідно), так і за очними (рис. 6) (0,39±0,21 проти 0,65±0,25 та 0,90±0,31 бала відповідно) симптомами.
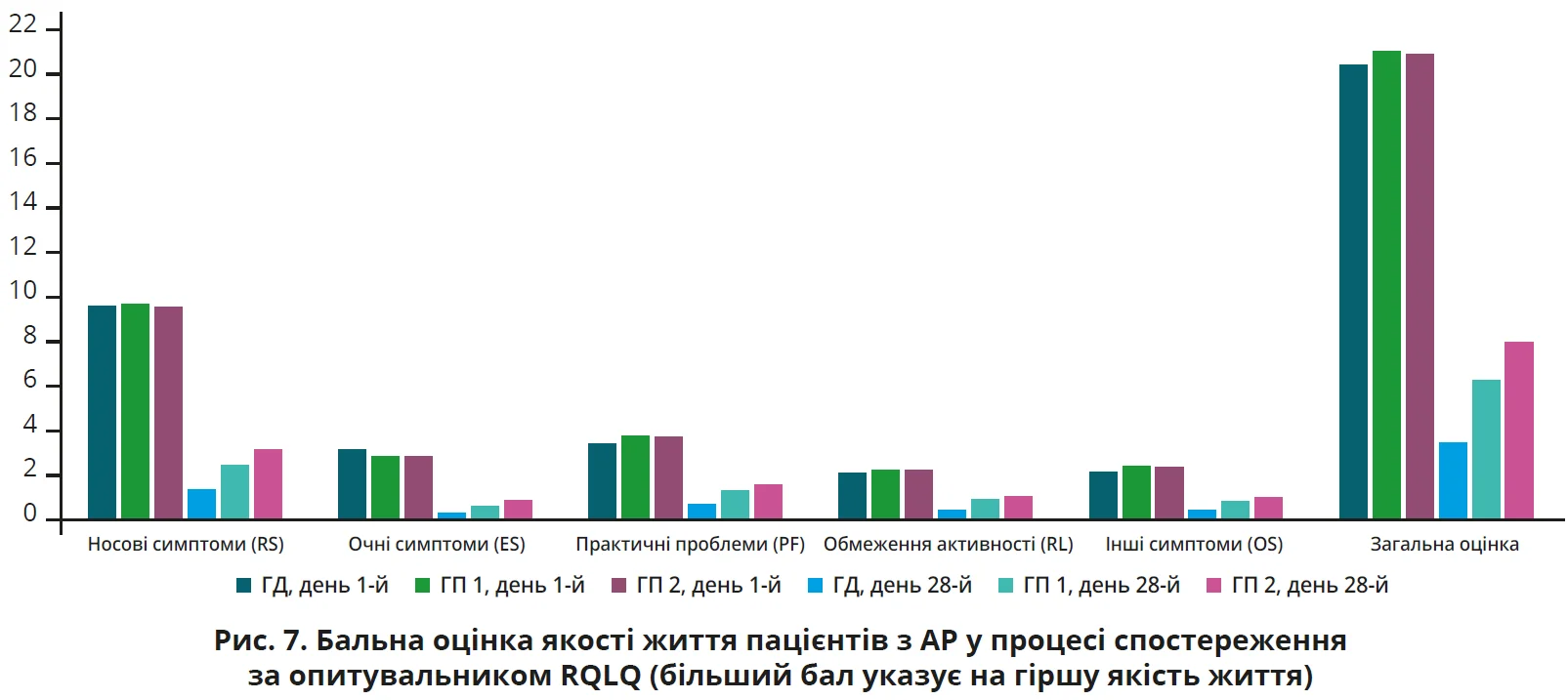
Згідно з метою та методами дослідження ми провели бальну оцінку якості життя пацієнтів за опитувальником RQLQ у процесі лікування. Відповідні дані наведено в таблиці 5 і на рисунку 10. У контрольній точці (день 28-й) спостереження відзначено статистично достовірне покращення якості життя за опитувальником RQLQ у процесі лікування в усіх групах обстежених, але в ГД (середня оцінка – 3,52±1,22 бала проти 6,26±1,96 бала в ГП 1 та 8,01±2,28 бала в ГП 2) воно виявилося достовірно (р<0,05 для всіх випадків) більшим, аніж у ГП 1 і ГП 2, що також свідчило про вищу ефективність у лікуванні АР оригінального мометазону фуроату порівняно з генеричними його препаратами.
Наприкінці спостереження пацієнти й лікарі оцінили переносимість оригінального мометазону фуроату та його генеричних препаратів за такими критеріями: 1) дуже хороша; 2) хороша; 3) погана; 4) дуже погана. У ГД 25 (83,3%) пацієнтів вважали переносимість оригінального мометазону фуроату дуже хорошою, 4 (13,3%) особи – хорошою та лише 1 (3,4%) пацієнт – поганою. Майже аналогічною була й оцінка переносимості мометазону фуроату з боку лікарів. Дуже хорошою вони вважали її у 24 (80,0%) осіб, хорошою – в 4 (13,3%) та поганою – у 2 (6,7%). Така оцінка переносимості препарату в ГД була пов’язана з тим, що вказані 2 особи відзначали відчуття печіння в носовій порожнині та подразнення слизової оболонки носа, які не завадили продовженню лікування. Дещо іншою виявилася оцінка пацієнтами та лікарями переносимості мометазону фуроату
в ГП 1 і ГП 2. Зокрема, дуже хорошою її оцінили 18 (60,0%) пацієнтів у ГП 1 і 16 (53,3%) осіб у ГП 2, хорошою – 7 (23,3%) пацієнтів у ГП 1 і 7 (23,3%) осіб у ГП 2. При цьому 5 (16,7%) хворих у ГП 1 і 7 (23,3%) у ГП 2 оцінили переносимість мометазону фуроату як погану або дуже погану. Аналогічною виявилася оцінка переносимості генеричних препаратів мометазону фуроату з боку лікарів, оскільки 3 осіб з ГП 1 і 4 осіб з ГП 2 скаржилися на відчуття печіння в носовій порожнині, 2 особи з ГП 1 і 3 особи з ГП 2 мали подразнення слизової оболонки носа. Вказані побічні ефекти не стали перепоною для проведення подальшого лікування, але свідчили на користь кращої переносимості оригінального мометазону фуроату порівняно з його генеричними препаратами.
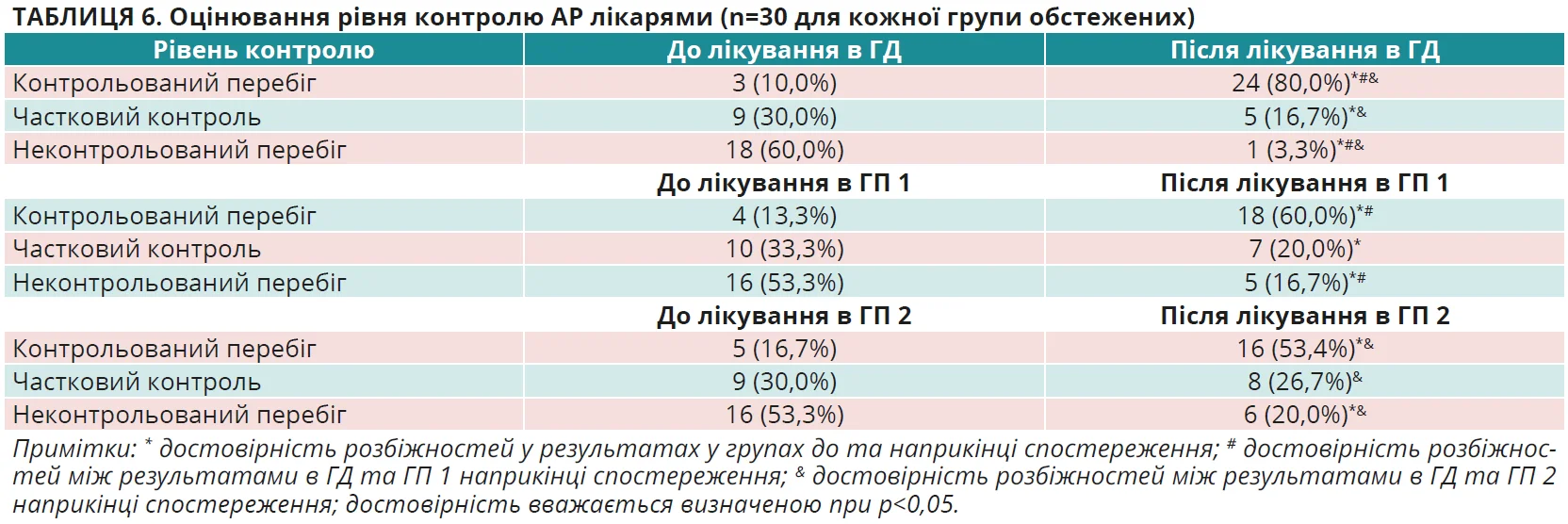
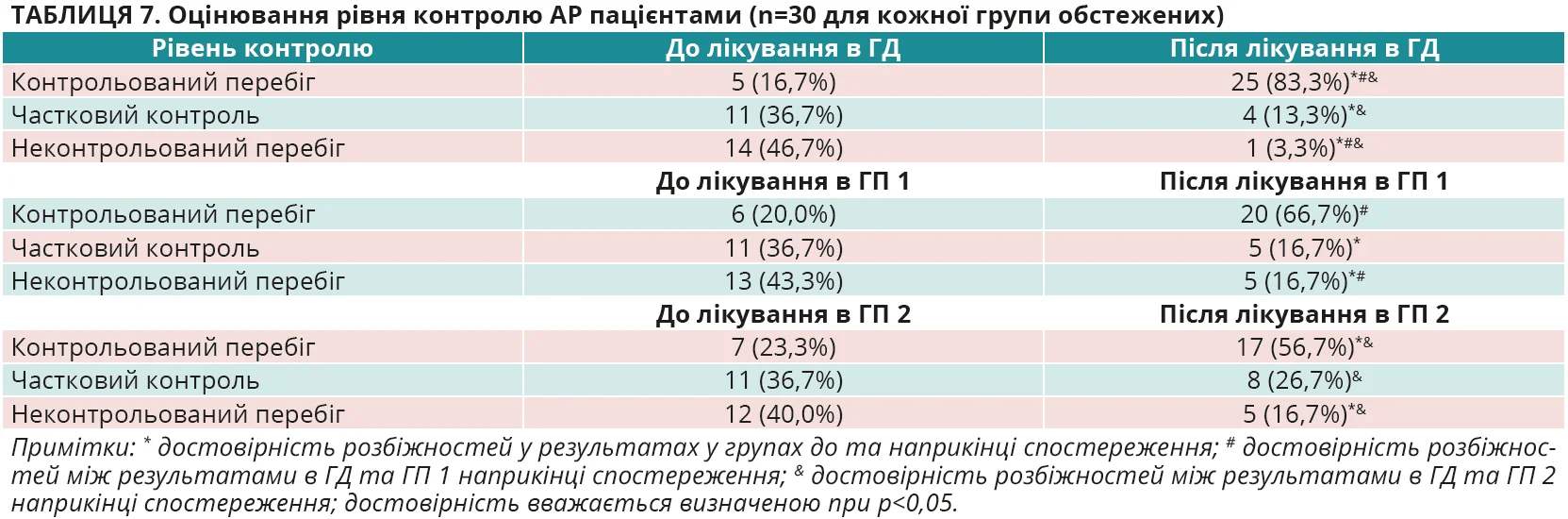
Важливе місце у визначенні ефективності лікування пацієнтів з АР займає оцінка контролю хвороби, яка проводилася лікарями й пацієнтами на початку та наприкінці спостереження з використанням стандартизованої ВАШ [13]. Відповідні результати наведено в таблицях 6 і 7. Вони додатково продемонстрували, що використання оригінального спрею мометазону фуроату, за оцінкою лікарів, у більшої кількості пацієнтів з АР дало змогу досягнути повного (у 80,0% у ГД проти 60,0% у ГП 1 та 53,4% у ГП 2) або часткового (у 16,7% у ГД проти 20,0% у ГП 1 та 26,7% у ГП 2) контролю над перебігом хвороби, що сумарно становило 96,7% випадків у ГД, 73,4% – у ГП 1 та 80,1% – у ГП 2. Отже, частота повного контролю перебігу АР через 28 днів спостереження, за оцінкою лікарів, збільшилася у 8 разів у ГД, в 4,5 раза в ГП 1 і в 3,2 раза в ГП 2. При цьому слід зазначити, що неконтрольованим перебіг АР залишився лише в 3,3% осіб у ГД проти 16,7% обстежених у ГП 1 та 20,0% осіб у ГП 2. Різниця результатів між групами достовірна, р<0,05 для всіх випадків. Подібними виявилися результати оцінки контролю симптомів АР і з боку пацієнтів. У більшої кількості пацієнтів з АР досягнуто повного (у 83,3% у ГД проти 66,7% у ГП 1 та 56,7% у ГП 2) або часткового (у 13,3% у ГД проти 16,7% у ГП 1 та 26,7% у ГП 2) контролю над перебігом хвороби, що сумарно становило 96,7% випадків у ГД, 83,4% – у ГП 1 та 83,4% – у ГП 2. Отже, частота повного контролю перебігу АР через 28 днів спостереження, за оцінкою пацієнтів, збільшилася в 5 разів у ГД, в 3,3 раза в ГП 1 і в 2,4 раза в ГП 2. При цьому слід підкреслити, що неконтрольованим перебіг АР залишився лише в 3,3% осіб у ГД проти 16,7% обстежених у ГП 1 та 26,7% осіб у ГП 2. Різниця результатів між групами достовірна, р<0,05 для всіх випадків.
Висновки
- Назальний спрей мометазону фуроату є ефективним засобом у лікуванні пацієнтів з персистивним АР, оскільки він ефективно усуває назальні й очні симптоми хвороби, а також істотно покращує якість життя відповідної категорії осіб.
- Оригінальний спрей мометазону фуро ату (за швидкістю настання терапевтичного ефекту на 7-й день лікування та збереження такого ефекту на 28-й день спостереження) виявився ефективнішим, аніж обидва (іноземного та вітчизняного виробника) генеричні препарати мометазону фуроату, оскільки в процесі лікування саме оригінальним препаратом відзначено статистично достовірно вираженіше покращення назальних (за шкалою TNSS), очних (за шкалою TОSS) симптомів і показників якості життя (за опитувальником RQLQ) пацієнтів з АР.
- За 4 тижні застосування оригінального та генеричних назальних спреїв мометазону фуро ату в жодного пацієнта не було зареєстровано серйозних (носові кровотечі, виразки слизової оболонки носа, бронхоспазм, анафілаксія тощо) побічних ефектів терапії, які примусили б їх відмовитися від подальшого застосування препаратів мометазону фуроату, але менш серйозні (відчуття печіння в носовій порожнині, подразнення слизової оболонки носа) побічні ефекти частіше відзначалися при застосуванні генеричних препаратів мометазону фуроату, що свідчило про їх дещо гіршу переносимість.
- Використання оригінального спрею мометазону фуроату дало змогу отримати повний або частковий контроль хвороби в більшої кількості пацієнтів з АР: 96,7% випадків у ГД, 73,4% – у ГП 1 та 80,1% – у ГП 2, за оцінкою лікарів, і в 96,7; 83,4 та 83,4% спостережень відповідно, за оцінкою пацієнтів. При цьому неконтрольованим перебіг АР залишився, за оцінкою лікарів, лише в 3,3% осіб у ГД проти 16,7% обстежених у ГП 1 та 20,0% осіб у ГП 2, а за оцінкою пацієнтів – у 3,3; 16,7 та 26,7% випадків відповідно.
- Чотиритижневий курс застосування назального спрею мометазону фуроату не забезпечував повного зникнення назальних, очних симптомів і нормалізації якості життя в пацієнтів з персистивним АР, тому лише комплексний підхід (освітні програми, елімінаційні заходи, тривала фармакотерапія, АСІТ) має використовуватися у веденні цієї категорії пацієнтів.
Список літератури – в редакції.