Оцінка ефективності та переносимості оригінального й генеричного препаратів монтелукасту натрію в базисній терапії пацієнтів з вірус-індукованими загостреннями бронхіальної астми
Автори: С.В. Зайков, доктор медичних наук, професор, Національний університет охорони здоров’я України ім. П.Л. Шупика (м. Київ), І.В. Гогунська, докторка медичних наук, професорка, ДУ «Інститут отоларингології ім. проф. О.С. Коломійченка НАМН України» (м. Київ)

Актуальність проблеми
Бронхіальна астма (БА) є найпоширенішим хронічним захворюванням дихальних шляхів. Незважаючи на появу високоефективних лікарських засобів і успіхів у веденні осіб з астмою, її загострення продовжують становити значний тягар для пацієнтів, їхніх родин, суспільства та системи охорони здоров’я [35]. Загострення БА характеризуються прогресивним наростанням інтенсивності симптомів, порушенням функції легень і являють собою погіршення звичайного стану пацієнта, що потребує посилення лікування. Загострення пов’язані з дихальною недостатністю, погіршенням якості життя пацієнтів, потребою в лікуванні системними кортикостероїдами та ризиком небажаних проявів від їх застосування, а також підвищеним ризиком астмазалежної смертності [18].
Загострення астми виникають унаслідок багатосторонньої взаємодії між чинниками довкілля й індивідуальними характеристиками пацієнта. Серед численних тригерів загострень, як-от дія алергенів та інших типів інгаляційного впливу (наприклад, факторів забруднення довкілля, погодних умов), низька прихильність пацієнтів до терапії, неконтрольований перебіг БА, куріння та генетичний поліморфізм, саме респіраторні вірусні інфекції (РВІ), особливо спричинені риновірусом, є переважними в різних вікових групах пацієнтів [18, 35].
Вважається, що близько 95% випадків загострень астми в дітей і близько 78% у дорослих пов’язані з вірусними інфекціями [37]. Доведено тісний зв’язок між РВІ та виникненням астми, зокрема з респіраторно-синцитіальним вірусом (RSV) і риновірусом (RV) [9].
Між механізмами патогенезу БА та РВІ є різноспрямований взаємозв’язок, але поєднаний вплив алергенів і вірусів чинить шкідливий синергічний ефект на клінічний перебіг астми та результати її лікування [28]. Сенсибілізація до аероалергенів не тільки бере безпосередню й активну участь у розвитку астми, але й підвищує сприйнятливість пацієнтів до рецидивних РВІ [35]. Підвищена чутливість до вірусів може бути спричинена первинним дефектом уродженого противірусного імунітету в деяких осіб з астмою, пов’язаним з підвищеною уразливістю епітелію та його бар’єрною дисфункцією, або дефектами у виробленні Тoll-подібного рецептора-7 чи інтерфероногенезу. Також відомо, що сенсибілізація до аероалергенів та/або наявність еозинофільного запалення пригнічують і механізми набутого противірусного імунітету [8].
Атопічна та неатопічна БА відрізняються тим, як імунні клітини бронхіального епітелію реагують на вірусні інфекції. Зв’язаний з алергеном імуноглобулін Е (IgE) пригнічує вироблення інтерферону (IFN-I) плазмоцитоїдними дендритними клітинами та супресором сигналізації цитокінів, що виробляється Th2-хелперами. Вроджені лімфоїдні клітини пригнічують вироблення противірусних IFN Th1-хелперами й епітеліальними клітинами [28]. Макрофаги через інтерлейкін-13 (IL-13) зумовлюють стимуляцію хітиназоподібного білка Ym1, який пригнічує противірусний імунітет. Хітинази та білки, подібні до хітинази, значно активуються при астмі й пов’язані зі зниженням противірусного захисту в пацієнтів з нейтрофільним фенотипом астми [8].
Пов’язані з БА порушення захисних механізмів і структурні аномалії підвищують чутливість організму осіб з астмою до респіраторних вірусів. Окрім того, хронічне запалення дихальних шляхів і зниження мукоциліарного кліренсу на тлі зміненої імунної відповіді сприяють реплікації та поширенню вірусів [40].
Своєю чергою, респіраторні віруси уражають епітелій дихальних шляхів і можуть призвести до запалення 2-го типу, яке й так характерне для більшості пацієнтів з БА, що супроводжується переважанням серед запальних клітин еозинофілів, які є ключовими для подальшої ескалації запальної відповіді. Наявність запалення 2-го типу та відповідне підвищення рівня певних біомаркерів істотно впливають на ризик і механізми розвитку вірус-індукованих загострень астми [35].
Вірус-індуковані загострення астми відрізняються від інших загострень астми навіть на молекулярному рівні та зазвичай мають більшу тяжкість. Після РВІ повільно, але на тривалий час підвищуються рівні цитокінів Th2. Це може пояснити тривалі післяінфекційні симптоми, які спостерігаються в пацієнтів з астмою. Існує реципрокний патогенний механізм, який продовжує цикл вірусної інфекції та запалення дихальних шляхів. У післяінфекційний період пацієнти мають підвищений ризик загострень астми ще й неінфекційної природи, оскільки віруси пошкоджують епітеліальний бар’єр дихальних шляхів, тим самим відкриваючи шлях для агресивної дії алергенів та інших тригерних факторів, які спричиняють наступні загострення хвороби [28, 35].
Тобто пацієнти з астмою не тільки більш схильні до вірусних інфекцій, але й переживають тяжчі загострення астми та триваліше відновлення стану здоров’я після кожного епізоду РВІ й загострення БА. Запальна реакція, зумовлена вірусними патогенами, може посилити бронхоконстрикцію та гіперсекрецію слизу, що додатково погіршує дихальну функцію. Такі вірусні інфекції загалом спричиняють прогресування хронічних захворювань легень [40].
Етіологічне різноманіття вірусів, які призводять до загострення БА, представлено риновірусами, RSV, вірусами грипу, парагрипу, метапневмовірусом, ентеровірусами й аденовірусами, бокавірусом, цитомегаловірусом, вірусом простого герпесу [34]. Проте саме RV є основним інфекційним чинником загострення астми. Молекулярна фізіологія свідчить, що в основі загострень астми, спричинених RV, лежить як додаткова активація запалення Т2, так і зміни у виробленні IFN. Еозинофіли сприяють імунній відповіді, індукованій RV, через еозинофіл-опосередковану презентацію антигена й ініціацію противірусної відповіді Т-клітин, що, своєю чергою, спричиняє запалення дихальних шляхів і посилює симптоми астми. Після зараження RV у дихальних шляхах активуються кілька сигнальних молекул T2, включно з IL-4, IL-5, IL-13, IL-25 та IL-33, які пов’язані зі збільшенням кількості еозинофілів у нижніх дихальних шляхах пацієнтів з астмою [37].
RSV є поширеним респіраторним збудником серед немовлят, особливо віком 2-3 місяці, відповідальним за приблизно 80% інфекцій нижніх дихальних шляхів. Це провідний тригер бронхіоліту та пневмонії в дітей раннього віку та є причиною гіперреактивності дихальних шляхів, лізингу й астми в 30-40% випадків. Підвищене утворення слизу є ключовим механізмом, що спричиняє тяжкий перебіг бронхіту та підвищений ризик загострення астми через вплив RSV [25].
На віруси грипу припадає близько 25% випадків загострення астми протягом відповідного епідемічного сезону. Дослідження на мишах показали, що шляхи запалення, пов’язані з і Т2, і не Т2, спричиняють загострення астми, пов’язані з вірусом грипу. Він може загострити перебіг астми, в тому числі, шляхом участі в ремоделюванні дихальних шляхів, що погіршує подальший прогноз для осіб з БА [25, 37].
Участь інших збудників у вірус-індукованих загостреннях астми є пропорційно меншою, але не менш клінічно важливою. Після пандемії коронавірусної хвороби (COVID-19) спостерігається зміна сезонності РВІ. Відбулося збільшення післяпандемічної захворюваності на грип, метапневмовірус, RSV і RV. Не лише зросла загальна кількість випадків, а й різко змістився пік захворюваності для певних вірусів [28].
Отже, РВІ залишаються глобальною проблемою охорони здоров’я, оскільки вони спричиняють високу захворюваність і смертність, особливо серед уразливих груп населення, дітей, людей похилого віку й осіб зі зниженим імунітетом. Це надзвичайно актуально і для пацієнтів, які страждають на БА, в тому числі дітей і дорослих, і для лікарів, які ними опікуються, адже вірусні інфекції призводять до загострень, обтяжують подальший перебіг захворювання та потребують не тільки лікування, але й раціональної профілактики як РВІ, так і загострень астми.
Хоча механізми, що лежать в основі вірус-індукованих загострень БА, до кінця не встановлені, роль багатьох молекулярних факторів і запальних клітин у цьому процесі є безсумнівною [42]. Одними з найважливіших ефекторів запалення виступають цистеїнілові лейкотрієни, які зв’язуються з відповідними рецепторами CysLT1 і реалізують розвиток бронхоспазму, активацію виділення мокротиння, підвищення проникності судин, збільшення кількості еозинофілів. Показано, що під час спровокованих РВІ загострень БА кількість цистеїнілових лейкотрієнів у дихальних шляхах істотно зростає [13, 17, 32]. Ефективно усунути вплив цистеїнілових лейкотрієнів на пацієнтів з БА й алергічним ринітом можливо завдяки використанню специфічних антагоністів їхніх рецепторів, зокрема монтелукасту. Саме ця група так званих антагоністів лейкотрієнових рецепторів (АЛТР) здатна підсилити протизапальні ефекти інгаляційних кортикостероїдів (ІКС), які не гальмують продукцію лейкотрієнів, і знижувати побічні ефекти останніх завдяки зменшенню їх кумулятивної дози [39]. У реальній клінічній практиці доведено, що селективний антагоніст АЛТР монтелукаст запобігає вірус-індукованим загостренням БА в дітей і дорослих [6, 11, 24, 36]. Переваги монтелукасту було зафіксовано як у осіб, які вживали ІКС, так і в пацієнтів, які не лікувалися ними. Навіть короткий курс монтелукасту (в межах 7 днів), розпочатий одразу після появи симптомів РВІ чи ознак загострення БА, здатен зменшити кількість відвідувань лікаря та госпіталізацій, тривалість хвороби, застосування β-агоністів і пероральних кортикостероїдів (преднізолону) [6, 36].
Поєднане застосування АЛТР та ІКС є дієвішим у лікуванні вірус-індукованих загострень, аніж монотерапія ІКС [33]. Метааналіз 11 рандомізованих контрольованих досліджень за участю 1097 дітей з кашльовим варіантом БА продемонстрував, що порівняно з монотерапією будесонідом призначення комбінації IКС і монтелукасту забезпечувало вищі показники відповіді на лікування, вираженіше зменшення частоти епізодів БА та покращення функції легень, у тому числі зростання об’єму форсованого видиху за 1-шу секунду (ОФВ1). Частота побічних ефектів у групах монотерапії та комбінованого лікування не відрізнялася [44].
Загалом монтелукаст є добре вивченим і найширше застосовуваним АЛТР у низці європейських і азійських країн [10, 20, 29]. Його ефективність засвідчена багатьма світовими рекомендаціями, зокрема Ініціативи «Алергічний риніт і його вплив на астму» (ARIA) та Глобальної ініціативи з БА (GINA). Важливо також те, що монтелукаст не лише чинить негайну протизапальну та протиалергічну дії, але й запобігає ремоделюванню дихальних шляхів, як було підтверджено достовірним зниженням одного з маркерів такого ремоделювання – C-кінцевого пептиду проколагену 1-го типу.
Монтелукасту властиві також плейотропні ефекти, як-от блокування еозинофіл-індукованої трансформації епітеліальних клітин у мезенхімальні, зменшення маси непосмугованої м’язової тканини дихальних шляхів, зниження рівнів прозапальних цитокінів у бронхіальному дереві, протидія фіброзу легень [21, 22, 26, 38].
Отож АЛТР монтелукаст має широкий спектр фармакологічних властивостей, що дає йому змогу в пацієнтів з БА знижувати частоту виникнення РВІ та загострень астми. Виражене гальмування еозинофільного запалення в нижніх дихальних шляхах під дією монтелукасту зумовлює доцільність його застосування в профілактиці та лікуванні епізодів БА різного походження, в тому числі різноманітних сезонних загострень, опосередкованих як пилком рослин, так і РВІ [23, 30]. Слід підкреслити, що основний масив доказових даних щодо ефективності та безпечності застосування монтелукасту натрію було отримано при використанні оригінального препарату Сингуляр.
Останнім часом у зв’язку з обмеженням державних витрат на охорону здоров’я в низці країн значно посилилася увага до використання генеричних препаратів. Навіть в економічно розвинених країнах застосування генериків стимулюється державою при обов’язковому дотриманні патентних прав виробників оригінальних лікарських засобів.
В економічному аспекті генерик завжди буде кращим за оригінальний препарат, оскільки не потребує величезних фінансових витрат на створення та подальше вивчення властивостей, а також є доступнішим широким верствам населення завдяки нижчій вартості порівняно з оригінальним препаратом. А ось питання ефективності та безпеки при застосуванні генеричних препаратів залишається відкритим. Для того щоб говорити про можливість заміни оригінального препарату генеричним, а також їх ідентичну ефективність і безпеку, потрібно дослідити біоеквівалентність. У цьому випадку вивчається й порівнюється біодоступність оригінального препарату та генерика. Своєю чергою, на рівень біоеквівалентності може впливати й низка фармацевтичних чинників: фізико-хімічні властивості та якість субстанції, допоміжні речовини, технологічний процес, умови зберігання, тип упаковки тощо. Наявність біоеквівалентності дає змогу з високим ступенем імовірності припускати, але не стверджувати наявність терапевтичної еквівалентності, яка дорівнює клінічній ефективності та безпеці. Отже, саме терапевтична еквівалентність є основною вимогою взаємозамінності лікарських засобів. Утім, як показує практика, при виробництві генеричного препарату не завжди є можливість врахувати всі чинники, які необхідні для збереження якості субстанції, її терапевтичної еквівалентності, та, відповідно, відтворити точну копію оригінального препарату [1].
Оскільки монтелукаст є перспективним препаратом для лікування пацієнтів з вірус-індукованими загостреннями БА, метою нашого дослідження стала оцінка ефективності та переносимості оригінального (Сингуляр) і генеричного препаратів монтелукасту натрію в пацієнтів з вірус-індукованою БА протягом 3 місяців спостереження. Відповідно до мети було сформульовано такі завдання дослідження:
- Оцінити денні симптоми БА (кількість на тиждень), нічні симптоми БА (кількість на тиждень) у пацієнтів з вірус-індукованою БА з додаванням до терапії оригінального та генеричного препаратів монтелукасту натрію з оцінкою даних функціонального й лабораторного досліджень:
- показники тестування легеневої функції (ТЛФ);
- концентрація фракційного оксиду азоту (NO) в повітрі, що видихається (FeNO);
- кількість еозинофілів (Еоз) периферичної крові.
- Комплексна оцінка ефективності застосування оригінального та генеричного препаратів монтелукасту натрію (визначається наприкінці лікування) на підставі аналізу таких показників:
- частота випадків РВІ;
- тяжкість епізоду РВІ;
- тривалість епізоду РВІ;
- частота загострень БА;
- тяжкість загострення БА;
- тривалість загострення БА;
- частота потреби в засобах «швидкої допомоги»;
- частота потреби в додаткових дозах ІКС;
- частота потреби в системних кортикостероїдах;
- частота звернень у відділення невідкладної допомоги;
- частота госпіталізацій;
- значення ОФВ1;
- значення пікової швидкості видиху (ПШВ);
- концентрація FeNO (ppb);
- кількість Еоз (%);
- оцінка контролю БА до та після лікування з використанням оригінального й генеричного препаратів монтелукасту натрію (контрольований перебіг, частковий контроль, неконтрольований перебіг).
- Комплексна оцінка переносимості оригінального та генеричного препаратів монтелукасту натрію (визначається наприкінці лікування) з огляду на аналіз випадків небажаних проявів побічної дії препарату, зміни у зв’язку з цим режиму терапії, а також на підставі оцінки переносимості лікування пацієнтом і лікарем.
Матеріали та методи
Це було спостережне одноцентрове відкрите проспективне дослідження пацієнтів з БА тривалістю 3 місяці, до якого ввійшли 60 пацієнтів з вірус-індукованими загостреннями БА. Усі пацієнти отримали консультацію й амбулаторне лікування на клінічній базі кафедри фтизіатрії і пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика, що розташована в ДУ «Національний науковий центр фтизіатрії, пульмонології та алергології ім. Ф.Г. Яновського НАМН України» (м. Київ).
Дизайн дослідження:
- Група пацієнтів з вірус-індукованими загостреннями БА (n=30), які у складі базисної терапії отримували оригінальний АЛТР (Сингуляр), таблетки 10 мг 1 раз на день (вечірній прийом) (група дослідження – ГД).
- Група пацієнтів з вірус-індукованими загостреннями БА (n=30), які у складі базисної терапії отримували генеричний АЛТР вітчизняного виробництва, таблетки 10 мг 1 раз на день (вечірній прийом) (група порівняння – ГП).
Критерії залучення в дослідження:
- Ознайомлення пацієнта з протоколом дослідження та підписання ним форми поінформованої згоди на участь у дослідженні.
- Вік пацієнтів ≥18 років.
- Діагноз БА, встановлений відповідно до критеріїв Наказу № 868 МОЗ України від 08.10.2013 «Про затвердження та впровадження медико-технічних документів зі стандартизації медичної допомоги при БА» та відповідно до поточної редакції міжнародної настанови GINA (2024), не менш ніж за 1 рік до початку дослідження.
- Значення показника ОФВ1 <80% від належного.
- Зворотність показника ОФВ1 у пробі з 400 мкг сальбутамолу ≥12% (або ≥200 мл).
- Частково контрольований або неконтрольований перебіг БА: денні симптоми БА >2 рази на тиждень, нічні >1 раз на 2 тижні; потреба в бронхолітиках швидкої дії >2 рази на тиждень, можливе обмеження фізичної активності внаслідок хвороби.
- Перебування пацієнта на 2-4-му ступені лікування БА за рекомендаціями GINA (2024).
- Анамнестичний зв’язок попередніх загострень БА в пацієнта під час епідемії/спалаху РВІ.
- Критерії РВІ: наявність щонайменше 2 з таких симптомів, як чхання, кашель, закладеність носа, ринорея, біль у горлі, гарячка (>38 °C).
- Критерії загострення БА: посилення свистячих хрипів, відчуття стискання грудної клітки, задишка чи свистячі хрипи під час обстеження.
- Критерії РВІ-індукованих загострень БА: поєднання симптомів РВІ та БА.
Критерії вилучення з дослідження:
- Вагітність, період лактації.
- Наявність у пацієнта інших захворювань легень, які могли би вплинути на результати дослідження.
- Приймання системних кортикостероїдів, інших протизапальних препаратів, антибіотиків, противірусних засобів в останні 3 місяці перед початком дослідження.
- Використання алергеноспецифічної імунотерапії, біологічної терапії в процесі дослідження.
- Зміни в базисній терапії БА в останні 4 тижні перед початком дослідження.
- Тяжкі неконтрольовані супутні хвороби серцево-судинної системи, печінки, нирок, неврологічні та психіатричні захворювання, алкоголізм, наркоманія.
- Медикаментозна алергія на препарат, що досліджується, або його складові частини.
- Відмова від участі в дослідженні.
- Порушення режиму лікування.
- Розвиток серйозної непередбачуваної побічної дії препарату, що досліджується.
Отже, відповідно до мети дослідження пацієнти були розподілені на дві репрезентативні групи.
Діагноз БА встановлювався за загальноприйнятими критеріями згідно з Наказом МОЗ України № 868 від 08.10.2013 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при БА» [5]. Тяжкість і контрольованість БА визначено за критеріями, що ґрунтуються на міжнародних рекомендаціях і наведені в Уніфікованому клінічному протоколі первинної, вторинної (спеціалізованої) медичної допомоги «Бронхіальна астма» й адаптованій клінічній настанові з БА [7, 18]. Усі пацієнти отримували стандартну терапію: базисну – ІКС (будесонід або флутиказон) у низьких або середніх дозах у комбінації з β2-агоністами (формотерол або салметерол) тривалої дії (БАТД) [18, 31, 43]. Серед обстежених обох груп дещо переважали жінки (60,0 проти 40,0% у ГД та 56,7 проти 43,3% у ГП). Середній вік обстежених в обох групах становив 39,45+8,34 та 41,04+7,94 року відповідно. Тривалість періоду від моменту встановлення діагнозу БА становила 10,37+5,11 року в ГД та 12,24+4,85 року в ГП. Серед коморбідних захворювань у обстежених в обох групах переважали хронічний риносинусит з/без носових поліпів (у 20,0 та 30,0% осіб) і алергічний риніт (у 33,3 та 30,0% осіб), з метою лікування котрих пацієнти отримували назальні іригації сольовими розчинами й антигістамінні препарати. Ніколи не курили 60,0% осіб з ГД та 53,3% осіб з ГП, продовжують курити на момент дослідження 13,3 та 20,0% обстежених. Індекс курця людини в обстежених становив 14,31+4,18 пачка-року
в ГД та 16,35+4,68 пачка-року в ГП. Переважна більшість пацієнтів в обох групах перебувала на 2-3-му кроці лікування БА (80,0 та 73,3% спостережень відповідно), інші обстежені (20,0 та 26,7% випадків) – на 4-му кроці. Частково контрольований перебіг БА мали 73,3% осіб з ГД та 70,0% обстежених з ГП, а неконтрольований її перебіг – 26,7 та 30,0% пацієнтів відповідно. Отже, за статево-віковим складом, тяжкістю перебігу, характером лікування до початку дослідження, рівнем контролю астми, індексом курця людини, супутньою патологією, тривалістю періоду встановлення діагнозу БА групи обстежених осіб були репрезентативними (p>0,05 для всіх випадків). Результати лікування пацієнтів обох груп оцінювали за динамікою даних клініко-функціонального й лабораторного обстежень. Було враховано верифіковані діагнози та дані консультацій суміжних спеціалістів, наявні результати загальноклінічних, функціональних і лабораторних обстежень. Дослідження проведені за згодою хворих, а методика їх виконання відповідала перегляду Гельсінської декларації 1983 р. Протокол дослідження було схвалено локальною етичною комісією, учасники були ознайомлені з погоджувальним листом і підписали його при залученні в дослідження, структура якого відповідала офіційно прийнятій. Усім пацієнтам виконувалася спірометрія з аналізом основних показників ТЛФ, які характеризують наявність і вираженість бронхообструкції, а саме: форсованої життєвої ємності легень (ЖЄЛ), ОФВ1, максимальної об’ємної швидкості видиху при 25%, 50%, 75% ЖЄЛ (FEV25, FEV50, FEV75), ПШВ. Дослідження проводилися зранку, після 12-14-годинної перерви в прийманні ліків з використанням апарату Master Screen PFT (SN 675125, 2008 р.) фірми Cardinal Health (Німеччина) [2, 3]. Концентрація FeNO визначалася неінвазивним методом за допомогою портативного пристрою NIOX VERO® FеNО. За норму була прийнята величина до 25 ppb. Кількість Еоз у периферичній крові визначали традиційним методом і виражали у відсотках. За норму була прийнята така їх кількість, яка дорівнювала 0,5-5% усіх лейкоцитів у формулі крові. Для моніторування перебігу астми хворі щодня заповнювали щоденники індивідуального спостереження [12, 19]. Враховувалися такі показники: задишка, нічні пробудження через симптоми БА, ранкова скутість (відчуття стискання в грудній клітці зранку), денні симптоми хвороби, загальний астма-рахунок, додаткова потреба в короткотривалих β2-агоністах або комбінації будесонід/формотерол, а також побічна дія комбінації препаратів у вигляді шлунково-кишкових, шкірних проявів і симптомів загострення БА. Ступінь вираженості симптомів оцінювався пацієнтами за 5-бальною шкалою (GINA, 2002): 0 – відсутність симптомів; 1 – легкий ступінь прояву; 2, 3 – помірний; 4, 5 – виражений [19]. Також проводився облік числа збільшення використання дози β2-агоністів короткої дії або комбінації будесонід/формотерол за потреби, системних кортикостероїдів, загострень та їхньої тяжкості, в тому числі пов’язаних з РВІ, викликів швидкої медичної допомоги з приводу астми, госпіталізацій з її приводу за період спостереження та днів перебування хворого в стаціонарі [12]. Статистична обробка виконувалася за допомогою математичних і статистичних можливостей MS Excel з використанням методу дисперсійного аналізу, F-критерію, а також t-критерію Стьюдента. За рівень вірогідності приймалися значення показника вірогідності між групами (р), які дорівнювали або були меншими за 0,05 [4].
Результати та їх обговорення
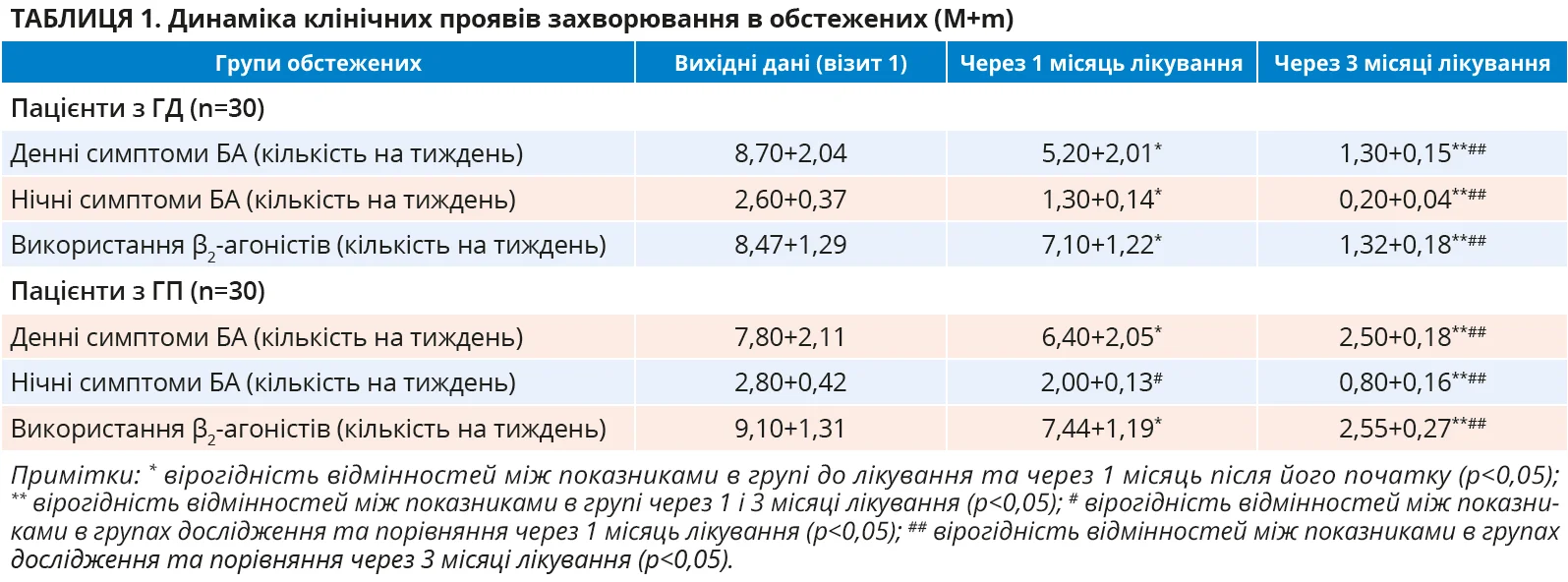
Важливим критерієм оцінки ефективності лікування пацієнтів з БА є оцінка основних її клінічних проявів, які дають змогу судити про наявність або відсутність контролю цього захворювання. Відповідні дані в динаміці спостереження наведено в таблиці 1.
Указані дані демонструють, що в обох групах терапія з використанням комбінації ІКС і БАТД з АЛТР виявила позитивну динаміку проявів астми в обстежених, що проявилося зниженням частоти денних і нічних симптомів астми, а також використання β2-агоністів на вимогу. У процесі терапії пацієнтів обох груп позитивна динаміка клінічних проявів БА визначилася вже через 1 місяць, але в ГД вона виявилася достовірно кращою за показником «нічні симптоми БА (кількість на тиждень)». Указана позитивна динаміка клінічних симптомів астми виявилася ще показовішою в обох групах обстежених через 3 місяці лікування, проведення котрого дало змогу досягти контролю над перебігом БА в переважної кількості пацієнтів. При цьому ефективнішим за оцінкою клінічної симптоматики виявилося лікування пацієнтів з ГД через 3 місяці за всіма 3 критеріями, що оцінювалися. Слід окремо зауважити, що на тлі лікування оригінальним монтелукастом у осіб з ГД більшою мірою, ніж у пацієнтів з ГП, відбулася й регресія симптомів алергічного риніту.
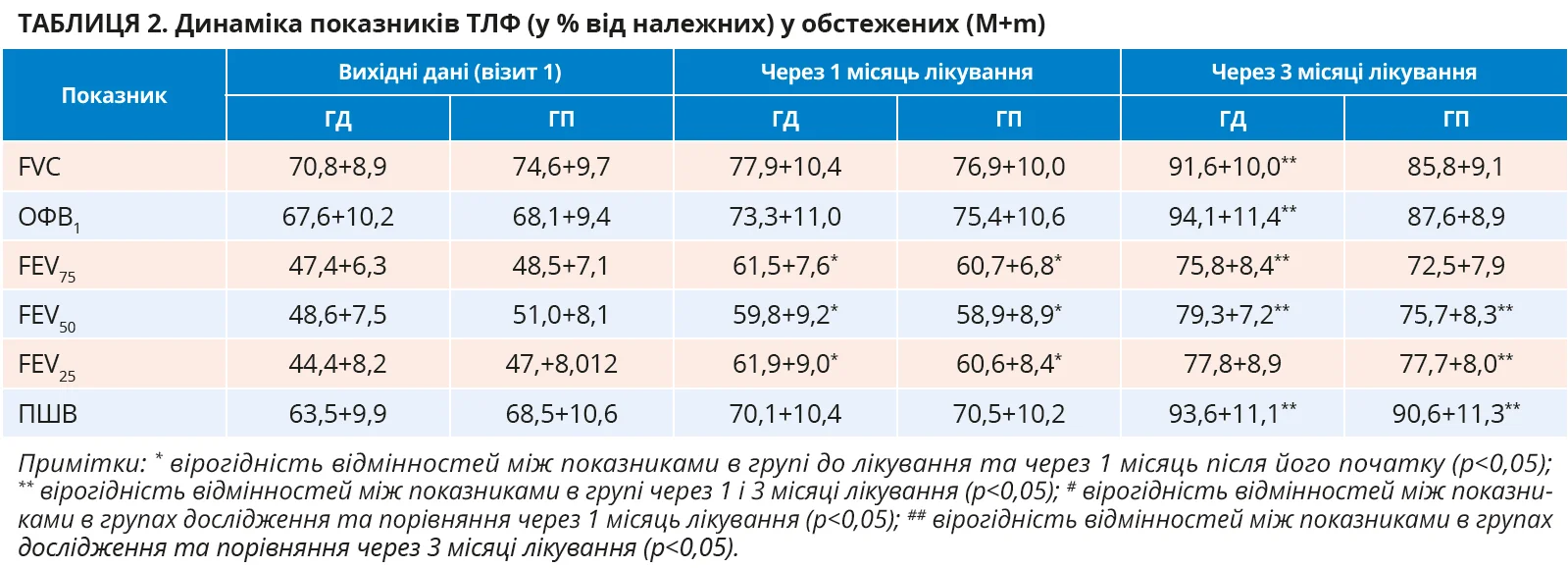
Для об’єктивної оцінки ефективності обраних режимів терапії в обстежених пацієнтів було вивчено динамічні показники легеневої функції. У всіх з них перед початком терапії відзначався обструктивний тип порушень показників ТЛФ (значення показника ОФВ1 <80% від належного) зі зворотним характером бронхообструкції (зворотність показника ОФВ1 у пробі з 400 мкг сальбутамолу ≥12%, або ≥200 мл), що характерно для перебігу БА в дорослих осіб молодого та середнього віку. Відповідні дані наведено в таблиці 2.
Ці дані також демонструють, що в обох групах обстежених проведена терапія з використанням комбінації ІКС із БАТД у поєднанні з АЛТР виявила позитивну динаміку показників ТЛФ. Через 1 місяць лікування вже простежувалася тенденція до покращення показників ТЛФ в обох групах обстежених, причому достовірно кращою стала прохідність бронхів різного калібру за даними FEV75-50-25.
Ця тенденція майже за всіма показниками ТЛФ стала ще вираженішою та достовірною через 3 місяці лікування пацієнтів з БА. Причому в ГД показники ТЛФ були потенційно кращі, ніж у ГП, особливо за показниками прохідності бронхів дрібного та середнього калібру за даними FEV75-50. Важливо, що під впливом саме оригінального монтелукасту в обстежених зростала прохідність бронхів дрібного та середнього калібру дещо більшою мірою, ніж в осіб у ГП.
Отже, за результатами дослідження в динаміці клінічної симптоматики та вентиляційних показників у пацієнтів з вірус-індукованою астмою можна відзначити, що застосування монтелукасту в базовій терапії дає змогу надійно контролювати бронхіальну прохідність, а за рівнем дії на показники ТЛФ він здатний потенційно посилювати відповідний ефект комбінації ІКС із БАТД. Функціональні показники легень більшою мірою зростали під впливом терапії оригінальним монтелукастом уже після 1-го місяця його використання, досягаючи ще більшого значення через 3 місяці спостереження.
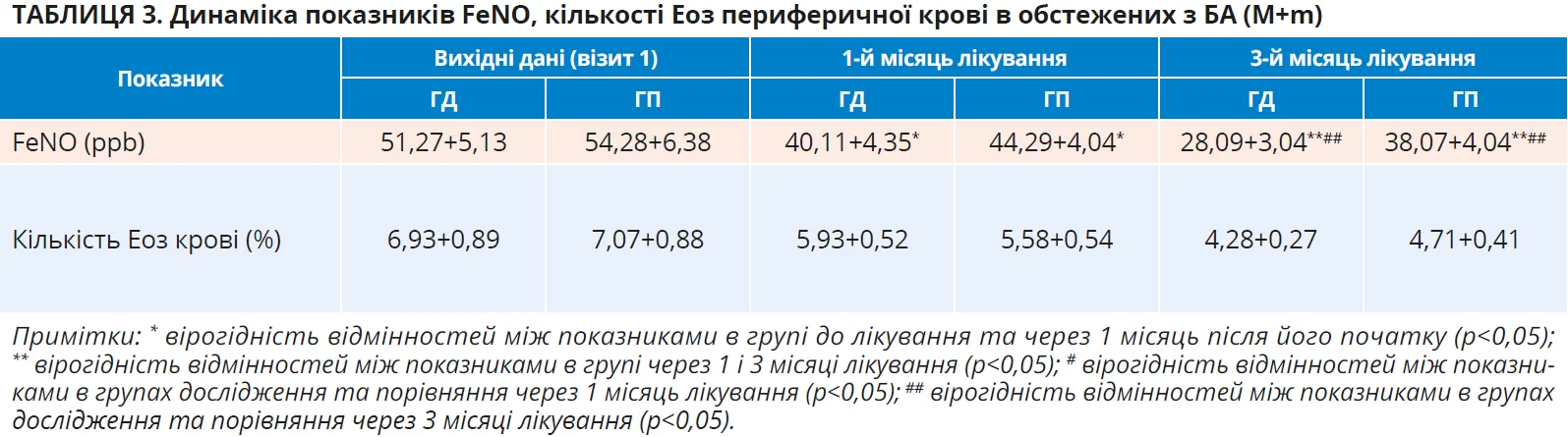
Вимірювання концентрації FeNO з 2011 р. рекомендоване Американським торакальним товариством як складова діагностичного алгоритму при астмі, що дає змогу непрямим шляхом оцінювати активність запального процесу при астмі й ефективність лікування відповідної категорії пацієнтів [14, 45]. Рівень Еоз периферичної крові також вважається важливим маркером алергічного запалення, котрий дає змогу непрямим шляхом оцінювати його тяжкість у разі БА, алергічного риніту, IgE-опосередкованого атопічного дерматиту [15]. Результати вимірювання в обстежених осіб концентрації FeNO та кількості Еоз периферичної крові наведено в таблиці 3.
Динаміка маркерів алергічного запалення (табл. 3) в осіб з БА під впливом лікування в обох групах обстежених мала односпрямований характер. У всіх пацієнтів простежувалися відсутність вірогідних змін умісту Еоз периферичної крові й поступове зниження показників концентрації FeNO вже через 1 місяць після початку дослідження. Через 3 місяці ця тенденція набула ще показовішого характеру, оскільки вказані показники або знизилися до норми, або наблизилися до неї. Проте вагоміший ефект на вказані показники мала терапія із застосуванням комбінації ІКС із БАТД і оригінальним монтелукастом. Отже, швидша та вираженіша позитивна динаміка маркерів алергічного запалення спостерігалася на тлі використання ІКС у комбінації з БАТД та саме з оригінальним препаратом монтелукасту.
Важливе значення в оцінці результатів лікування пацієнтів з БА має оцінка ефективності лікування з боку пацієнта та лікаря, що проводилася за допомогою критеріїв, які наведені в таблиці 4.
Слід зазначити, що переважна кількість пацієнтів в обох групах обстежених наприкінці дослідження, на їхню думку, почувалися набагато краще:
22 із 30 (73,3%) у ГД та 17 із 30 (56,7%) у ГП. Значно менше число пацієнтів почувалися ненабагато краще: 7 із 30 (23,3%) у ГД та 10 із 30 (33,3%) у ГП. Лише 1 пацієнт з ГД та 3 особи з ГП відзначили, що почуваються так, як було. При цьому жоден пацієнт з обох груп не став почуватися гірше або набагато гірше. На думку ж лікарів, значне покращення відзначено у 24 із 30 (80,0%) осіб з ГД й у 21 з 30 (70,0%) обстежених з ГП. Незначне покращення стану відзначили лікарі в 6 з 30 (20,0%) осіб і в 7 з 30 (23,3%) пацієнтів відповідно. Стан «без змін» не відзначено в жодного пацієнта з ГД й у 2 осіб з ГП. Незначне або значне погіршення стану обстежених не відзначено лікарями в жодному випадку в обох групах обстежених. Тобто результати лікування в обох групах, на думку пацієнтів і лікарів, були кращими саме в групі осіб, що отримували оригінальний монтелукаст Сингуляр.
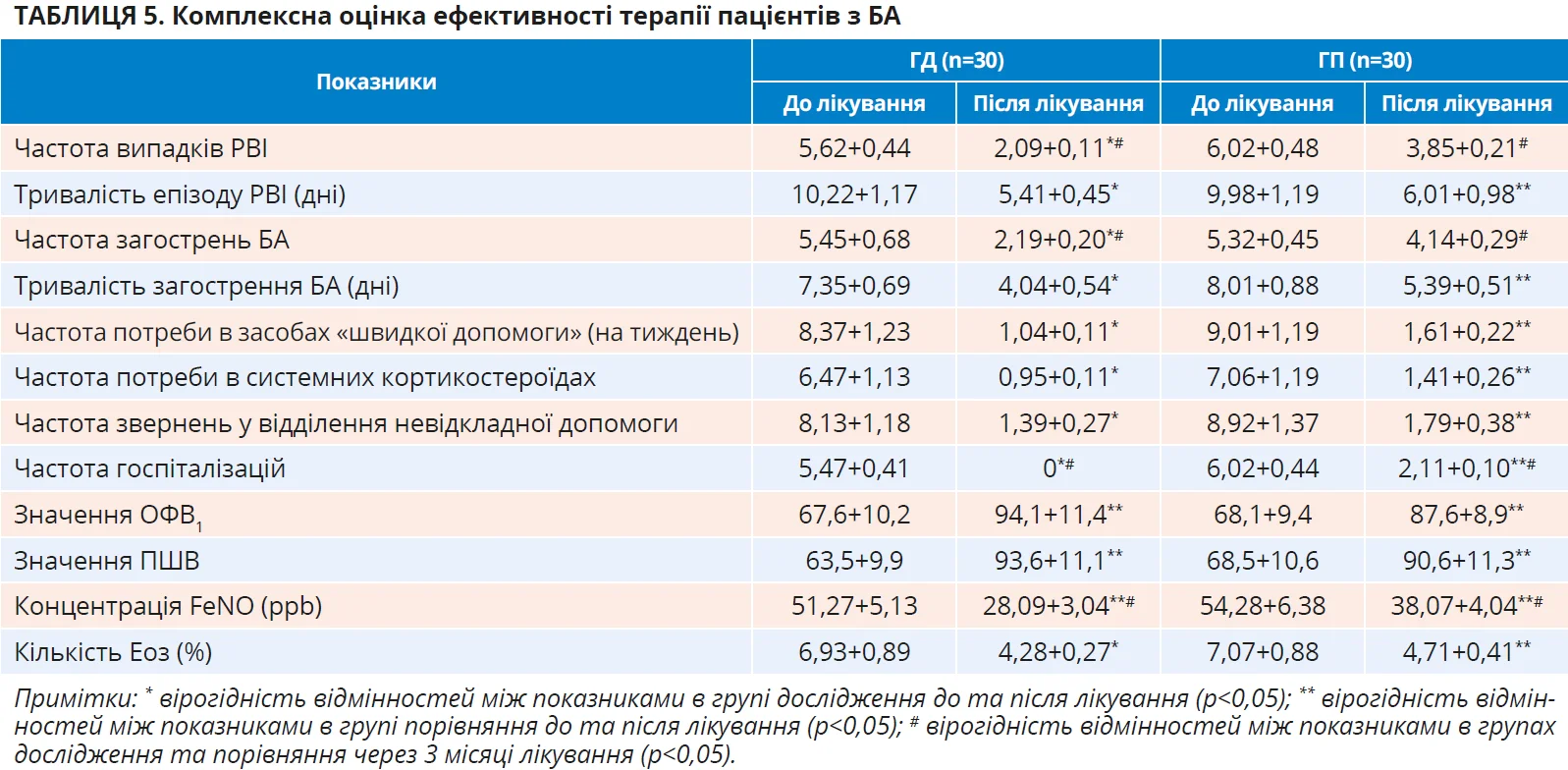
Наприкінці дослідження було проведено комплексну оцінку ефективності обох режимів терапії пацієнтів з вірус-індукованою БА, результати якої відображено в таблиці 5.
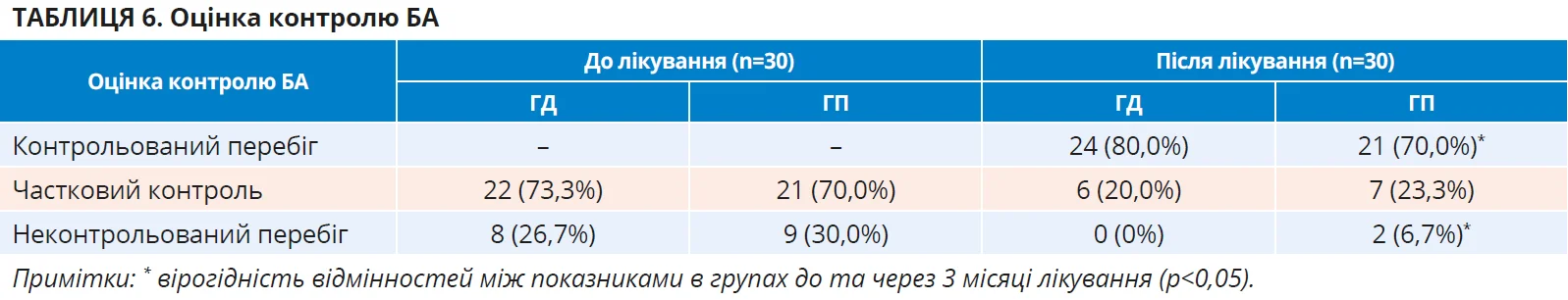
При такій комплексній оцінці результатів лікування пацієнтів обох груп з’ясувалося, що обидва режими терапії були ефективними за клінічними, функціональними та лабораторними даними, але використання саме оригінального монтелукасту (Сингуляру) дало змогу досягти кращих результатів за такими показниками: частота випадків РВІ (зменшення у 2,7 раза в ГД проти 1,6 раза в ГП), частота загострень БА (зменшення у 2,5 раза проти 1,3 раза), частота госпіталізацій (зменшення з 5,47+0,41 до 0 проти з 6,02+0,44 до 2,11+0,10), результати вимірювання концентрації FeNO (зниження в 1,8 раза в ГД проти 1,4 раза в ГП). При цьому слід підкреслити, що в пацієнтів обох груп відзначено зменшення вираженості симптомів коморбідної патології – хронічного риносинуситу й алергічного риніту. Оскільки однією з найважливіших цілей ведення пацієнта з БА є досягнення контролю хвороби, ми оцінили його в обох групах обстежених наприкінці періоду дослідження. Відповідні результати представлено в таблиці 6.
Наведені дані показують, що додавання до режиму терапії пацієнтів з вірус-індукованою БА монтелукасту дає змогу в більшому числі випадків досягти часткового й особливо повного контролю хвороби.
Важливе значення в оцінці результатів лікування пацієнтів з БА має оцінка не лише ефективності, але й переносимості з боку пацієнта та лікаря, що проводилася за допомогою критеріїв, які наведені в таблиці 7.
Оцінка переносимості лікування пацієнтами обох груп з акцентом на переносимість саме оригінального й генеричного препаратів монтелукасту була проведена за весь період дослідження та катамнестичного спостереження. Добра (дуже хороша) чи задовільна (хороша) переносимість лікування, на думку пацієнтів, була у 28 з 30 (93,3%) осіб з ГД й у 22 з 30 (73,3%) осіб з ГП. На думку лікарів, добра переносимість лікування була у 27 з 30 (90,0%) та у 23 з 30 (76,7%) пацієнтів відповідно. Побічні дії монтелукасту (тимчасові болі в животі в перші дні лікування) відзначили лише 2 пацієнти з ГД, проте це не стало перешкодою для подальшого приймання препарату ними, оскільки надалі на такі прояви вони вже не скаржилися. Дещо серйознішою видавалася ситуація в ГП, в якій у 2 пацієнтів відзначалися порушення сну, дратівливість, збудження, також 2 особи скаржилися на сонливість і головний біль, а в 3 пацієнтів спостерігалися біль у животі, нудота, діарея, що примушувало робити перерви в прийманні генеричного препарату монтелукасту. Загалом усі пацієнти відзначили простоту та зручність користування монтелукастом (пероральне приймання препарату 1 раз на день) порівняно з інгаляційними засобами, що забезпечило високий рівень комплаєнсу з боку пацієнтів.
Варто зауважити, що отримані нами дані стосовно ефективності застосування монтелукасту натрію (особливо оригінального препарату Сингуляр) у лікуванні пацієнтів з вірус-індукованою БА загалом відповідають даним інших дослідників. Зокрема, в рандомізованому контрольованому дослідженні PREVIA доведено ефективність Сингуляру в зменшенні вірус-індукованих загострень БА в дітей 2-5 років [10, 11]. Окрім того, порівняно з плацебо препарат дав змогу знизити в обстежених частоту використання ІКС на 39,8%, а системних кортикостероїдів – на 17,5%.
У дослідженні MOSAIC за участю дітей з легкою астмою Сингуляр протягом 12 місяців продемонстрував таку саму ефективність, як й інгаляційний флутиказон, за клінічними даними та показниками легеневої функції [16]. У відкритому рандомізованому багатоцентровому дослідженні з порівняння ефективності інгаляційного будесоніду (суспензія 0,5 мг) і монтелукасту (Сингуляр 4 або 5 мг) у дітей раннього віку з легкою персистивною астмою протягом 52 тижнів показано зіставні результати терапії пацієнтів [41]. У багатоцентровому подвійному сліпому рандомізованому дослідженні в паралельних групах продемонстровано зіставні результати щодо позитивної дії на клінічну симптоматику БА в дітей при застосуванні Сингуляру й інгаляційного флутиказону протягом 3 місяців [27]. Подібні результати аналогічної, а за деякими показниками навіть вищої ефективності Сингуляру порівняно з інгаляційним флутиказоном щодо впливу на клінічні, функціональні та лабораторні показники дітей з астмою наведено в роботі О.М. Охотнікової [6].
Висновки
- РВІ є одними з найбільш значущих причин загострень астми та втрати контролю над нею.
- Інгібітор лейкотрієнових рецепторів монтелукаст завдяки своєму впливу на лейкотрієновий шлях розвитку запалення дає змогу покращити клінічний перебіг, показники легеневої функції, зменшити запалення в дихальних шляхах, знизити частоту загострень астми й епізодів РВІ, а також потребу в β2-агоністах і системних кортикостероїдах.
- Із метою лікування вірус-індукованих загострень БА краще використовувати оригінальний монтелукаст (Сингуляр), який порівняно з генеричним препаратом демонструє вищу ефективність і кращу переносимість пацієнтами протягом 3 місяців спостереження, а також дає змогу в більшому числі випадків досягти контролю над перебігом хвороби.
Список літератури – в редакції.