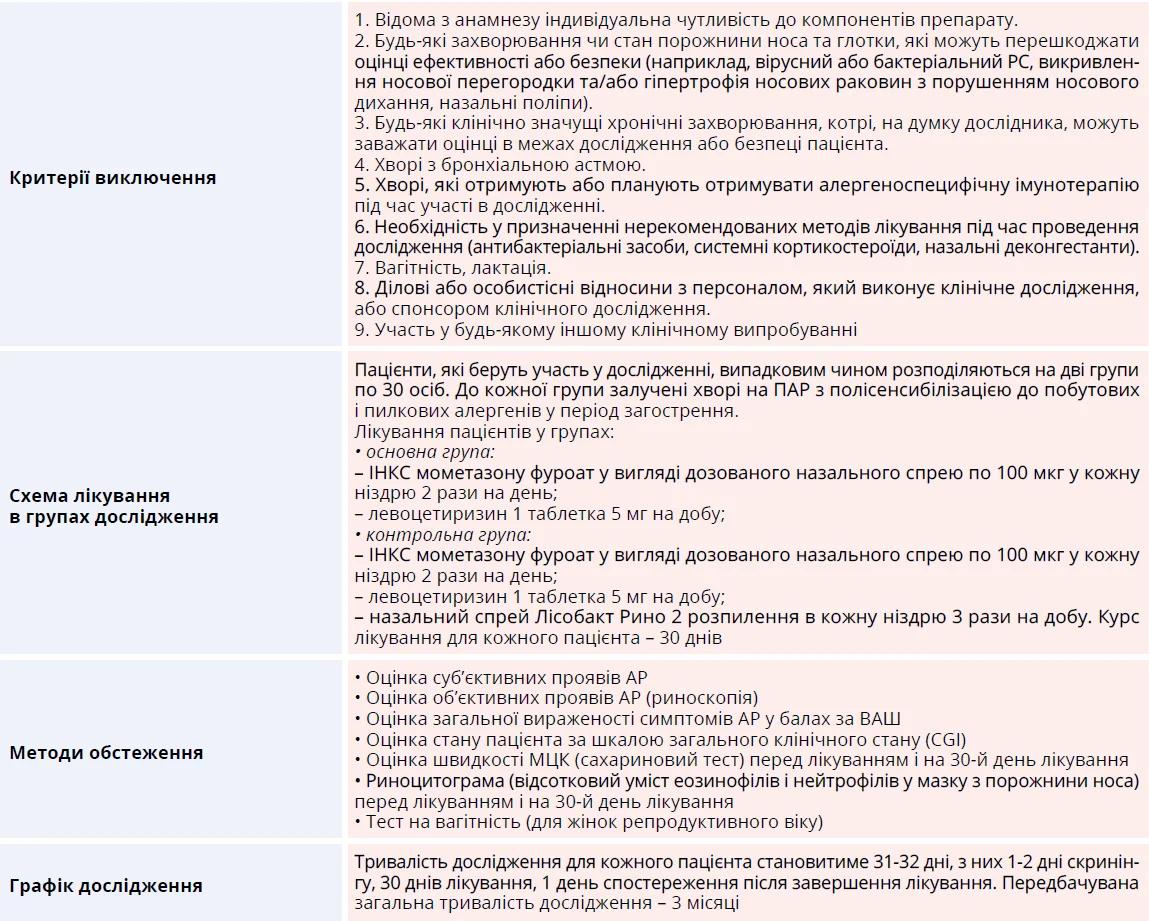
Оцінка ефективності гіперосмолярного назального спрею зі вмістом лізоциму в комплексному лікуванні хворих на персистуючий алергічний риніт з полісенсибілізацією до побутових і пилкових алергенів
Автори: І.В. Гогунська, Д.Д. Заболотна, Т.В. Смагіна, В.І. Нестерчук, ДУ «Інститут отоларингології ім. проф. О.С. Коломійченка НАМН України» (м. Київ)
Алергічний риніт (АР) провокується алергенами, які містяться в повітрі, зокрема компонентами побутового пилу та пилку різних рослин. Імунна система сенсибілізованих пацієнтів реагує на алергени, що клінічно найчастіше проявляється такими симптомами, як закладеність носа, ринорея, чхання та свербіж у носі [1-4].
Згідно зі статистичними даними Всесвітньої організації охорони здоров’я алергічні розлади вражають близько 40% населення світу, і їх частота продовжує зростати зі збільшенням тяжкості захворювання та розширенням спектра сенсибілізації до алергенів [4]. Поширеність АР досягає піків у дитинстві та підлітковому віці й поступово зменшується в людей старшого віку. Отже, захворюваність на АР формує високий соціальний та економічний тягар у всьому світі [1-6].
Серед більш ніж 80 тисяч хворих на АР, які були обстежені W.H. Crown і співавт. (2003), у 79% пацієнтів було діагностовано сезонний АР (САР) і у 21% – цілорічний АР (ЦАР) [7]. CАР найчастіше провокується алергенами пилку дерев, трав або бур’янів, а ЦАР – алергенами кліщів хатнього пилу (КХП) або плісняви [1-7].
Окрім САР і ЦАР у документі ARIA виділяють інтермітуючий АР (ІАР), коли симптоми захворювання спостерігаються менш ніж 4 дні на тиждень або не більш ніж 4 тижні на рік, і персистуючий АР (ПАР), коли симптоми захворювання зберігаються понад 4 дні на тиждень і понад 4 тижні на рік [1].
В епідеміологічному дослідженні V. Bauchau та співавт. (2005) ІАР і ПАР легкого ступеня діагностовано в 10 та 14% пацієнтів, а помірного/тяжкого – в 17 та 59% хворих відповідно. Понад 50% пацієнтів з ПАР були сенсибілізовані до алергенів пилку або КХП [8].
Наявність взаємозв’язку між АР та гострим і хронічним риносинуситом (РС) постулюється протягом багатьох років і підтверджується епідеміологічними даними [9]. Крім того, загальний патофізіологічний механізм, що пов’язує ці захворювання, є переконливим і підтримується сучасною парадигмою «єдиних дихальних шляхів».
Докази свідчать про те, що алергія може призвести до загального порушення механічної та імунологічної захисної функції слизової оболонки носа проти вірусів і що протиалергічне лікування здатне значно зменшити кількість і тяжкість інфекцій верхніх дихальних шляхів (ВДШ), включаючи застудні захворювання в дітей [10-12]. Вірусні інфекції ВДШ можуть призвести до циліарної дисфункції та згущення назального слизу, а пацієнти із супутнім АР можуть мати підвищений ризик розвитку гострого РС у разі вірусних інфекцій ВДШ [13]. На думку W. Gan і співавт. (2021), дисбактеріоз назальної порожнини у хворих з АР може відігравати певну роль у патогенезі гетерогенного запалення слизової оболонки носа [14].
У дослідженні M. Yariktas і співавт. (2003) за результатами комп’ютерної томографії (КТ) навколоносових синусів було виявлено ознаки РС у 66,7% пацієнтів із САР і в 77,4% хворих на ЦАР. Оцінки КТ-стадії РС за шкалою Lund-Mackay серед пацієнтів із ЦАР були значно вищими, ніж у групі САР (р=0,014). Хоча істотної різниці між частотою РС у разі САР і ЦАР не було, в цьому дослідженні тяжкість РС була серйознішою у випадках із ЦАР [15].
Відомо, що при таких патологічних станах, як АР, лізоцим і лактотрансферин активізуються після провокації алергеном [16]. Тривале алергічне запалення є критичним фактором у патогенезі пошкодження тканин у дихальних шляхах, яке спричиняється цитотоксичними катіонними білками, зокрема еозинофільним нейротоксином, еозинофільним катіонним і основним протеїнами. Зміни в протимікробних властивостях секрету дихальних шляхів, вторинні або через пошкодження поверхні слизової оболонки чи хронічне запалення, можуть зумовлювати колонізацію епітелію бактеріями при РС. У дослідженні V.C. Kalfa та співавт. (2004) було продемонстровано, що рівень еозинофільного нейротоксину був достовірно підвищений, а рівень лізоциму – знижений у групі хворих з ПАР і РС порівняно з пацієнтами з ПАР і здоровими особами. Ці результати свідчать про більшу схильність до РС за наявності персистуючого алергічного запалення слизової оболонки носа та підтверджує концепцію того, що лізоцим є ключовим білком у захисті ВДШ, зокрема порожнини носа. Зниження рівня лізоциму в пацієнтів з ПАР може пояснити асоціацію РС і АР [17].
Одним з основних факторів ризику розвитку гострого бактеріального РС є порушення механізму транспортування слизу (мукоциліарного кліренсу – МЦК) в порожнині носа. У хворих на АР спостерігається пошкодження структури війок миготливого епітелію порожнини носа, а також зміна в’язкості слизу внаслідок тривалого хронічного запалення. Механічна обструкція також може призводити до застою слизу, спричиняючи перицелюлярну компресію та погіршення мукоциліарного транспорту (МЦТ) у носовій порожнині. При сповільненні МЦТ утруднюється елімінація алергенів зі слизової оболонки носа, збільшується контакт з алергенами, а отже, створюються умови для пролонгації запалення та зменшення ефективності лікування [18, 19].

У дослідженнях доведено значну кореляцію між еозинофілією назального секрету та вираженістю клінічних ознак АР. Продукти еозинофільних гранулоцитів (зокрема, основний і еозинофільний катіонний білок) накопичуються під час пізньої фази алергічної реакції та чинять цитотоксичну дію на респіраторний епітелій носа [20]. Риноцитограма змінюється залежно від типу алергенів, до яких пацієнти чутливі. Зокрема, в пацієнтів з ПАР, що характеризується постійним впливом алергену низької інтенсивності, риноцитограми демонструють «мінімальне стійке запалення», котре представлене переважно нейтрофілами, а відсоток еозинофілів залишається мінімальним. Навпаки, при САР риноцитограми різняться залежно від того, обстежуються пацієнти за умови експозиції алергенів чи ні. Під час палінації в пацієнтів спостерігаються всі клінічні ознаки АР, а цитологічне дослідження мазка з порожнини носа демонструє наявність еозинофілів, нейтрофілів, лімфоцитів та опасистих клітин, значною мірою дегранульованих; поза сезоном експозиції в пацієнта чітко спостерігається клінічна та цитологічна «тиша» [21-23].
В Україні діагностику та лікування АР рекомендується виконувати за критеріями міжнародного погоджувального документа ARIA (2016) і вітчизняного уніфікованого клінічного протоколу «Алергічний риніт» (2017) [1, 2, 24].
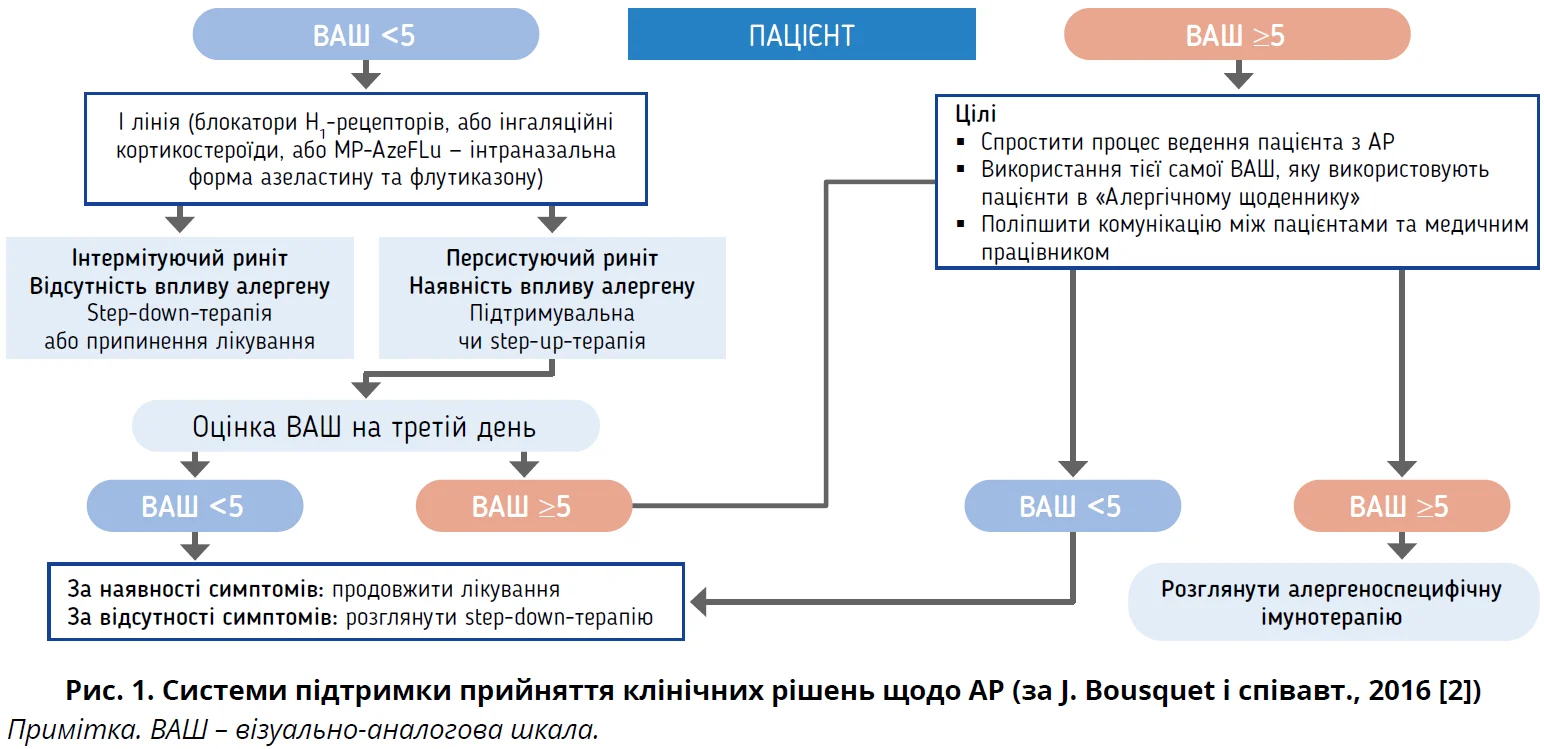
Відповідно до останніх рекомендацій інтраназальні кортикостероїдні спреї (ІНКС) є першою лінією лікування АР [1-6, 24] (рис. 1). ІНКС значно зменшують вироблення цитокінів і пригнічують рекрутинг запальних клітин, що сприяє зниженню проявів алергічного запалення. ІНКС ефективні в забезпеченні симптоматичного зменшення назальної обструкції та ринореї, мають сприятливий профіль безпеки. Мометазону фуроат (МФ) – сучасний синтетичний ІНКС з вираженою протизапальною дією, при застосуванні якого в рекомендованих дозах не спостерігається розвиток системних ефектів. Механізм протизапальної та протиалергічної дії МФ переважно пов’язаний з його здатністю пригнічувати виділення медіаторів алергічних реакцій за місцевого застосування [25].
До рекомендованих лікарських засобів першої лінії терапії АР належать блокатори H1-рецепторів, або антигістамінні препарати (АГП). Сучасні АГП другого покоління практично не проникають крізь гематоенцефалічний бар’єр, не чинять седативної та холінолітичної дій, майже не впливають на психомоторні функції. Левоцетиризин є представником АГП другого покоління, котрому властиві сприятливі фармакодинамічні та фармакокінетичні характеристики, зокрема швидкий початок дії, високі біодоступність, спорідненість і зайнятість H1-рецептора, обмежений розподіл, мінімальний метаболізм у печінці разом з незначними побічними ефектами. Проведені рандомізовані клінічні дослідження продемонстрували високу ефективність, безпеку та протизапальні властивості левоцетиризину в лікуванні АР [26].
Сольові розчини тривалий час застосовуються в ринології як ефективні засоби для полегшення симптомів риніту та РС і входять до переліку рекомендацій щодо лікування пацієнтів із запальною й алергічною патологією носа та навколоносових синусів [1-6, 24]. Буферний гіпертонічний розчин фізіологічно стимулює поверхневий шар гелю, збільшує гідратацію шару золю, сприяє збільшенню товщини шару слизу та зменшенню його в’язкості, результатом чого є покращення МЦК [27]. Отже, сольові розчини здатні підвищити ефективність лікування хворих на риніт і РС, патогенетичною ланкою яких є порушення функції війчастого епітелію [28]. У систематичному огляді та метааналізі продемонстровано, що промивання носа гіпертонічним розчином порівняно з ізотонічним розчином було значно ефективнішим у покращенні назальних симптомів і руху війок і супроводжувалося помірними побічними ефектами [29]. Завдяки властивості гіперосмолярного сольового розчину усувати набряк та очищати носову порожнину можна очікувати збільшення біодоступності інтраназальних засобів стандартної терапії АР.
Систематичні огляди та метааналізи підтверджують, що ефективність промивання сольовим розчином як додаткового лікування АР є значною, а ефект зрошення гіпертонічним розчином був кращим, аніж за використання ізотонічного розчину [30-32].
Лізоцим (мурамідаза) – гуморальний фактор уродженого імунітету, фермент лізосомального походження лейкоцитів крові, який уперше був описаний Олександром Флемінгом 1922 року, коли він у пацієнтів з ринітом виявив бактерицидну здатність носового секрету після його інкубації з бактеріальними культурами [33]. Антибактеріальна дія лізоциму особливо ефективна проти грампозитивних бактерій завдяки його здатності гідролізувати β-1,4-глікозидний зв’язок, присутній у полісахаридному шарі клітинних стінок цих бактерій. Ефект проти грамнегативних бактерій слабший через наявність захисного шару ліпополісахаридів на зовнішній мембрані [34, 35]. Враховуючи добре відому антибактеріальну, противірусну, протигрибкову, протизапальну, протипухлинну й імуномодулюючу активність [36], лізоцим має великий потенціал, головним чином у клінічному застосуванні, для лікування патогенів різної природи [35].
J.L. Parrot і співавт. у дослідженні підтвердили антигістамінну активність лізоциму [36]. Спрей, що містить ксилометазолін з лізоцимом, продемонстрував швидший ефект зі значно коротшим часом зменшення закладеності носа порівняно із застосуванням тільки ксилометазоліну [37].
Отже, можна очікувати, що застосування спрею Лісобакт Рино, який містить гіперосмолярний сольовий розчин і лізоцим, у комплексному лікуванні пацієнтів з ПАР може сприяти швидшому полегшенню симптомів і поліпшенню якості життя пацієнтів порівняно зі стандартною комбінацією МФ спрею назального дозованого та левоцетиризину.
Динаміку об’єктивних і суб’єктивних симптомів ПАР оцінювали на 1-й, 10-й, 20-й і 30-й дні лікування за такими даними:
- Об’єктивні клінічні ознаки АР, які оцінюються в балах лікарем під час виконання риноскопії:
- набряк слизової оболонки носа;
- кількість секрету в порожнині носа (ступінь вираженості ознак визначається в балах, де 0 – відсутність ознаки, 1 – слабкий ступінь вираженості, 2 – помірний ступінь вираженості, 3 – значний ступінь вираженості);
- характеристика вмісту в носових ходах (водянистий прозорий, прозорий слиз, мутний слиз, слизово-гнійний, гнійний).
- Суб’єктивні клінічні ознаки АР, які оцінюються пацієнтами обох груп дослідження:
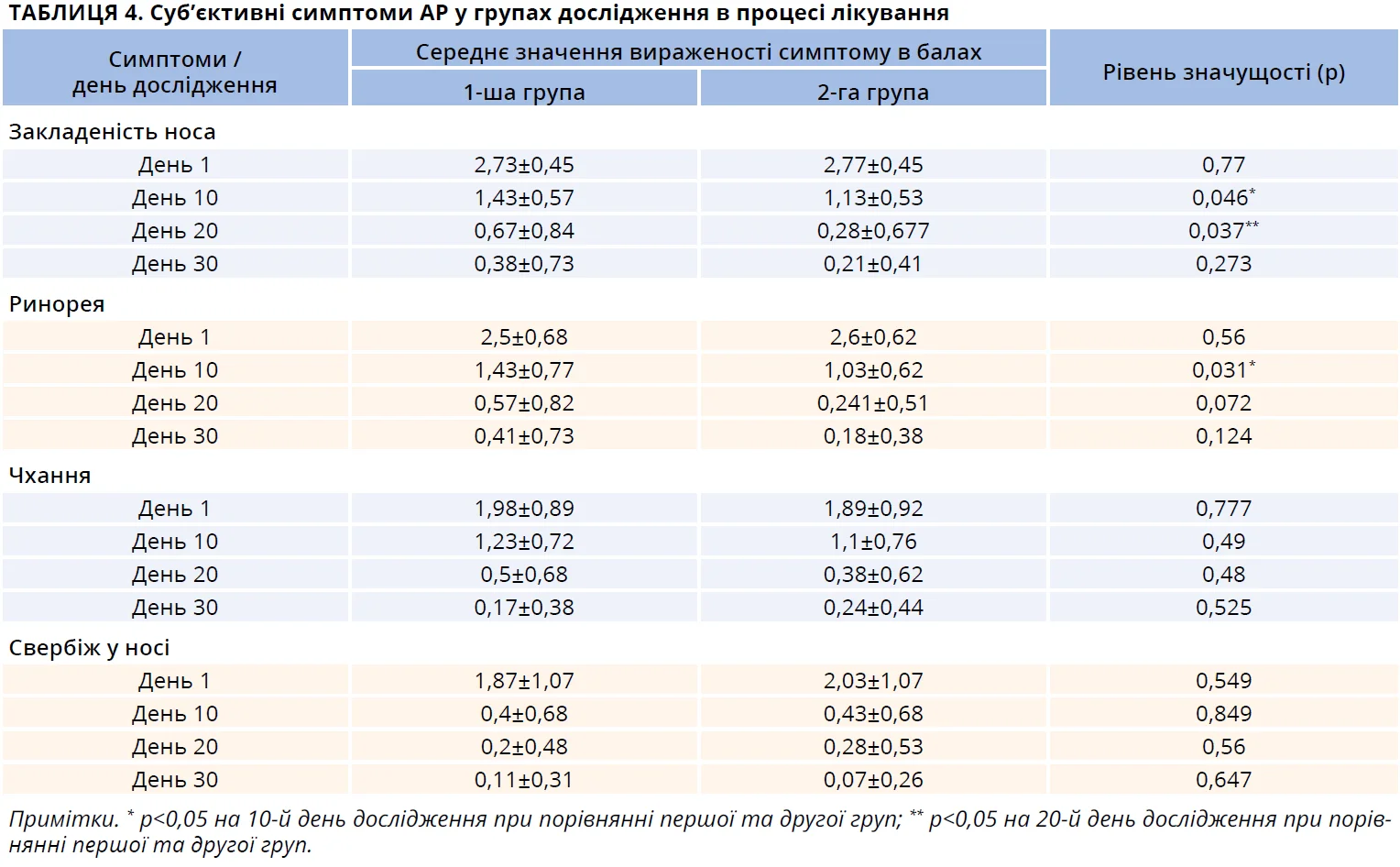
- закладеність носа;
- ринорея;
- свербіж у порожнині носа;
- чхання (ступінь вираженості ознак визначається в балах, де:
0 – відсутність ознаки,
1 – слабкий ступінь вираженості,
2 – помірний ступінь вираженості,
3 – значний ступінь вираженості).
Для оцінки чотирьох основних суб’єктивних симптомів АР, які наведено вище, застосовувалася загальноприйнята бальна система TNSS (Total Nasal Symptom Score) – загальна оцінка назальних симптомів, відповідно до якої виділяється чотири рівні зі значеннями балів від 0 до 3:
0 – відсутність симптомів (відсутність проявів);
1 – легкі симптоми (мінімальні прояви, легко переносяться);
2 – помірні симптоми (помірна вираженість симптомів);
3 – виражені симптоми (симптоми, які важко переносити; погіршують якість життя та/або порушують сон) [1-5].
Отже, максимальна можлива сумарна оцінка для наведених вище суб’єктивних симптомів АР за шкалою TNSS становить 12 балів.
- Оцінка ступеня поліпшення стану пацієнта за шкалою CGI-I (шкала глобального клінічного враження, підшкала оцінки ступеня поліпшення стану) [38, 39].
Після закінчення курсу лікування пацієнтові пропонували порівняти свій стан до та після лікування й оцінити, наскільки він змінився:
- виражено покращився;
- помітно покращився;
- дещо покращився;
- без змін;
- дещо погіршився;
- помітно погіршився;
- дуже сильно погіршився.
Позитивною відповіддю на лікування вважається відповідність категоріям «виражене поліпшення» або «помітне поліпшення» шкали CGI-I. В іншому разі відповідь на лікування розглядається як негативний результат.
- Оцінка вираженості симптомів АР за ВАШ.
Ступінь тяжкості симптомів АР за ВАШ оцінював особисто пацієнт, який позначав відповідь на запитання «Наскільки симптоми, пов’язані з АР, турбують Вас сьогодні?» на відрізку в 10 см, де 1 см відповідає 1 балу (рис. 2). При цьому відповідь «не турбують узагалі» приймається за 0 балів, а «дуже сильно турбують» – за 10 балів, як це рекомендовано в останній настанові ARIA [1].

Залежно від бала ВАШ АР розподіляють за ступенем вираженості (тяжкістю захворювання) на легкий (0-5 балів) і середньотяжкий (>5 балів).
- Оцінка швидкості МЦК за методом сахаринового тесту (методика I. Andersen і співавт., 1974) виконувалася перед початком лікування та на 30-й день лікування [40, 41]. Для проведення тесту чверть таблетки сахарину 0,1 г діаметром близько 1 мм (0,025 г) за допомогою пінцета розміщували на слизовій оболонці нижньої носової раковини, відступивши дозаду на 1 см від її переднього кінця. Пацієнти перебували в положенні сидячи з дещо нахиленою назад головою. Досліджуваних просили повідомити лікаря про появу будь-якого нового смаку в глотці (не акцентували увагу на появі солодкого смаку, щоб запобігти помилковим позитивним результатам). Реєстрували час у секундах від моменту розміщення сахарину до сигналу пацієнта про початок відчуття нового смаку в глотці.
- Риноцитограма (цитологічне дослідження мазка з порожнини носа) виконувалася на початку дослідження та після його закінчення (день 30) з метою додаткової оцінки ефективності лікування й визначення можливої присутності інфекційного компонента етіології риніту. До аналізу були залучені відсоткові показники еозинофілії та нейтрофілії в назальних мазках.
- Під час останнього візиту (день 30) пацієнти оцінювали переносимість лікування за такою шкалою оцінок: «дуже хороша», «хороша», «задовільна», «погана», «дуже погана».
Усі пацієнти, які були залучені до дослідження, на момент початку лікування вже мали підтвердження сенсибілізації до КХП та пилку рослин (трави, бур’яни, дерева) за результатами алерготестування (шкірні прик-тести або визначення специфічного IgE) (табл. 1).
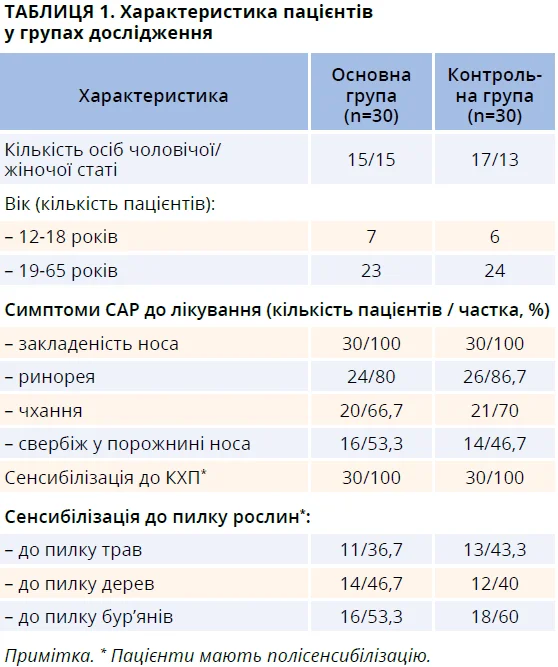
Серед симптомів ПАР у пацієнтів, які нами спостерігалися, найчастіше реєстрували назальні прояви у вигляді закладеності носа (100%) та ринореї (табл. 1). Згідно з даними анамнезу понад третина пацієнтів обох груп (41,1%) мали близьких родичів, які страждали на алергічні захворювання, що свідчить на користь їх генетичної схильність до розвинення алергії. Серед пацієнтів у дослідженні тривалість захворювання на ПАР становила від 1 до 31 року.
Достовірність отриманих результатів оцінювали за критерієм Стьюдента.
Результати та їх обговорення
На початку дослідження до кожної групи було залучено по 30 пацієнтів з діагнозом ПАР у стадії загострення. Надалі для аналізу результатів лікування був виключений 1 пацієнт першої групи, з яким було втрачено контакт після візиту на 20-й день. Також 1 пацієнт другої групи припинив участь у дослідженні з особистих причин і не з’явився для огляду на 20-й і 30-й дні. З отриманої від згаданих пацієнтів інформації відомо, що припинення участі в дослідженні не було пов’язане з відсутністю ефективності від лікування або його поганою переносимістю (наявністю суттєвої побічної дії).
Результати оцінки клінічного перебігу АР у групах дослідження
На початку спостереження як об’єктивні, так і суб’єктивні симптоми АР мали високий ступінь вираженості в усіх хворих (табл. 2-4), що підтверджувало наявність загострення ПАР під впливом експозиції сезонних алергенів, до яких були сенсибілізовані пацієнти. Статистично достовірна різниця між пацієнтами в групах дослідження на момент візиту в 1-й день була відсутня.

У процесі лікування серед пацієнтів в обох групах спостерігалося швидке зниження вираженості таких об’єктивних ознак АР, як набряклість слизової оболонки носа та кількість ексудату в порожнині носа.
Протягом дослідження (від 10-го дня до останнього 30-го дня спостереження) динаміка зменшення середнього бала зазначених об’єктивних ознак АР залишалася помітнішою в другій групі, пацієнти якої отримували додатково до базового лікування назальний спрей Лісобакт Рино (табл. 2), причому статистична достовірність була підтверджена на момент візитів на 10-й і 20-й дні для симптому «набряк слизової оболонки носа» та на момент візиту на 20-й день для симптому «кількість ексудату в порожнині носа» (табл. 2). Отже, достовірно швидше зменшення набряклості слизової порожнини носа серед пацієнтів другої групи можна пояснити додатковою протинабряковою дією гіперосмолярного сольового розчину при лікуванні АР, що підтверджується відповідними даними літератури [28-32].
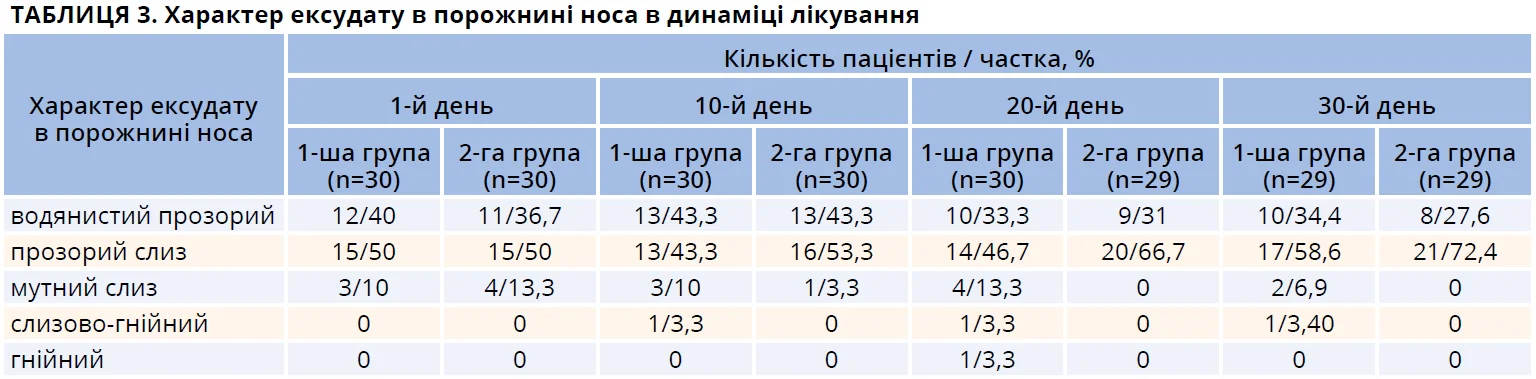
На момент візиту в 1-й день ексудат у порожнині носа серед пацієнтів обох груп мав характер «водянистий прозорий» або «прозорий слиз» у 90% пацієнтів першої групи та 86,7% пацієнтів другої групи (табл. 3). У невеликої частини пацієнтів у порожнині носа був присутній мутний слиз (10 та 13,3% в першій і другій групах відповідно). Серед пацієнтів обох груп у процесі лікування спостерігалося зменшення кількості ексудату в порожнині носа, про що вже повідомлялося вище (табл. 2). Стосовно властивостей ексудату, то в більшості пацієнтів при подальшому спостереженні він характеризувався як «прозорий слиз», що характерно для здорового стану носової порожнини.
У 10 та 13,3% пацієнтів першої та другої групи відповідно на момент початку лікування виявлено мутний слиз у порожнині носа. При подальшому спостереженні наявність мутного слизу виявлено на 10-й, 20-й і 30-й дні в частини пацієнтів першої групи (табл. 3). Серед пацієнтів другої групи на момент візитів на 20-й і 30-й дні мутного слизу в носовій порожнині виявлено не було. Під час візиту на 10-й день в 1 пацієнта першої групи було виявлено наявність слизово-гнійного ексудату, який на момент візиту на 20-й день уже мав характер гнійного. У згаданого пацієнта було діагностовано бактеріальний РС і призначено відповідне лікування. Отже, можна зробити обґрунтоване припущення, що присутність лізоциму, якому притаманні протизапальна, антибактеріальна та противірусна властивості [33-35], сприяла зменшенню ймовірності розвитку інфекційного запального процесу в порожнині носа та, відповідно, впливала на характер ексудату.
Серед пацієнтів у групах дослідження спостерігався позитивний результат від проведеного лікування у вигляді суб’єктивного відновлення носового дихання, зменшення ринореї, свербіння в носі та чхання. Аналіз показників суб’єктивної оцінки проводився за динамікою вираженості середнього бала окремих вищезгаданих симптомів та їх сумарною динамікою в групах дослідження.
В обох групах дослідження не спостерігалося достовірної різниці у вираженості згаданих симптомів до початку лікування: найбільш вираженими й частими були симптоми «закладеність носа» та «ринорея» (табл. 4). При подальшому спостереженні за пацієнтами виявлено, що динаміка двох основних вищезгаданих суб’єктивних симптомів корелювала зі змінами об’єктивних клінічних ознак АР (набряклість слизової оболонки носа та кількість ексудату в порожнині носа) в процесі лікування. Значне покращення носового дихання та зменшення кількості виділень з порожнини носа було досягнуте вже на момент другого візиту (10-й день спостереження) в пацієнтів обох груп. При порівнянні середнього бала вираженості симптому «закладеність носа» виявлено достовірно менші показники на момент візитів на 10-й і 20-й дні серед пацієнтів другої групи, які отримували назальний спрей Лісобакт Рино. Також був достовірно нижчим середній бал вираженості симптому «ринорея» в другій групі на момент візиту на 10-й день. Стосовно середнього бала вираженості симптомів ПАР «чхання» та «свербіж у носі» спостерігалася виражена тенденція до швидшого зниження середнього бала згаданих показників серед пацієнтів другої групи, однак різниця не була статистично достовірною (табл. 4).
До лікування середній сумарний бал назальних симптомів (TNSS) відповідав стану загострення ПАР, становив 9,13±1,74 та 9,41±1,61 у першій і другій групах відповідно й не відрізнявся достовірно між групами дослідження (табл. 5).
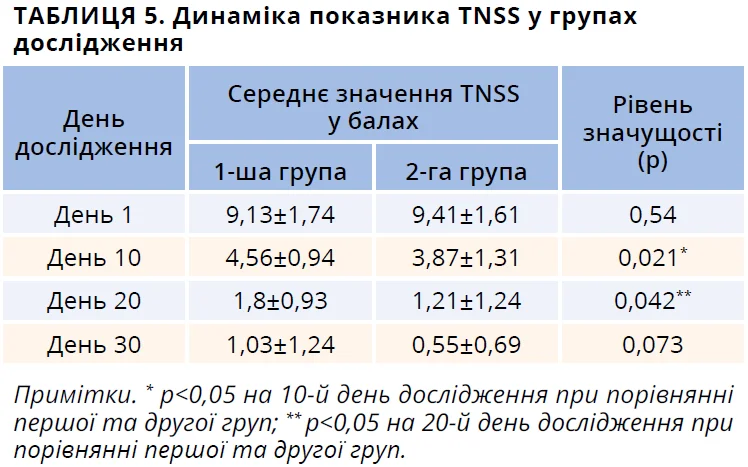
На 10-й і 20-й дні лікування виявлено достовірну різницю середнього сумарного бала назальних симптомів (TNSS): 4,56±0,94 та 3,87±1,31 (p<0,05) при порівнянні результату в першій і другій групах (табл. 5). На момент четвертого візиту (30-й день дослідження) простежувалася тенденція до вираженішого зниження показника TNSS серед пацієнтів, які отримували назальний спрей Лісобакт Рино, проте різниця не була достовірною.
Отже, більш виражений і швидкий клінічний ефект лікування в другій групі пацієнтів підтверджується показниками вираженості об’єктивних і суб’єктивних симптомів АР і може бути зумовлений додатковою позитивною дією назального спрею Лісобакт Рино.
Результати цитологічного дослідження мазків з порожнини носа (риноцитограма)
У хворих на АР перед початком лікування при цитологічному дослідженні мазка з порожнини носа спостерігалося підвищення відсоткового вмісту еозинофілів і нейтрофілів (табл. 6), що характерно для персистуючого АР у стадії загострення згідно з даними літератури [20-23]. Достовірної різниці в досліджуваних показниках до лікування не виявлено.

Після лікування (день 30) в обох групах дослідження спостерігалося зниження відсоткового вмісту еозинофілів і нейтрофілів у мазку з порожнини носа, що відповідає зниженню інтенсивності персистуючого алергічного запалення в стадії загострення, котре відзначалося на початку дослідження. Зменшення вираженості еозинофілії було статистично достовірно суттєвішим (p<0,05) при порівнянні показників у першій і другій групах. Така різниця у відсотковому вмісті еозинофілів у мазках-відбитках наприкінці лікування може бути зумовленою додатковою дією назального спрію Лісобакт Рино, яка полягала в очищенні та зволоженні слизової оболонки порожнини носа, а отже, створенні сприятливіших умов для здійснення протиалергічної дії МФ. Зменшення нейтрофілії мало тенденцію до вираженішої серед пацієнтів другої групи дослідження, в яких також спостерігалася швидша нормалізація кількості та характеристики вмісту носової порожнини в динаміці спостереження (табл. 2, 3), що можна пояснити додатковою протизапальною та протиінфекційною дією лізоциму. Відзначалася значна нейтрофілія на момент візиту на 20-й день у пацієнта першої групи з діагнозом «гострий бактеріальний РС», яка зменшилася після антибактеріальної терапії.
Оцінка мукоциліарного кліренсу за часом сахаринового тесту
Перед початком лікування тривалість часу сахаринового тесту (ЧСТ) була значно підвищеною в пацієнтів з АР в обох групах дослідження, що відповідає опублікованим даним стосовно ЧСТ при АР [18, 19]. Між групами дослідження не спостерігалося статистично достовірної різниці в показниках ЧСТ при першому обстеженні (табл. 7). Варіабельність індивідуальних показників ЧСТ була помітною серед пацієнтів обох груп як до, так і після лікування, що зумовлюється віковими та статевими особливостями епітелію порожнини носа, наявністю шкідливих звичок і професійних факторів тощо.
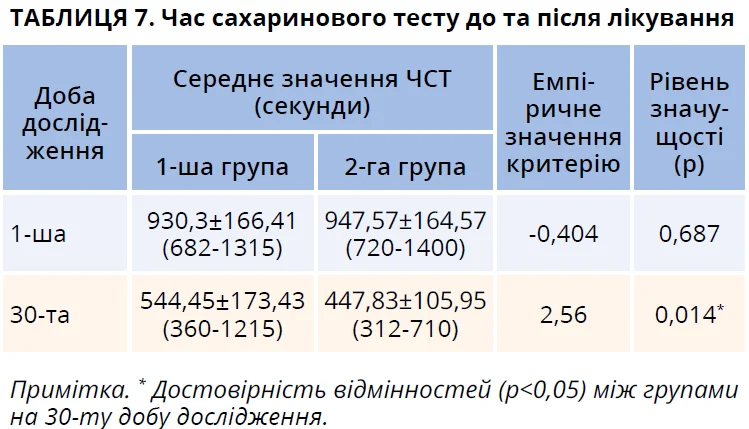
Наприкінці дослідження (день 30) в обох групах пацієнтів зареєстровано поліпшення функції МЦТ, що підтверджувалося зменшенням ЧСТ (табл. 7, рис. 3).
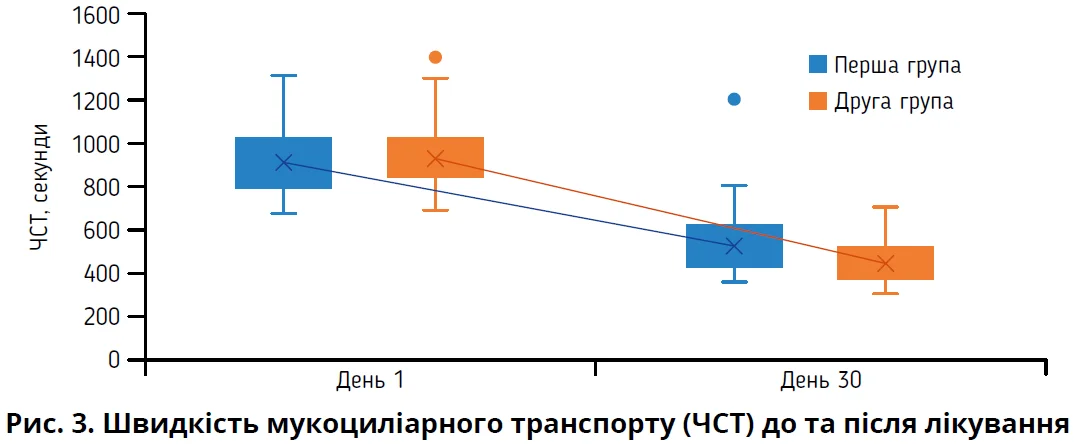
ЧСТ наприкінці дослідження був достовірно меншим у другій групі пацієнтів (p<0,05), що може слугувати підтвердженням сприятливого впливу назального спрею, який містить гіпертонічний розчин натрію хлориду та лізоцим, на функцію миготливого епітелію слизової оболонки порожнини носа хворих на ПАР.
Оцінка ефективності лікування в групах дослідження за візуально-аналоговою шкалою
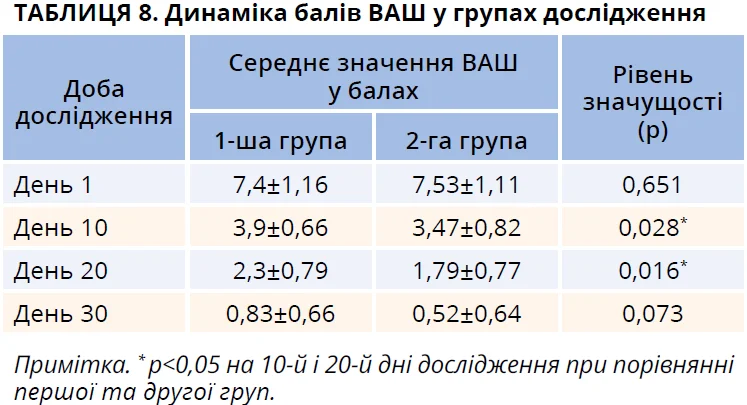
Стійка тенденція до вищої ефективності лікування в другій групі пацієнтів, які окрім базової терапії отримували назальний спрей Лісобакт Рино, підтверджена після аналізу динаміки балів ВАШ у дослідженні.
Достовірно вираженішим було зниження оцінки вираженості АР за ВАШ у другій групі пацієнтів на 10-й і 20-й дні дослідження (табл. 8). Отже, можна припустити, що додавання до базової терапії назального спрею зі вмістом гіпертонічного розчину натрію хлориду та лізоциму сприяє швидшому відновленню погіршеної внаслідок симптомів ПАР якості життя пацієнтів.
Оцінка ефективності лікування за шкалою CGI-I
Дані опитування пацієнтів груп дослідження за шкалою CGI-I (шкала глобального клінічного враження, підшкала оцінки ступеня поліпшення стану) [38, 39] фіксувалися до початку лікування та на 30-й день лікування. Після аналізу отриманих даних виявлено, що відповідь на терапію була позитивною в усіх пацієнтів, які закінчили лікування, тобто відповідали категоріям «виражене покращення» або «помітне покращення» (рис. 4). Пацієнт першої групи, в якого було діагностовано бактеріальний РС, оцінив свій стан після лікування як «помітно покращився», оскільки на момент візиту на 30-й день уже отримав відповідне лікування та не мав скарг з боку навколоносових синусів.

Стан на 30-й день лікування був оцінений як «виражено покращився» 24 пацієнтами першої групи (82,8%) та 26 пацієнтами другої групи (89,7%). Наведені результати оцінки за шкалою CGI-I можуть свідчити на користь кращої відповіді на лікування в групі пацієнтів, які застосовували назальний спрей Лісобакт Рино.
Оцінка переносимості лікування в групах дослідження
Серед пацієнтів другої групи четверо осіб відзначали відчуття незначного дискомфорту (троє – легкі відчуття подразнення й один – легке відчуття печіння) протягом від 3 до 10 хвилин після застосування назального спрею зі вмістом гіперосмолярного сольового розчину та лізоциму, які минали поступово самостійно й не потребували будь-якого лікування. Такі випадки побічної дії описано в літературі як відомі та передбачувані для гіпертонічного сольового назального розчину [28-32]. Серед пацієнтів другої групи не було випадків відмови від застосування назального спрею Лісобакт Рино протягом усього періоду дослідження.
Чотирьох пацієнтів першої групи й одного пацієнта другої групи наприкінці лікування турбувало відчуття дещо підвищеної сухості слизової оболонки носа легкого ступеня вираженості, що можна пояснити відомою побічною дією назального спрею МФ. Менша частота описаного вище відчуття сухості серед пацієнтів другої групи може бути зумовленою додатковою зволожувальною дією сольового розчину у складі назального спрею Лісобакт Рино.
На момент візиту на 30-й день пацієнти, які закінчили дослідження (по 29 осіб першої та другої груп), оцінювали переносимість лікування (рис. 5).
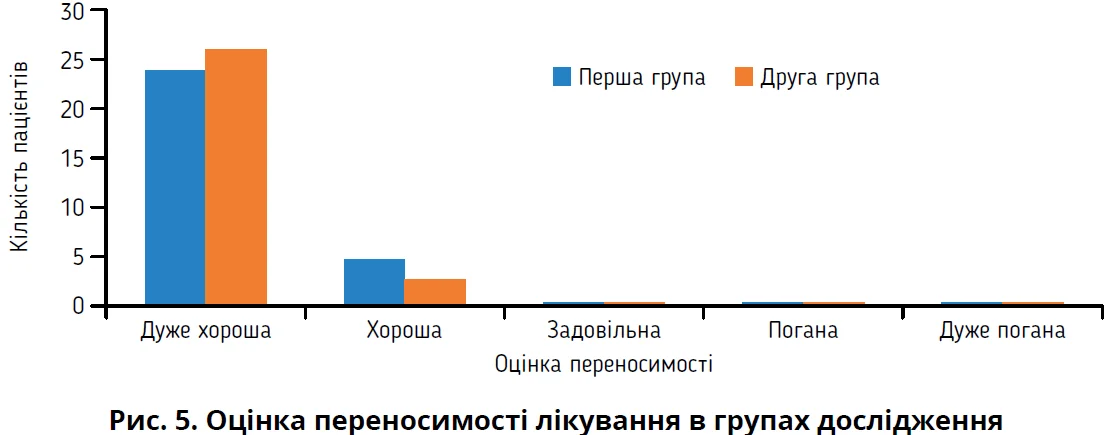
Переносимість лікування як «дуже хорошу» характеризували 24 (82,8%) пацієнти першої групи та 26 (89,7%) пацієнтів другої групи (рис. 5). Загалом переносимість як «хорошу» та «дуже хорошу» охарактеризували 100% осіб в обох групах дослідження. Присутність випадків легкої побічної дії серед пацієнтів, які отримували назальний спрей зі вмістом гіперосмолярного сольового розчину та лізоциму (друга група), не вплинула суттєво на характеристику переносимості пацієнтами. Отже, в проведеному дослідженні спостерігався сприятливий профіль переносимості та безпеки, притаманний назальному спрею Лісобакт Рино.
Висновки
За результатами проведеного дослідження можна стверджувати, що застосування назального спрею Лісобакт Рино в комбінації зі стандартною терапією (назальний спрей МФ і левоцетиризин) у дорослих пацієнтів і підлітків з ПАР у стадії загострення сприяє більш вираженому та швидкому регресу об’єктивних і суб’єктивних клінічних проявів захворювання й, відповідно, підвищенню ефективності лікування хворих.
Як доведено в численних опублікованих дослідженнях, гіпертонічний розчин (складова частина назального спрею Лісобакт Рино) фізіологічно сприяє зменшенню набряку слизової оболонки носа, збільшенню товщини шару слизу та зменшенню його в’язкості, результатом чого є покращення МЦК і, відповідно, підвищення ефективності лікування хворих на АР, патогенетичною ланкою якого є порушення функції війчастого епітелію. У нашому дослідженні отримано статистично достовірне підтвердження позитивного впливу назального спрею Лісобакт Рино на відновлення МЦК при лікуванні пацієнтів з ПАР у стадії загострення.
Зменшення вираженості еозинофілії було статистично достовірно суттєвішим при застосуванні назального спрею Лісобакт Рино. Така різниця у відсотковому вмісті еозинофілів у мазках-відбитках наприкінці лікування може бути зумовленою додатковою дією назального спрею Лісобакт Рино, яка полягала в очищенні та зволоженні слизової оболонки порожнини носа, а отже, створенні сприятливіших умов для покращення біодоступності та протиалергічної дії МФ. Зменшення нейтрофілії в мазку-відбитку з порожнини носа мало тенденцію до вираженішого серед пацієнтів, котрі отримували назальний спрей Лісобакт Рино, в яких також спостерігалася швидша нормалізація кількості й характеристики вмісту носової порожнини в динаміці спостереження, що можна пояснити додатковою протизапальною та протиінфекційною дією лізоциму. Серед хворих, які лікувалися за стандартною схемою, в 1 пацієнта на 20-й день спостереження було діагностовано гострий бактеріальний РС. Можна припустити, що наявність лізоциму у складі назального спрею Лісобакт Рино могла протидіяти інфекційному ускладненню АР.
Випадки побічної дії назального спрею Лісобакт Рино були передбачуваними для сольових розчинів і відповідали легкому ступеню вираженості, що в жодному випадку не спонукало пацієнтів до припинення застосування досліджуваного спрею. Отже, з огляду на власні спостереження можна зробити висновок про можливість характеризувати назальний спрей Лісобакт Рино як засіб зі сприятливим профілем безпеки.
Враховуючи отримані результати дослідження, можна розглядати застосування назального спрею Лісобакт Рино як раціональний вибір при АР у дорослих і підлітків, що може сприяти швидшому полегшенню симптомів, підвищенню ефективності стандартного лікування, зменшення ризику розвинення бактеріального РС і поліпшенню якості життя хворих з АР.
Література
- Brożek J.L., Bousquet J., Agache I., et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines – 2016 revision. J. Allergy Clin. Immunol. 2017 Oct; 140 (4): 950-958. doi: 10.1016/j.jaci.2017.03.050. Epub 2017 Jun 8. PMID: 28602936.
- Bousquet J., Schunemann H.J., Hellings P.W., Arnavielhe S., Bachert C., Bedbrook A., et al. MACVIA clinical decision algorithm in adolescents and adults with allergic rhinitis. J. Allergy Clin. Immunol. 2016; 138 (2): 367-374. doi: 10.1016/j.jaci.2016.03.025.
- Bellanti J.A., Wallerstedt D.B. Allergic rhinitis update: epidemiology and natural history. Allergy Asthma Proc. 2000 Nov-Dec; 21 (6): 367-370. doi: 10.2500/108854100778249088.
- Liu W., Ota M., Tabushi M., Takahashi Y., Takakura Y. Development of allergic rhinitis immunotherapy using antigen-loaded small extracellular vesicles. J. Control. Release. 2022 May; 345: 433-442. doi: 10.1016/j.jconrel.2022.03.016. Epub 2022 Mar 14.
- Pawankar R., Canonica G.W., Holgate S., Lockey R., Blaiss M. WAO white book on allergy: 2013 update. World Allergy Organization, Milwaukee, 2013.
- Morjaria J.B., Caruso M., Emma R., Russo C., Polosa R. Treatment of allergic rhinitis as a strategy for preventing asthma. Curr. Allergy Asthma Rep. 2018; 18: 23. doi: 10.1007/s11882-018-0781-y.
- Crown W.H., Olufade A., Smith M.W., Nathan R. Seasonal versus perennial allergic rhinitis: drug and medical resource use patterns. Value Health.2003 Jul-Aug; 6 (4): 448-456. doi: 10.1046/j.1524-4733.2003.64231.x.
- Bauchau V., Durham S.R. Epidemiological characterization of the intermittent and persistent types of allergic rhinitis. Allergy. 2005 Mar; 60 (3): 350-353. doi: 10.1111/j.1398-9995.2005.00751.x.
- Ahmad N., Zacharek M.A. Allergic rhinitis and rhinosinusitis. Otolaryngol. Clin. North Am. 2008 Apr; 41 (2): 267-281. doi: 10.1016/j.otc.2007.11.010. PMID: 18328367.
- De Corso E., Lucidi D., Cantone E., Ottaviano G., Di Cesare T., Seccia V., Paludetti G., Galli J. Clinical evidence and biomarkers linking allergy and acute or chronic rhinosinusitis in children: a systematic review. Curr. Allergy Asthma Rep. 2020 Sep 5; 20 (11): 68. doi: 10.1007/s11882-020-00967-9.
- Alho O.P., Karttunen T.J., Karttunen R., Tuokko H., Koskela M., Suramo I., Uhari M. Subjects with allergic rhinitis show signs of more severely impaired paranasal sinus functioning during viral colds than nonallergic subjects. Allergy. 2003 Aug; 58 (8): 767-771. doi: 10.1034/j.1398-9995.2003.00252.x.
- Berrettini S., Carabelli A., Sellari-Franceschini S., Bruschini L., Abruzzese A., Quartieri F., Sconosciuto F. Perennial allergic rhinitis and chronic sinusitis: correlation with rhinologic risk factors. Allergy. 1999 Mar; 54 (3): 242-248. doi: 10.1034/j.1398-9995.1999.00813.x. PMID: 10321560.
- Marom T., Alvarez-Fernandez P.E., Jennings K., Patel J.A., McCormick D.P., Chonmaitree T. Acute bacterial sinusitis complicating viral upper respiratory tract infection in young children. Pediatr. Infect. Dis. J. 2014; 33 (8): 803-808. doi: 10.1097/INF.0000000000000278.
- Gan W., Yang F., Meng J., Liu F., Liu S., Xian J. Comparing the nasal bacterial microbiome diversity of allergic rhinitis, chronic rhinosinusitis and control subjects. Eur. Arch. Otorhinolaryngol. 2021 Mar; 278 (3): 711-718. doi: 10.1007/s00405-020-06311-1.
- Yariktas M., Doner F., Demirci M. Rhinosinusitis among the patients with perennial or seasonal allergic rhinitis. Asian Pac. J. Allergy Immunol. 2003 Jun; 21 (2): 75-78. PMID: 14629123.
- Raphael G.D., Jeney E.V., Baraniuk J.N., et al. Pathophysiology of rhinitis. Lactoferrin and lysozyme in nasal secretions. J. Clin. Invest. 1989; 84 (5): 1528-1535.
- Kalfa V.C., Spector S.L., Ganz T., Cole A.M. Lysozyme levels in the nasal secretions of patients with perennial allergic rhinitis and recurrent sinusitis. Ann. Allergy Asthma Immunol. 2004 Sep; 93 (3): 288-292. doi: 10.1016/S1081-1206(10)61503.
- Lale A.M., Mason J.D., Jones N.S. Mucociliary transport and its assessment: a review. Clin. Otolaryngol. Allied Sci. 1998 Oct; 23 (5): 388-396. doi: 10.1046/j.1365-2273.1998.00173.x.
- Button B., Okada S.F., Frederick C.B., Thelin W.R., Boucher R.C. Mechanosensitive ATP release maintains proper mucus hydration of airways. Sci. Signal. 2013 Jun 11; 6 (279): ra46. doi: 10.1126/scisignal.2003755.
- Meltzer E.O., Orgel H.A., Rogenes P.R., Field E.A. Nasal cytology in patients with allergic rhinitis: effects of intranasal fluticasone propionate. J. Allergy Clin. Immunol. 1994 Oct; 94 (4): 708-715. doi: 10.1016/0091-6749(94)90178-3.
- Caruso C., Giancaspro R., Guida G., Macchi A., Landi M., Heffler E., Gelardi M. Nasal cytology: an easy diagnostic tool in precision medicine for inflammation in epithelial barrier damage in the nose. A perspective mini review. Front. Allergy. 2022 Apr 6; 3: 768408. doi: 10.3389/falgy.2022.768408.
- Ciprandi G., Buscaglia S., Pesce G., Pronzato C., Ricca V., Parmiani S., Bagnasco M., Canonica G.W. Minimal persistent inflammation is present at mucosal level in patients with asymptomatic rhinitis and mite allergy. J. Allergy Clin. Immunol. 1995 Dec; 96 (6 Pt. 1): 971-979. doi: 10.1016/s0091-6749(95)70235-0.
- Gelardi M., Maselli Del Giudice A., Candreva T., Fiorella M.L., Allen M., Klersy C., Marseglia G.L., Ciprandi G. Nasal resistance and allergic inflammation depend on allergen type. Int. Arch. Allergy Immunol. 2006; 141 (4): 384-389. doi: 10.1159/000095465.
- Zabolotnyi D.I., Gogunska I.V., Dytiatkovska Ye.M., et al. Unified clinical protocol of primary, secondary (specialized) and tertiary (highly specialized) medical care “Allergic rhinitis”. Rhinology. 2017; 3-4: 19-43 [Ukrainian].
- Passali D., Spinosi M.C., Crisanti A., Belussi L.M. Mometasone furoate nasal spray: a systematic review. Multidiscip. Respir. Med. 2016; 11: 18. doi: 10.1186/s40248-016-0054-3.
- Nettis E., Calogiuri G.F., Di Leo E., Cardinale F., Macchia L., Ferrannini A., Vacca A. Once daily levocetirizine for the treatment of allergic rhinitis and chronic idiopathic urticaria. J. Asthma Allergy. 2008 Dec 16; 2: 17-23. doi: 10.2147/jaa.s3022.
- Talbot A.R., Herr T.M., Parsons D.S. Mucociliary clearance and buffered hypertonic saline solution. Laryngoscope. 1997 Apr; 107 (4): 500-503.doi: 10.1097/00005537-199704000-00013.
- Lansley А.В., Sanderson M.J., Dirksen E.R. Control of the beat cycle of respiratory tract cilia by Ca2+ and cAMP. Am. J. Physiol. 1992 Aug; 263 (2 Pt. 1): L232-42. doi: 10.1152/ajplung.1992.263.2.L232.
- Keojampa B.K., Nguyen M.H., Ryan M.W. Effects of buffered saline solution on nasal mucociliary clearance and nasal airway patency. Otolaryngol. Head Neck Surg. 2004 Nov; 131 (5): 679-682. doi: 10.1016/j.otohns.2004.05.026.
- Han Z.Q., Cheng F.L., Zhao C.Q., Wang Y., Li Q., Zhu M.L., Zhao W. Nasal irrigation with different concentrations of saline as an adjunctive treatment in allergic rhinitis: a systematic review and meta-analysis. Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2018 Dec; 32 (24): 1865-1870 [Chinese]. doi: 10.13201/j.issn.1001-1781.2018.24.005.
- Kanjanawasee D., Seresirikachorn K., Chitsuthipakorn W., Snidvongs K. Hypertonic saline versus isotonic saline nasal irrigation: systematic review and meta-analysis. Am. J. Rhinol. Allergy. 2018 Jul; 32 (4): 269-279. doi: 10.1177/1945892418773566.
- Wang Y., Jin L., Liu S.X., Fan K., Qin M.L., Yu S.Q. Role of nasal saline irrigation in the treatment of allergic rhinitis in children and adults: a systematic analysis. Allergol. Immunopathol. (Madr.). 2020 Jul-Aug; 48 (4): 360-367. doi: 10.1016/j.aller.2020.01.002.
- Fleming A. On a remarkable bacteriolytic element found in tissues and secretions. Proc. R. Soc. Lond. B. 1922; 93: 6-317. doi: 10.1098/rspb.1922.0023.
- Ferraboschi P., Ciceri S., Grisenti P. Applications of lysozyme, an innate immune defense factor, as an alternative antibiotic. Antibiotics (Basel).2021 Dec 14; 10 (12): 1534. doi: 10.3390/antibiotics10121534.
- Barbara L., Pellegrini R. Fleming’s lysozyme: biological significance and therapeutic applications. Edizioni Minerva Medica; Torino, Italy; 1976.
- Parrot J.L., Nicot G. Antihistaminic action of lysozyme. Nature. 1963 Feb 2; 197: 496. doi: 10.1038/197496a0.
- Pintol Z., Pušara Z., Imamović S., Hodžić Đenad., Skopljak A., Šukalo A., et al. Efficacy and safety of xylometazoline-based nasal sprays with and without lysozyme in the treatment of acute nasopharyngitis: lysozyme in treatment of nasopharyngitis. ABCR [Internet]. 2023 Dec 28 [cited 2024 Apr 16];2 (2): 119-125. Available at: https://abcr-mefmo.org/index.php/abcr/article/view/37.
- de la Hoz Caballer B., Rodríguez M., Fraj J., Cerecedo I., Antolín-Amérigo D., Colás C. Allergic rhinitis and its impact on work productivity in primary care practice and a comparison with other common diseases: the Cross-sectional study to evаluate work Productivity in allergic Rhinitis compared with other common dIseases (CAPRI) study. Am. J. Rhinol. Allergy. 2012 Sep-Oct; 26 (5): 390-394. doi: 10.2500/ajra.2012.26.3799.
- Berk M., Ng F., Dodd S., Callaly T., Campbell S., Bernardo M., Trauer T. The validity of the CGI severity and improvement scales as measures of clinical effectiveness suitable for routine clinical use. J. Eval. Clin. Pract. 2008 Dec; 14 (6): 979-983. doi: 10.1111/j.1365-2753.2007.00921.x.
- Andersen I., Proctor D.F. Measurement of nasal mucociliary clearance. Eur. J. Respir. Dis. Suppl. 1983; 127: 37-40.
- Borum P., Holten A., Loekkegaard N. Depression of nasal mucociliary transport by an aerosol hair-spray. Scand. J. Respir. Dis. 1979; 60 (5): 253-259.
