Навігація в мінливому ландшафті атопічного дерматиту: виклики та майбутні перспективи згідно з четвертою Давоською декларацією
Переклала й адаптувала канд. мед. наук Ольга Королюк
Четверта Давоська декларація розроблена у 2022 р. під час Глобального алергологічного форуму в Давосі (Швейцарія) для покращення допомоги пацієнтам з атопічним дерматитом (АД). Під час форуму провідні науковці, клініцисти, фахівці створення політики та захисту прав пацієнтів обговорювали критичні аспекти AД – нейроімунологію, чинники довкілля, супутні хвороби, досягнення в профілактиці, діагностиці й лікуванні.
Атопічні хвороби, як-от АД, алергічний риніт, астма та харчова алергія, є поширеними й виснажливими станами, що вражають людей будь-якого віку та часто недооцінюються фахівцями первинної ланки. Наслідком неадекватного лікування є непотрібні страждання пацієнтів, особливо в групах з низьким рівнем доходу, які часто мають обмежений доступ до адекватної терапії та гірший прогноз через хронічний тяжкий перебіг. Атопічні хвороби знижують якість життя та становлять значний соціально-економічний тягар для пацієнтів і суспільства. Найпоширенішим видом атопії є АД, перші прояви якого зазвичай з’являються в ранньому віці й часто передують іншим алергічним хворобам, у зв’язку з чим АД вважається «вхідними воротами» алергії. Наразі методу вилікування не існує, але інноваційні та цільові методи лікування є перспективними для досягнення контролю хвороби. Нижче наведено основні повідомлення Глобального алергологічного форуму та виявлені прогалини в знаннях щодо АД.
Шкірний епітеліальний бар’єр і порушення внаслідок атопії
Визначення епітеліального бар’єра
Шкірний епітеліальний бар’єр (ШЕБ) є одним з перших місць взаємодії з довкіллям, відіграє важливу роль в адаптації та має низку функцій: бар’єрну, секреторну, видільну, поглинальну, фільтраційну, дифузійну й сенсорну. Взаємодія між ШЕБ та імунною системою досліджувалася впродовж 20 років. Гени, пов’язані з ШЕБ, та їхні білки, зокрема філагрин, відіграють ключову роль у формуванні ороговілої оболонки рогового шару шкіри.
У пацієнтів з АД виявлено мутації в гені філагрину та низьку кількість копій філагрину, що знижує експресію білка. Продукти розпаду органічних кислот філагрину сприяють кислому pH шкіри, що важливо для ШЕБ; мутації філагрину в разі АД призводять до підвищення рН шкіри.
За останні 60 років істотно зросла поширеність хронічних неінфекційних запальних захворювань, зокрема AД. Це пояснюється гіпотезою ШЕБ: зовнішні впливи (мийні засоби, харчові емульгатори) пошкоджують ШЕБ, що призводить до вивільнення алармінів і мікробних змін із транслокацією бактерій або їхніх продуктів до глибших тканин,
що спричиняє алергію та хронічні хвороби.
Роль ШЕБ у патогенезі АД
Зміни клімату та глобальна індустріалізація значно посилили впливи антропогенних екзогенних стресорів, з якими ШЕБ функціонально не справляється, особливо в промислово розвинутих регіонах. Щоденний вплив токсинів і хімічних речовин спричиняє дисфункцію ШЕБ і є важливим механізмом алергічних захворювань. Продемонстровано епідеміологічні докази зв’язку виникнення АД з прямим впливом мийних засобів; у здорових немовлят до появи AД спостерігаються значні зміни у структурі епідермальних ліпідів. Зміни ШЕБ можливі після домашнього впливу жорсткої води, особливо в осіб з мутаціями гена філагрину, що вказує на взаємодію «ген – довкілля».
Імунна система шкіри: вроджені й адаптивні реакції, тренований імунітет
У шкірі пацієнтів з АД домінує імунна відповідь Th2 з можливим внеском інших імунних шляхів – Th1, Th17 і Th22 (рис. 1). Активовані клітини Th2 вивільняють цитокіни – інтерлейкін-4 (IL-4) й IL-13, які спричиняють дисфункцію ШЕБ, пригнічуючи експресію бар’єрних білків, зокрема філагрину. З’являються докази щодо більш значущої патогенетичної ролі IL-13 порівняно з IL-4. Обидва цитокіни використовують α-рецептор IL-4 2-го типу. У разі АД експресія гена IL-13 у шкірі підвищена; експресія IL-13 негативно корелює з функцією генів ШЕБ, натомість блокування IL-13 ралокінумабом скасовує індуковане IL-13 зниження експресії генів у дослідженні in vitro.
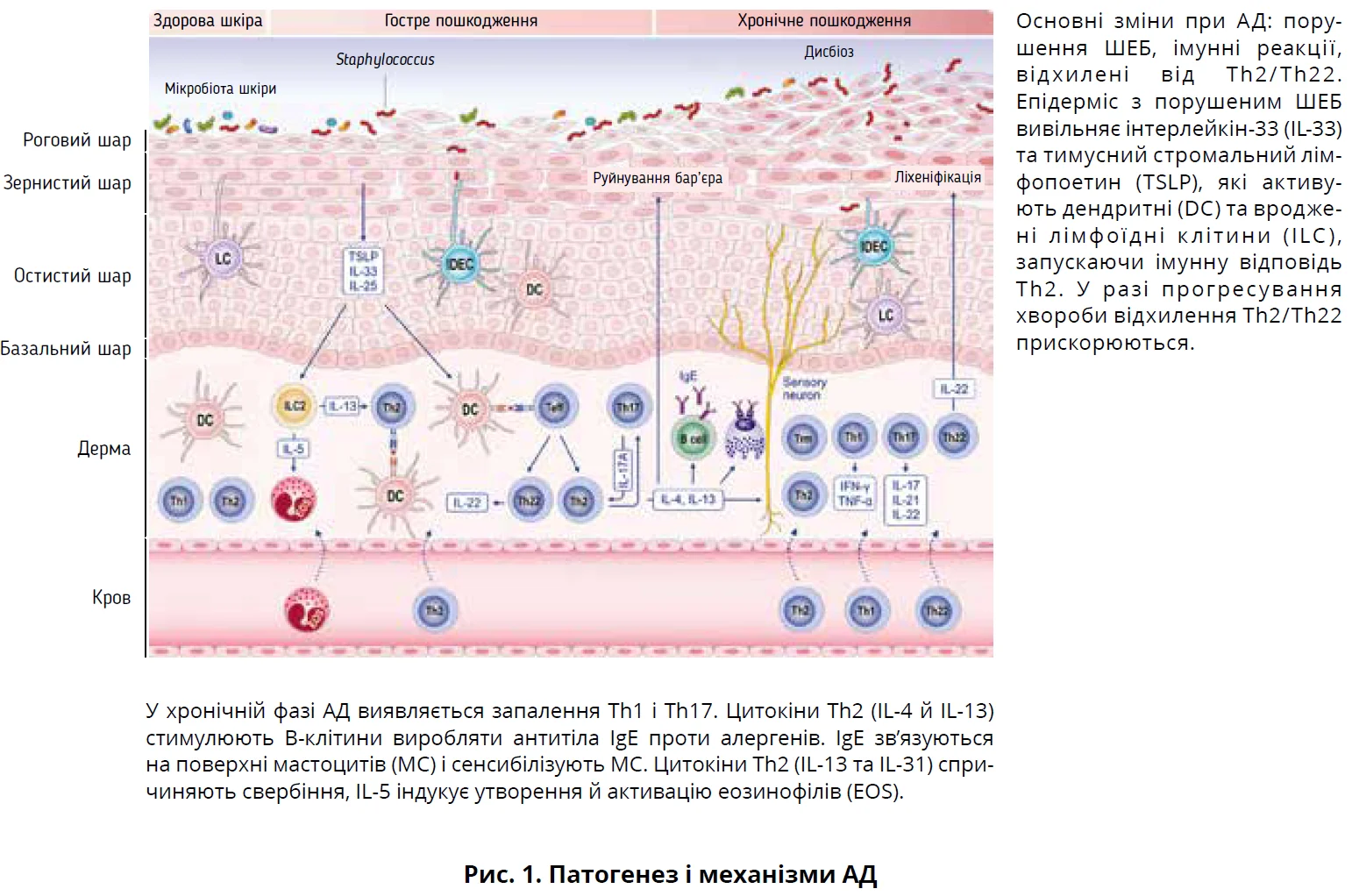
Блокування передачі сигналів IL-4 й IL-13 покращує клінічні ознаки AД, включаючи функцію ШЕБ. Ранні втручання для підтримки ШЕБ здатні запобігати епікутанній презентації антигена та подальшому розвитку інших алергічних станів, зокрема харчової алергії. Проте, коли лікування переривається, хвороба часто рецидивує, що свідчить про наявність клітин пам’яті в шкірі й інших патогенних уроджених і адаптивних імунних механізмів. Аналіз одноклітинної РНК-seq шкіри з AД виявив детальні типи клітин та їхню активність, демонструючи наявність клітин Th2A, зрілих дендритних і цитотоксичних клітин навіть після 1 року лікування. Наявність уроджених лімфоїдних клітин і запальна чи вроджена пам’ять епітеліальних стовбурових клітин шкіри вказують на їхню потенційну роль у підтримці запальних уражень при AД. Зокрема, запальні гени в епітеліальних клітинах-попередниках легше активуються через вторинні стимули внаслідок епігенетичних і метаболічних змін, що призводить до порушень доступності хроматину.
Протимікробний захист шкіри
Протимікробні пептиди (ПМП), які постійно виробляються й індукуються під час інфекції та пошкоджень, є першою лінією протимікробного захисту шкіри. Асоціація Staphylococcus aureus і вірусних інфекцій, зокрема простого герпесу, сприяє диференційній експресії кератиноцитами таких ПМП, як людський β-дефензин-2 (HBD-2), HBD-3, LL-37, РНКаза-7 і псоріазин, у пацієнтів з AД на відміну від здорових людей і пацієнтів із псоріазом. Роговий шар також є джерелом «катіонних внутрішньо невпорядкованих ПМП» (CIDAMP), як-от горнерин, філагрин-2, білки пізньої ороговілої оболонки та спейсерні ділянки філагрину. CIDAMP виявляють потужну бактерицидну активність за кислого рН щодо грамнегативних бактерій; пальмітоїльовані CIDAMP потужно протидіють S. aureus; бактерицидна дія реалізується через вплив на рибосомальні білки, подібно до аміноглікозидів. S. aureus виділяє позаклітинні протеази (V8 або SspA), які розщеплюють позаклітинні білки, порушуючи ШЕБ і спричиняючи свербіж. Пошкодженню, опосередкованому V8, запобігає HBD-2.
Метаболізм шкіри
Правильна функція клітини залежить від ефективного використання різних метаболічних шляхів і від наявності глюкози, амінокислот, ліпідів, мінералів і кисню, котрі порушуються при AД. У разі АД запальні ураження характеризуються гіперпроліферацією кератиноцитів і збільшенням запальних клітин, що свідчить про специфічне метаболічне перепрограмування шкіри. Підвищені рівні циркулювального лактату та сигнатури експресії генів указують на зміни гліколізу й метаболічний зсув у бік анаеробного гліколізу, тоді як неураженій шкірі притаманне окисне фосфорилювання.
Важливу роль у патогенезі АД відіграє ліпідний метаболізм. Лікування дупілумабом (анти-IL-4/IL-13) може змінити метаболом уражень AД з клінічними відповідями у вигляді посилення метаболізму гліцерофосфоліпідів і циклу трикарбонових кислот. Ці метаболічні маркери можуть бути невід’ємною частиною вилікування AД; наприклад, у мишачих моделях АД жирні кислоти з коротким ланцюгом, отримані з кишківника, покращували цілісність ШЕБ, ранню сенсибілізацію до алергенів і розвиток хвороби.
Сенсорна й адаптаційна роль ШЕБ
Характерними ознаками патобіології АД є перехресні зв’язки між запаленням шкіри 2-го типу, нейроімунною дисфункцією та дисфункцією ШЕБ, що зрештою призводять до хронічного свербіння. Під час нейрогенного запалення активуються соматосенсорні аферентні нервові волокна під впливом медіаторів, які вивільняються різними клітинами шкіри, зокрема пошкодженими кератиноцитами й імунними клітинами. У запаленні та свербінні задіяно багато цитокінів 2-го типу: IL-4, IL-13, IL-31, аларміни (IL-33, тимусний стромальний лімфопоетин – TSLP) (рис. 1).
Безпосередня взаємодія й сенсибілізація сенсорних нейронів IL-4, IL-13 та IL-31 підтримують свербіж. За хронічного свербіння підвищується рівень IL-33, передача сигналів від його рецепторів до сенсорних нейронів індукує свербіння. У гуманізованих мишей спостерігалися характерні нейроімунологічні розлади, зокрема зниження регуляції β2-адренорецепторів з дисфункцією ШЕБ. Хімічне забруднення епітеліальних тканин асоціюється з гіперчутливістю, хронічним запаленням та окисним стресом, кожен з яких призводить до дефектів ШЕБ і впливає на центральну нервову систему.
Зміни довкілля як рушійна сила атопічних захворювань
Тривожне зростання частоти атопічних захворювань тісно пов’язане зі впливом довкілля на тлі генетичної сприйнятливості. Підвищення температури, посуха, лісові пожежі, вологість і забруднення посилюють впливи пилку, плісняви, паразитів, диму та комах, а також вторинні зміни у складі експозиції в приміщенні. Забруднення повітря, як компонент експозиції, спричиняє глобальні зміни клімату та загострює АД й астму. Отже, компоненти експозиції, а також тривалість впливів у ранньому дитинстві або пізніше в дорослому віці мають вирішальне значення для вивчення та зменшення поширеності атопічних захворювань. На розвиток імунітету немовлят сильно впливають біологія господаря та довкілля. «Гігієнічна гіпотеза» припускає, що знижений вплив мікробів у промислово розвинених країнах погіршує розвиток імунітету. Глобальні дослідження співвідносять мікробіоту раннього віку з атопією, але точні механізми все ще досліджуються.
З потеплінням клімату нові алергени (кліщі й амброзія) поширюються в раніше менш уразливі регіони. Дарвінівська теорія «виживання найпристосованішого» демонструє, як інвазивні види витісняють багату різноманітну місцеву фауну та флору, масово змінюючи експозицію. Втрата біорізноманіття в макро- та мікросередовищі асоціюється зі збільшенням частоти атопічних захворювань. Яскравим прикладом впливу змін довкілля на алергічні хвороби є збільшення популяції кліщів, які спричиняють синдром α-гал (галактозо-α-1,3- галактози), що передається через укус кліща та зумовлює «алергію на червоне м’ясо». У пацієнтів із синдромом α-гал виявляють антитіла класу IgE до вуглеводу α-гал, який передається через укуси кліщів; клінічні ознаки коливаються від кропив’янки до загрозливої для життя анафілаксії після споживання α-гал, який міститься в червоному м’ясі або продуктах ссавців. Іншим прикладом є високоалергенний пилок амброзії (Ambrosia artemisiifolia), інвазивної квіткової рослини, що походить з Північної Америки, але успішно розширила свою присутність по всій Європі. У країнах з теплим кліматом цей алерген істотно збільшує частоту алергічних захворювань унаслідок підвищення температури.
Захисні чинники довкілля
У дедалі урбанізованішому світі перебувають під загрозою такі природні захисні чинники, як харчування та довкілля, котрі протидіють алергії. Мешканці сільської місцевості переймають риси міського способу життя. Індустріалізація сільського господарства та харчової промисловості була важливою для розширення поставок продуктів харчування, а встановлення вимог до гігієнічних процесів зменшило потенційне зараження й ризик інфекцій. Проте так званий ефект ферми, який включає різноманітні впливи довкілля та мікробів, асоціюється з нижчими показниками алергічних захворювань. Перероблення харчових продуктів асоціюється з вищою імуногенністю й алергенністю білків. Для розроблення можливих профілактичних і терапевтичних методів або харчових утручань важливо розуміти, як індустріалізація спричиняє виникнення атопії та як біорізноманіття асоціюється з атопічними хворобами.
Мікробні аспекти
Складні зв’язки між експозицією та господарем, особливо причинно-наслідкові зв’язки між АД і мікробіомом, недостатньо вивчені. Зокрема, в разі АД підвищується pH шкіри, з чим корелює кількість S. aureus. Проблема в з’ясуванні причинно-наслідкового зв’язку полягає в тому, що дослідження переважно вивчають асоціації, в яких зміни мікробіому шкіри описуються разом із прогресуванням AД й ефективністю лікування, але зазвичай не надають доказів причинного зв’язку. Встановлено, що S. aureus може спричиняти запалення шкіри; це підкреслює складність взаємозв’язків між АД та мікробами. У когорті немовлят зменшення різноманітності мікробіому шкіри у віці 2 місяців було прогностичним чинником подальшого розвитку AД у ранньому дитинстві. Для глибшого розуміння мікробіому шкіри та його потенційного використання для персоналізованої медицини потрібні лонгітюдні дослідження за участю людей зі стандартизованими протоколами оцінювання мікробіому шкіри.
Концепція імунологічного маршу під час перебігу АД
Фізіологічний розвиток імунітету проти імунологічного маршу
Імунна система – це динамічна конструкція, котра постійно зазнає впливів зовнішніх і внутрішніх сигналів і реагує на них. Імунна система формується до народження та проходить фізіологічний розвиток упродовж життя, внаслідок чого формується міцний збалансований імунітет, який включає залежну від віку появу різних типів клітин, експресію та функцію рецепторів розпізнавання образів на антигенпрезентувальних клітинах, а також імунологічні відповіді, класифіковані як Т-хелперні клітини та регуляторні Т-відповіді на основі специфічних цитокінових профілів (рис. 2).
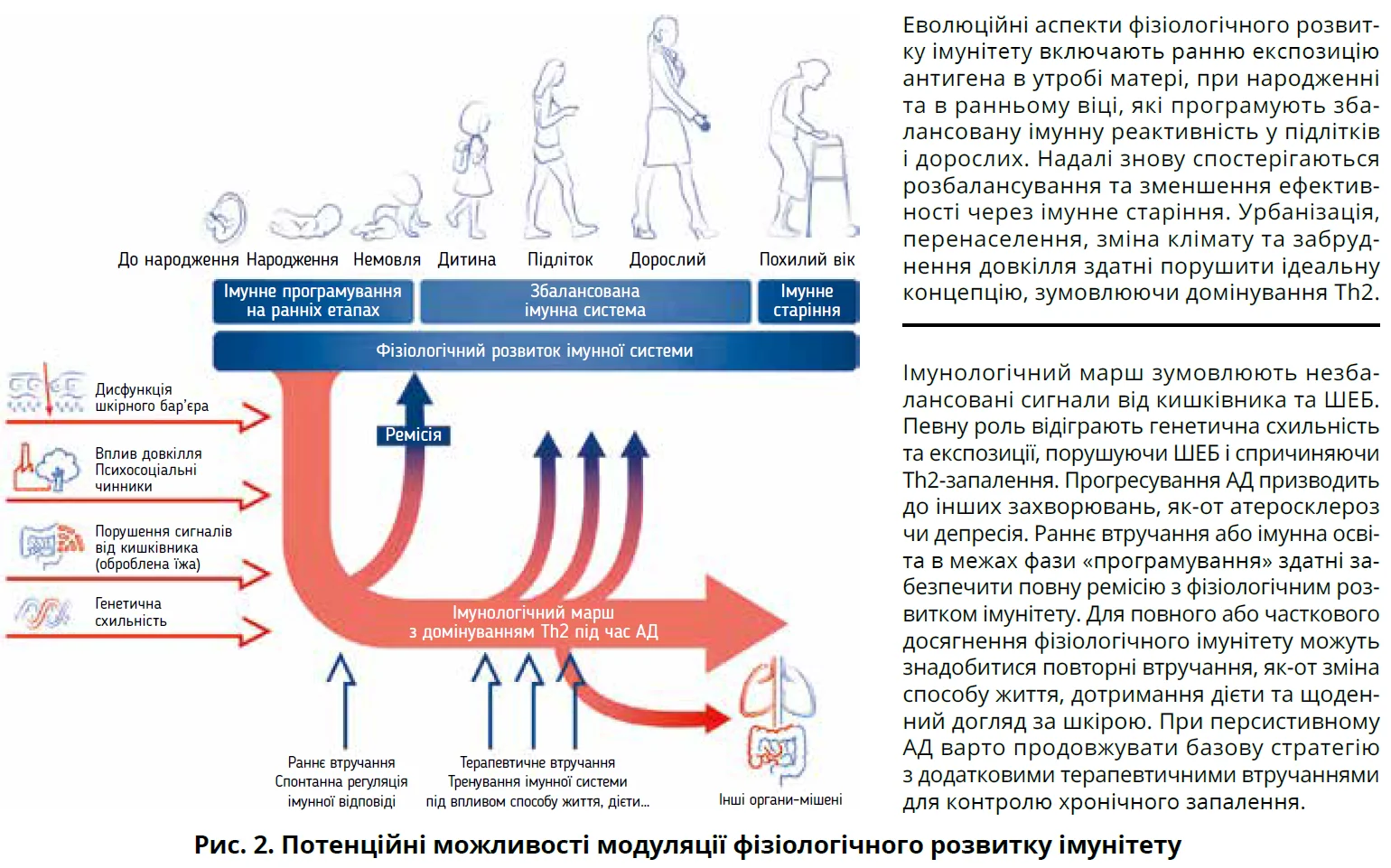
Під час перебігу AД описано імунологічні відмінності від фізіологічного розвитку та вікових змін імунітету, зокрема активація локальної вродженої імунної системи в шкірі, що призводить до домінування Th2-адаптивної імунної відповіді. Підвищені епідермальні рівні тимічного, регульованого активацією хемокіну (TARC) у здорових немовлят передбачають пізніший початок AД. У дослідженнях за участю дітей, підлітків і дорослих з АД спостерігалися чіткі відповіді Th1, Th17 і Th22 різної інтенсивності, зосереджені навколо початкової основної відповіді Th2. Залежне від віку збільшення IFN-γ/Th1 у здорових дітей і дорослих до 40 років відсутнє або приховане домінуванням Th2. У пацієнтів з AД спостерігалося значне підвищення IL-13 і TARC порівняно з групою контролю; з віком відзначається постійне підвищення IL-6, IL-17A й IL-22, тоді як у групі контролю рівні вказаних цитокінів були сталими або навіть зниженими у віці до 60 років. Отже, імунні відхилення в різних вікових групах АД (так званий імунологічний марш) відрізняються від фізіологічного розвитку імунітету.
У розумінні імунологічного маршу при AД є прогалини, оскільки більшість даних узято з перехресних досліджень конкретних вікових груп, які відображають певні характеристики AД. Отже, потрібні лонгітюдні дослідження.
«Атопічний марш» включає можливість виникнення інших атопічних захворювань, пов’язаних з Th2, – алергічної астми, алергічного риніту, харчової алергії, еозинофільного езофагіту. Проте інформації щодо детальної динаміки імунологічного маршу, його механізмів і зв’язків із клінічними траєкторіями AД недостатньо. До супутніх захворювань, опосередкованих Th2, може призводити епікутанна сенсибілізація; однак інші механізми не відомі. Потребують з’ясування роль IgE в разі АД, яка добре задокументована для інших супутніх станів, зумовлених Th2, роль індукованого Th2 перемикання класу B-клітин на продукцію IgE та вплив IgE-специфічності. Незадовільні результати терапії, націленої на IgE (омалізумаб) у пацієнтів з AД, вказують на потребу глибшого розуміння механізмів. Слід вивчити імунологічні механізми, пов’язані з пізнім початком АД та спонтанною ремісією. Нещодавні епідеміологічні дослідження показали, що в разі початку АД з дитинства вищі шанси на астму, харчову алергію й інші види атопії, але менша ймовірність алергічного риніту, ніж у разі початку АД у дорослому віці. Тож сучасне розуміння клінічних зв’язків з імунологічним маршем недостатнє. Декілька тваринних моделей AД й інших атопічних захворювань дають змогу зрозуміти певні аспекти базових патологічних механізмів, але для розуміння складності постійного та динамічного атопічного діатезу терміново потрібні нові тваринні моделі. Додаткову інформацію можуть надати дослідження певних порід собак (весті, бігль, боксер), які генетично схильні до AД і живуть у подібних до людей умовах, а відповідно, мають схожі експозицію та спосіб життя. Отже, слід розширити співпрацю між ветеринарами та науковцями, котрі займаються фундаментальними дослідженнями людини.
Стратегії втручання для відновлення фізіологічного імунітету
На фізіологічний розвиток імунної системи активно впливають дієта та кишково-мікробні сигнали, які формують «нормальний» стан імунної відповіді. З іншого боку, порушення ШЕБ і активація вродженої імунної системи в шкірі можуть призвести до хронічного запалення, змінюючи фізіологічний шлях імунологічного маршу. Ці знання надають унікальні можливості для різних стратегій втручання: 1) шляхом надання природних імунних сигналів на ранньому етапі життя (можливо, під час вагітності), які прискорюють фізіологічний розвиток; 2) шляхом відновлення функції ШЕБ і зменшення епікутанної сенсибілізації; 3) шляхом фармакологічного втручання (наприклад, раннє й інтенсивне лікування запалення шкіри); або комбінацій указаних стратегій. Однак ефективність цих заходів може залежати від часу втручання, котрий іще належить визначити. Наприклад, у дорослих позитивні ефекти від зміни зовнішніх чинників зазвичай нетривкі; для збереження ефекту може знадобитися постійна модифікація поведінки. Адаптацію способу життя пацієнтів до атопічного захисту за допомогою дієт, підвищення активності та відмови від куріння слід розглядати як терапевтичний захід у лікуванні AД. Навчання цьому має бути частиною догляду за пацієнтом. Невідомо, чи існує певний часовий проміжок у ранньому віці, коли екологічні або терапевтичні втручання мали б довгострокову користь. Дієта матері під час вагітності може вплинути на ризик розвитку AД у дитини, що вказує на важливість пренатального впливу. Крім того, вплив вагінального мікробіому матері під час народження може знизити ризик виникнення АД. Отже, з’являється чимраз більше доказів щодо можливості позитивного впливу втручань на ранньому етапі життя для запобігання імунологічному маршу та його клінічній кореляції – атопічному маршу в довгостроковій перспективі.
Нейроімунологія, системне запалення та супутні хвороби
У галузі вивчення АД дедалі більшої ваги набувають нейроімунологічні дослідження для з’ясування механізмів впливу системного запалення на нейроімунні реакції в організмі, підкреслюючи складний двобічний зв’язок між імунною та нервовою системами.
Свербіж: від нейроімунних до психосоматичних аспектів
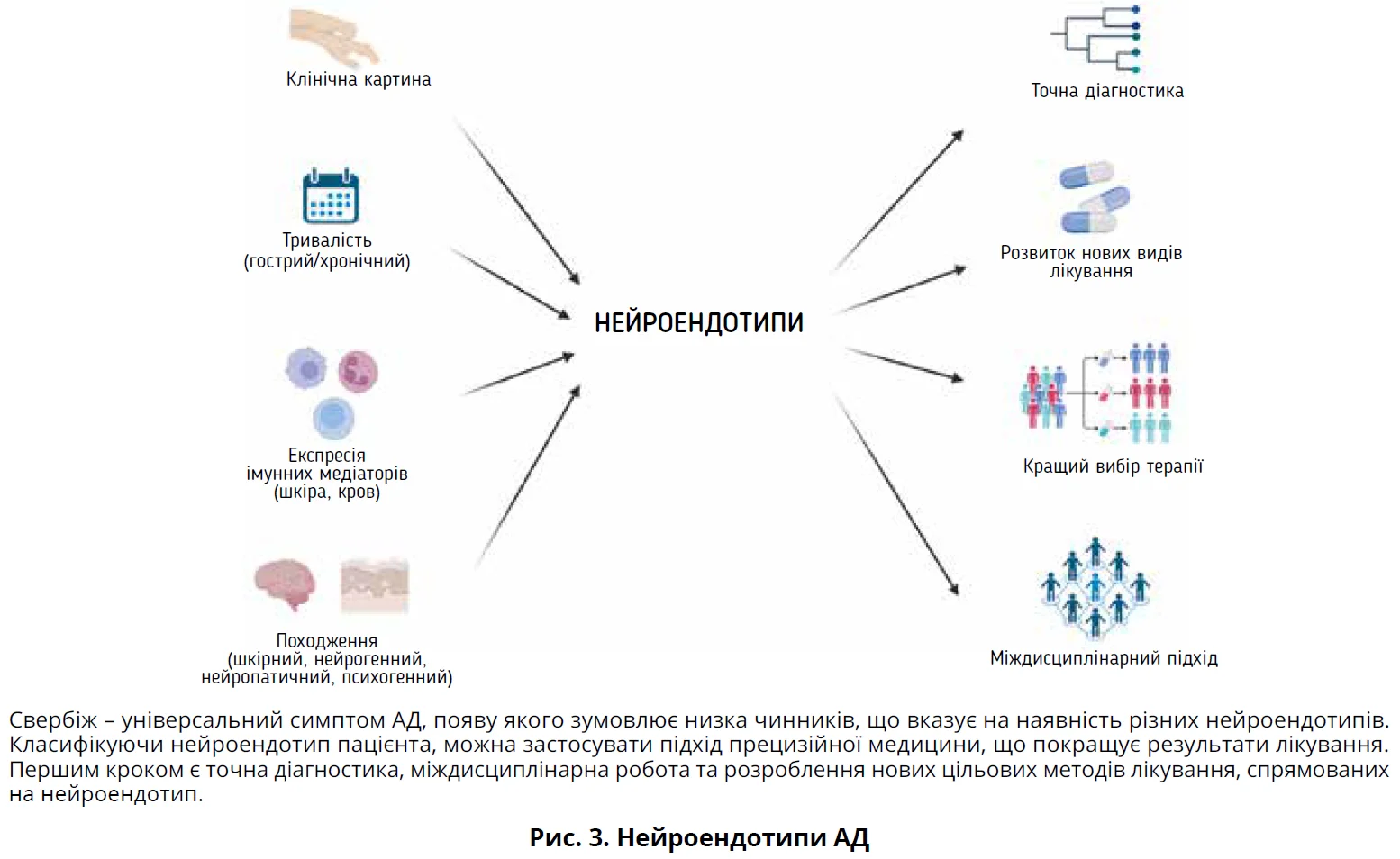
Свербіж – неприємне відчуття, що викликає бажання почухатися, є основним симптомом і характерною ознакою AД. Пацієнти з АД вважають свербіж та екзему на видимих ділянках тіла одними з найобтяжливіших проявів хвороби, що часто призводить до стигматизації. Свербіння часто турбує цілодобово, порушуючи сон і нормальне існування, включаючи працездатність, успішність у школі, соціальне життя та стосунки. Пацієнти страждають від хибного кола «свербіж ® подряпини ® запалення». Механізми свербіння до кінця не вивчені. Серед численних факторів, які впливають на свербіж (рис. 3), ключовою є взаємодія між нервовою системою, імунною системою та шкірою, зокрема тучними клітинами.
Активація сенсорних нервів передає сигнали в центральну нервову систему, яка модулює фізіологію шкіри шляхом вивільнення гормонів, активації нейропептидів і нервових рецепторів (вісь «шкіра – мозок»). У відчуттях свербіння та болю задіяні однакові шляхи, але різні цитокіни. Сенсорні нерви, залучені до відчуття свербіння, викликають відповідь шляхом вивільнення низки нейропептидів: пептид, пов’язаний з геном кальцитоніну, поліпептид, що активує аденілатциклазу гіпофіза, субстанція P. Складна патофізіологія свербіння умовлена тісною двобічною взаємодією нервів та імунних клітин (Т-клітин, еозинофілів, базофілів, мастоцитів), що спричиняє нейрогенне запалення. Медіатори, вивільнені імунними клітинами, прямо впливають на нерви, зокрема гістамін, триптаза, лейкотрієни, нейропептиди, цитокіни (IL-4, IL-5, IL-13, IL-31) і аларміни (TSLP117). Блокада α-рецепторів IL-4 й IL-31, а також пригнічення Янус-кінази-1/2 забезпечує контроль свербіння. Ендогенні опіоїди та їхні рецептори в центральних і периферичних нервах і різних клітинах шкіри також спричиняють свербіння та зміни ШЕБ.
Важливою є роль центральної нервової системи та психіки. Візуалізаційні дослідження мозку чітко вказують на активацію різноманітних ділянок мозку, включаючи лімбічну систему, під час відчуття свербіння. Психосоціальні фактори спричиняють індукцію соматоформного свербіння; значний вплив на відчуття свербіння мають словесні навіювання чи інструкції. З іншого боку, свербіж може індукувати або посилювати розвиток таких психосоматичних реакцій, як тривога чи депресія. Декілька досліджень продемонстрували зв’язок між AД та супутніми психіатричними хворобами.
Активно обговорюється концепція того, якою мірою стани зі свербінням, зокрема АД, можна розглядати як хвороби із системним запаленням, що діє не лише на нервову систему, а й на інші органи – серце, легені або кишківник. Наприклад, певні групи пацієнтів з АД мають вищий ризик серцево-судинних захворювань, імовірно, через порушення сну та зниження фізичної активності. Цікаво, що раніше зареєстрований зв’язок «доза – реакція» між тяжкістю AД та ризиком серцево-судинних захворювань указує на вираженіше системне запалення при тяжкому AД, хоча абсолютний ризик мінімальний. Запальні медіатори можна виявити при хворобах шкіри, травного тракту та легенів, що підкреслює важливість вивчення коморбідності при хворобах, які супроводжуються свербінням. Чхання та кашель унаслідок подразнення носа й дихальних шляхів є відповідними реакціями з боку вказаних органів, як і подряпини у відповідь на свербіж, тобто ці прояви, вочевидь, є поведінковими реакціями господаря.
Виявлено різні тригери свербіння, зокрема алергени та мікроби. Сенсорні нейрони здатні виявляти молекулярні ліганди бактерій (особливо S. aureus), що впливає на відчуття свербіння та болю. Окрім мікробіому шкіри, до свербіння може призводити кишковий мікробіом через кишково-шкірну вісь та/або вісь «кишківник – мозок», хоча конкретні механізми не з’ясовані.
Терапевтичні, освітні та глобально-економічні аспекти
Нові революційні методи лікування АД
Останнім часом значного прогресу досягли цільові методи лікування АД. У Європі для системної терапії при помірному-тяжкому AД схвалено такі біологічні препарати: дупілумаб (анти-IL-4Rα), тралокінумаб (анти-IL-13), лебрикізумаб (анти-IL-13), а також барицитиніб, упадацитиніб і аброцитиніб (інгібітори Янус-кінази). Зважаючи на гетерогенність АД, прийнятнішою стратегією лікування є підхід прецизійної медицини, але для стратифікації ендо- та фенотипів конче потрібні біомаркери. Призначення цільової терапії потребує ретельного оцінювання коморбідності, коротко- й довгострокової ефективності та профілю безпеки (рис. 4).

Незважаючи на значну поширеність АД та терапевтичні досягнення, зберігається значна глобальна, економічна й освітня нерівність у лікуванні. Для забезпечення кожного пацієнта оптимальною терапією потрібна співпраця пацієнтів, медичних фахівців і фармацевтичної промисловості, щоб наукові досягнення застосовувалися на практиці.
Глобальний консенсус щодо індивідуальних цілей лікування
Чи не найбільшою проблемою в лікуванні AД є відсутність глобального консенсусу щодо визначення індивідуальних цілей та оцінювання тяжкості хвороби. Адже АД є клінічно неоднорідною хворобою з великим діапазоном клінічних фенотипів і базових ендотипів, які зумовлюють різні відповіді на лікування, включаючи початок, швидкість і тривалість відповіді; профілі побічних ефектів і реакції біомаркерів. Окрім того, в різних етнічних групах і кліматичних умовах патомеханізми АД можуть відрізнятися: домінування Th2 в осіб європейського походження; додатковий компонент Th17 в осіб азійського й африканського походження. Майбутні дослідження мають зосередитися на вивченні патологічних особливостей AД у різних етнічних групах і ролі довкілля, що сприятиме ефективнішій та економічно вигіднішій діагностиці й адаптації терапевтичних підходів. Для оцінювання тяжкості хвороби, визначення відповідних цілей лікування та показань до системної терапії потрібний глобальний консенсус. Європейська робоча група з АД та Міжнародна рада з екземи намагалися визначити вказані аспекти. У значної частки пацієнтів з легким-помірним АД підвищені рівні біомаркерів, пов’язаних з тяжкістю хвороби, вказують на системний вплив запалення шкіри. Нові європейські настанови вже розглядають більш персоналізоване впровадження системної терапії за межами ієрархічних об’єктивних оцінок тяжкості, пропонуючи показники результатів, які оцінюються клініцистами та пацієнтами, відповідно до Ініціативи щодо узгоджених результатів лікування екземи. Крім того, системна терапія рекомендується за недостатньої відповіді на «належним чином проведену місцеву терапію» або обмеження повсякденного життя через недостатній контроль хвороби.
Ведення й ефективне лікування AД як засіб запобігання прогресуванню AД й атопічному маршу – до модифікації хвороби
Доступність нових ефективних варіантів лікування створює вікно можливостей для профілактики або зміни прогресування на ранніх стадіях AД. Раннє достатнє топічне лікування з додатковим цільовим видом системної терапії здатні зменшити тяжкість хвороби й кількість загострень, забезпечити тривалу ремісію та знизити ризик супутніх захворювань 2-го типу.
Впровадження системної терапії та покращення контролю хвороби порушує низку питань щодо практичних аспектів лікування: визначення «ремісії» та «модифікації АД»; тривалість системної терапії в разі добре контрольованого АД; стабільність відповіді за зниження дози або подовження інтервалів між уведенням; поєднання різних видів системної терапії; визначення пацієнтів з недостатньою відповіддю (рис. 5). Крім того, можна очікувати певних проблем, зокрема лікування пацієнтів зі складними медичними профілями (вагітність або метастатичні злоякісні пухлини), практичні проблеми через значні витрати та високі ціни на ліки, які не покриваються страхуванням.

Для оцінювання ефективності різних комбінацій для досягнення терапевтичної ремісії потрібні добре сплановані проспективні дослідження; важливо також зібрати клінічні та лабораторні дані з реєстрів пацієнтів і академічних досліджень. Занепокоєння щодо економічної ефективності треба збалансувати з наслідками зниження якості життя, обмеження працездатності та негативного впливу на тривалість життя.
Глобальні аспекти ведення АД
Сучасні методи системної терапії обмежені або недоступні в багатьох регіонах світу. У деяких регіонах прості методи лікування, як-от пом’якшувальні засоби або місцеві стероїди, вважаються продуктами розкоші. Додатковими перешкодами є відсутність компетентних або навчених лікарів і погана медична інфраструктура. Ця ситуація може змінитися тепер, коли Всесвітня організація охорони здоров’я почала інтегрувати поширені шкірні хвороби в глобальну стратегію охорони здоров’я. Настанови мають надавати чіткі, практичні та реалістичні рекомендації, які оптимізують усі доступні методи лікування й підтримують спільне прийняття рішень. Величезне значення мають подальші дослідження профілактики й модифікації АД із залученням аспектів зміни клімату та здоров’я планети.
Освітні програми як потужні інструменти для ведення AД
Глобальний план навчання пацієнтів, що включає онлайн-інформацію та цифрові інструменти, може покращити догляд за пацієнтами з АД.
Відсутність освіти щодо місцевої терапії призвела до поширених недоліків у лікуванні. Багато пацієнтів не знають про весь спектр доступних варіантів лікування, а лікарі можуть не мати знань або ресурсів для надання оптимальної допомоги. Ці проблеми підкреслюють потребу підвищення рівня обізнаності, освіти та ресурсів для пацієнтів і медиків, а також важливість співпраці всіх учасників для розроблення ефективних освітніх заходів і програм. Слід усунути прогалини в освіті за допомогою цільових освітніх утручань. Навчання має зважати на сім’ю як невід’ємний чинник цілісного догляду та вік пацієнта. Ефективна освіта включає доставлення інформації та досвіду, коли обидві сторони (надавач і одержувач) інвестовані, мотивовані й залучені; наприкінці навчання мають спостерігатися поведінкові зміни. Запуск програми «Глобальний атлас з АД» (GAAD) був спробою розширити освіту, що в ідеалі збільшить обізнаність і знання в цілому світі.
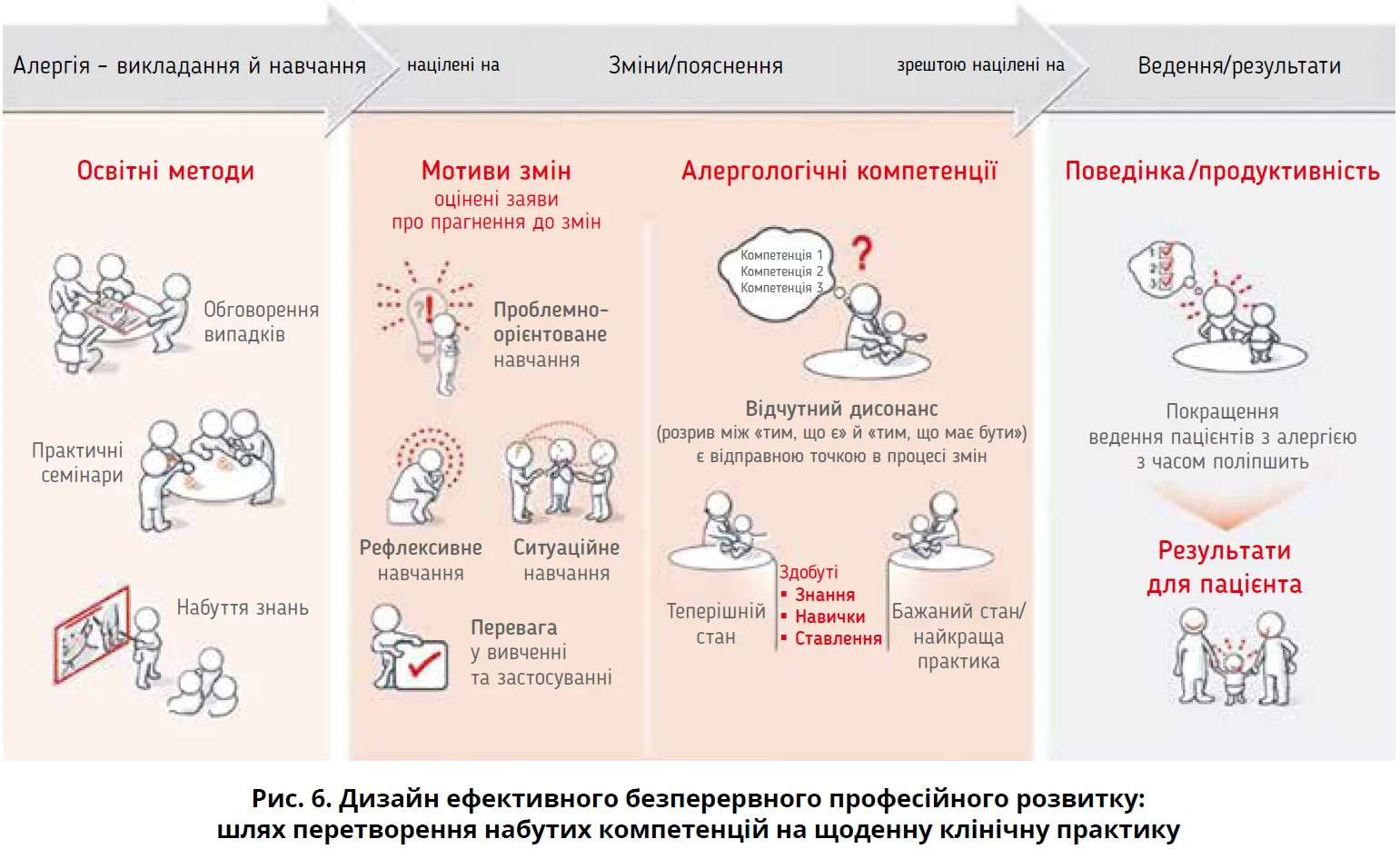
Пріоритетними є цілісні передові методи навчання, що ґрунтуються на доказах. Важливо оцінювати потреби шляхом «аналізу прогалин». Для ефективної передачі знань і навичок потрібно залучати інтерактивні методи, як-от «змішане навчання» та «перевернута класна кімната», а також інноваційні підходи, зокрема «дизайн мислення». Вибравши адекватні методи навчання, можна досягти мотивації до змін і кращої компетентності щодо алергії, а отже, змін поведінки та покращення результатів (рис. 6).
Для покращення самоконтролю AД та якості життя, зменшення дистресу, тривалої рентабельності лікування потрібні добре підготовані медичні фахівці. Програма навчання пацієнтів має бути стандартизована, проте водночас гнучка для задоволення індивідуальних потреб із застосуванням усвідомленого емпатійного підходу. Щоб визначити галузі освітніх досліджень з AД, доцільно створити багатодисциплінарну групу за участю лікарів, медсестер, дієтологів, психологів і пацієнтів. Слід використовувати найуспішніші практики, визначені для інших хронічних захворювань, зокрема діабету. Адаптація різних стилів навчання й уподобань підвищить ефективність освітнього досвіду. Варто проводити масові відкриті онлайн-курси.
Цифрова медицина в алергології: використання натільних пристроїв, штучного інтелекту й моніторингу експозиції для оптимізації лікування та профілактики
Досягнення цифрової медицини надають унікальну можливість систематичних досліджень експозиції та лікування алергічних захворювань, включаючи освіту, персоналізовані нагадування й моніторинг результатів, про які повідомляють пацієнти. Технологічний прогрес може бути корисним у вдосконаленні ведення АД. Для вимірювання й інтерпретації змін у довкіллі можна використовувати методи штучного інтелекту та пристрої, які носить пацієнт. Їх можна застосовувати для індивідуальної профілактики, зокрема шляхом сповіщення в регіоні з підвищеним рівнем забруднення повітря, котре може призвести до загострення астми чи АД. Потенційна цінність моніторингу експозиції через використання застосунків для надання даних для досліджень, прогнозування розвитку хвороб, лікування, освіти та профілактики має бути збалансована з ризиком конфіденційності. Міжнародна група підкреслила важливість надійного захисту персональних даних, зважаючи на широкий потенційний спектр застосувань у галузі цифрової медицини щодо управління комплексною терапією хронічних запальних алергічних захворювань.
Майбутні напрями щодо виявлених прогалин і потреб
Епітеліальний бар’єр і чинники довкілля
Вирішальне значення для розроблення профілактичних стратегій, персоналізованої терапії та розуміння географічних варіацій захворюваності на AД має дослідження впливу чинників довкілля, генетичної схильності та змін мікробіому шкіри на ослаблення ШЕБ.
- Вплив зміни клімату: який конкретний вплив чинників, пов’язаних зі зміною клімату (підвищення температури, зміни вологості, нові алергени, зміни структури пилку), на виникнення або загострення AД?
- Генетичні чинники проти чинників довкілля: якою мірою генетична схильність спричиняє ослаблення ШЕБ порівняно з чинниками довкілля?
- Динаміка мікробіому шкіри: як зміни в мікробіомі шкіри під впливом чинників довкілля спричиняють руйнування ШЕБ при AД?
- Лонгітюдні дослідження змін довкілля: які довгострокові комбіновані наслідки змін довкілля (урбанізація, зміни способу життя та дієти) на поширеність і тяжкість AД?
- Потреба: багатовимірний аналіз експозиції та реакції в часі й просторі, включаючи лонгітюдні дослідження та реєстри на міжнародному рівні.
- Взаємодія між ШЕБ й імунною системою: як зміни ШЕБ під впливом чинників довкілля взаємодіють з імунною системою та як ця взаємодія спричиняє системне запалення й подальші супутні хвороби?
- Профілактичні стратегії: чи можуть зміни впливу довкілля (зменшення впливу забруднювальних речовин або алергенів) протидіяти погіршенню ШЕБ і запобігти або пом’якшити AД?
- Географічні варіації захворюваності на AД: чи існують географічні тенденції захворюваності на AД, які корелюють з конкретними екологічними чи кліматичними чинниками?
- Терапевтичні підходи, спрямовані на ШЕБ: які терапевтичні підходи найефективніші для зміцнення ШЕБ при AД, враховуючи впливи довкілля та мікробіому?
- Персоналізована терапія з огляду на мікробіом: як можна використати індивідуальні варіації мікробіому шкіри для розроблення персоналізованих стратегій лікування AД?
Атопічний та імунологічний марші, нейроімунологія
Важливим є всебічне розуміння чинників, що впливають на прогресування AД до інших атопічних захворювань: імунологічних, молекулярних, психоімунних та екологічних, включаючи роль дисфункції ШЕБ і взаємодії між мікробіомом й імунною системою.
- Перехід від AД до інших атопічних захворювань: які ключові імунологічні та молекулярні механізми зумовлюють перехід AД до інших атопічних захворювань, як-от астма чи алергічний риніт?
- Чинники атопічного маршу в ранньому віці: як ранні впливи та генетична схильність зумовлюють ініціацію атопічного маршу, починаючи з AД?
- Роль дисфункції ШЕБ: як дисфункція ШЕБ впливає на системну імунну відповідь і спричиняє прогресування атопічного маршу?
- Психоімунні чинники прогресування AД: яку роль відіграють психоімунні чинники в прогресуванні AД до подальших стадій атопічного маршу?
- Характеристики імуностаріння при AД: яка роль імуностаріння в дорослому та старшому віці порівняно зі здоровими людьми?
- Біомаркери прогресування атопічного маршу: чи існують ідентифіковані біомаркери на ранніх стадіях AД, здатні передбачити прогресування атопічного маршу?
- Вплив раннього втручання: як раннє втручання змінює перебіг атопічного маршу?
- Взаємодія між мікробіомом та імунною системою при атопічному марші: як взаємодія між мікробіомами шкіри, кишківника й імунною системою впливає на прогресування атопічного маршу?
- Психологічний стрес і прогресування AД: як психологічний стрес в осіб з AД призводить до імунологічних змін, пов’язаних з атопічним маршем?
- Вплив чинників довкілля на атопічний марш: як чинники довкілля (алергени, забруднювачі) впливають на перехід AД до інших атопічних хвороб?
- Профілактичні стратегії, спрямовані на атопічний марш: які стратегії можна застосувати на ранніх стадіях AД, щоб зупинити або сповільнити прогресування атопічного маршу?
- Використання знань для профілактики: як втручання (селективна заміна мікробів, дієта, фармакологічні підходи) можуть вплинути на імунологічний марш; як систематично оцінити перехід до фізіологічного розвитку імунітету?
- Розроблення ефективніших стратегій ведення AД, зокрема зменшення свербіння та стигматизації пацієнтів: розуміння складної взаємодії між нервовою системою, імунною системою та шкірою.
- Нейрональна сигналізація: як розуміння нейроімунних ланцюгів і нейронної сигналізації може сприяти оптимізації стратегій контролю таких патомеханізмів АД, як запалення, дисфункція бар’єра та свербіж?
Освіта та профілактика
Ефективне ведення AД потребує мультимодальних освітніх і адвокаційних кампаній, своєчасного втручання з урахуванням індивідуальних відмінностей і спільних зусиль ключових організацій для покращення прихильності до лікування, підвищення обізнаності про хворобу та розроблення точної терапії залежно від стадії.
- Від первинної до третинної профілактики: який вплив мала б мультимодальна освітня та просвітницька кампанія, орієнтована на пацієнтів, їхні родини, політиків, медичних фахівців, на покращення розуміння доступних варіантів лікування; як освітні програми можуть підвищити прихильність до терапії та покращити клінічні результати?
- Ефект інформаційних кампаній: як інформування пацієнтів з AД у співпраці з організаціями пацієнтів підвищить обізнаність щодо впливів свербіння, втрати сну й інших аспектів психічного здоров’я на якість життя; які стратегії були б найефективнішими для вирішення проблем?
- Втручання впродовж життя: зважаючи на докази того, що раннє втручання може запобігти алергії, як час і характер утручань (на ранніх етапах або під час вагітності порівняно з утручаннями в дорослих) впливають на ефективність профілактики або змінюють перебіг AД?
- Оптимізовані терапевтичні підходи: як оптимізувати терапевтичні підходи відповідно до стадії хвороби й імунологічного маршу; чи існує потенціал підходу точної медицини?
- Етнічні та статеві відмінності: чи існують індивідуальні відмінності, які потрібно враховувати при розробленні стратегій лікування та профілактики?
- Співпраця товариств: рекомендовано, щоб Міжнародне товариство АД, Міжнародна рада з екземи й ініціатива HOME співпрацювали в дослідженнях, освіті та захисті пацієнтів з AД.
- Впровадження освіти для пацієнтів та осіб, які за ними доглядають, адже це дуже ефективний інструмент для підвищення обізнаності й ведення АД.
Виявлені прогалини в діагностиці та терапії
Для покращення якості охорони здоров’я, забезпечення справедливого лікування пацієнтів у світі, визнання різних проявів хвороби та впливу на людей вирішальне значення мають такі дослідження.
- Виявлення варіацій: дослідити, як різні країни та культури визначають і лікують ту саму хворобу з урахуванням сенсорних і психосоціальних симптомів у цілях лікування.
- Аналіз впливу різних визначень: оцінювання впливу різних визначень і підходів до лікування на результати для розуміння впливу на ефективність терапії та задоволеність пацієнтів.
- Розроблення глобальних стандартів: робота над створенням стандартизованого, глобально прийнятого набору рекомендацій щодо визначення та лікування АД із залученням широкого діапазону поглядів і забезпечення адаптації настанов до різних культурних контекстів.
- Покращення догляду, орієнтованого на пацієнта: забезпечення достатньої гнучкості глобальних стандартів для адаптації до індивідуальних потреб пацієнтів, які можуть значно відрізнятися між окремими людьми.
- Міжкультурна співпраця й освіта: сприяння співпраці медиків для обміну знаннями та передовим досвідом з урахуванням культурних відмінностей у підходах до лікування.
Література
Traidl–Hoffmann C., Afghani J., Akdis C., et al. Navigating the evolving landscape of atopic dermatitis: challenges and future opportunities: the 4th Davos declaration. Allergy. 2024 Aug 4. doi: 10.1111/all.16247.
