Кропив’янка
Переклала й адаптувала канд. мед. наук Лариса Стрільчук
Кропив’янка являє собою поширене гетерогенне запальне захворювання шкіри, щонайменше один епізод якого протягом життя відзначають 20% населення світу [1, 2]. Хвороба виникає при активації та дегрануляції опасистих клітин шкіри з подальшим вивільненням гістаміну й інших медіаторів, що призводить до активації чутливих нервів, вазодилятації, екстравазації плазми й залучення до патологічного процесу інших клітин [3, 4]. Цей процес зумовлює ознаки та прояви, типові для кропив’янки: висип та/або ангіонабряк.
Кропив’янку поділяють на гостру (ГК, тривалістю ≤6 тижнів) і хронічну (ХК, тривалістю >6 тижнів), а також на індуковану та спонтанну [4]. При індукованій кропив’янці ознаки й симптоми провокує специфічний визначений тригер (наприклад, холод у разі холодової кропив’янки), а при спонтанній чітко визначені тригери відсутні. Спонтанна кропив’янка є поширенішою за індуковану, і в одного пацієнта можуть відзначатися обидві форми (табл. 1) [4-6].
Більшість випадків ГК минають самостійно впродовж 1 тижня, а <40% випадків хронізуються. ХК часто триває протягом кількох років до спонтанної ремісії. Причини ГК зазвичай залишаються невідомими, хоча вважається, що вагому роль відіграє вживання певних продуктів і препаратів. Прояви ХК потужно впливають на якість життя, порушуючи сон, погіршуючи фізичний та емоційний стан і перешкоджаючи навчанню й роботі [7, 8]. Поточні можливості лікування дотепер обмежені та є неефективними в третини пацієнтів із ХК, що обґрунтовує потребу в нових терапевтичних методах [9].
Природний перебіг і чинники ризику
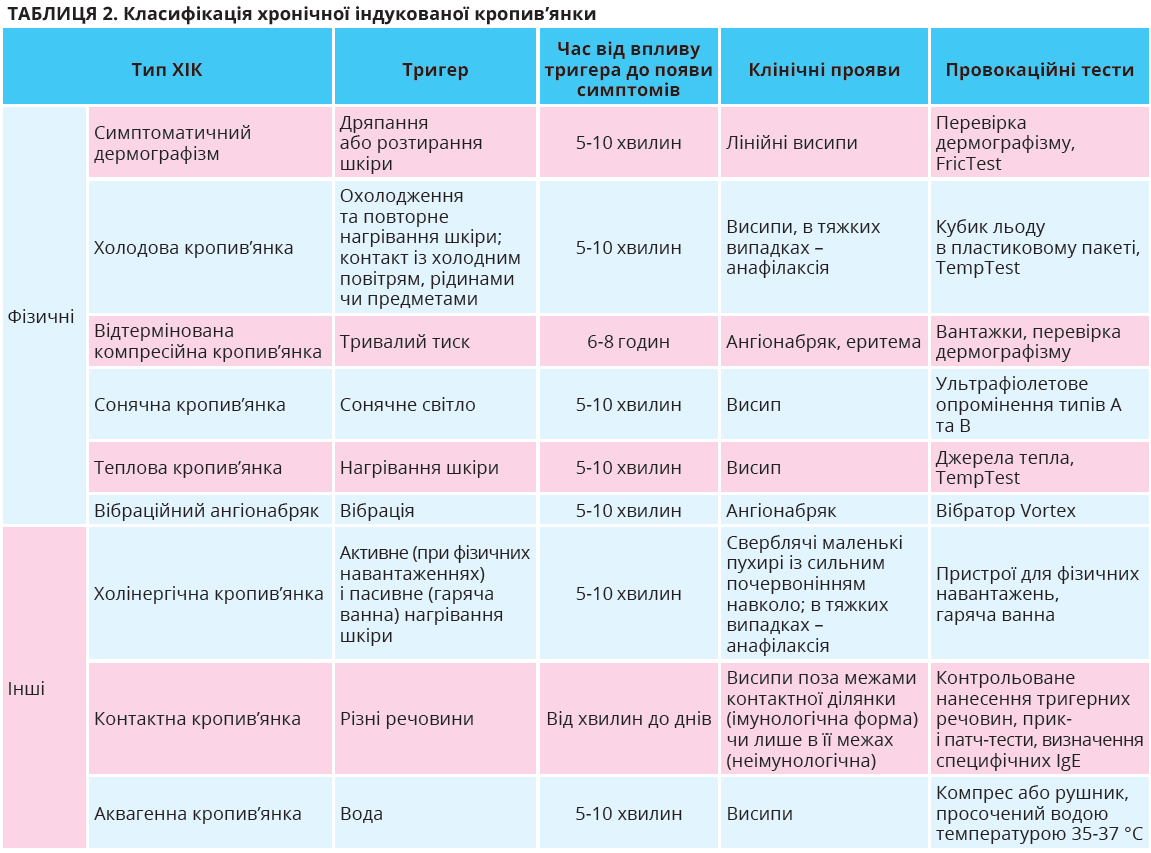
Середня тривалість епізоду ГК становить ≤1 тиждень. Частка прогресування ГК до ХК дорівнює 5-39%. ХСК зазвичай має коротшу тривалість, аніж ХІК, – у межах 1-4 років. У середньому спонтанна ремісія через 5 років спостерігається в 45% пацієнтів, а через 20 років – у 73% [10]. Рецидиви ХСК відзначають у 6-31% пацієнтів. Середня тривалість основних типів ХІК (симптоматичний дермографізм, холінергічна та холодова кропив’янка) становить 2-5, 3-8 і 2-9 років відповідно (табл. 2). Протягом 5 років ремісія ХІК відбувається лише в третини пацієнтів, найчастіше – при симптоматичному дермографізмі й рідше – при холінергічній і холодовій кропив’янці [11].
Чинниками ризику ГК є висока густина населення, а також особистий і родинний анамнези алергічних захворювань [2, 12-14]. Вища поширеність ГК може асоціюватися з низьким соціоекономічним статусом [12, 15], а ймовірність розвитку ХК – із високим [2, 18, 19], що, втім, підтвердилося не в усіх дослідженнях [20, 21]. Дослідження близнюків свідчать, що схильність до кропив’янки частково зумовлена генетично [13].
Діагностика
Клінічні прояви кропив’янки в різних вікових, етнічних і статевих групах є однаковими. Основними першими кроками в діагностиці є ретельний збір анамнезу та фізикальне обстеження. Оскільки типовий висип і ангіонабряк є минущими й на момент огляду можуть бути відсутніми, лікарям потрібно також переглядати фотографії пацієнтів, зроблені в найгострішому періоді хвороби [4].
ГК, за визначенням, є самообмежувальним захворюванням і не потребує діагностичних тестів, окрім деяких випадків, коли діагностична програма зумовлена специфічним анамнезом [4]. Наприклад, у пацієнтів з анамнезом харчової алергії 1 типу чи гіперчутливості до препаратів симптоми кропив’янки можуть виникати одразу після контакту з відповідними алергенами, тому тести на виявлення алергії можуть допомогти уникнути контакту з причинними факторами.
Що стосується ХСК, то в більшості пацієнтів (≈57%) спостерігається лише висип, приблизно в третини (≈37%) – висип і ангіонабряк, а в 6% – лише ангіонабряк. Ознаки та симптоми ХСК можуть виникати в будь-який час доби, але типовою є поява їх увечері та вночі [21]. Висипи можуть виникати на будь-якій ділянці тіла, але найчастіше виникають на руках і ногах [21], а ангіонабряк – на обличчі (губи, повіки), долонях і стопах [1].
Поточні міжнародні рекомендації з ведення пацієнтів із кропив’янкою пропонують застосовувати в ході діагностики ХСК концепцію 7C, яка передбачає такі пункти: confirm (підтвердження) – виключення інших потенційних причин симптоматики; cause (причина) – виявлення маркерів автоімунної кропив’янки; cofactors (кофактори) – пошук потенційних тригерів; consequences (наслідки) – виявлення автоімунних процесів, психічних розладів, порушень сну, статевого життя та соціальних функцій; components (складники) – оцінку потенційних біомаркерів і предикторів відповіді на лікування; course (перебіг) – моніторинг і контроль активності ХСК [4].
Основні діагностичні тести при кропив’янці включають розгорнутий клінічний аналіз крові, визначення рівня С-реактивного білка в усіх пацієнтів із ХСК, антитіл до тиреопероксидази класу IgG і загального сироваткового вмісту IgE на третинному рівні лікування. Останні два обстеження здатні допомогти у виявленні автоімунної ХСК й автоімунного тиреоїдиту [22-24]. Інші обстеження проводяться лише за показаннями та рідко потрібні [4].
У пацієнтів із ХІК тривалість висипів зазвичай є меншою (≤1 година), ніж у осіб із ХСК (до 24 годин) [4, 25]. Хоча висипання переважно обмежені ділянкою шкіри, яка контактувала з тригерним чинником,
у разі ХІК можуть виникнути системні реакції, включаючи анафілаксію, тому пацієнтам високого ризику потрібно призначати автоінжектори адреналіну [26]. Під час вагітності близько половини жінок відзначають покращення стану, натомість у третини процес, навпаки, загострюється [27]. Діагноз ХІК ґрунтується на ретельному анамнезі та результатах провокаційного тестування, цілями якого є визначення відповідних тригерів і оцінка порогів їхнього впливу, що дає змогу встановити активність хвороби й відстежувати реакцію на лікування.
Для скринінгу кропив’янки в загальній популяції методів не існує. Пацієнтам з автоімунними хворобами, зокрема автоімунним тиреоїдитом, варто ставити запитання щодо ознак і симптомів ХСК [23, 28, 29], і навпаки: в осіб із ХСК потрібно регулярно перевіряти стан щитоподібної залози за допомогою пальпації та визначення вмісту тиреоїдних гормонів, антитіл до тиреопероксидази й тиреоглобуліну [4, 23, 29].
Профілактика
Первинна профілактика існує лише для алергічної кропив’янки, за якої можна застосовувати загальні профілактичні методи для всіх алергічних захворювань. Популяційне крос-секційне дослідження показало, що грудне вигодовування протягом >6 місяців може зменшувати ризик розвитку кропив’янки [14]. Заходи вторинної профілактики передбачають уникнення відповідних тригерів, як-от носіння тісного одягу в пацієнтів із відтермінованою компресійною кропив’янкою чи вживання певних продуктів/ліків пацієнтами з алергічною кропив’янкою [4]. Третинна профілактика можлива завдяки симптоматичному лікуванню рекомендованими засобами, наприклад антигістамінними препаратами й омалізумабом [4], і при індукції тривалої ремісії за допомогою хворобомодифікувального лікування, наприклад алергеноспецифічної імунотерапії в пацієнтів з алергічною кропив’янкою [30], циклоспорину – у хворих з автоімунною ХСК [31, 32] тощо.
Лікування
Терапія кропив’янки суттєво прогресувала останні дві декади, і тепер контроль хвороби можливий щонайменше для 2/3 пацієнтів [33-35]. Загалом метою лікування є безпечне й ефективне досягнення повного контролю над хворобою на тлі задовільної якості життя. Поточний консенсусний алгоритм лікування кропив’янки представлено на рисунку [4].
Елімінація причинних факторів та уникнення тригерів
ГК або рецидивна ХСК із визначеним екзогенним тригером, як-от нестероїдний протизапальний препарат, ефективно лікується за допомогою уникнення тригера та молекул із перехресною реактивністю [4, 26]. Оскільки індукована кропив’янка, за визначенням, має провокувальний чинник, їх уникнення є основним засобом лікування, проте воно може бути складним або несприятливо впливати на якість життя [4]. Успішним методом лікування автоімунної ХСК є усунення антитіл за допомогою плазмаферезу, котрий, на жаль, є дороговартісним методом [37, 38]. Усунення причинних або асоційованих із хворобою факторів не завжди здатне покращити перебіг ХК. Наприклад, суперечливими є дані щодо ерадикації Helicobacter pylori [39] та лікування тиреоїдиту Хашімото чи хвороби Грейвса [29, 40].
Н1-антигістамінні засоби другого покоління
Стандартним першим кроком у лікуванні кропив’янки є застосування Н1-АГП2 [41, 42]. Більшість рекомендацій не радять використовувати антигістамінні препарати першого покоління у зв’язку з їхніми седативними й антихолінергічними ефектами та міжлікарськими взаємодіями [4, 43]. Показано, що більшість Н1-АГП2 у стандартних дозах є ефективними при кропив’янці [4]. Дослідження також підтвердили безпечність та ефективність використання Н1-АГП2 поза показаннями (off-label) у високих дозах (до вчетверо більше за середню денну дозу); серед цих препаратів – біластин, цетиризин, дезлоратадин, ебастин, фексофенадин, левоцетиризин і рупатадин [34, 44-48]. Однак застосування Н1-АГП2 у підвищеному дозуванні асоціюється з вищим ризиком сонливості, ніж у разі застосування стандартних доз (відносний ризик 3,28; 95% довірчий інтервал 1,55-6,95; p=0,002) [49]. Слід зауважити, що британська настанова з лікування кропив’янки (2021) радить не перевищувати рекомендовану дозу мізоластину [50]. Н1-АГП2 у високих дозах вважаються наступним етапом у лікуванні кропив’янки, якщо стандартної дози недостатньо для контролю симптомів [4]. Ураховуючи тривалість напіврозпаду антигістамінних засобів, двотижневого періоду зазвичай достатньо для отримання ефекту при ХК [51]. Оптимальна тривалість і підходи до скасування антигістамінної терапії дотепер залишаються дискутабельними питаннями. Пацієнтам, які не відповідають на підвищені дози Н1-АГП2, рекомендоване додавання до терапії омалізумабу [4].
Омалізумаб
Омалізумаб являє собою моноклональне анти-IgE антитіло [52-55]. Застосування омалізумабу як додатка до антигістамінної терапії має найпотужнішу доказову базу з усіх методів лікування ХСК у пацієнтів віком ≥12 років [35]. Метааналіз 67 досліджень ХСК із реальної клінічної практики виявив повну та часткову відповідь на омалізумаб у 72 і 18% учасників відповідно, причому середня частота побічних ефектів становила 4% [56]. Продемонстровано також ефективність омалізумабу в лікуванні ХІК, зокрема симптоматичного дермографізму, холодової, холінергічної та сонячної кропив’янки [54, 57-60]. Альтернативними омалізумабу підходами є комбінація Н1-АГП2 з іншими системними імуносупресантами (циклоспорином, дапсоном і колхіном) чи перехід на третю лінію терапії – циклоспорин [4, 52, 61, 62].
Циклоспорин
Циклоспорин – це імуносупресор Т-клітин, який водночас пригнічує вивільнення медіаторів із базофілів та опасистих клітин [63]. Наявні рекомендації
радять використовувати циклоспорин off-label як додаток до Н1-АГП2 у пацієнтів із тяжкою ХСК, рефрактерною до комбінації високих доз Н1-АГП2 й омалізумабу [4]. За даними метааналізів, частка відповіді на таке лікування становить близько 73% [64]. Побічні ефекти можуть бути тяжкими (наприклад, ураження нирок) і виникають у ≈50% пацієнтів, тому більшість рекомендацій не радять застосовувати циклоспорин як стандартне лікування [4]. Утім, за відсутності доступу до омалізумабу циклоспорин застосовується як додаток до Н1-АГП2 за неефективності останніх, оскільки забезпечує сприятливіший профіль співвідношення користь/ризик порівняно з довготривалим застосуванням кортикостероїдів (КС) [4].
Альтернативні та специфічні види лікування
Внутрішньовенні чи пероральні системні КС є ефективними при ГК та тяжких спалахах ХСК [4]. Рекомендації радять обмежити тривалість перорального застосування стероїдів до 10 днів і використовувати найменшу ефективну дозу [4]. Інші препарати, які з різним успіхом застосовувалися при ХСК, включають дапсон, колхіцин, сульфасалазин, метотрексат, інтерферон, внутрішньовенний імуноглобулін, а процедури – фототерапію та плазмаферез [4, 65].
Деякі підгрупи пацієнтів із ХСК можуть отримати сприятливий результат від специфічних підходів, наприклад особи, які не переносять аспірин, – від застосування антагоністів лейкотрієнових рецепторів [4, 66]. Для певних пацієнтів із холінергічною, холодовою чи сонячною кропив’янкою може бути корисною індукція толерантності [67].
Лікування особливих популяцій пацієнтів
Безрецептурний продаж антигістамінних препаратів призводить до того, що їх уживання на ранніх етапах вагітності є поширеним явищем [4], хоча безпеку для вагітних продемонстровано лише для цетиризину та лоратадину [68, 69]. Ці препарати також рекомендуються для жінок, які годують груддю [4], оскільки антигістамінні засоби першого покоління потрапляють у грудне молоко й можуть зумовлювати в немовлят седацію [70]. Повідомлялося, що омалізумаб є безпечним під час вагітності [27, 71-74] й у малих дітей, хоча поточне ліцензування допускає його використання лише для осіб віком ≥12 років [35].
У дітей доведену ефективність і безпечність мають такі Н1-АГП2, як біластин, цетиризин, дезлоратадин, фексофенадин, левоцетиризин, лоратадин і рупатадин [4].
Популяція осіб похилого віку є особливо чутливою до побічних ефектів антигістамінних засобів першого покоління, тому останніх слід уникати [75]. Наявні дані свідчать про ефективність і безпечність стандартних доз Н1-АГП2 й омалізумабу в осіб віком ≥65 років [75, 76], але при перевищенні рекомендованих доз цетиризину та лоратадину вказана популяція може бути чутливою до седативного впливу цих препаратів [75]. Окрім того, підвищення доз Н1-АГП2 супроводжується збільшенням ризику розвитку побічних ефектів у пацієнтів похилого віку з нирковими, печінковими та/або серцевими захворюваннями.
Література
- Zuberbier T., Balke M., Worm M., Edenharter G., Maurer M. Epidemiology of urticaria: a representative cross-sectional population survey. Clin. Exp. Dermatol. 2010; 35: 869-873.
- Lee S.J., et al. Prevalence and risk factors of urticaria with a focus on chronic urticaria in children. Allergy Asthma Immunol. Res. 2017; 9: 212-219.
- Church M.K., Kolkhir P., Metz M., Maurer M. The role and relevance of mast cells in urticaria. Immunol. Rev. 2018; 282: 232-247.
- Zuberbier T., et al. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022; 77: 734-766.
- Kolkhir P., Maurer M. in Urticaria and Angioedema (eds. Zuberbier T., Grattan C., Maurer M.) 77-107 (Springer International, 2021).
- Weller K., et al. Epidemiology, comorbidities, and healthcare utilization of patients with chronic urticaria in Germany. J. Eur. Acad. Dermatol. Venereol. 2022; 36: 91-99.
- Goncalo M., et al. The global burden of chronic urticaria for the patient and society. Br. J. Dermatol. 2021; 184: 226-236.
- Maurer M., et al. The burden of chronic spontaneous urticaria is substantial: real-world evidence from ASSURE-CSU. Allergy. 2017; 72: 2005-2016.
- Kolkhir P., Elieh-Ali-Komi D., Metz M., Siebenhaar F., Maurer M. Understanding human mast cells: lesson from therapies for allergic and non-allergic diseases. Nat. Rev. Immunol. 2022; 22: 294-308.
- Balp M.-M., et al. Clinical remission of chronic spontaneous urticaria (CSU): a targeted literature review. Derm. Ther. 2022; 12: 15-27.
- Bal F., Kahveci M., Soyer O., Sekerel B.E., Sahiner U.M. Chronic inducible urticaria subtypes in children: clinical features and prognosis. Pediatr. Allergy Immunol. 2021; 32: 146-152.
- Jadhav R., Alcala E., Sirota S., Capitman J. Risk factors for acute urticaria in central California. Int. J. Environ. Res. Public Health. 2021; 18: 3728.
- Thomsen S.F., van der Sluis S., Kyvik K.O., Backer V. Urticaria in monozygotic and dizygotic twins. J. Allergy. 2012; 2012: 125367.
- Yabin H., et al. Breastfeeding duration modified the effects of neonatal and familial risk factors on childhood asthma and allergy: a population-based study. Respir. Res. 2021; 22: 41.
- Peck G., et al. Global epidemiology of urticaria: increasing burden among children, females and low-income regions. Acta Derm. Venereol. 2021; 101: adv00433.
- Xiao Y., et al. The prevalence of atopic dermatitis and chronic spontaneous urticaria are associated with parental socioeconomic status in adolescents in China. Acta Derm. Venereol. 2019; 99:
321-326. - Rosman Y., et al. Characterization of chronic urticaria and associated conditions in a large population of adolescents. J. Am. Acad. Dermatol. 2019; 81: 129-135.
- Gaig P., et al. Epidemiology of urticaria in Spain. J. Investig. Allergol. Clin. Immunol. 2004; 14: 214-220.
- Ferrer M. Epidemiology, healthcare, resources, use and clinical features of different types of urticaria. Alergológica 2005. J. Investig. Allergol. Clin. Immunol. 2009; 19: 21-26.
- Maurer M., Ortonne J.P., Zuberbier T. Chronic urticaria: an internet survey of health behaviours, symptom patterns and treatment needs in European adult patients. Br. J. Dermatol. 2009; 160:
633-641. - Schoepke N., et al. Biomarkers and clinical characteristics of autoimmune chronic spontaneous urticaria: results of the PURIST study. Allergy. 2019; 74: 2427-2436.
- Kolkhir P., et al. Autoimmune diseases are linked to type IIb autoimmune chronic spontaneous urticaria. Allergy Asthma Immunol. Res. 2021; 13: 545-559.
- Kolkhir P., et al. Autoimmune chronic spontaneous urticaria detection with IgG anti-TPO and total IgE. J. Allergy Clin. Immunol. Pract. 2021; 9: 4138-41468.
- Magerl M., et al. The definition, diagnostic testing, and management of chronic inducible urticarias – the EAACI/GA(2)LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016; 71: 780-802.
- Bizjak M., et al. Risk factors for systemic reactions in typical cold urticaria: results from the COLD-CE study. Allergy. 2022; 77: 2185-2219.
- Kocatürk E., et al. Effects of pregnancy on chronic urticaria: results of the PREG-CU UCARE study. Allergy. 2021; 76: 3133-3144.
- Kim Y.S., et al. Increased risk of chronic spontaneous urticaria in patients with autoimmune thyroid diseases: a nationwide, population-based study. Allergy Asthma Immunol. Res. 2017; 9: 373-377.
- Kolkhir P., Metz M., Altrichter S., Maurer M. Comorbidity of chronic spontaneous urticaria and autoimmune thyroid diseases: a systematic review. Allergy. 2017; 72: 1440-1460.
- Shi C.-R., et al. IgE-mediated allergy: a rare cause of chronic spontaneous urticarial with allergen-specific immunotherapy as treatment option – a systematic review with meta-analysis from China. J. Eur. Acad. Dermatol. Venereol. 2012; 26: 533-544.
- Alves F., Calado R., Relvas M., Gomes T., Gonçalo M. Short courses of ciclosporin can induce long remissions in chronic spontaneous urticaria. J. Eur. Acad. Dermatol. Venereol. 2022; 36: 645-646.
- Kolkhir P., Pogorelov D., Kochergin N. Chronic spontaneous urticaria associated with vitiligo and thyroiditis (autoimmune polyglandular syndrome IIIC): case series. Int. J. Dermatol. 2017; 56: 89-90.
- Maurer M., et al. Unmet clinical needs in chronic spontaneous urticaria. A GA²LEN task force report. Allergy. 2011; 66: 317-330.
- Guillen-Aguinaga S., Jauregui Presa I., Aguinaga-Ontoso E., Guillen-Grima F., Ferrer M. Updosing nonsedating antihistamines in patients with chronic spontaneous urticaria: a systematic review
and meta-analysis. Br. J. Dermatol. 2016; 175: 1153-1165. - Agache I., et al. EAACI biologicals guidelines – omalizumab for the treatment of chronic spontaneous urticaria in adults and in the paediatric population 12-17 years old. Allergy. 2022; 77: 17-38.
- Doña I., et al. NSAID-induced urticaria/angioedema does not evolve into chronic urticaria: a 12-year follow-up study. Allergy. 2014; 69: 438-444.
- Grattan C.E., Francis D.M., Slater N.G., Barlow R.J., Greaves M.W. Plasmapheresis for severe, unremitting, chronic urticaria. Lancet. 1992; 339: 1078-1080.
- Aleksandraviciute L., Malinauskiene L., Cerniauskas K., Chomiciene A. Plasmapheresis: is it a potential alternative treatment for chronic urticaria? Open Med. (Wars.). 2022; 17: 113-118.
- Shakouri A., Compalati E., Lang D.M., Khan D.A. Effectiveness of Helicobacter pylori eradication in chronic urticaria: evidence-based analysis using the grading of recommendations assessment, development,
and evaluation system. Curr. Opin. Allergy Clin. Immunol. 2010; 10: 362-369. - Gonzalez-Diaz S.N., et al. Chronic urticaria and thyroid pathology. World Allergy Organ. J. 2020; 13: 100101.
- Sharma M., Bennett C., Cohen S.N., Carter B. H1-antihistamines for chronic spontaneous urticaria. Cochrane Database Syst. Rev. 2014; 11: Cd006137.
- Zuberbier T., Maurer M. Antihistamines in the treatment of urticaria. Adv. Exp. Med. Biol. 2010; 709: 67-72.
- Church M.K., et al. Risk of first-generation H1-antihistamines: a GA(2)LEN position paper. Allergy. 2010; 65: 459-466.
- Zuberbier T., et al. Double-blind crossover study of high-dose cetirizine in cholinergic urticaria. Dermatology. 1996; 193: 324-327.
- Staevska M., et al. The effectiveness of levocetirizine and desloratadine in up to 4 times conventional doses in difficult-to-treat urticaria. J. Allergy Clin. Immunol. 2010; 125: 676-682.
- Siebenhaar F., Degener F., Zuberbier T., Martus P., Maurer M. High-dose desloratadine decreases wheal volume and improves cold provocation thresholds compared with standard-dose treatment in patients with acquired cold urticaria: a randomized, placebo-controlled, crossover study. J. Allergy Clin. Immunol. 2009; 123: 672-679.
- Gimenez-Arnau A., Izquierdo I., Maurer M. The use of a responder analysis to identify clinically meaningful differences in chronic urticaria patients following placebo-controlled treatment with
rupatadine 10 and 20 mg. J. Eur. Acad. Dermatol. Venereol. 2009; 23: 1088-1091. - Cataldi M., Maurer M., Taglialatela M., Church M.K. Cardiac safety of second-generation H1-antihistamines when updosed in chronic spontaneous urticaria. Clin. Exp. Allergy. 2019; 49: 1615-1623.
- Zhou P., Zeng S., Fu L., Chen H., Li L. Efficacy and safety of intensive nonsedating antihistamines for chronic spontaneous urticaria: a meta-analysis of randomized controlled trials. Int. Arch. Allergy Immunol. 2022; 183: 796-803.
- Sabroe R.A., et al. British Association of Dermatologists guidelines for the management of people with chronic urticaria 2021. Br. J. Dermatol. 2022; 186: 398-413.
- Türk M., et al. Experience-based advice on stepping up and stepping down the therapeutic management of chronic spontaneous urticaria: where is the guidance? Allergy. 2022; 77: 1626-1630.
- Gimenez-Arnau A.M., Salman A. Targeted therapy for chronic spontaneous urticaria: rationale and recent progress. Drugs. 2020; 80: 1617-1634.
- Maurer M., et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N. Engl. J. Med. 2013; 368: 924-935.
- Maurer M., et al. Omalizumab treatment in patients with chronic inducible urticaria: a systematic review of published evidence. J. Allergy Clin. Immunol. 2018; 141: 638-649.
- Kaplan A.P., Giménez-Arnau A.M., Saini S.S. Mechanisms of action that contribute to efficacy of omalizumab in chronic spontaneous urticaria. Allergy. 2017; 72: 519-533.
- Tharp M.D., et al. Benefits and harms of omalizumab treatment in adolescent and adult patients with chronic idiopathic (spontaneous) urticaria: a meta-analysis of “real-world” evidence. JAMA Dermatol. 2019; 155: 29-38.
- Gastaminza G., et al. Efficacy and safety of omalizumab (Xolair) for cholinergic urticaria in patients unresponsive to a double dose of antihistamines: a randomized mixed double-blind and open-label placebo-controlled clinical trial. J. Allergy Clin. Immunol. 2019; Pract. 7: 1599-1609.e1.
- Dressler C., et al. Chronic inducible urticaria: a systematic review of treatment options. J. Allergy Clin. Immunol. 2018; 141: 1726-1734.
- Maurer M., et al. Omalizumab is effective in symptomatic dermographism – results of a randomized placebo-controlled trial. J. Allergy Clin. Immunol. 2017; 140: 870-873.
- Metz M., et al. Omalizumab is effective in cold urticaria – results of a randomized placebo-controlled trial. J. Allergy Clin. Immunol. 2017; 140: 864-867.
- Salman A., Ergun T., Gimenez-Arnau A.M. Real-life data on the effectiveness and safety of omalizumab in monotherapy or combined for chronic spontaneous urticaria: a retrospective cohort study. J. Dermatol. Treat. 2020; 31: 204-209.
- Rosenblum J.D., Nassau S., Fonacier L., Mawhirt S.L. Concomitant treatment with omalizumab and cyclosporine for chronic spontaneous urticaria. Ann. Allergy Asthma Immunol. 2020; 125: 111-112.
- Harrison C.A., Bastan R., Peirce M.J., Munday M.R., Peachell P.T. Role of calcineurin in the regulation of human lung mast cell and basophil function by cyclosporine and FK506. Br. J. Pharmacol. 2007; 150: 509-518.
- Kulthanan K., et al. Cyclosporine for chronic spontaneous urticaria: a meta-analysis and systematic review. J. Allergy Clin. Immunol. 2018; Pract. 6: 586-599.
- Rutkowski K., Grattan C.E.H. How to manage chronic urticaria ‘beyond’ guidelines: a practical algorithm. Clin. Exp. Allergy. 2017; 47: 710-718.
- Pacor M.L., Di Lorenzo G., Corrocher R. Efficacy of leukotriene receptor antagonist in chronic urticaria. A double-blind, placebo-controlled comparison of treatment with montelukast and cetirizine in patients with chronic urticaria with intolerance to food additive and/or acetylsalicylic acid. Clin. Exp. Allergy. 2001; 31: 1607-1614.
- Beissert S., Stander H., Schwarz T. UVA rush hardening for the treatment of solar urticaria. J. Am. Acad. Dermatol. 2000; 42: 1030-1032.
- Weber-Schoendorfer C., Schaefer C. The safety of cetirizine during pregnancy. A prospective observational cohort study. Reprod. Toxicol. 2008; 26: 19-23.
- Schwarz E.B., Moretti M.E., Nayak S., Koren G. Risk of hypospadias in offspring of women using loratadine during pregnancy: a systematic review and meta-analysis. Drug Saf. 2008; 31: 775-788.
- Ngo E., et al. Antihistamine use during breastfeeding with focus on breast milk transfer and safety in humans: a systematic literature review. Basic Clin. Pharmacol. Toxicol. 2022; 130: 171-181.
- Namazy J., et al. The Xolair pregnancy registry (EXPECT): the safety of omalizumab use during pregnancy. J. Allergy Clin. Immunol. 2015; 135: 407-412.
- Gonzalez-Medina M., Curto-Barredo L., Labrador-Horrillo M., Gimenez-Arnau A. Omalizumab use during pregnancy for chronic spontaneous urticaria (CSU): report of two cases. J. Eur. Acad. Dermatol. Venereol. 2017; 31: e245-e246.
- Ghazanfar M.N., Thomsen S.F. Successful and safe treatment of chronic spontaneous urticaria with omalizumab in a woman during two consecutive pregnancies. Case Rep. Med. 2015; 2015: 368053.
- Ensina L.F., Cusato-Ensina A.P., Camelo-Nunes I.C., Sole D. Omalizumab as third-line therapy for urticaria during pregnancy. J. Investig. Allergol. Clin. Immunol. 2017; 27: 326-327.
- Ventura M.T., et al. Management of chronic spontaneous urticaria in the elderly. Drugs Aging. 2015; 32: 271-282.
- Nettis E., et al. Omalizumab in elderly patients with chronic spontaneous urticaria: an Italian real-life experience. Ann. Allergy Asthma Immunol. 2018; 120: 318-323.
Освітньо-практичний журнал Allergy Practice №1 2023р.