Клінічна ефективність застосування антилейкотрієнових препаратів за хронічного риносинуситу з назальним поліпозом і алергічним ринітом
Автор: Юлія Валеріївна ДЄЄВА, докторка медичних наук, професорка, завідувачка кафедри оториноларингології Національного медичного університету ім. О.О. Богомольця (м. Київ)
 Хронічний риносинусит (ХРС) уражає приблизно 5-15% загальної популяції як у Європі, так і в Сполучених Штатах, при цьому поширеність діагностованого лікарем ХРС становить приблизно 2-4% [1, 2]. Зазвичай пацієнти з ХРС із носовими поліпами (ХРСізНП), на частку якого припадає 20% усіх пацієнтів із ХРС, щонайменше 12 тижнів страждають принаймні від двох із чотирьох основних симптомів, одним з яких є закладеність носа та/або виділення з носа, а також зменшення/втрата нюху та/або тиск чи біль у проєкції приносових пазух (ПНП). Окрім синоназальних симптомів, для підтвердження діагнозу, відповідно до рекомендацій EPOS (European Position Paper on Rhinosinusitis and Nasal Polyps) 2020 [3], потрібні дані назальної ендоскопії та/або комп’ютерної томографії (КТ), які підтверджують наявність поліпів.
Хронічний риносинусит (ХРС) уражає приблизно 5-15% загальної популяції як у Європі, так і в Сполучених Штатах, при цьому поширеність діагностованого лікарем ХРС становить приблизно 2-4% [1, 2]. Зазвичай пацієнти з ХРС із носовими поліпами (ХРСізНП), на частку якого припадає 20% усіх пацієнтів із ХРС, щонайменше 12 тижнів страждають принаймні від двох із чотирьох основних симптомів, одним з яких є закладеність носа та/або виділення з носа, а також зменшення/втрата нюху та/або тиск чи біль у проєкції приносових пазух (ПНП). Окрім синоназальних симптомів, для підтвердження діагнозу, відповідно до рекомендацій EPOS (European Position Paper on Rhinosinusitis and Nasal Polyps) 2020 [3], потрібні дані назальної ендоскопії та/або комп’ютерної томографії (КТ), які підтверджують наявність поліпів.
Сьогодні пацієнтів із ХРСізНП із відповідними симптомами, незважаючи на максимально можливу медикаментозну терапію, лікують за допомогою ендоскопічної синусової хірургії (FESS) [3]. FESS має на меті не тільки покращити вентиляцію пазух, мукоциліарний кліренс та інтраназальне розпилення кортикостероїдів, але й зменшити навантаження антигенів, що спричиняють запалення, шляхом видалення запальної тканини. Наскільки FESS оптимізує результати лікування, остаточно не встановлено [4], хоча деякі дослідження свідчать, що більше хірургічне втручання покращує стан хворого та зменшує ризик ревізійного втручання [5].
Однак частота рецидивів після FESS у пацієнтів із ХРСізНП усе ще висока [5]. Довгострокова ефективність хірургічного втручання залежить від післяопераційного лікування та подальшого дотримання режиму терапії. Відомо, що інтраназальні й пероральні кортикостероїди ефективні для зниження частоти рецидивів після хірургічного втручання та рекомендовані як європейськими, так і американськими настановами, проте навіть із ними пацієнти часто страждають на рецидиви основного захворювання [6, 7].
Важливим елементом негативного прогнозу ХРСізНП є супутній алергічний риніт (АР), що визначено як ендотип захворювання [3]. Крім АР, значний внесок у ранні рецидиви може робити супутня бронхіальна астма (БА) [3]. Тому комплексне індивідуалізоване лікування пацієнтів з огляду на їхні супутні захворювання та коморбідні стани наразі є вкрай важливим.
Монтелукаст є антагоністом лейкотрієнових рецепторів. Його дія спрямована на зв’язування з цистеїніллейкотрієновими рецепторами, внаслідок чого білки (цистеїніллейкотрієни), які виділяються прозапальними клітинами, конкурентно витісняються монтелукастом, що проявляється в пригніченні запальної та/або алергічної реакції [8]. Переважно ці білки локалізуються на слизових оболонках дихальних шляхів, тому зазвичай монтелукаст використовують у разі БА й АР. Проте, зважаючи на спільний патогенез цих захворювань із ХРСізНП, застосування антилейкотрієнових препаратів може бути корисним і в контролі ХРСізНП й АР.
Мета
Оцінити ефективність оригінального монтелукасту (Сингуляр) у контролі вираженості захворювання у хворих, які перенесли оперативне втручання в порожнині носа.
Матеріали та методи
Дизайн цього проспективного контрольованого дослідження відповідає рівню доказовості 3b (випадок – контроль) згідно з модифікованою Оксфордською класифікацією CEBM (Centre for Evidence-Based Medicine). Об’єктом дослідження є ХРСізНП й АР.
Критеріями включення хворих були:
- вік 18-60 років;
- показання до оперативного втручання в порожнині носа з хронічним поліпозним риносинуситом з АР (як ендотипом захворювання);
- письмова інформована згода.
Критерії виключення:
- медикаментозний вазомоторний риніт (прийом топічних деконгестантів);
- наявність системних захворювань крові;
- вагітність;
- прийом системних кортикостероїдів та/або антибактеріальних засобів за останні 4 тижні до першого візиту;
- тяжкі соматичні чи психічні (в тому числі алкоголізм і наркоманія) захворювання;
- нездатність дотримуватися рекомендацій лікаря.
Протокол лікування
Усі без винятку пацієнти, які були включені в дослідження, проходили передопераційну підготовку, що передбачала проведення ендоскопії носової порожнини з підрахунком загального бала за Ланд – Кеннеді [9], КТ ПНП із розрахунком загального бала за Ланд – Маккей [10], проходження опитування згідно з ADSS (Adelaide Disease Severity Score) [11], передопераційний пакет аналізів (загальний аналіз крові розгорнутий, загальний аналіз сечі, біохімічний аналіз крові, серологічні дослідження на інфекції (ВІЛ, гепатит С та В, сифіліс), коагулограму, електрокардіографію, рентгенографію легень (або флюорографію) та додатково визначення еозинофільного катіонного білка (ЕКБ) і загального IgE для встановлення ендотипу захворювання.
За відсутності протипоказань до хірургічного втручання всім пацієнтам проводилася FESS (функціональна ендоскопічна синус-хірургія), що полягала у видаленні поліпозних тканин за допомогою ендоскопа й додаткових інструментів (у тому числі мікродебридера) в порожнині носа та приносових пазухах. Видалені матеріали обов’язково направлялися на патогістологічне дослідження. Після хірургії хворі перебували у відділенні 1 день під наглядом. Як післяопераційне лікування хворим обох груп призначали таке: промивання носової порожнини сольовими розчинами, після чого пацієнти мали застосовувати назальний спрей з активною речовиною мометазону фуроатом по 2 дози в кожну ніздрю 2 рази на добу впродовж 3 місяців. Також пацієнтам основної групи додатково призначався оригінальний монтелукаст (Сингуляр) 10 мг 1 раз на добу протягом 3 місяців.
Повторне проведення назальної ендоскопії й анкетування було регламентоване на 2-й тиждень, через 1 і 3 місяці після операції. Повторна КТ ПНП виконувалася через 3 місяці. Усі пацієнти надали інформовану згоду на участь у дослідженні.
Методи збору даних
Відповідно до дизайну дослідження об’єктивна характеристика стану хворих полягала у визначенні стандартизованої бальної оцінки за допомогою ендоскопічних і променевих (КТ ПНП) шкал за Ланд – Кеннеді та Ланд – Маккей відповідно. Також для об’єктивізації суб’єктивних скарг пацієнтів було використано анкету-опитувальник ADSS, під час заповнення котрої пацієнти давали відповідь на певні запитання в балах від 1 до 5 (таких запитань було 5: закладеність носа, виділення з носа, постназальне затікання, біль у проєкції навколоносових пазух, відчуття запахів) і від 0 до 7 (1 запитання щодо якості життя). Нижчий бал указував на меншу вираженість кожного із симптомів.
Аналіз даних
Для базового статистичного аналізу (середні значення, медіани, стандартні відхилення тощо) необроблених даних і формування бази даних використовувалося програмне забезпечення Microsoft Office 365 Excel. Отримані оброблені результати було оцінено, категоріальні змінні представлено з використанням частоти та відсотків. Зв’язок між категоріальними змінними оцінювали за допомогою критеріїв χ2 і Фішера, а динамічні показники оцінено за парним тестом Вілкоксона в програмному забезпеченні IBM SPSS Statistics Version 22. Значення p<0,05 вважалося статистично значущим.
Етичні аспекти
Роботу було виконано відповідно до етичного кодексу Всесвітньої медичної асоціації (Гельсінкська декларація), стандартів GCP у межах НДР «Інноваційні підходи до діагностики й лікування гострої та хронічної патології вуха, верхніх дихальних шляхів і суміжних ділянок», № держреєстрації: 0123U1000921.
Організаційні аспекти
Дослідження проведено на клінічних базах кафедри оториноларингології Національного медичного університету ім. О.О. Богомольця (відділення отоларингології для дорослих і дітей КНП «Олександрівська клінічна лікарня м. Києва») в період із жовтня 2023 року по лютий 2024 року. Кожний включений у дослідження хворий перебував під спостереженням 3 місяці після проведення хірургічного втручання.
Досліджуваний препарат
Оригінальний монтелукаст (Сингуляр) 10 мг у таблетках.
Результати
За період дослідження було обстежено та прооперовано з приводу ХРСізНП 74 пацієнтів. Із них 47 мали супутній АР, визначений за клінічними та лабораторними даними. Тому 27 осіб без АР були виключені у зв’язку з невідповідністю до дизайну дослідження.
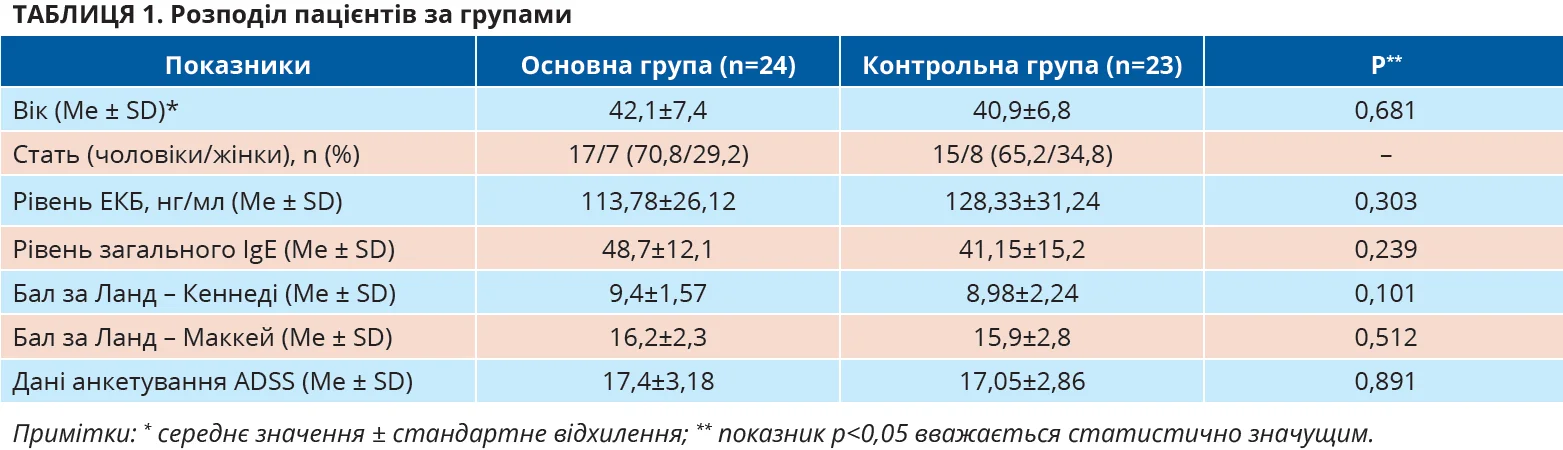
Враховуючи лабораторні показники (ЕКБ, загальний IgE), дані ендоскопії, КТ ПНП, анкетування, вік і стать, пацієнтів було рівномірно розподілено на дві групи: основна (додатково в післяопераційному періоді отримували оригінальний монтелукаст (Сингуляр) 10 мг) і контрольна (отримували лише регламентоване лікування). Основна група налічувала 24 особи, контрольна – 23. Дані щодо розподілу пацієнтів за вищезгаданими критеріями наведено в таблиці 1. У таблиці також указано значення достовірності, отримані при порівнянні результатів між групами. Зважаючи на те що розподіл пацієнтів був контрольований, статистично достовірна різниця між групами вибірки відсутня.
Хоча БА й не була предметом наших обстежень, її персистенцію попередньо було діагностовано іншими лікарями в третини нашої вибірки всіх пацієнтів – 34,04%. При цьому згідно з анамнезом хворі не приймали жодних постійних препаратів для її контролю, оскільки всі мали БА легкого перебігу, у зв’язку з чим приймали певні медикаменти тільки в періоди загострення – весняно-літній сезон.
Згідно з дизайном дослідження повторні огляди пацієнтів були заплановані через 7 днів, 1 і 3 місяці після операції. Тому, користуючись умовним позначенням «В» (візит), було порівняно динаміку клінічних, ендоскопічних і рентгенологічних змін у хворих обох груп. Отже, В0 – огляд до операції, В1 – візит на 7-й день після операції, В2 – візит через 1 місяць, В3 – візит через 3 місяці.
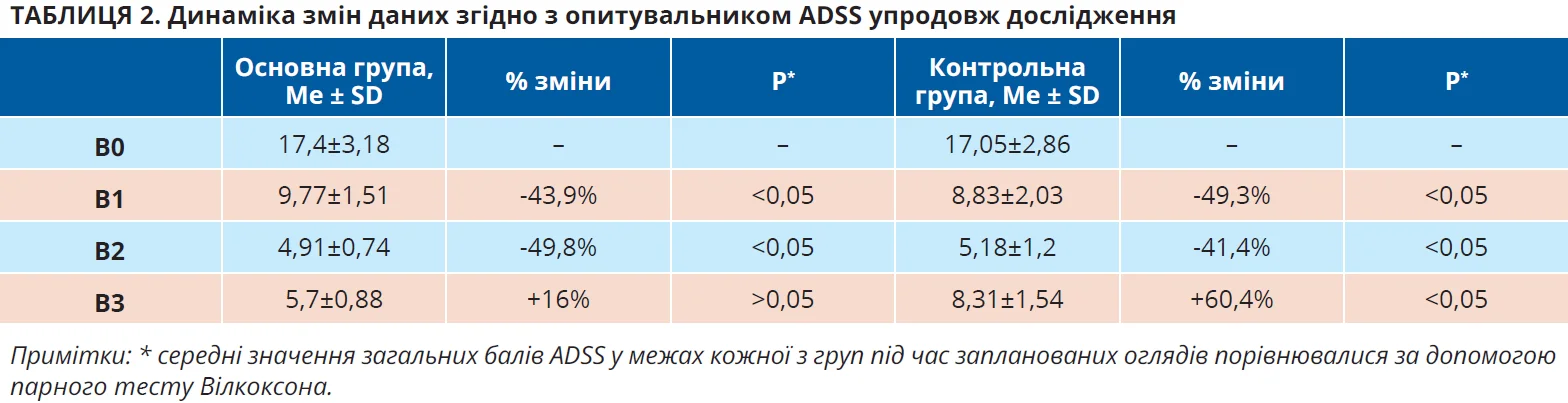
При оцінюванні назальних симптомів за опитувальником ADSS виявилося, що після хірургічного втручання вже на 7-й день пацієнти обох груп відзначали значне зниження симптомів ХРС. При цьому наприкінці першого місяця дані опитувальника вказували, що в усієї вибірки симптоми знизилися вдвічі порівняно з оглядом до операції. До другого післяопераційного візиту зниження симптомів було статистично достовірним в обох групах. Тоді як основна група показувала добрий контроль симптомів на третій місяць після FESS, у контрольній групі результат був протилежним: симптоми (закладеність носа та постназальне затікання) достовірно збільшилися (в середньому на 60,4%) на В3. Окремим питанням для деяких пацієнтів в обох групах став симптом порушення нюху: в 10,6% випадків нюх не покращився або не відновився після хірургічного втручання. Дані динаміки змін середніх балів ADSS наведено в таблиці 2.
Ще одним аспектом опитувальника ADSS була якість життя, що оцінювалася за 7-бальною шкалою. Її динаміку наведено на рисунку 1. Як і в разі даних розподілу пацієнтів, середні значення якості життя пацієнтів були статистично подібними. При цьому така подібність даних спостерігалася до третього візиту, під час якого середнє значення впливу ХРС на якість життя була дещо вища в групі контролю, але при порівнянні статистично достовірної різниці між групами не наставало. Тому, незважаючи на достовірне погіршення назальних симптомів у хворих контрольної групи, їхній вплив на якість життя був недостатньо суттєвий.
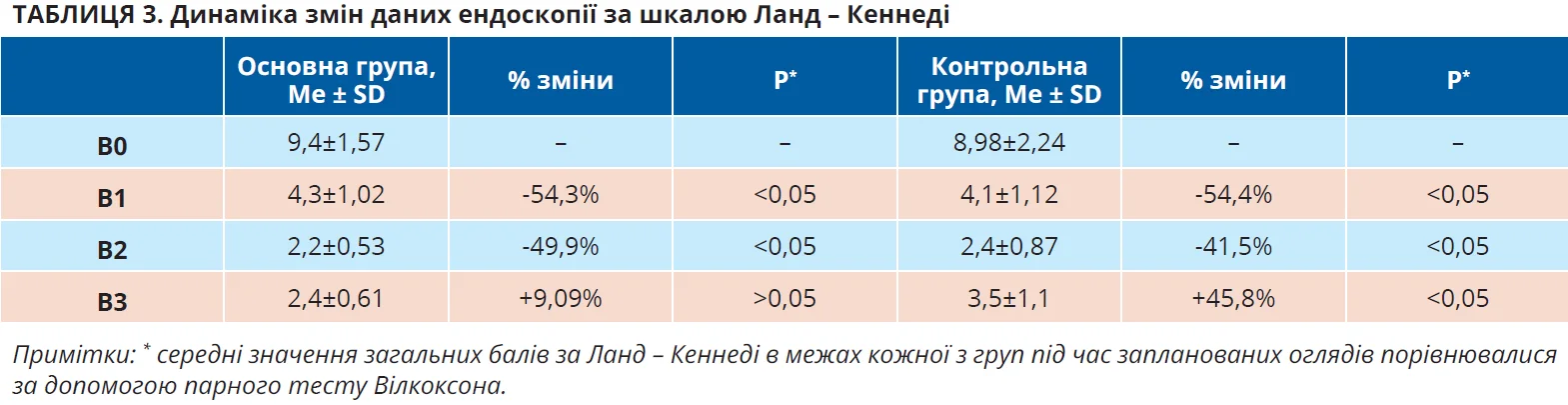
Схожа ситуація відбулася із середніми значеннями ендоскопічної шкали Ланд – Кеннеді: різницю між групами було отримано тільки на момент третього візиту. При порівнянні даних В2 та В3 в основної групи було виявлено відсутність статистично достовірної різниці, що вчергове вказує на кращий контроль захворювання в пацієнтів, які додатково приймали оригінальний монтелукаст (Сингуляр) у добовій дозі 10 мг. Щодо групи контролю, то порівняння В2 та В3 показало суттєву різницю на користь збільшення ендоскопічних проявів ХРС. Передовою ендоскопічною ознакою в пацієнтів при цьому був набряк слизових оболонок, мода якого становила 2 бали (максимум із можливих). Дані динаміки змін ендоскопічної картини ХРС після хірургічного втручання продемонстровано в таблиці 3.
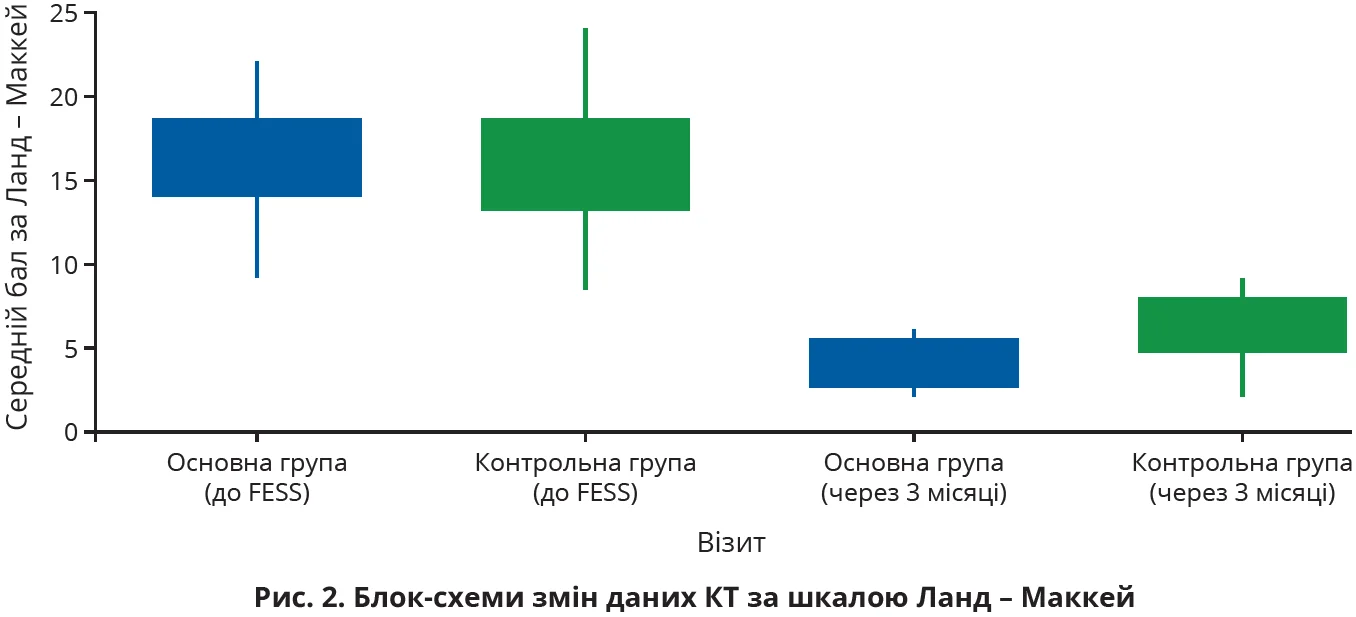
Одним з елементів контролю ХРСізНП й АР у нашому дослідженні була оцінка КТ ПНП за шкалою Ланд – Маккей. Вихідні дані та дані на третій місяць обстеження наведено на рисунку 2.
На рисунку показано, що до хірургічного втручання середні значення шкали Ланд – Маккей були статистично подібні. Проте через 3 місяці після хірургії середнє значення для основної групи становило 4±1,4 бала, а для контрольної групи – 6,25±1,55 бала, що при порівнянні показувало настання статистично достовірної різниці з Р=0,0012 (Р<0,05). Тому об’єктивні дані КТ ПНП показують, що в основній групі контроль захворювання був вищим. Варто зазначити, що значення шкали Ланд – Маккей >5 балів вважається рецидивом ХРС.
Додатково було оцінено переносимість оригінального монтелукасту у хворих основної групи, які приймали його щодня на ніч упродовж 3 місяців. Жодної небажаної реакції на тлі прийому оригінального монтелукасту (Сингуляр) 10 мг хворі не відзначали. Скарги частини хворих (n=8) на сухість у носі після операції були здебільшого пов’язані з топічним застосуванням мометазону фуроату та, ймовірно, з осінньо-зимовим сезоном (нерегульований тепловий режим із низькою вологістю повітря в оселях). Для усунення цих скарг хворим до лікування додавали назальні ізотонічні спреї для зволоження носа, після чого симптом зникав.
Обговорення
Згідно з EPOS 2020 монтелукаст не був рекомендований (ступінь рекомендації А) для передопераційного та післяопераційного лікування пацієнтів із ХРСізНП. Ця рекомендація ґрунтувалася на одному дослідженні якості 1а й декількох контроверсійних дослідженнях, які визначали роль монтелукасту порівняно з плацебо та топічними кортикостероїдами в пацієнтів після FESS [3].
На сьогодні існує значно більше досліджень щодо використання монтелукасту при ХРСізНП [12-16]. При цьому частина досліджень демонструє його ефективність, а інша частина – неефективність. Зокрема, дослідження Mostafa та співавт. (2005) із доказовістю 1b показало, що застосування монтелукасту не сприяє покращенню симптомів і зменшенню частоти рецидивів ХРСізНП порівняно з контрольною групою [12]. Пізніше Schaper і співавт. (2011) у проспективному рандомізованому дослідженні (1b) продемонстрували, що при спостереженні впродовж 6 місяців група, яка отримувала додатково монтелукаст, мала достовірне зниження симптомів, біомаркерів алергічного запалення, покращення результатів ольфактометрії та ринопневмоманометрії порівняно з плацебо-групою ХРСізНП [13]. На противагу цим даним Vuralkan і співавт. (2012) із подібним дизайном дослідження та більшою вибіркою пацієнтів і тривалішим спостереженням виявили відсутність достовірної різниці між групами монтелукасту та плацебо-контролю [14].
Також свою лепту в контроверсійність застосування монтелукасту при ХРСізНП внесла група вчених Yelverton і співавт., які в ретроспективному дослідженні виявили, що монтелукаст є ефективним у зниженні загального бала SNOT-22 та NPS (Nasal Polyp Score) [15]. Подальші якісні дослідження Van Gerven і співавт. (2017) демонстрували неефективність антилейкотрієнових препаратів [16].
Після огляду цих досліджень було виявлено, що переважна їх більшість зосереджена тільки на фенотипі ХРС, а саме на ХРСізНП. При цьому в деяких роботах АР і БА були навіть критеріями виключення. Тому не дивно, що в цих публікаціях монтелукаст не продемонстрував очікуваного результату в контролі симптомів і зниженні рецидивів ХРСізНП. Також цей факт пояснює відсутність єдиного консенсусу в міжнародних клінічних настановах щодо доцільності використання монтелукасту при ХРСізНП.
Наше дослідження було зосереджено саме на ендотипі ХРСізНП й АР. Тому отримані результати показують ефективність оригінального монтелукасту при ХРСізНП й АР, що зумовлено його фармакологічними властивостями. Пригнічуючи алергічне запалення, оригінальний монтелукаст (Сингуляр) знижував клінічні й ендоскопічні прояви ХРС за даними анкетування ADSS і шкали Ланд – Кеннеді. Крім того, основна група показала кращий контроль симптомів упродовж 3 місяців після проведення хірургічного лікування порівняно з контрольною групою. Додатково цей факт підтверджено проведенням КТ ПНП: в основної групи результати бальної оцінки променевого дослідження були достовірно нижчі та в середньому не були вище 5 балів, що говорить про відсутність раннього рецидиву ХРСізНП. При цьому в контрольній групі, яка застосовувала лише мометазону фуроат, можна було спостерігати рецидивування хвороби. Таким пацієнтам надалі було розглянуто питання проведення терапії моноклональними антитілами.
Обмеження дослідження
Зважаючи на дизайн дослідження типу випадок – контроль, одними з обмежень можуть бути відсутність рандомізації пацієнтів, неможливість виключення впливу сторонніх чинників або ефекту плацебо на результати дослідження. Також, зважаючи на те що FESS проводилася трьома заздалегідь визначеними отоларингологами, різниця в результатах може бути пов’язана з їхніми хірургічними навичками та методологією хірургічного втручання. Проте розуміння цих обмежень допомагає належним чином контекстуалізувати результати дослідження й уникнути необґрунтованих висновків.
З огляду на згадані обмеження наразі існує потреба в проведенні високоякісних рандомізованих плацебо-контрольованих досліджень.
Висновки
- Додавання оригінального монтелукасту (Сингуляр) 10 мг для тривалого післяопераційного лікування у хворих на ХРСізНП й АР достовірно покращує контроль захворювання.
- Оригінальний монтелукаст (Сингуляр) у добовій дозі 10 мг достовірно краще сприяє контролю основних симптомів ХРСізНП (закладеність носа, виділення з носа, постназальне затікання, біль у проєкції навколоносових пазух, відчуття запахів) порівняно з контрольною групою.
- Дані об’єктивних досліджень (ендоскопії носової порожнини та КТ ПНП) указують на відсутність рецидивів ХРСізНП у хворих, які приймали оригінальний монтелукаст (Сингуляр) упродовж 3 місяців, порівняно з контрольною групою пацієнтів.
- За період дослідження оригінальний монтелукаст (Сингуляр) 10 мг не спричинив жодної небажаної реакції, тому препарат можна вважати безпечним для тривалого використання.
Отже, оригінальний монтелукаст (Сингуляр) 10 мг може бути застосований як одна з опцій контролю ХРСізНП й АР у післяопераційному періоді для тривалого використання. Варто зазначити, що особливо актуальним його застосування є для хворих із супутньою БА: в нашій вибірці таких пацієнтів налічувалося 34,04%.
Література
- Hastan D., Fokkens W.J., Bachert C., Newson R.B., Bislimovska J., Bockelbrink A., Bousquet P.J., Brożek G.M., Bruno A., Dahlen S.E., et al. Chronic rhinosinusitis in Europe – an underestimated disease. A GA(2)LEN study. Allergy. 2011; 66: 1216-1223.
- Palmer J.N., Messina J.C., Biletch R., Grosel K., Mahmoud R.A. A cross-sectional, population-based survey of U.S. adults with symptoms of chronic rhinosinusitis. Allergy Asthma Proc. 2019; 40: 48-56.
- Fokkens W., et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020; 58 (Suppl. S29): 1-464. doi: 10.1055/b-0034-97635.
- Smith T.L., Schlosser R.J., Mace J.C., Alt J.A., Beswick D.M., DeConde A.S., Soler Z.M. Long-term outcomes of endoscopic sinus surgery in the management of adult chronic rhinosinusitis. International Forum of Allergy & Rhinology. 2019 Aug; 9 (8): 831-841.
- Haxel B.R. Recovery of olfaction after sinus surgery for chronic rhinosinusitis: a review. The Laryngoscope. 2019; 129 (5): 1053-1059.
- Ikeda K., Ito S., Hibiya R., Homma H., Ono N., Okada H., et al. Postoperative management of eosinophilic chronic rhinosinusitis with nasal polyps: impact of high-dose corticosteroid nasal spray. International Archives of Otorhinolaryngology. 2019; 23: 101-103.
- Carvalho V., Olej B., de Moraes J.R., Boechat J.L. Mometasone furoate is not superior to saline for chronic rhinitis in the elderly. World Allergy Organization Journal. 2019; 12 (10): 100064.
- Lee Y.J., Kim C.K. Montelukast use over the past 20 years: monitoring of its effects and safety issues. Clinical and Experimental Pediatrics. 2020; 63 (10): 376.
- Lund V., Kennedy D. Staging for rhinosinusitis. Otolaryngology – Head and Neck Surgery. 1997; 117: S35-S40. doi: 10.1016/S0194-59989770005-6.
- Lund V.J., Mackay I.S. Staging in rhinosinusitis. Rhinology. 1993; 107: 183-184.
- Naidoo Y., Tan N., Singhal D., Wormald P. Chronic rhinosinusitis assessment using the Adelaide Disease Severity Score. The Journal of Laryngology & Otology. 2013; 127: S24-S28. doi: 10.1017/S0022215113000558.
- Mostafa B.E., Abdel Hay H., Mohammed H.E., Yamani M. Role of leukotriene inhibitors in the postoperative management of nasal polyps. ORL J. Otorhinolaryngol. Relat. Spec. 2005; 67: 148-153.
- Schaper C., Noga O., Koch B., et al. Anti-inflammatory properties of montelukast, a leukotriene receptor antagonist in patients with asthma and nasal polyposis. J. Investig. Allergol. Clin. Immunol. 2011; 21: 51-58.
- Vuralkan E., Saka C., Akin I., et al. Comparison of montelukast and mometasone furoate in the prevention of recurrent nasal polyps. Ther. Adv. Respir. Dis. 2012; 6: 5-10.
- Yelverton J.C., Holmes T.W., Johnson C.M., Gelves C.R., Kountakis S.E. Effectiveness of leukotriene receptor antagonism in the postoperative management of chronic rhinosinusitis. Int. Forum Allergy Rhinol. 2016; 6: 243-247.
- Gerven L., Langdon C., Cordero A., Cardelús S., Mullol J., Alobid I. Lack of long-term add-on effect by montelukast in postoperative chronic rhinosinusitis patients with nasal polyps. The Laryngoscope. 2018; 128. doi: 10.1002/lary.26989.