Хронічна спонтанна кропив’янка: як визначати успіх лікування
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Хронічна спонтанна кропив’янка (ХСК) – це захворювання шкіри, яке характеризується спонтанною появою пухирів та/або ангіонабряку протягом >6 тижнів. Загалом на ХСК страждає 0,6-1,0% населення світу. Середній час від моменту появи симптомів до встановлення діагнозу становить 2 роки; діагностичний процес включає оцінку кофакторів, коморбідних станів, предикторів активності хвороби та відповіді на лікування.
Вважається, що патогенез ХСК опосередкований автоімунними механізмами, активацією опасистих клітин і подальшим вивільненням гістаміну.
Виділяють три підтипи ХСК: тип І (автоалергічний; опосередкований імуноглобуліном (Ig) E), тип IIb (автоімунний; опосередкований IgG) та тип, причини якого невідомі. ХСК притаманні рецидивний перебіг і тривалість у межах 1-5 років.
Згідно з наявними алгоритмами перша лінія лікування ХСК передбачає застосування H1-антигістамінних препаратів (АГП) другого покоління, а подальші стратегії – застосування АГП у високих дозах, омалізумабу та циклоспорину. Метою лікування ХСК є досягнення та підтримка ремісії, однак, оскільки значна частка пацієнтів не може досягти цього стану, існує потреба у визначенні успіху лікування та створенні практичних рекомендацій для його досягнення.
Проведений авторами літературний пошук виявив, що для оцінки активності ХСК використовуються шкала активності кропив’янки (Urticaria Activity Score, UAS7), шкала активності ангіонабряку (Angioedema Activity Score, AAS7), тест контролю кропив’янки (Urticaria Control Test, UCT), тест контролю ангіонабряку (Angioedema Control Test, AECT), опитувальник щодо впливу хронічної кропив’янки на якість життя (Chronic Urticaria Quality of Life Questionnaire, CU-Q2oL), дерматологічний індекс якості життя (Dermatology Life Quality Index, DLQI) й опитувальник щодо впливу ангіонабряку на якість життя (Angioedema Quality of Life Questionnaire, AE-QoL).
Цілі лікування
Станом на сьогодні засобів для повного усунення ХСК не існує; наявні засоби спрямовані на контроль активності хвороби та профілактику рецидивів. Загалом цілями лікування є досягнення контролю над симптомами, тобто оцінка за UAS7 на рівні 0, і нормалізація якості життя. Значна кількість пацієнтів не досягає їх, тому виникає запитання, чи є ці цілі адекватними.
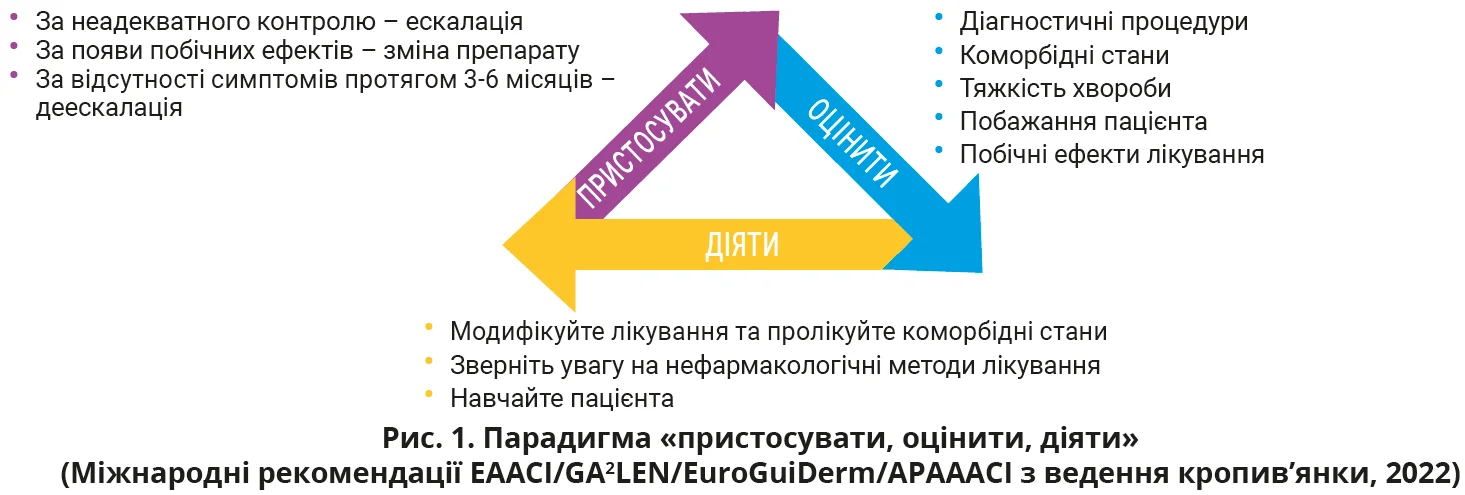
Парадигма «пристосувати, оцінити, діяти» передбачає постійну періодичну оцінку перебігу хвороби пацієнта за допомогою тесту контролю кропив’янки з метою адаптації лікування (рис. 1).
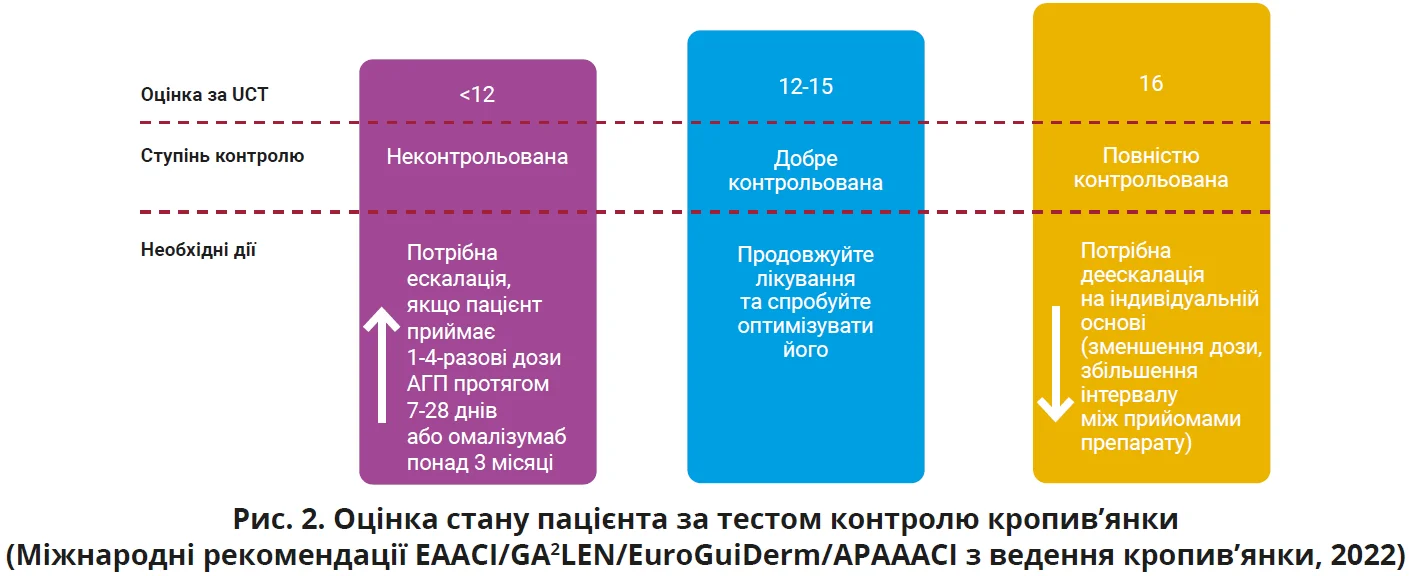
Тест контролю кропив’янки являє собою опитувальник із чотирьох запитань, який дає змогу розподілити пацієнтів на групи повністю контрольованої, добре контрольованої та неконтрольованої хвороби (рис. 2).
Ключова ознака ХСК – непередбачуваність рецидивів висипів та інтенсивності свербежу; це значно погіршує якість життя пацієнтів і негативно впливає на їхній комфорт, щоденну активність і сон. Відповідно, метою лікування можна вважати усунення свербежу, печіння та висипів. За даними опитування DERMLINE, близько половини пацієнтів із кропив’янкою взагалі не задоволені, не задоволені або незначно задоволені поточним лікуванням у зв’язку з відсутністю відповіді або побічними ефектами. Пацієнти також зазначили, що їхній лікар не розуміє істинного емоційного та фізичного тягаря ХСК.
Вибір правильного лікування та перехід на інше лікування є багатофакторним рішенням, під час прийняття котрого слід керуватися наявними рекомендаціями, хоча, на думку деяких лікарів, рекомендації надмірно спрощують складну природу ХСК. Окрім того, патофізіологія ХСК вивчена не повністю й не всі лікарі погоджуються з автоімунною природою цієї хвороби, що призводить до відмінностей у підходах до лікування.
Наразі узагальненого підходу treat-to-target (лікування до встановленої мети) для ХСК не існує. Запропоновано, наприклад, досягати та зберігати контроль над симптомами хвороби (оцінка ≤6 за UAS7) або досягати ремісії (оцінка 0 за UAS7). Хоча UAS7 є цінним показником активності хвороби, для оцінки впливу всіх її аспектів потрібно враховувати результати лікування, котрі оцінює сам пацієнт.
Клінічні та лабораторні біомаркери, що враховуються при прийнятті рішень
У клінічній практиці дедалі частіше використовуються різноманітні біомаркери, деякі з яких асоціюються з наслідками лікування для пацієнта. Наприклад, значна тривалість хвороби пов’язана з недостатньою відповіддю на стандартні дози АГП, коморбідна хронічна індукована кропив’янка – з пізнім початком хвороби (після 45 років), непереносимістю нестероїдних протизапальних препаратів, ангіонабряком і рецидивним перебігом. У дослідженні за участю 549 пацієнтів із ХСК у 20,2% спостерігалася коморбідна хронічна індукована кропив’янка. Ця підгрупа пацієнтів потребувала вищих доз АГП, крім того, через 5 років лікування стійка симптоматика кропив’янки спостерігалася в більшої кількості хворих цієї групи порівняно з пацієнтами виключно з ХСК (Curto-Barredo L. et al., 2018).
Що стосується лабораторних біомаркерів, то тяжкий перебіг хвороби асоціюється з підвищеними рівнями С-реактивного білка та D-димеру. Біомаркери також застосовуються для диференційної діагностики ХСК типу IIb, яка асоціюється з тяжчим перебігом хвороби. Кропив’янка типу IIb характеризується низьким рівнем IgE, підвищеним умістом антитіл до тиреопероксидази класу IgG, позитивним тестом на вивільнення гістаміну базофілами, позитивним шкірним тестом з автологічною сироваткою, наявністю автоантитіл anti-FcεRI класу IgG, базо- й еозинопенією. Незадовільна відповідь на АГП асоціюється з підвищеними рівнями С-реактивного білка та D-димеру, а незадовільна відповідь на омалізумаб – із низьким рівнем IgE, базо- й еозинопенією, підвищеним умістом антитіл до тиреопероксидази. Позитивний тест на вивільнення гістаміну базофілами теж пов’язаний із незадовільною відповіддю на омалізумаб і хорошою відповіддю на циклоспорин.
Кінцеві точки та цілі лікування, що застосовувалися в ключових клінічних дослідженнях
У ключових клінічних дослідженнях АГП і біологічних препаратів найчастіше використовуваними первинними та вторинними кінцевими точками були зміни в оцінці за UAS7 порівняно з вихідним рівнем. Також часто оцінювалися зміни за шкалою тяжкості свербежу протягом тижня (Itch Severity Score, ISS7) і загальною шкалою тяжкості кропив’янки.
Вторинні кінцеві точки були різноманітними та включали зміни в оцінці якості життя за опитувальником DLQI, час до досягнення мінімального клінічно значущого зниження оцінки за ISS7, частку пацієнтів з оцінкою ≤6 за UAS7. Для оцінки життя пацієнтів із кропив’янкою існує спеціалізований опитувальник, який радять застосовувати наявні рекомендації (CU-Q2oL), однак у дослідженнях частіше використовується анкета DLQI, ймовірно, у зв’язку з тим, що лікарі краще з нею ознайомлені.
Загалом кінцеві точки в дослідженнях фокусуються на ефективності препаратів, натомість оцінка якості життя та показники, пов’язані з інтенсивністю ангіонабряку, застосовуються рідко. Критерієм хорошої відповіді на лікування є оцінка ≤6 за UAS7.
Чи переносяться цілі лікування, використані в клінічних дослідженнях, у реальну практику?
Ми спостерігаємо значну розбіжність між рекомендаціями, дизайном клінічних досліджень і реальною практикою. У систематичному огляді J.A. Bernstein і співавт. (2018), присвяченому застосуванню омалізумабу при ХСК, було з’ясовано, що найчастіше використовується шкала активності кропив’янки (UAS або UAS7). Натомість тест контролю кропив’янки (UCT) використовувався лише в 1,2% досліджень, а опитувальники щодо якості життя DLQI та CU-Q2oL – у 7,1 й 6,0% відповідно.
Дослідження AWARE та ASSURE-CSU продемонстрували, що клінічна практика дедалі частіше включає методи оцінки успішності лікування, рекомендовані керівними вказівками. Наприклад, у дослідженні AWARE тягар ХСК оцінювали за контролем симптомів (UAS7 і AAS), контролем хвороби (UCT), якістю життя (DLQI, CU-Q2oL, AE-QoL) і продуктивністю праці (за опитувальником щодо продуктивності праці та порушень активності WPAI – Work Productivity and Activity Impairment Questionnaire). Проте це дослідження виявило, що менш ніж 1/3 пацієнтів, яких слід було перевести на третю лінію терапії, не були переведені. Це може свідчити або про недостатню інтеграцію рекомендацій у клінічну практику, або про відсутність чітких вказівок щодо ескалації терапії.
Проблеми впровадження визначень цілей та успіху лікування в клінічну практику
Відповідно до поточних рекомендацій цілями лікування ХСК є досягнення оцінки за UAS7 на рівні 0 балів, повний контроль хвороби (оцінка за UCT на рівні 16 балів) і нормалізація якості життя. Однак цілі за UAS7 та UCT не відображають реалій ведення цих пацієнтів і складності ХСК. Окрім того, рекомендації не встановлюють критеріїв нормалізації якості життя, тому існує потреба в чіткіших визначеннях.
Для оцінки покращення стану пацієнта інформативними можуть бути найменші клінічно значущі зміни, наприклад оцінка ≤6 за UAS7 і ≥12 за UCT (або збільшення від вихідного рівня щонайменше на 3 бали).
Хоча 43-59% пацієнтів із ХСК мають ангіонабряки, показники їхньої тяжкості (AAS, AECT, AE-QoL) застосовуються рідко. Імовірно, лікарі використовують із цією метою нестандартизовану власну оцінку.
Оскільки клінічні та лабораторні показники можуть допомогти в прогнозуванні тривалості й тяжкості ХСК, а також відповіді на лікування, лікарів потрібно своєчасно сповіщати про інформативні біомаркери. Застосування маркерів прогнозу може значно впливати на прийняття рішень.
Рух у напрямку універсального визначення успіху лікування
Наявна література практично не вказує, що саме варто вважати успіхом лікування. Метою терапії була й залишається ремісія, однак цей термін може бути багатозначним і означати, наприклад, відсутність пухирів і ангіонабряку протягом останніх 3 місяців за відсутності лікування; частку пацієнтів, яким, на їхню думку, вдалося повністю вилікувати ХСК; відсутність кропив’янки протягом щонайменше 4 тижнів без фармакотерапії; відсутність лікування кропив’янки протягом щонайменше 1 року.
Залишаються й інші невирішені питання: чи є ремісія постійною, чи тимчасовою, який проміжок часу пацієнтам потрібно провести без лікування для діагностики ремісії, чи можуть біологічні препарати забезпечувати стійку ремісію тощо. Нещодавній консенсусний документ визначив ремісію як повну відсутність ознак або симптомів хвороби за відсутності лікування протягом 2 тижнів для стандартних доз АГП, 4 тижнів для підвищених доз АГП та 3-6 місяців для біологічних препаратів. Однак упровадження цього визначення залишається проблемою. Наприклад, скасування омалізумабу може призвести до клінічного погіршення навіть через 6 місяців.
Іншою проблемою є відсутність чітких рекомендацій щодо того, коли варто знижувати інтенсивність лікування. У наявних керівних вказівках єдиним критерієм цього є оцінка за тестом контролю кропив’янки.
Існує також потреба в чіткому визначенні рецидиву. Нині рецидив визначають як повторну появу симптомів щонайменше через 6 місяців після скасування контрольного лікування та відновлення попередньої симптоматики кропив’янки, але виникає питання, чи не є цей стан епізодом нової хвороби.
Наостанок, для визначення успіху лікування слід застосовувати показники якості життя пацієнта, враховуючи не лише зменшення тягаря ХСК, а й побічні ефекти препаратів, потребу в уживанні кількох медикаментів, у тому числі з профілактичною метою.
Висновки
Перед тим як сформулювати універсальне визначення успіху лікування, слід дати відповідь на декілька запитань. Існує потреба в термінологічному визначенні ремісії та рецидиву, а також у створенні рекомендацій щодо зниження інтенсивності лікування. Крім того, слід визначати вплив ХСК на якість життя пацієнта, бажано протягом тривалого часу.
Література
Armstrong A.W., Soong W., Bernstein J.A. Chronic spontaneous urticaria: how to measure it and the need to define treatment success. Dermatol. Ther. (Heidelb.). 2023; 13: 1629-1646. doi: 10.1007/s13555-023-00955-7.