Хронічна кропив’янка: сучасний менеджмент і можливі виклики
Автор: Сергій Вікторович ЗАЙКОВ, доктор медичних наук, професор кафедри фтизіатрії і пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), президент ВГО «Асоціація алергологів України»
Визначення та класифікація
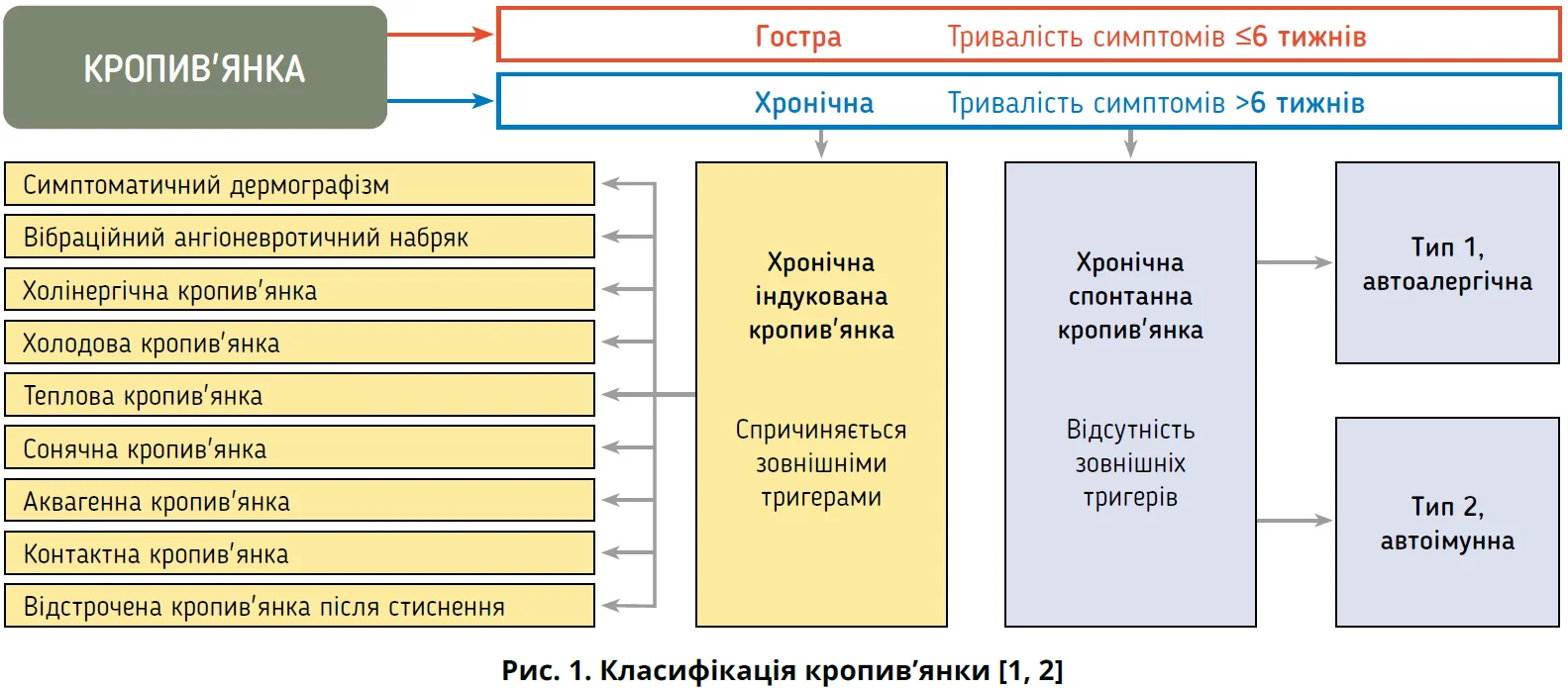
Кропив’янку визначають як опосередковану мастоцитами хворобу шкіри, що характеризується уртикарним висипом (сверблячими пухирями) та/або ангіоневротичним набряком (АН). За тривалістю видокремлюють гостру (≤6 тижнів) і хронічну (>6 тижнів). Хронічна кропив’янка (ХК) поділяється на хронічну спонтанну кропив’янку (ХСК), що з’являється без певного тригера, та хронічну індуковану кропив’янку (ХІК), коли симптоми спричиняють специфічні відтворювані чинники, зокрема тертя, тепло, холод, вплив сонячного світла, тиск, фізичні навантаження або вібрація (рис. 1) [1].
Епідеміологія та клінічні прояви
Найпоширенішим підтипом є ХСК (60-90% усіх випадків ХК), яка переважає в дорослих – 0,02-2,7% проти 0,1-0,9% у дітей [3]. Вік появи ХСК у дітей становить 6-9 років, у дорослих – 30-50 років. У 86% пацієнтів діагностують помірну-тяжку ХСК [3, 4]. Порівняно з дорослими діти зазвичай мають нижчу частоту АН (19 проти 60%) і коротшу середню тривалість хвороби (5 проти 12 місяців) [5]. За даними обсерваційних досліджень, тривалість хвороби зазвичай становить 1-10 років [6, 7]; але до 40% пацієнтів можуть хворіти >10 років [8]. Приблизно дві третини пацієнтів з ХСК повідомляють про системні скарги – біль у суглобах і втому; поширеність системних проявів вища в разі тривалої хвороби (>4 роки) [9].
При ХCК пухирі з’являються спонтанно внаслідок невідомих (ідіопатична кропив’янка) чи відомих причин. Зокрема, можливе загострення хвороби у відповідь на тригери: стрес, фізичні подразники (частіше при супутній ХІК), дієта, псевдоалергени, паразитарні інвазії, інфекції (простий герпес, HHV-4, HHV-6, норовірус, SARS-CoV-2), лікування нестероїдними протизапальними засобами, вакцинація проти COVID-19 [2, 3, 10-12].
Пухирі мають різні розмір і форму, часто оточені еритемою; пацієнти переважно вказують на свербіж та/або печіння. Кожен ізольований випадок ХСК зникає впродовж 24 годин; можливий супутній АН, який зникає протягом 72 годин [1]. Зокрема, в 57% пацієнтів спостерігаються лише пухирі, в 37% – пухирі з АН, у 6% – ізольований АН [3]. Пухирі можуть з’явитися на будь-якій ділянці тіла, однак переважною локалізацією є руки та ноги; АН найчастіше виникає на обличчі й характеризується глибокою припухлістю в нижній частині дерми, підшкірної тканини або слизових оболонок, що виникає раптово та часто супроводжується відчуттям поколювання, печіння або стиснення [3].
Ознаки та симптоми ХСК можуть виникати щоденно або мати періодично рецидивний перебіг з появою в будь-який час доби, найчастіше ввечері [1, 14]. Можлива спонтанна ремісія ХСК у будь-який час; але понад 50% пацієнтів не досягають ремісії через 5 років. За даними огляду літератури, кумулятивні середньозважені оцінки спонтанної ремісії через 1, 5 і 20 років становили 17, 45 і 73% відповідно [15].
Основні механізми й ендотипи
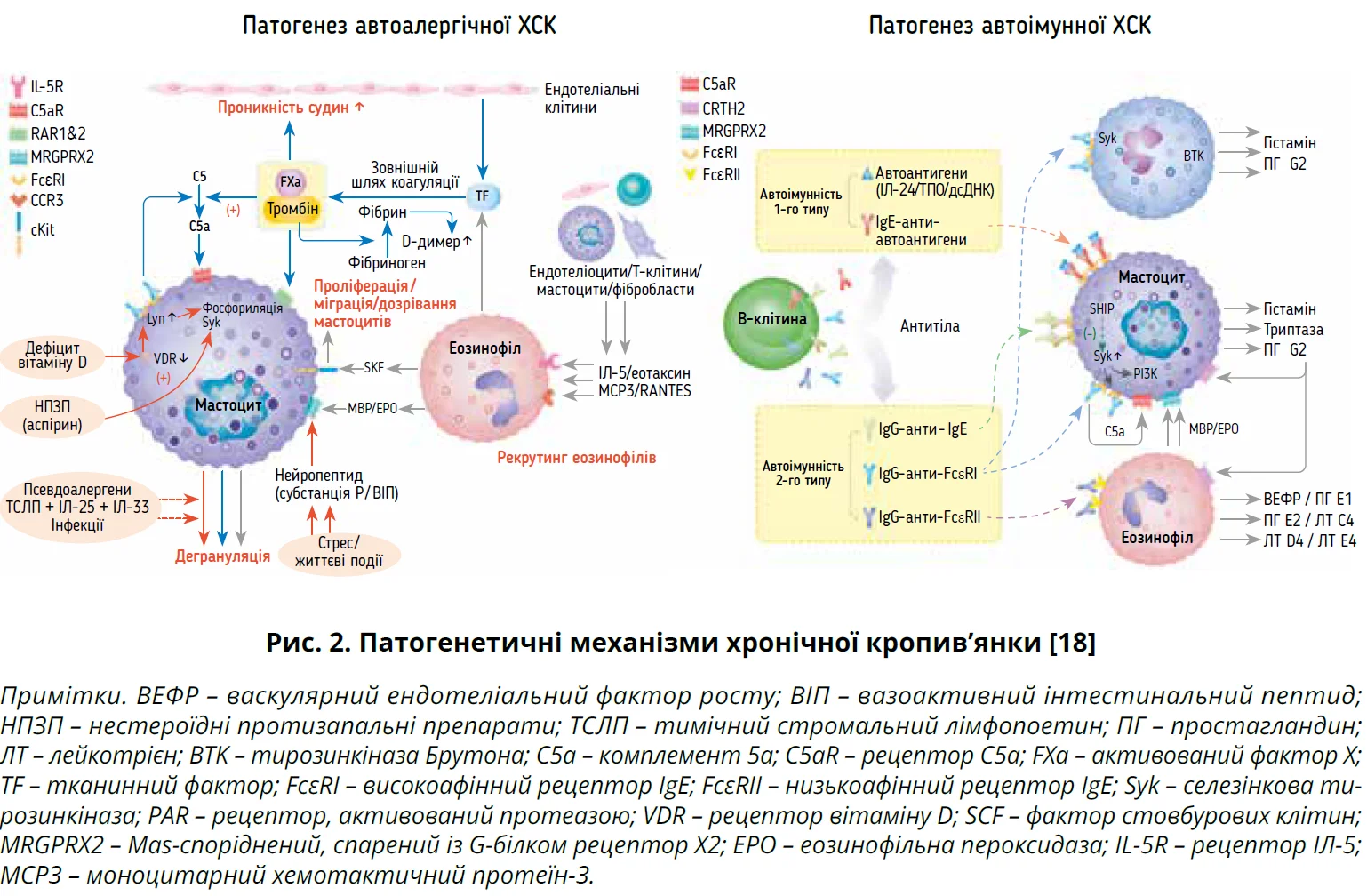
Механізм активації мастоцитів (тучних клітин) у разі ХСК зазвичай автоімунний. Розрізняють два ендотипи: 1) автоалергічний ендотип типу 1 характеризується утворенням IgE-автоантитіл проти таких автоалергенів, як тиреопероксидаза (ТПО) й інтерлейкін-24 (ІЛ-24); 2) автоімунний ендотип типу 2b характеризується наявністю автоантитіл класу IgG (іноді IgA чи IgM) проти високоафінного рецептора IgE (FcεRI) або пов’язаних з ним IgE [10, 16]. Обидва ендотипи включають перехресне зв’язування FcεRI й активацію низхідних сигнальних шляхів через тирозинкіназу Брутона [10, 17, 18] (рис. 2). Можливі також неімунні шляхи активації, зокрема через Mas-споріднений, спарений із G-білком рецептор Х2 (MRGPRX2) – багатолігандний рецептор, який опосередковує дегрануляцію мастоцитів, базофілів та еозинофілів через IgE-незалежну активацію [19].
Активація мастоцитів призводить до вивільнення низки запальних медіаторів (гістамін, цитокіни 2-го типу, хемокіни) та синтезу ейкозаноїдів [3, 20]. Надалі відбуваються активація сенсорних нервів, вазодилатація та збільшення проникності судин, що спричиняє утворення пухирів та/або АН [1, 20]. Гострий свербіж виникає у відповідь на гістамін, що виділяється мастоцитами, базофілами та кератиноцитами; передача сигналу відбувається гістамінергічним шляхом. Хронічний свербіж опосередкований пруритогенами (протеази, цитокіни, хемокіни), які секретують мастоцити, гранулоцити, макрофаги, лімфоцити, кератиноцити та нейрони; шляхи передачі сигналу при цьому негістамінергічні [21].
Сучасні принципи ведення пацієнтів із кропив’янкою
Міжнародні настанови EAACI/GA2LEN/EuroGuiDerm/APAAACI (2022) пропонують індивідуальний підхід до ведення пацієнтів із кропив’янкою. Його основні стратегії ілюструє рисунок 3 [1].
Діагностика
Основні кроки обстеження пацієнтів з підозрою на ХК включають:
1) докладний анамнез;
2) об’єктивне обстеження;
3) базові лабораторні тести: загальний аналіз крові, С-реактивний білок (СРБ), швидкість осідання еритроцитів (ШОЕ); для пацієнтів, які перебувають під наглядом спеціаліста, – загальні IgE й IgG, антитіла до ТПО;
4) визначення активності, стану контролю та негативних впливів хвороби з використанням інструментів оцінювання результатів, про які повідомляє пацієнт:
- тижнева шкала активності кропив’янки (UAS7) і шкала активності АН (AAS) для визначення активності хвороби та відповіді на лікування;
- контрольні тести на кропив’янку (UCT) й АН (AECT) для оцінювання стану контролю хвороби;
- опитувальники якості життя при ХК (CU-Q2oL) й АН (AE-QoL) [1].
На жаль, у клінічній практиці цей перелік не завжди виконується [2].
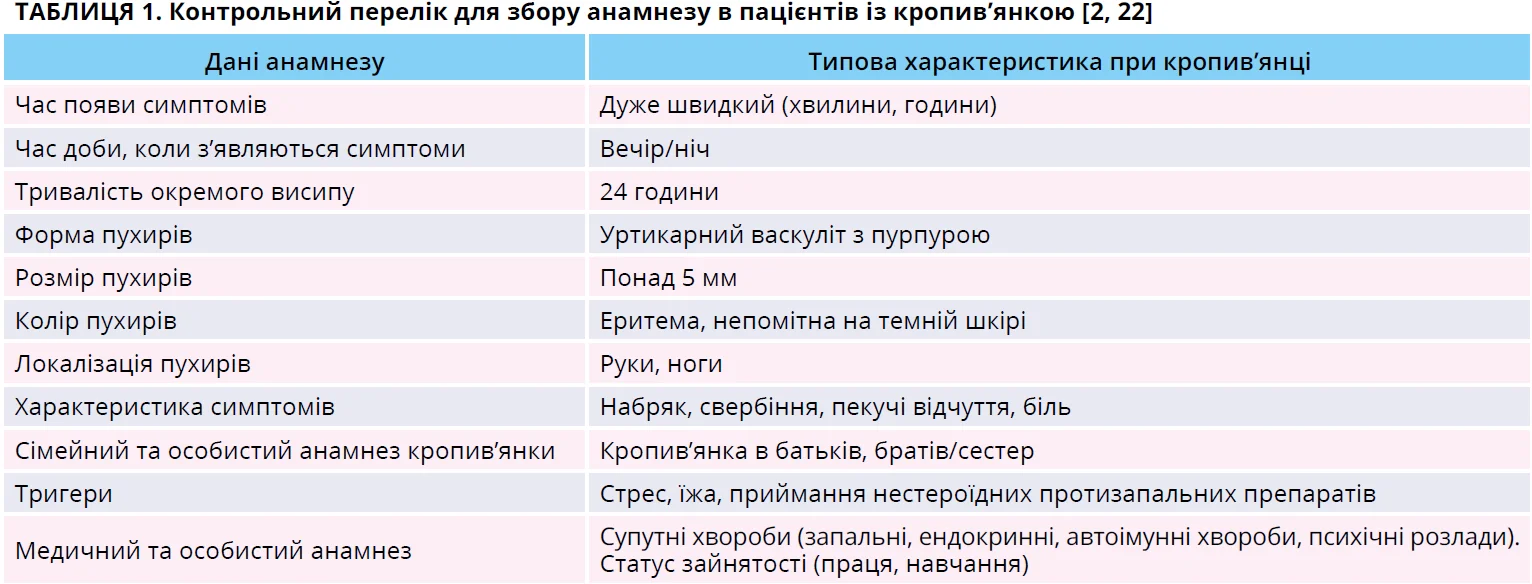
Щоби спростити діагностичний процес та уникнути багаторазових консультацій, під час збору анамнезу потрібно з’ясувати всі деталі, вказані в таблиці 1[2, 22, 23]. Важливі запитання, котрі слід поставити пацієнтам з підозрою на ХСК для виключення інших діагнозів, підсумовано в таблиці 2 [2, 23].
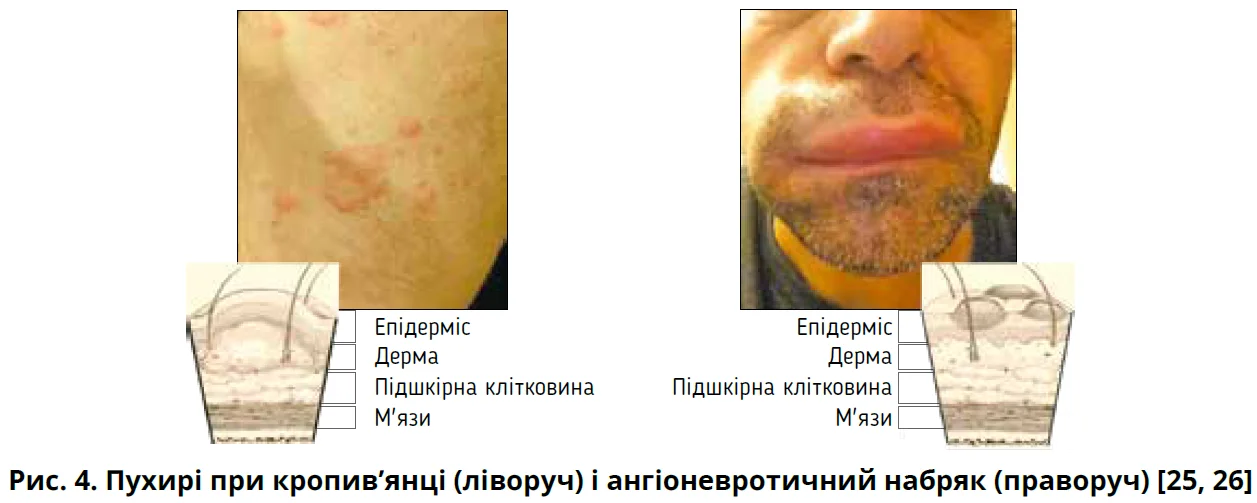
Вигляд пухирів за кропив’янки й АН при об’єктивному обстеженні демонструє рисунок 4. Подряпини й екскоріації не характерні, оскільки пацієнти зазвичай труть, а не дряпають пухирі. Отже, виявлення розчухів допомагає відрізнити кропив’янку від атопічного дерматиту, якому притаманні значні екскоріації [24].
Специфічних біомаркерів ХСК немає, окремі лабораторні тести дають змогу диференціювати ендотипи й оцінити тяжкість хвороби (табл. 3) [2].
Розгорнуте тестування на харчову/інгаляційну алергію показане лише в окремих випадках, коли на алергію вказують особистий анамнез та об’єктивне обстеження пацієнта [1]. Тестування на антинуклеарні антитіла (ANA) не рекомендоване, але рішення провести тест на ANA чи інші автоімунні маркери можливе за підозри на автоімунні хвороби [27].
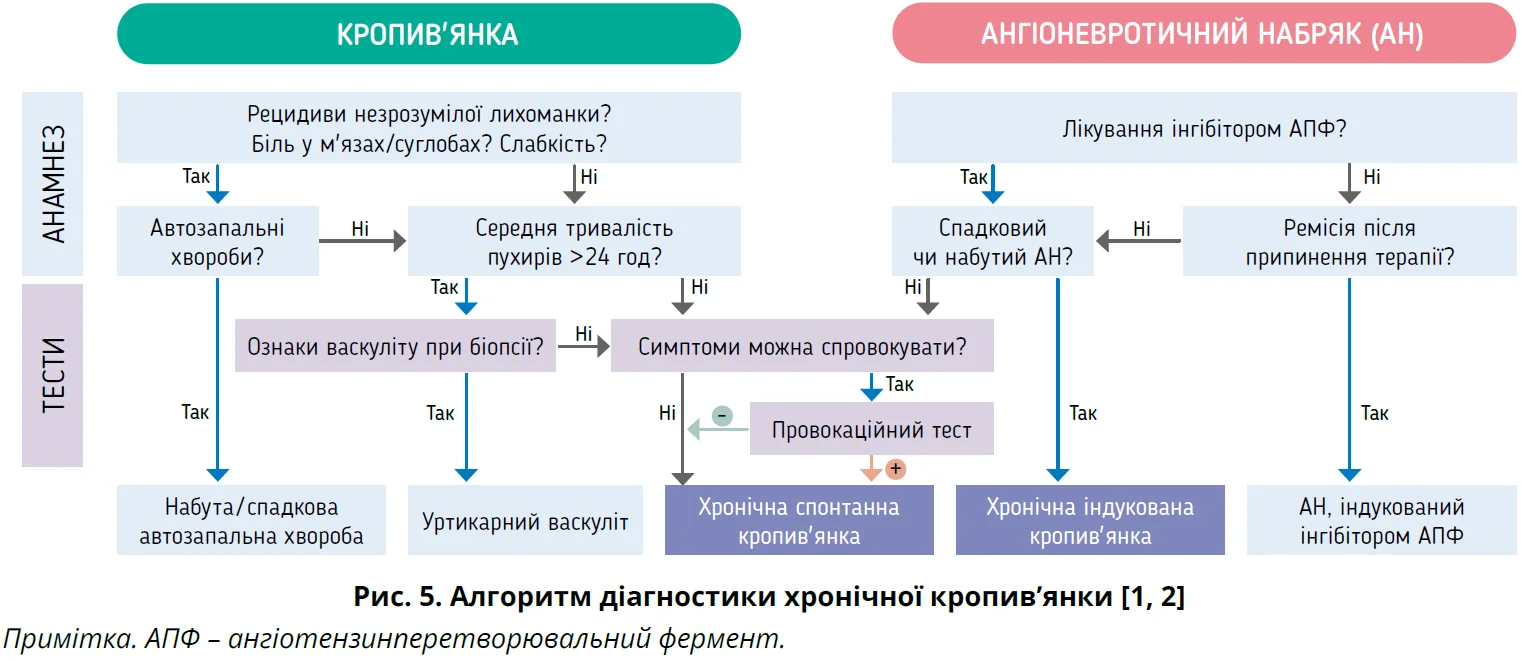
Міжнародні настанови EAACI/GA2LEN/EuroGuiDerm/APAAACI (2022) надають заснований на доказах алгоритм діагностики кропив’янки (рис. 5) [1].
Диференційний діагноз
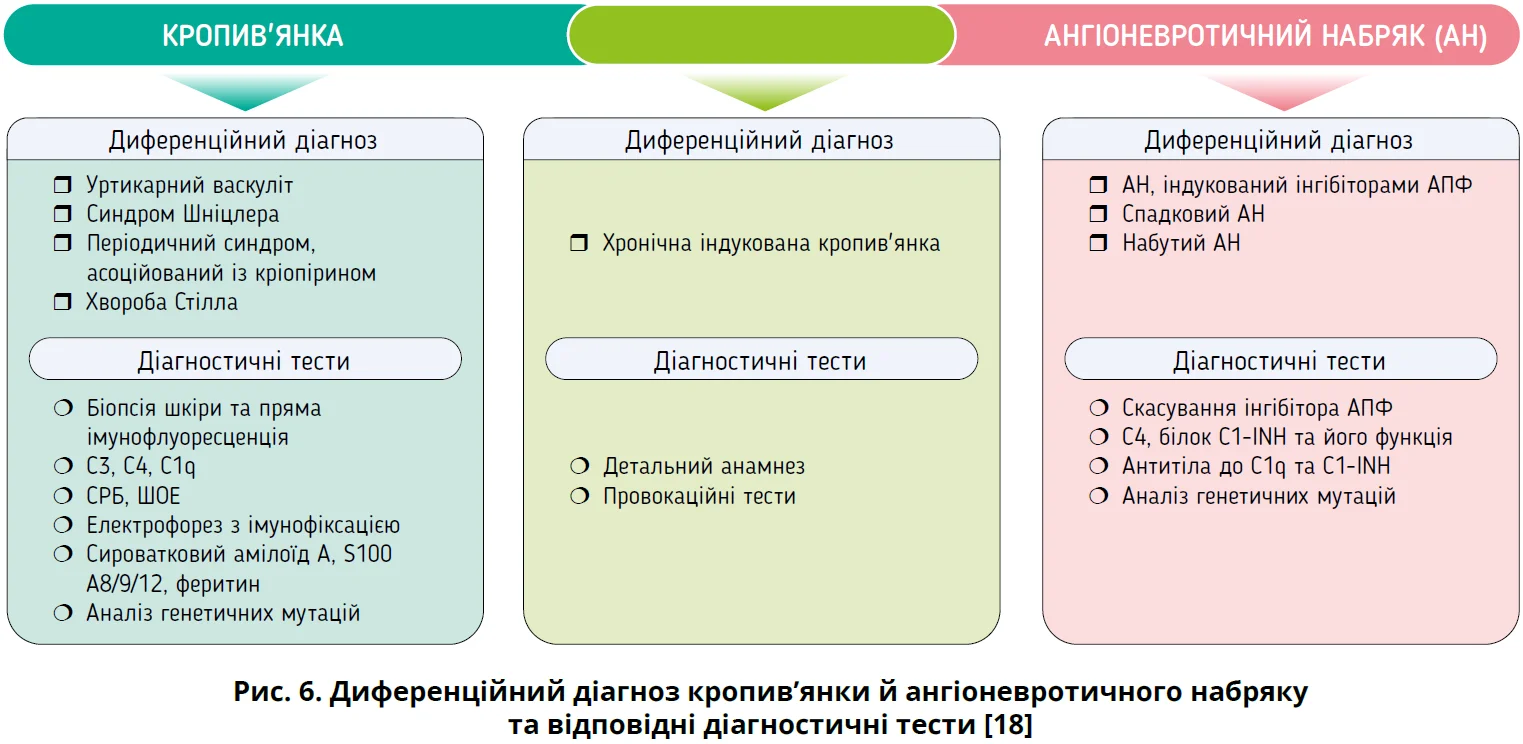
Важливо диференціювати ХК від інших станів, які проявляються пухирями та/або АН (рис. 6) [1, 18].
Зокрема, дермографізм часто співіснує з ХСК. Інші рідкісні стани включають уртикарний васкуліт, мастоцитоз, синдром активації мастоцитів, автозапальні синдроми (періодичний синдром, асоційований із кріопірином, або синдром Шніцлера), опосередкований брадикініном АН, медикаментозний уртикарний висип, екзематозний уртикарний дерматит, синдром Велла, бульозний пемфігоїд, реакції на укуси комах і багатоформна еритема [28]. У пацієнтів з ізольованою кропив’янкою слід виключити уртикарний васкуліт, уртикарний пемфігоїд та інші автозапальні хвороби; пацієнти з ізольованим АН потребують диференціації з АН, опосередкованим брадикініном, індукованим інгібіторами ангіотензинперетворювального ферменту та спадковим АН [1, 2, 18].
Можливі виклики на етапі діагностики
Незважаючи на простий процес діагностики ХК, який ґрунтується на докладному анамнезі й окремих лабораторних тестах, поширеною проблемою є тривалі затримки встановлення діагнозу через періодичність симптомів і недостатню обізнаність про хворобу [29]. Від появи симптомів ХК до встановлення діагнозу минає в середньому 2-4 роки, іноді до 15 років [3, 29]. Дослідження в США показало, що серед пацієнтів з ХСК період очікування від першої консультації лікаря до встановлення діагнозу становив 14 тижнів; 45% пацієнтів уперше контактували з лікарем лише через 6 тижнів після появи симптомів [30].
Іноді до встановлення діагнозу пацієнти відвідують різних фахівців – сімейного лікаря, алерголога, дерматолога, ендокринолога, ревматолога [29]. Зокрема, дослідження проведене в Італії, вказує, що 75% пацієнтів відвідали ≥3 лікарів до встановлення діагнозу ХСК та призначення відповідного лікування [31].
ХК є непередбачуваною хворобою з можливими рецидивами після місяців – років повної ремісії [1]. Останні дослідження вказують на частоту рецидивів на рівні 6-31% [3]. Окрім того, ХК асоціюється з широким спектром супутніх захворювань: патологія щитоподібної залози, психічні розлади, атопічні, ревматичні та запальні хвороби, остеопороз і рак, особливо в разі тривалого перебігу [32, 33]. За даними обсерваційного дослідження, ХК асоціюється з підвищеним ризиком виникнення автоімунних захворювань, особливо в жінок, які діагностують упродовж 10 років після встановлення діагнозу ХК [34].
Сучасні принципи лікування
Рекомендації, засновані на доказах
Лікування ХСК ґрунтується на поетапному підході відповідно до тяжкості хвороби та відповіді на лікування. Сучасні стандартні методи лікування переважно спрямовані на гістамін та IgE. Запропонований міжнародними настановами алгоритм лікування наведено на рисунку 7 [1].
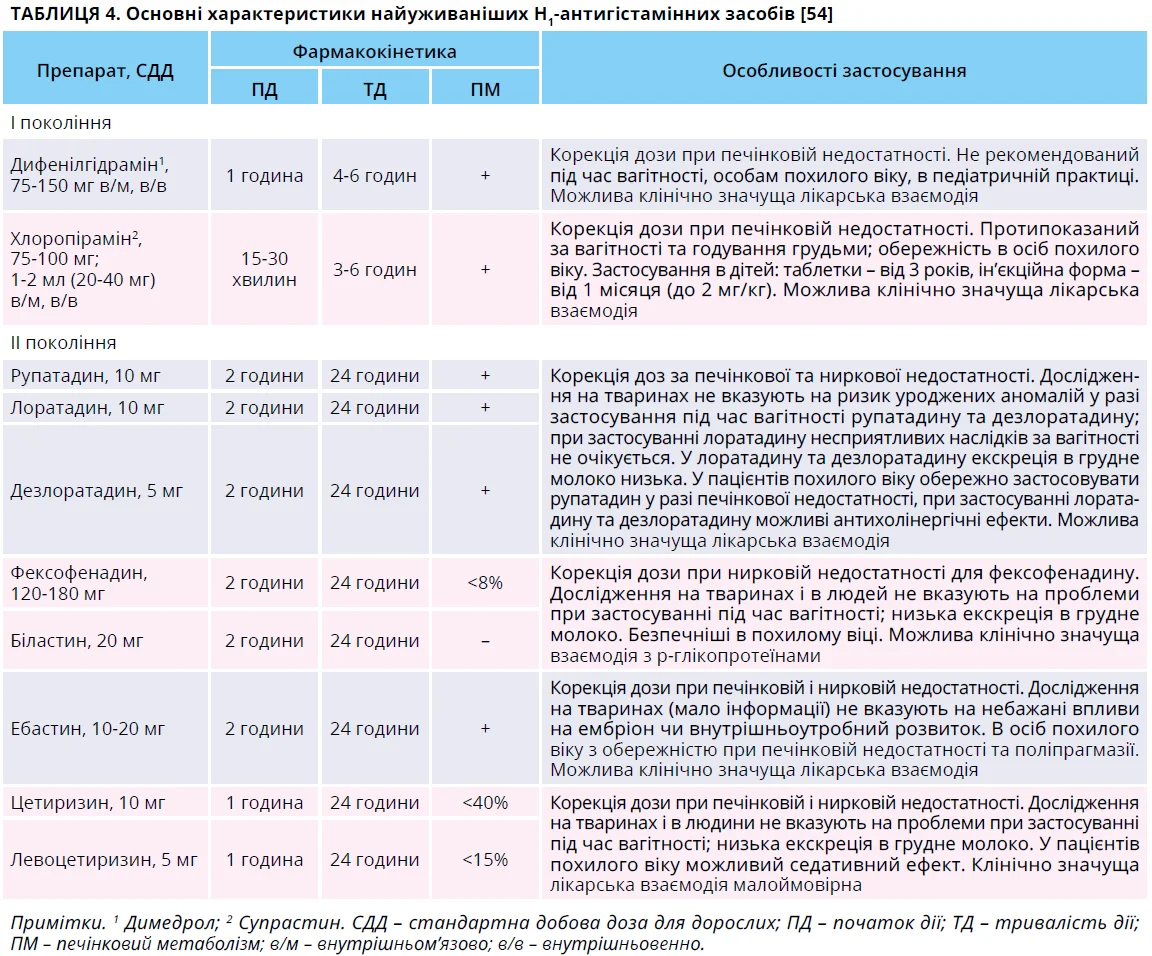
Згідно з настановами EAACI/GA2LEN/EuroGuiDerm/APAAACI стандартним лікуванням І лінії ХК є неседативні або мінімально седативні антигістамінні засоби другого покоління (АГЗ ІІ). Антигістамінні засоби першого покоління (АГЗ І) не рекомендуються через виражені седативний і антихолінергічний ефекти, взаємодію з алкоголем та іншими лікарськими засобами. Якщо стандартної дози АГЗ ІІ недостатньо для контролю симптомів, рекомендується збільшення дози до 4 разів [1].
Омалізумаб – моноклональне антитіло проти IgE, що рекомендують як додаткову терапію до АГЗ ІІ для дорослих і підлітків (≥12 років) з ХСК та неадекватною відповіддю на АГЗ. Рекомендована початкова доза – 300 мг що 4 тижні підшкірно [1]. У 2021 р.
Управління США з контролю продовольства та медикаментів (FDA) дозволило самостійний прийом омалізумабу після принаймні 3 доз під наглядом лікаря пацієнтам з ХСК за відсутності анафілаксії або реакцій гіперчутливості в анамнезі [35]. Існують надійні клінічні та реальні докази, що підтверджують ефективність і безпеку омалізумабу в лікуванні ХСК та різних видів ХІК. Омалізумаб запобігає розвитку АН, помітно покращує якість життя, підходить для тривалого застосування й ефективний у разі рецидиву хвороби після припинення лікування [36-44].
За відсутності контролю на тлі терапії АГЗ ІІ й омалізумабом до 6 місяців рекомендовано імуносупресант циклоспорин А в дозі 3,5-5 мг/кг/добу як доповнення до АГЗ ІІ [1]. Ефективність циклоспорину для лікування ХСК продемонстровано в клінічних випробуваннях і реальній практиці [45].
Короткий курс системних кортикостероїдів включено до рекомендацій щодо швидкого контролю тяжких загострень ХК – до 10 днів у мінімально ефективній дозі через серйозні побічні ефекти на тлі тривалого лікування. За можливості рекомендується уникати призначення кортикостероїдів [1].
Альтернативні варіанти лікування, що можуть виявитися ефективними в окремих випадках, включають азатіоприн, гідроксихлорохін, мікофенолату мофетил, метотрексат, дапсон, фототерапію; їх слід використовувати з обережністю через відсутність доказів [1].
Новітні методи лікування
Глибше вивчення патогенезу сприяло відкриттю понад 10 молекул таргетної терапії, які нині проходять клінічні випробування в пацієнтів з резистентною ХСК [46]. Таргетна терапія спрямована на пригнічення мастоцитів через вплив на інгібіторні рецептори або на зменшення кількості тучних клітин [1]. Зокрема, ремібрутиніб націлений на тирозинкіназу Брутона, яка передає сигнали FcεRI та B-клітинного рецептора, тобто контролює FcεRI-опосередковану активацію мастоцитів і утворення автоантитіл B-клітинами [2, 46, 47]. Ремібрутиніб пройшов дослідження II фази за участю 311 пацієнтів з ХСК, рефрактерних до АГЗ ІІ, продемонструвавши високу ефективність порівняно з плацебо; більшість побічних явищ були легкого-середнього ступеня тяжкості [48]. Мішенню барзолволімабу є KIT – рецептор клітинної поверхні, присутній на мастоцитах, що має потенціал зменшення їх кількості та/або пригнічення диференціації [47, 49]. Барзолволімаб продемонстрував сприятливий профіль безпеки та клінічну активність у I фазі дослідження багаторазових, щоразу більших доз у дорослих з помірною-тяжкою ХСК, рефрактерною до АГЗ ІІ [50]. Важливу роль у патогенезі ХСК відіграють запальні цитокіни ІЛ-4 й ІЛ-13, здатні активувати мастоцити, базофіли й еозинофіли. Дупілумаб – моноклональне антитіло, яке блокує рецептор ІЛ-4Rα, запобігаючи передачі сигналів IЛ-4 й IЛ-13, пройшов два рандомізовані плацебо-контрольовані дослідження III фази в пацієнтів з ХСК [51].
Можливі виклики на етапі лікування
Недотримання рекомендацій
Для досягнення оптимальних результатів украй важливо дотримуватися настанов, що не завжди виконується в реальній клінічній практиці [2]. Зокрема, проведене у 2017 р. глобальне опитування лікарів (n=1140, більшість – алергологи / клінічні імунологи) виявило, що майже третина лікарів не дотримується настанов або відхиляється від рекомендацій. Фахівці, які дотримувалися рекомендацій, частіше використовували АГЗ ІІ як терапію І лінії (64 проти 36%) і вказували на їхню ефективність порівняно з лікарями, які не дотримувалися рекомендацій [52]. Інше дослідження, проведене у Великій Британії, показало значну розбіжність між різними фахівцями щодо настанов, які вони використовують для ведення пацієнтів з ХК та відмінності в застосуванні АГЗ І [53].
Проблеми, пов’язані з використанням АГЗ
Основним медіатором, що вивільняється під час активації мастоцитів, є гістамін, який може мати прозапальну або протизапальну дію залежно від зв’язування з певним гістаміновим рецептором (Н1, Н2, Н3, Н4). Н1-рецептори відповідають за захисну й імунорегуляторну дії гістаміну, а також за гострі та хронічні алергічні запалення. Їх експресія широко представлена в організмі: нерви, ендотелій, гладкі м’язи судин, респіраторний епітелій, печінка, дендритні клітини та лімфоцити. Зв’язування гістаміну з Н1-рецепторами на дрібних венулах зумовлює утворення набрякових еритематозних пухирів (кропив’янки) або АН унаслідок розширення та підвищення проникності судин, що спричиняє витік плазми в інтерстицій. Окрім того, гістамін індукує стимуляцію сенсорних нервів, що призводить до свербіння, а також залучення еозинофілів, базофілів, нейтрофілів та інших імунних клітин, які інфільтрують пухирі [54].
Термін «антигістамінний засіб» стосується лише препаратів, які діють на Н1-рецептори; антагоністи інших гістамінових рецепторів не є АГЗ. Фактично АГЗ – це зворотні агоністи конституційно активних H1-рецепторів, здатні знижувати активність гістаміну в Н1-рецепторах і антагонізувати його впливи шляхом стабілізації Н1-рецептора в неактивній конформації. Тому їх називають «H1-АГЗ», а не «антагоністами гістаміну» [54].
АГЗ усувають місцеву вазодилатацію та зменшують спричинену гістаміном проникність судин, що усуває місцевий набряк. Окрім блокування дії гістаміну на рецептори дрібних судин і сенсорних нейронів, АГЗ опосередковано зменшують алергічне запалення, пригнічуючи накопичення запальних клітин у тканинах й імунну відповідь на антигени, впливаючи на ядерний фактор κB та кальцієві канали [54].
Селективність АГЗ І до Н1-рецепторів низька; вони мають спорідненість до мускаринових, серотонінергічних і α-адренорецепторів, а також до калієвих каналів серця, що призводить до низки побічних ефектів: запор, сухість у роті, розмитість зору.
При передозуванні АГЗ І, зокрема дифенгідраміну, можливі антихолінергічні ефекти: лихоманка, припливи, тахікардія, гіпотензія, судоми, сонливість, марення, розширення зіниць, затримка сечі, пригнічення дихання та кома [54]. Через ліпофільність АГЗ І проникають крізь гематоенцефалічний бар’єр і потенційно здатні пригнічувати центральну нервову систему, спричиняючи психомоторні розлади, сонливість, коматозний стан або навіть смерть.
Але частіше їх застосування асоціюється із седативним ефектом, тому нерідко їх називають седативними АГЗ. Натомість АГЗ ІІ мають більшу селективність до H1-рецепторів і позбавлені вказаних побічних ефектів [54].
Іншою важливою проблемою при застосуванні АГЗ І є кардіотоксичність, особливо при передозуванні або прийманні високих доз [65]. До групи високого ризику належать особи похилого віку, пацієнти з поліморбідністю та поліпрагмазією. Найчастіше кардіотоксичність зумовлена блокадою потенціалозалежних Kþ-каналів hERG (Kv11.1), що призводить до подовження інтервалу QT і небезпечних для життя аритмій [66]. На сьогодні немає повідомлень щодо клінічно значущих кардіотоксичних ефектів АГЗ ІІ, вказаних у таблиці 4, навіть у разі застосування вищих доз [66].
Численні рандомізовані контрольовані дослідження (РКД) забезпечили надійну доказову базу щодо використання АГЗ ІІ при ХК: ефективність не поступається або перевищує АГЗ І, але седативна дія та ризик інших побічних ефектів значно нижчі через вищу селективність до Н1-рецепторів і обмежене проникнення в мозок. Окрім того, суттєво довший період напіввиведення АГЗ ІІ (табл. 4) забезпечує можливість дозування 1 раз на добу, що покращує прихильність до лікування [54].
Отже, АГЗ ІІ є препаратами першого вибору при кропив’янці. Лікування проводиться за принципом «стільки, скільки потрібно, але якнайменше» з урахуванням активності та контролю хвороби. Мета – безперервне й безпечне лікування з повним контролем симптомів і стійкою нульовою активністю хвороби [54].
Чи вказує це на потребу цілковитої відмови від використання АГЗ І у клінічній практиці? АН, опосередкований мастоцитами, є набагато поширенішим за інші варіанти – опосередкований брадикініном або спадковий АН. Підозра на спадковий АН має виникати, коли пацієнти повідомляють про будь-яку з таких ознак: 1) позитивний сімейний анамнез; 2) поява симптомів у дитинстві / підлітковому віці; 3) періодичні больові абдомінальні симптоми; 4) поява набряку верхніх дихальних шляхів; 5) відсутність реакції на АГЗ, кортикостероїди, омалізумаб або адреналін; 6) наявність продромальних ознак або симптомів перед набряками; 7) відсутність пухирів [55]. Виникнення АН на обличчі (язик, глотка, гортань) становить ризик для життя [56]. Тому, якщо анамнез не відповідає спадковому АН, показано негайну терапію, яка включає АГЗ, за потреби адреналін і кортикостероїд [55]. Саме в таких випадках короткочасне використання АГЗ І цілком виправдане, зважаючи на швидкість дії та наявність ін’єкційних форм (табл. 4). На сьогодні немає РКД щодо ефективності застосування АГЗ при АН і анафілаксії [57, 58]. Знайдено лише одне ретроспективне дослідження за участю 146 пацієнтів, які відповідали критеріям NIAID/FAAN для діагностики анафілаксії. Пацієнти експериментальної групи (n=62) отримували комбінацію АГЗ I хлоропіраміну та Н2-блокатора ранітидину, пацієнти групи контролю (n=84) – тільки хлоропірамін. Наприкінці догоспітального лікування анафілаксії в пацієнтів експериментальної групи зафіксовано вищі показники діастолічного тиску та нижчі – частоти серцевих скорочень (обидва p<0,001). Наприкінці лікування в експериментальній групі спостерігалося достовірне підвищення середнього артеріального тиску порівняно з початковими значеннями. Час зникнення шкірної кропив’янки та свербіння в експериментальній групі був на 18 хвилин коротшим, аніж у групі контролю (41±14 проти 59±25 хвилин). Автори дійшли висновку, що, хоча комбінація хлоропіраміну й ранітидину не є потенційно рятівним варіантом лікування анафілаксії, позитивні серцево-судинні ефекти та швидше зникнення шкірних симптомів виправдовують її застосування як додаткової терапії не загрозливої для життя анафілаксії; існує нагальна потреба масштабних РКД для встановлення найбільш відповідного моменту призначення комбінації H1-АГЗ та H2-блокаторів у лікуванні анафілаксії й оцінювання їх внеску в терапевтичні результати [59].
Крім того, деякі національні настанови пропонують використання АГЗ І як терапії ІІ лінії, про що йтиметься нижче [60, 61].
Резистентність до АГЗ
Від третини до двох третин пацієнтів з ХК не відповідають на стандартні дози АГЗ ІІ [62-64]. За відсутності лікування або адекватного контролю ХК негативно впливає на якість життя, емоційний добробут, повсякденну діяльність, якість сну та продуктивність пацієнтів [4]. Окрім того, ХК асоціюється зі значними прямими та непрямими витратами, включаючи відвідування закладів охорони здоров’я, потребу невідкладної допомоги та нижчу продуктивність праці [4, 67].
Якщо міжнародна настанова EAACI/GA2LEN/EuroGuiDerm/APAAACI та низка національних настанов підтримують застосування стандартних доз АГЗ ІІ як терапії І лінії, то в рекомендаціях щодо терапії ІІ лінії є певні розбіжності [1, 60, 61, 68, 69]. Міжнародна настанова пропонує збільшення дози АГЗ ІІ до 4 разів і не підтримує комбіновану терапію різними АГЗ ІІ через відсутність переваг [1]. Стратегію збільшення дози випробувано для всіх АГЗ ІІ, вказаних у таблиці 4 [70]. Натомість американські настанови окреслюють 5 різних варіантів терапії ІІ лінії, які можна застосовувати окремо або в комбінації: збільшення дози попереднього АГЗ ІІ; додавання іншого АГЗ ІІ, або H2-блокатора, або антагоніста лейкотрієнових рецепторів, або АГЗ І перед сном [60]. Турецькі настанови пропонують перейти на інший АГЗ ІІ, китайські – рекомендують 4-разове збільшення дози АГЗ ІІ або додавання АГЗ ІІ чи АГЗ І [61, 69].
Єдине РКД, в якому прямо порівнювали комбінацію АГЗ ІІ та збільшення дози АГЗ ІІ, включало 234 пацієнтів з ХК, яких рандомізовано на дві групи. Пацієнти експериментальної групи приймали стандартні дози левоцетиризину й ебастину, пацієнти контрольної – отримували левоцетиризин. Установлено значно кращу клінічну ефективність лікування в експериментальній групі порівняно з групою контролю; крім того, після лікування в експериментальній групі відзначено більш значуще зниження сироваткових біомаркерів – фактора некрозу пухлин-α, ІЛ-6 та ІЛ-10 [71].
Нещодавнє багатоцентрове експериментальне дослідження в реальному житті порівнювало клінічну ефективність і безпеку лікування ХСК ІІ лінії згідно з міжнародними й американськими рекомендаціями. Дослідження тривало 52 тижні та включало 169 пацієнтів. Порівнювалися такі режими: 2-разова та 4-разова дози АГЗ ІІ; еквівалентні дози комбінації АГЗ ІІ; 4-разова доза АГЗ ІІ + H2-блокатор або антагоніст лейкотрієнових рецепторів; еквівалентна доза комбінації АГЗ ІІ + H2-блокатор або антагоніст лейкотрієнових рецепторів. Ефективність і безпеку продемонстрували як група підвищених доз АГЗ ІІ, так і група комбінації АГЗ ІІ. На 52-му тижні не було суттєвих відмінностей між групами підвищення дози та комбінованої терапії за такими показниками: 1) частота повної ремісії після терапії (відсутність симптомів принаймні 4 тижні без лікування); 2) частота повної ремісії під час терапії (відсутність симптомів у пацієнтів, які приймають ліки); 3) частота обох «станів ремісії». За відсутності статистичних переваг частота відповіді в групі 2-разової дози АГЗ ІІ була дещо вищою, ніж у групі 2-разової комбінації різних АГЗ ІІ (18,3 проти 14,8% відповідно) [72].
У нещодавньому ретроспективному дослідженні за участю 657 пацієнтів з ХК (556 – із ХСК та 101 – із ХІК) у контексті терапії ІІ лінії показано дещо вищу частоту ремісії при застосуванні режиму 2-разової дози АГЗ ІІ порівняно з групою 2-разової комбінації різних АГЗ ІІ (46,3 проти 35,8%), хоча відмінності не були статистично значущими; що стосується 4-разової дози АГЗ ІІ, то рівень ремісії в цій групі виявився найменшим (29,4%). Коли групи з 2-разовим і 4-разовим дозуванням АГЗ ІІ об’єднали в одну групу та порівняли з групою, яка отримувала 2-разову комбінацію різних АГЗ ІІ, та групою, яка отримувала стандартну дозу АГЗ ІІ + АГЗ І, частота ремісії становила, відповідно, 38,3; 35,8 та 37,5% [62]. Інше нещодавнє рандомізоване відкрите дослідження порівнювало два режими лікування ХК ІІ лінії: 4-разову дозу АГЗ ІІ та комбінацію 4 різних АГЗ ІІ. Після 4 тижнів лікування статус контролю кропив’янки за оцінкою спеціалістів класифікували як «добре контрольований», «частково контрольований» або «неконтрольований». Частка «добре контрольованих» пацієнтів у групі 4-разової дози АГЗ ІІ була дещо вищою, але не статистично значущою – 57,7 проти 46,4% у групі комбінації 4 різних АГЗ ІІ (p=0,616). Проте частка пацієнтів з нульовим показником активності за шкалою UAS7 істотно переважала в групі 4-разової дози АГЗ ІІ – 40 проти 10,7% у групі комбінованої терапії (p=0,030). Різниці в частоті побічних реакцій між двома групами лікування не виявлено [73].
Докази щодо частоти відповіді на вищі дози АГЗ ІІ дуже різняться. Систематичний огляд з метааналізом повідомляє про ремісію в 63% випадків [63]. За даними інших досліджень, хвороба залишається неконтрольованою у 18-70% пацієнтів [64, 74, 75]. За даними глобального проспективного дослідження AWARE (A World-wide Antihistamine-Refractory chronic urticaria patient Evaluation), 42% пацієнтів з неконтрольованою ХК після підвищеної дози АГЗ ІІ не отримували подальшої інтенсифікації до терапії ІІІ лінії [64].
Через відсутність добре спланованих клінічних випробувань, які порівнювали б ефективність і безпеку всіх сучасних АГЗ ІІ при кропив’янці, настанови EAACI/WAO/GA2LEN не надають рекомендацій щодо вибору АГЗ ІІ. Тому клініцисти здійснюють вибірз огляду на власний досвід. Оскільки АГЗ ІІ все ж різняться за ступенем спорідненості до рецепторів, фармакокінетикою й особливістю застосування в певних підгрупах (табл. 4), ці нюанси обов’язково треба враховувати в кожному окремому випадку.
Заслуговує на увагу препарат левоцетиризин – покращена версія цетиризину, тобто активний лівообертальний енантіомер з удвічі вищою спорідненістю до H1-рецептора та в 600 разів вищою спорідненістю до Н1-рецепторів порівняно з рецепторами інших типів – холінергічних, мускаринових, серотонінових [76]. Низький ступінь метаболізму забезпечує лінійну фармакокінетику препарату, не залежну від дози й часу прийому, та відсутність клінічно значущої взаємодії з іншими препаратами, що є особливо цінним у пацієнтів з поліморбідністю та в осіб похилого віку (табл. 4). Левоцетиризин не посилює ефекту алкоголю, а також удвічі рідше спричиняє підвищення активності печінкових ферментів порівняно з цетиризином [77]. Після гострого та підгострого призначення левоцетиризину в дозі 5 мг не спостерігалося погіршення пам’яті, концентрації уваги та моторних функцій, на відміну від дифенгідраміну в дозі 50 мг [78]. Висока біодоступність зумовлює швидкий початок дії та значну тривалість антигістамінного ефекту, а високе зв’язування з білками плазми – низький об’єм розподілу препарату [78]. Початок дії левоцетиризину настає через 1 годину, що вдвічі швидше порівняно з іншими АГЗ ІІ (табл. 4). Дослідження в дітей з атопічними хворобами вказує, що профіль безпеки левоцетиризину відповідає такому плацебо [79]. У терапевтичній (5 мг) і супратерапевтичній (30 мг) дозах левоцетиризин не подовжував фактичний і корегований інтервали QT, у зв’язку з чим слугував еталоном відсутності впливу на тривалість QT у методологічних дослідженнях [80]. Левоцетиризин – один з найуживаніших препаратів для лікування ХСК [54]. Його переваги в стандартних дозах щодо ефективності та безпеки встановлено над кількома АГЗ – олопатадином, лоратадином і дезлоратадином [81-83]. Нещодавно опубліковано результати дослідження, котре вивчало ефективність левоцетиризину в 92 пацієнтів з ХК і його вплив на рівні загального IgE та факторів запалення в сироватці крові. Пацієнти були рандомізовані на дві групи: в експериментальній групі застосовували левоцетиризин, у групі контролю – дезлоратадин. Порівняльний аналіз включав клінічні результати лікування, оцінку симптомів, субпопуляцій Т-лімфоцитів, рівні загального IgE та запальних маркерів у сироватці крові, побічні реакції. В експериментальній групі виявлено вищу загальну ефективність лікування (97,8 проти 82,6% у групі контролю; p<0,05), вищі рівні CD3+, CD4+, CD4+/CD8+ та інтерферону-γ (p<0,05), але нижчі рівні IgE, IЛ-4 й IЛ-13 (p<0,05). Автори дійшли висновку, що при ХК левоцетиризин забезпечує значніший клінічний ефект, аніж дезлоратадин, а також знижує рівні факторів запалення та пом’якшує імунну дисфункцію [84]. Ефективність і безпеку високих доз левоцетиризину вивчено в пацієнтів з резистентною ХК: 80 пацієнтів віком 19-67 років рандомізували до подвійного сліпого лікування левоцетиризином (n=40) або дезлоратадином (n=40). Лікування починали зі звичайних добових доз 5 мг, які щотижня збільшували до 10, 20 мг або 20 мг протилежного препарату за відсутності покращення. Оцінювали кропив’янку, свербіж, якість життя, дискомфорт пацієнта, сонливість і безпеку. У 13 пацієнтів зникнення симптомів забезпечили дози 5 мг (левоцетиризин – 9, дезлоратадин – 4). Із 28 пацієнтів, які не реагували на 20 мг дезлоратадину, в 7 симптоми зникли після 20 мг левоцетиризину. Жоден з 18 пацієнтів, які не відповіли на левоцетиризин, не отримав користі від 20 мг дезлоратадину. Збільшення доз не посилювало сонливість і покращувало якість життя. Побічних ефектів, які потребували би припинення лікування, не спостерігалося [85].
Цікаво, що пацієнти з ХК мають не лише різну відповідь на АГЗ, але й різну схильність до побічних ефектів [86]. Значною мірою це пояснюється генетичними змінами та є предметом вивчення фармакогеноміки – галузі, яка вивчає зв’язки між генетикою пацієнта та відповіддю на ліки. З відповіддю на АГЗ при ХК пов’язано декілька генетичних поліморфізмів, що впливають на метаболізм ліків (активність ферментів), транспортування ліків і активність цільових рецепторів [87]. Зокрема, до генетичних варіацій дуже чутлива ферментна система цитохрому P450 (CYP), відповідальна за метаболізм АГЗ у печінці. Варто зауважити, що левоцетиризин не є інгібітором ферментів CYP 1A2, 2C9, 2C19, 2A1, 2D6, 2E1, 3A4 або індуктором CYP 1A2, 2C9, 3A4, UGT1A1. Оскільки в організмі людини метаболізується <14% прийнятої дози левоцетиризину, ймовірність впливу генетичних поліморфізмів на фармакокінетику препарату або вживання інгібіторів ферментів, що метаболізують цей препарат, украй низька.
Біомаркери відповіді на АГЗ при кропив’янці
Зважаючи на резистентність до АГЗ у значної частки пацієнтів і негативний вплив неконтрольованої ХК на якість життя, виникає критична потреба пошуку специфічних біомаркерів для прогнозування відповіді на АГЗ, що сприятиме проактивному корегуванню стратегій лікування.
Нещодавній систематичний огляд проаналізував різні предиктори відповіді на лікування ХСК. На відсутність або погану відповідь на АГЗ ІІ вказують: висока оцінка активності кропив’янки за шкалою UAS7, підвищені рівні СРБ або D-димеру (сильні докази); попереднє лікування кортикостероїдами, супутня ХІК і нижчі показники за анкетою CU-Q2oL (слабкі докази); супутні алергічні хвороби, наявність АН, позитивний результат автологічної сироваткової шкірної проби (ASST), низька кількість еозинофілів у крові, позитивні антитиреоїдні антитіла, підвищення ШОЕ (суперечливі докази). Отримано сильні докази щодо відсутності зв’язку між відповіддю на АГЗ та віком, статтю, тривалістю хвороби й рівнем C4 у сироватці крові [88].
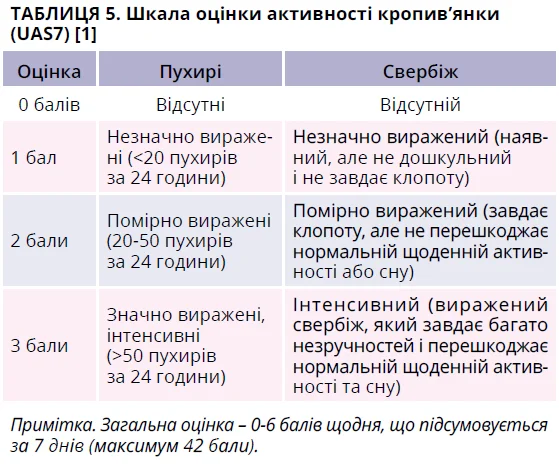
Одним із предикторів є шкала UAS7, рекомендована міжнародними настановами як інструмент визначення активності хвороби на підставі двох основних ознак кропив’янки – кількість пухирів та інтенсивність свербіння, котрі щоденно оцінюються пацієнтом упродовж 7 днів (табл. 5) [1]. За даними проспективного дослідження (n=283), високі показники UAS7 були предиктором поганої відповіді на лікування АГЗ ІІ (відношення шансів 1,023; p=0,024) [89]. Цей висновок підтверджено іншим масштабним дослідженням (n=549), яке продемонструвало значно вищі початкові показники UAS7 у рефрактерних пацієнтів порівняно з групою, котра відповіла на лікування (p=0,035) [90].
Підвищені рівні запального маркера СРБ спостерігаються принаймні в третини пацієнтів з ХСК [54]. Три ретроспективні дослідження з великим розміром вибірки продемонстрували, що в пацієнтів з поганою або відсутньою відповіддю на АГЗ ІІ частіше підвищені рівні СРБ. Зокрема, серед 1019 пацієнтів з ХСК рівні СРБ ≥5 мг/л виявлено в 313 пацієнтів (31%), значно частіше в рефрактерних до терапії АГЗ ІІ (p<0,001 порівняно з чутливими до АГЗ ІІ) [91]. Крім того, підвищені рівні СРБ асоціювалися з позитивним результатом ASST, високою активністю кропив’янки, підвищеними рівнями маркерів запалення та коагуляції [92].
Роль D-димеру в патогенезі ХСК підозрювалася давно, а згодом була підтверджена різними дослідженнями. Активація шляху зсідання пов’язана із тканинним фактором, який експресується еозинофілами [93]. Активація еозинофільними білками шляху коагуляції призводить до утворення тромбіну та дегрануляції мастоцитів [94]. Підвищені рівні D-димеру асоціювалися з тяжчою хворобою та зниженою реакцією на АГЗ, що спонукало вивчення варіантів лікування транексамовою кислотою й гепарином до появи лікування анти-IgE [95]. Тяжкі загострення ХК асоціюються із сильною активацією коагуляційного каскаду та фібринолізу [96]. У нещодавніх дослідженнях отримано чіткі докази, що рівні D-димеру статистично вищі серед пацієнтів, рефрактерних до АГЗ ІІ [92, 97]. Крім того, вищі рівні D-димеру виявляють у пацієнтів із супутнім автоімунними хворобами та/або автоантитілами, зокрема анти-ТПО [98].
Як відомо, ХІК може бути окремою хворобою або супутньою ознакою ХСК. За даними дослідження AWARE, їх поєднання поширеніше серед пацієнтів, рефрактерних до АГЗ ІІ [99]. Поєднання ХСК та ХІК потребувало частішого лікування після 5 років або вищих доз АГЗ ІІ [62, 90, 100].
Серед пацієнтів з ХІК, резистентних до АГЗ, значно вища частка підвищення анти-ТПО, ніж у пацієнтів, які відповідають на терапію. У цьому самому дослідженні виявлено інші чинники ризику резистентності до АГЗ: контрольний тест на кропив’янку (UCT) ≤4 (p<0,001), ургентна госпіталізація (p=0,002) та сімейний анамнез ХСК (p=0,008) [62].
Проблеми, пов’язані з терапією ІІІ-IV лінії
Дані дослідження AWARE за участю 2727 пацієнтів з ХСК вказують, що омалізумабом лікується лише третина пацієнтів протягом перших 2 років після встановлення діагнозу [64]. Одними з пояснень є обмежена доступність і висока вартість. Лікування омалізумабом потребує моніторингу анафілаксії (попередження FDA про чорну скриньку), що зазвичай виникає протягом перших 3 доз омалізумабу. Анафілаксія спостерігалася в 0,1% пацієнтів з астмою в клінічних дослідженнях і приблизно в 0,2% пацієнтів згідно з постмаркетинговими даними. Повідомлень про анафілаксію в пацієнтів з ХСК під час III фази клінічних досліджень не було [38, 39, 101].
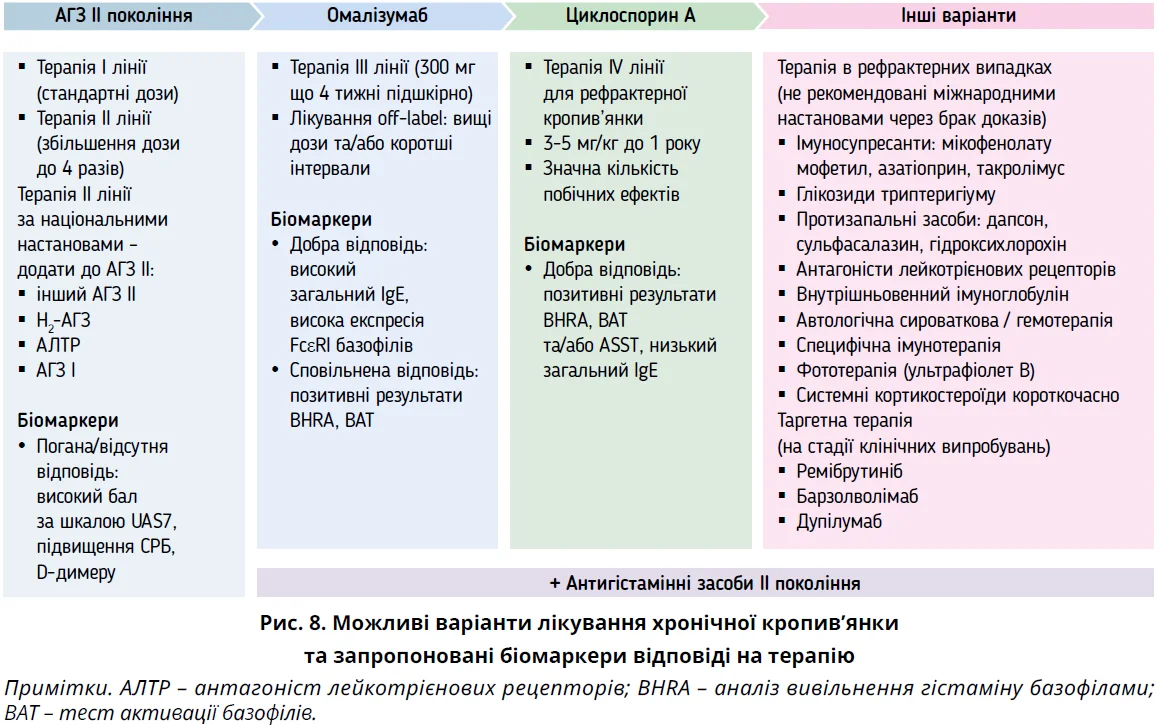
Дослідження в реальній практиці, проведене Пекінським довідковим центром із кропив’янки (UCARE), продемонструвало, що 75,3% пацієнтів з ХК досягли повної відповіді на терапію омалізумабом, іще 14,6% мали часткову відповідь [102]. Отже, 10,1% пацієнтів не відповідають на лікування омалізумабом. Запропоновано прогностичні маркери відповіді на омалізумаб (рис. 8), хоча результати суперечливі [103-105].
Що стосується терапії циклоспорином А, то ретроспективний аналіз (n=110) показав, що в пацієнтів, які відповідали на терапію, частіше спостерігалися ознаки автоімунної кропив’янки типу 2b: позитивний автологічний сироватковий шкірний тест, низький загальний IgE та позитивні антитіла до ТПО, порівняно з пацієнтами, які відповідали на омалізумаб (рис. 8) [106]. Використання циклоспорину не можна рекомендувати як стандартне лікування через високу частоту побічних ефектів [1]. Зокрема, при застосуванні вищих доз у 20-30% випадків повідомляли про гіпертензію, периферичну нейропатію, азотемію [107]. Кропив’янка не належить до основних показань для призначення циклоспорину А, тому його застосування рекомендується лише пацієнтам з тяжким перебігом, рефрактерним до будь-яких доз комбінації АГП й омалізумабу. З іншого боку, циклоспорин А має набагато кращий показник ризик/користь порівняно з тривалим застосуванням кортикостероїдів [1].
Висновки
Діагностика ХК ґрунтується на докладному анамнезі й окремих лабораторних тестах, але періодичність симптомів і недостатня обізнаність про хворобу призводять до тривалих затримок установлення діагнозу та початку лікування. За відсутності адекватного контролю ХК значно погіршує якість життя, повсякденну діяльність і асоціюється зі значними витратами; супутній АН може становити загрозу для життя. Лікування ХК ґрунтується на поетапному підході відповідно до тяжкості хвороби та відповіді на лікування. Терапією І лінії є АГЗ ІІ через кращі профілі ефективності та безпеки порівняно з АГЗ І. Левоцетиризин – один з найуживаніших АГЗ ІІ у пацієнтів з ХК, що характеризується високою ефективністю, відмінним профілем безпеки, зручністю використання та низькою ймовірністю лікарських взаємодій. АГЗ І, зокрема хлоропірамін, можна розглянути в окремих випадках для контролю симптомів, зважаючи на швидкість дії та можливість парентерального введення, або як один з компонентів терапії ІІ лінії. За відсутності адекватної відповіді на АГЗ подальше лікування має ґрунтуватися на доказах, але бути персоніфікованим залежно від тяжкості й ендотипу хвороби, предикторів відповіді на терапію, індивідуальних характеристик пацієнта, супутніх захворювань і фармакологічних особливостей рекомендованих препаратів.
Отже, лікарі України мають можливість використовувати для лікування своїх пацієнтів сучасні АГЗ ІІ, зокрема левоцетиризин, а за наявності відповідних показань – й АГЗ І.
Список літератури – в редакції.