Холодова кропив’янка: сучасне розуміння, принципи діагностики та лікування
Підготувала канд. мед. наук Ольга Королюк
Холодова кропив’янка (ХК) – друга за поширеністю форма хронічної індукованої кропив’янки, що характеризується появою сверблячих пухирів з ангіоневротичним набряком або без нього внаслідок вивільнення лейкотрієнів, гістаміну та прозапальних медіаторів мастоцитів після впливу на шкіру холоду (повітря, рідини або предметів). Зазвичай перебіг хвороби самообмежений із середньою тривалістю симптомів 4-6 років. Через ризик анафілаксії може становити загрозу для життя [1]. Описано атипові випадки ХК, коли важко встановити правильний діагноз [2].
Перша згадка в літературі датується 1663 роком, коли описано появу висипу на шкірі людини після прогулянки парком у холодний лютневий день [3]. Докладніший опис ХК зробив австрійський лікар J.P. Frank у своїй книжці «De curandis hominum morbis epitome» 1792 року. У 1860-х роках опубліковано серію повідомлень про випадки кропив’янки з набряком шкіри та проявами шоку після впливу холоду або споживання холодних напоїв. Цікаво, що Behier описав власні симптоми кропив’янки та непритомності після купання в холодній воді [4]. W.W. Duke вперше відніс гіперчутливість до холоду до алергій, спричинених впливом фізичних агентів. У 1936 році В.Т. Horton, G.E. Brown і G.М. Roth опублікували огляд 76 випадків гіперчутливості до холоду, знайдених у тогочасній літературі, та відзначили зв’язок небезпечних для життя шокових реакцій із перебуванням у холодній воді [3, 4]. Перша публікація про родинні випадки ХК датується 1928 роком. Її автори, W. Jadassohn та E. Schaaf, описують уртикарний висип на обличчі та руках у брата й сестри після впливу холоду. У 1935 році з’являється публікація J.L. Kobacker і H.J. Parkhurst про трьох сестер, які одночасно перехворіли на кір, а незабаром після одужання в них почали з’являтися локалізовані прояви кропив’янки після контакту з холодними предметами, які поступово зменшувалися й до 1 року цілковито зникли [3].
Визначення
ХК – це форма індукованої кропив’янки, за якої вплив низьких температур (повітря, рідини або твердих поверхонь) може спричинити швидку появу пухирів, та/або ангіоневротичного набряку, та/або системних реакцій із великою варіабель-ністю клінічних проявів [5].
Класифікація
Типова ХК характеризується появою пласких припіднятих блідо-рожевих або червонуватих пухирів після впливу холоду, які переважно виникають при зігріванні та зникають упродовж 1 години. Висип зазвичай з’являється під час проведення провокаційного тесту зі стимуляцією холодом (ПТСХ) [6].
Атипова ХК характеризується атиповим висипом або реакціями у відповідь на холод та/або потребою проведення атипових ПТСХ (табл. 1). До атипових форм відносять системну ХК, локалізовану ХК, локалізовану холодову рефлекторну кропив’янку, пізню ХК, холінергічну кропив’янку, спричинену холодом, і холодозалежний дермографізм [4, 7-17].
Існує також етіологічна класифікація, котра поділяє кропив’янку на первинну (ідіопатичну) та вторинну, яка виникає внаслідок певних впливів (табл. 2) [18, 19]. Проте докази причинно-наслідкових зв’язків цих станів із ХК доволі слабкі.
Епідеміологія
За оцінками, захворюваність на ХК становить 0,05%, показники вищі в країнах із холодним кліматом. Трапляється в чоловіків і жінок, але жінки хворіють частіше [1]. Перші прояви хвороби можуть виникати в будь-якому віці, але здебільшого впродовж другої-четвертої декади життя [1, 8, 20, 21].
Етіологія й патогенез
Активація та дегрануляція тучних клітин призводять до розвитку ознак і симптомів кропив’янки внаслідок вивільнення гістаміну й інших медіаторів, які активують чутливі шкірні нерви (свербіж), розширюють кровоносні судини шкіри (еритема), зумовлюють витік плазми за межі судин (набряк, приплив інших імунних клітин) [22]. Точні причини ХК невідомі. Патогенетичні механізми доволі складні (рис. 1) та мало вивчені. Як потенційні механізми на сьогодні розглядають автоалергію, автоімунні стани, нейрогенні шляхи й аномальну температурну чутливість [22].
Вплив холоду може призвести до утворення автоантигенів de novo, здатних індукувати IgE-опосередковану відповідь. Згодом у сенсибілізованих осіб виникає IgE-залежна дегрануляція тучних клітин із появою кропив’янки [23]. Проте поки що немає прямих доказів на підтримку цієї теорії, оскільки холодозалежних шкірних антигенів не виявлено. Непрямі докази цієї теорії підсумовано в таблиці 3 [24-26].
Хоча початкові події, що перетворюють холодовий стимул на послідовність молекулярно-клітинних змін шкіри, достеменно не відомі, патологічний процес може бути імунологічно опосередкованим, зважаючи на можливість пасивного переносу імуноглобулінів (Ig) класів E та G у 10-50% пацієнтів [24, 27].
Можлива також патогенетична роль автоімунних процесів типу IIb, спрямованих на тучні клітини, з активацією автоантитіл. У пацієнтів із ХК описано появу антитіл до IgE, які належали до класів IgG та/або IgМ [28].
Обговорюється роль автореактивності шкіри й активності вивільнення гістаміну. З’ясовано, що сироватки крові пацієнтів із ХК й автореактивністю шкіри, встановленою на підставі позитивного тесту ASST, по-різному вивільняють гістамін із базофілів здорових донорів без будь-якої кореляції з анти-IgE-гістаміновим рецептором. Це вказує на наявність циркулювальних гістаміновивільняльних факторів, які активуються за температури тіла [29].
Інші питання стосуються механізмів дегрануляції дермальних тучних клітин, що відіграють важливу роль у виникненні ангіоневротичного набряку. Вивільнення гістаміну при ХК досягає максимуму впродовж декількох хвилин після впливу холоду та супроводжується появою симптомів [24]. У моделі in vitro продемонстровано значне збільшення вивільнення гістаміну після охолодження протягом 10 хвилин і повторного нагрівання до 37 °C [24].
Є повідомлення, що під час провокаційних холодових тестів можливе вивільнення нейтрофільних та еозинофільних хемотаксичних факторів, простагландинів D2 і фактора некрозу пухлини-α (ФНП-α) [75].
Недостатньо вивчено активацію базофілів у разі ХК. Є дані, що вивільнення гістаміну базофілами не залежить від впливу холоду [27]. Інші дослідження вказують, що після впливу холоду вивільнення гістаміну базофілами на стимуляцію C5a та f-MMM залишається незмінним або навіть знижується. Дефектне вивільнення гістаміну базофілами при ХК, імовірно, є рецептор-опосередкованим. Відсутність змін кількості базофілів і вмісту в них гістаміну вказує на те, що спричинені холодом зміни вивільнення гістаміну не пояснюються активацією базофілів in vivo [32].
У пацієнтів із ХК спостерігалася нормальна кількість тучних клітин у пошкоджених та інтактних ділянках шкіри [33]. Реактивність судин шкіри на гістамін мало відрізнялася від такої в здорових осіб [34]. Імовірно, певну роль відіграє субстанція P, яка вливає на функцію тучних клітин шкіри шляхом зниження порога активації [35]. В осіб із ХК сироваткові рівні субстанції P були вищими, ніж у здорових людей, але нижчими, ніж у пацієнтів із хронічною спонтанною кропив’янкою [36].
На тваринних моделях продемонстровано, що датчиками холоду мікроциркуляторного русла шкіри є катіонні канали транзиторного рецепторного потенціалу анкірину-1 (TRPA1) і меластатину-8 (TRPM8), які можуть відігравати певну роль у патогенезі ХК [37].
Гістологічні зміни при ХК варіабельні. Наприклад, після одноразової провокації холодом упродовж 24 годин спостерігалися дегранульовані тучні клітини та набряк ендотеліальних клітин без лейкоцитарної інфільтрації [38]. Біоптати шкіри з уражень, зумовлених холодом, демонстрували мононуклеарні інфільтрати в деяких пацієнтів із ХК [39]. Інше дослідження виявило запальний інфільтрат із переважанням нейтрофілів [40]. В окремих пацієнтів із ХК виявлено дефіцит α1-антихімотрипсину, що може вказувати на недостатній контроль нейтрофільного катепсину G або хімази тучних клітин [41].
Роль еозинофілів у разі ХК здебільшого невідома, однак орієнтоване на еозинофіли лікування реслізумабом виявлялося ефективним у цій когорті [42]. Серійна біопсія впродовж 24 годин у 6 пацієнтів із ХК не виявила постійних змін у клітинному інфільтраті в будь-який момент часу [43]. Послідовні біопсії шкіри в пацієнтів із ХК показали підвищену регуляцію ендотеліального ФНП-α та збільшення експресії інтерлейкіну-3 протягом 30 хвилин після тесту з кубиком льоду [44].
Варто з’ясувати можливі впливи кріоглобулінів на активацію тучних клітин шкіри. Кріоглобуліни – це імуноглобуліни, які преципітують за низьких температур, але розчиняються при повторному нагріванні [45]. Вважається, що кріоглобуліни активують компоненти комплементу C3a та C5a, підвищуючи проникність судин, чим пояснюється пошкодження при кріоглобулінемічному васкуліті [46]. Утім, експериментально доведено, що очищений плазмовий IgE функціонує як мономер і не полімеризується на холоді, що спростовує гіпотезу кріопротеїну IgE [27].
Застосування антигістамінного засобу ципрогептадину сприяло зменшенню клінічних симптомів без впливу на вивільнення гістаміну в більшості пацієнтів; вивільнення гістаміну значно зменшилося лише в 1 пацієнта [47]. Пероральне застосування преднізолону в дозі 20-25 мг протягом 1-5 днів пригнічувало спричинене холодом вивільнення гістаміну в більшості пацієнтів, тоді як клінічна відповідь на преднізолон була сталою [48]. Тож судинні явища при ХК не пояснюються лише впливом гістаміну. Місцеве застосування капсаїцину запобігало виникненню кропив’янки в 7 пацієнтів із ХК, що вказує на роль нервових волокон у патогенезі [49].
Отже, патогенетичні механізми ХК доволі складні та потребують подальшого вивчення на різних рівнях.
Клінічна картина
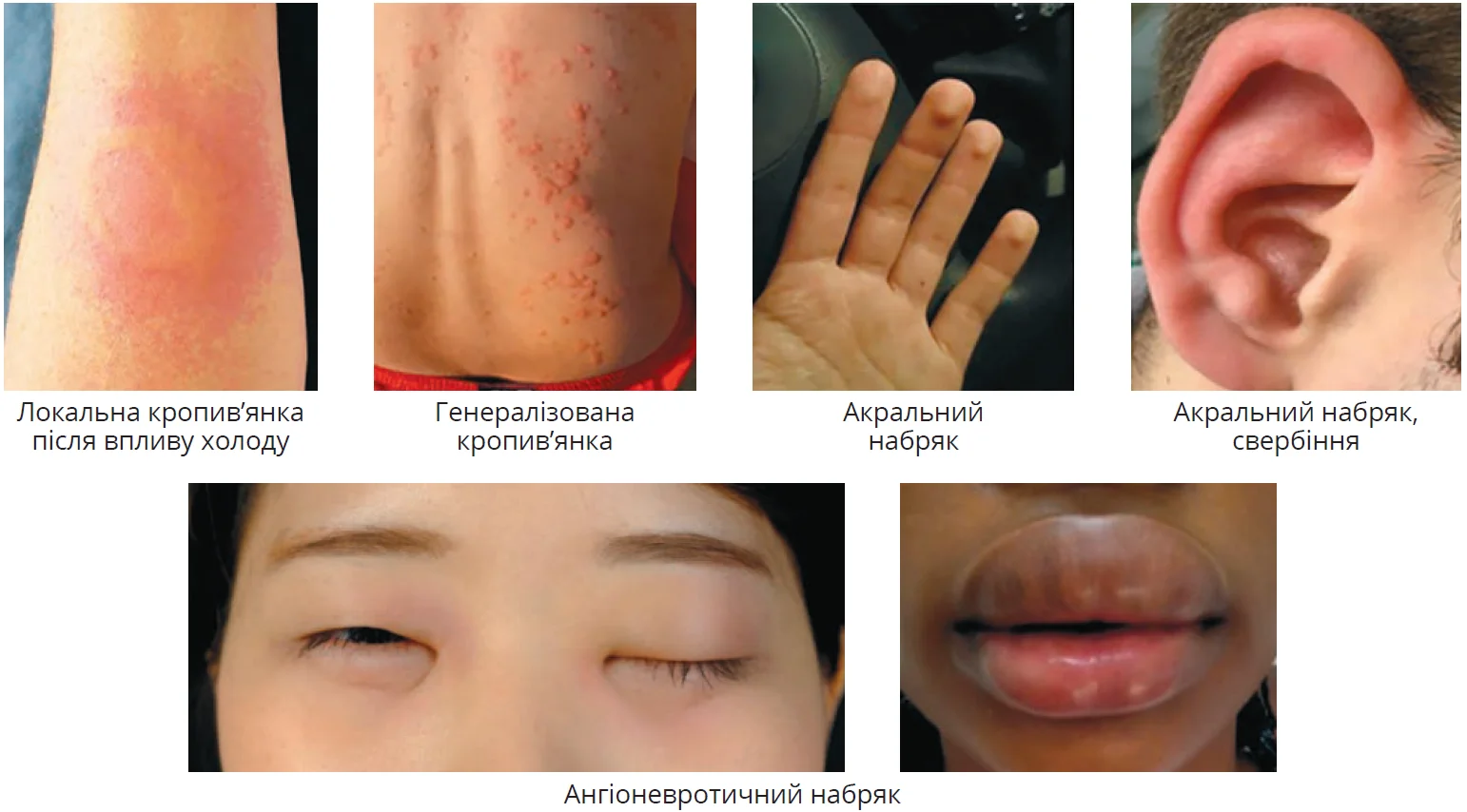
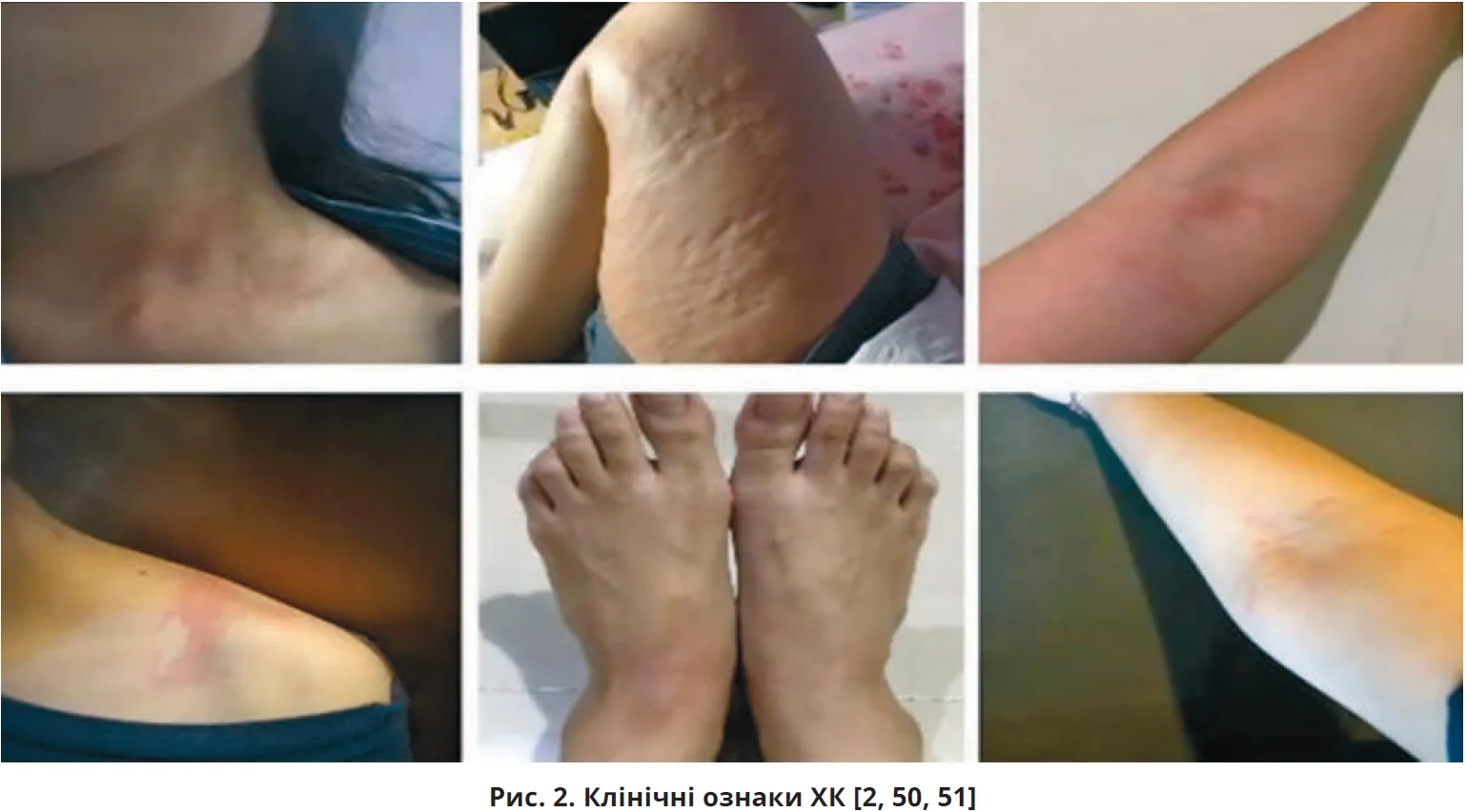
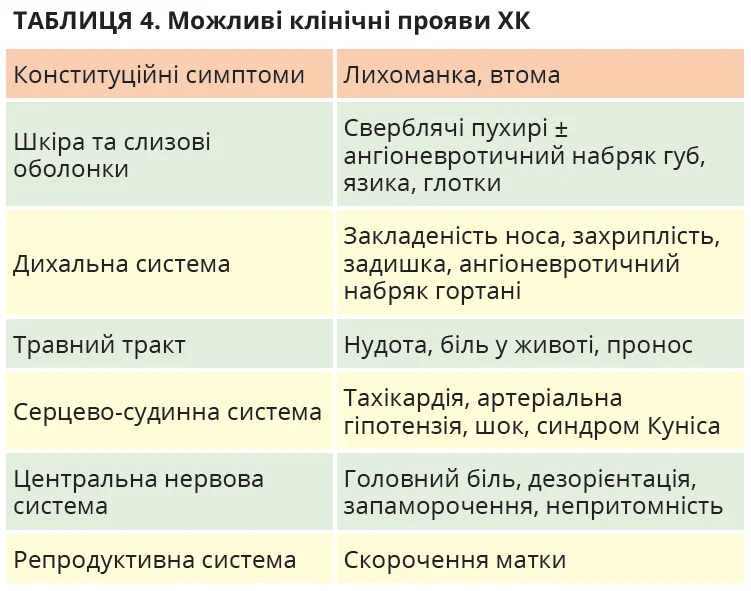
Клінічна картина ХК залежить від інтенсивності та тривалості впливу холоду, індивідуального порога холодової чутливості, а можливо, й від інших, поки що невідомих чинників. Клінічні прояви доволі варіабельні – від місцевого уртикарного висипу до системних симптомів із боку різних органів і систем (рис. 2, табл. 4) або навіть шоку [1, 2, 8, 50, 51].
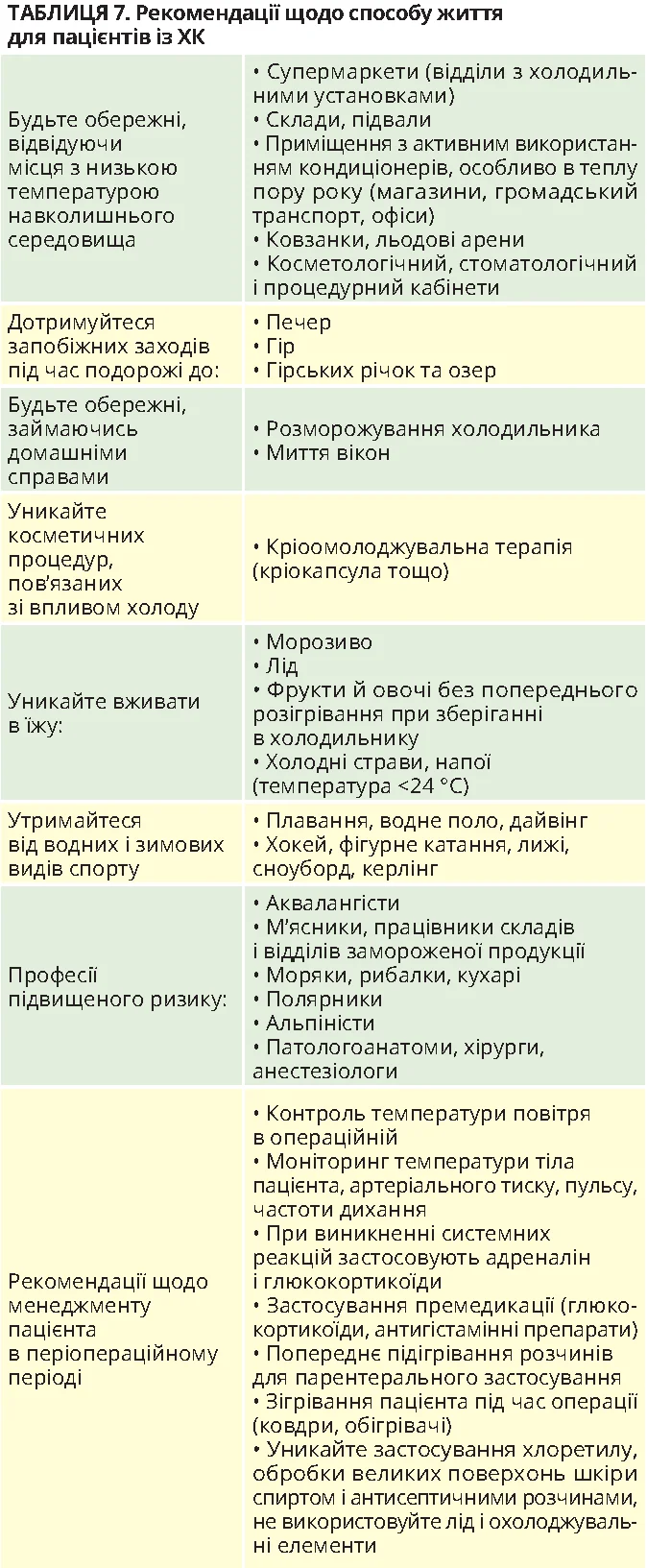
Можливими тригерами ХК є контакт із холодними предметами або поверхнями, холодною водою (холодний душ, плавання у відкритих водоймах), вітер, низька температура повітря (холодна пора року, кондиціонер), уживання холодних напоїв або їжі (морозиво, їжа з холодильника), застосування холодних інфузійних розчинів, тривалі хірургічні втручання, зокрема гіпотермічне серцево-легеневе шунтування.
Хоча симптоми кропив’янки частіше з’являються в холодний період року, в понад половини пацієнтів не спостерігається сезонних змін симптомів [52]. Ризик і тяжкість симптомів істотно посилюються за впливу холоду на велику поверхню шкіри.
Зокрема, в пацієнта з ХК описано вазоспастичний коронарний розлад (синдром Куніса) після купання в морі [53].
Чутливість до холоду характеризується двома показниками: 1) критичний температурний поріг (CTT – critical temperature threshold) – найвища температура, яка спричиняє кропив’янку; 2) критичний поріг часу стимуляції (CSTT – critical stimulation time threshold) – найкоротший час, потрібний для індукції кропив’янки [6, 54]. Діапазон індивідуальних CTT у пацієнтів коливається від <4 до >27 °C. Показники CTT зазвичай корелюють з оцінкою пацієнтами тяжкості їхнього стану [55]. Натомість показник CSTT ≤3 хвилини асоціюється з вищою частотою тяжких системних реакцій після природного впливу холоду та виникненням орофарингеального ангіоневротичного набряку після вживання крижаної їжі або генералізованою кропив’янкою з можливістю шокоподібних реакцій після плавання в холодній воді [8, 56]. Причини індивідуальної варіабельності CTT і CSTT не з’ясовані.
Частота виникнення анафілаксії в пацієнтів із ХК дуже варіабельна та, за даними різних досліджень, коливається від 4 до 52% [1, 8, 52, 56, 57]. Холодова анафілаксія діагностується за наявності будь-якого з трьох діагностичних критеріїв анафілаксії: 1) раптовий початок протягом хвилин до кількох годин симптомів із боку шкіри та/або слизових оболонок; 2) раптова поява ≥2 із таких проявів після впливу тригера: шкірні або слизові симптоми/ознаки; респіраторні симптоми, раптове зниження артеріального тиску або симптоми дисфункції органів-мішеней; шлунково-кишкові симптоми; 3) зниження артеріального тиску після контакту з відомим для цього пацієнта алергеном або тригером [58]. Проте холодовій анафілаксії притаманна певна «дозозалежність» від площі та часу впливу, що не характерно для класичної IgE-опосередкованої анафілаксії.
У травні 2019 року розпочато дослідження COLD-CE – перше міжнародне багато центрове проспективне обсерваційне перехресне академічне дослідження для комплексного аналізу пацієнтів із різних географічних регіонів світу для збору докладних реальних даних про характеристики хвороби. Нещодавно опубліковано перший аналіз цього дослідження, котрий вивчав поширеність холодової анафілаксії [51]. Серед 551 пацієнта зі встановленою ХК три чверті (n=412) мали позитивні результати ПТСХ, у 151 пацієнта (37%) виникла анафілаксія. Найчастішим тригером анафілаксії було повне занурення в холодну воду. Проте в жителів країн із теплим кліматом анафілаксію могло спричинити й холодне повітря. Нижчу частоту анафілаксії відзначено в пацієнтів із супутньою хронічною спонтанною кропив’янкою (4% порівняно з 39% серед інших учасників, p=0,003). Чинниками ризику серцево-судинних проявів були попередня системна реакція на укус перетинчастокрилих, ангіоневротичний набряк, орофарингеальні/ларингеальні симптоми та свербіж мочок вух [51].
Дослідження COLD-CE також визначило ознаки тяжкого захворювання: індукована холодом генералізована кропив’янка, ангіоневротичний набряк, акральний набряк, орофарингеальні або ларингеальні симптоми та свербіж мочок вух [51]. Іншими інструментами оцінки тяжкості ХК є індекс тяжкості набутої ХК (ACUSI – Acquired Cold Urticaria Severity Index) [52], а також спосіб визначення тяжкості за реакцією на природний вплив холоду (табл. 5) [8].
Перебіг хвороби
Середня тривалість ХК становить 4-6 років, хоча описано випадки тривалістю понад 20 років [1, 21]. До клінічних прогностичних чинників тривалої ХК відносять ранній початок, тяжке захворювання та високі показники CTT [1]. Показник CSTT вважається клінічним предиктором тяжкої ХК [1, 8].
У більшості пацієнтів симптоми виникають протягом 1-5 хвилин після впливу холоду [26]. За даними Wanderer і співавт., реакції 3 типу частіше спостерігалися в пацієнтів зі швидкою появою симптомів (≤3 хвилини) після провокаційного холодового тесту [8]. Інше дослідження вказує на нижчі показники CSTT у пацієнтів із реакціями 3 типу порівняно з пацієнтами з реакціями 1 та 2 типів [59].
У літературі є дані про можливість поєднання ХК з іншими атопічними хворобами (від 25 до 78%, частіше в дітей), хронічною спонтанною кропив’янкою (від 1,8 до 13%) або іншими видами хронічної індукованої кропив’янки (холінергічна, сонячна, аквагенна тощо) [1, 2, 22].
Діагностика
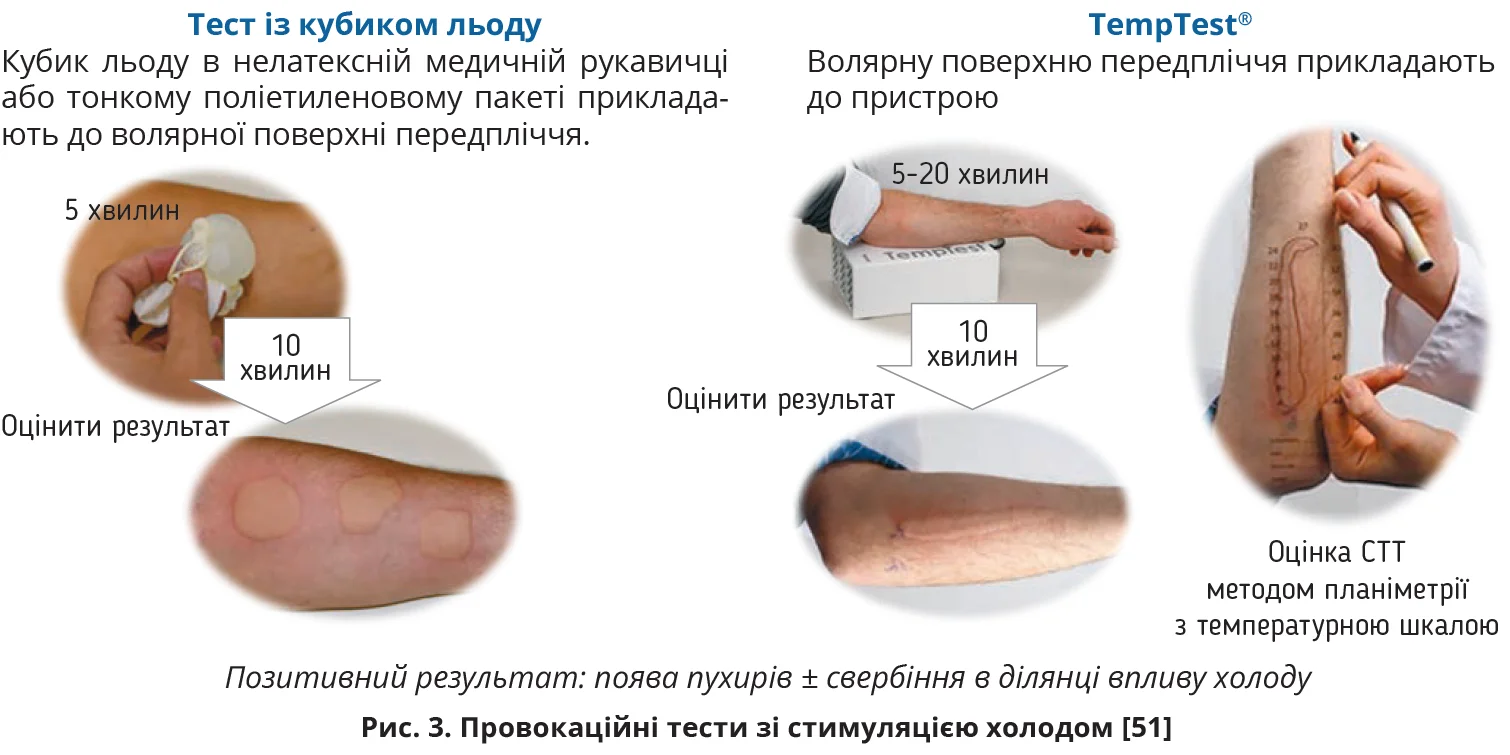
Діагноз ХК ґрунтується на даних анамнезу та результатах ПТСХ, які варто проводити за допомогою тесту з кубиком льоду та/або пристрою TempTest® (рис. 3) [6, 54]. Рутинне застосування тестів із використанням холодних пакетів або ванн із холодною водою не рекомендується. H1-антигістамінні засоби (H1-АГ) II покоління потрібно скасувати принаймні за 3 дні до проведення тесту, системні глюкокортикоїди – за 7 днів [6].
Тест із кубиком льоду простий і доступний у рутинній клінічній практиці. За даними різних дослідників, його чутливість коливається від 53 до 83%, а специфічність становить від 97 до 100% [60, 61]. Тест може оцінити CSTT, але не здатний оцінити CTT.
Метод TempTest® вважається стандартизованим способом оцінки, що надає об’єктивні, відтворювані та перевірені результати й оцінює як CSTT, так і CTT з точністю ±1 °C. Пристрій TempTest складається з одного U-подібного п’єзоелектричного елемента, який створює температурний діапазон від 4 до 44 °C. Технологія TempTest® заснована на ефекті Пельтьє, що включає нагрівання або охолодження пластикових вбудованих термоелектричних елементів відповідно до полярності та напруги електричного струму, що проходить через два напівпровідники [60].
Пацієнти з негативним результатом ПТСХ потребують подальшого обстеження. Можна повторити тест, збільшивши час провокації до 20 хвилин [6]. Альтернативою тесту з кубиком льоду може бути обережне занурення одного передпліччя у воду температурою 5-10 °C на термін до 15 хвилин [6]. Якщо результат надалі негативний, рекомендуються інші тести на атипові ХК (табл. 1). У складних випадках умови провокації холодом слід адаптувати для імітації реальних ситуацій, які спричиняють симптоми в пацієнта [6]. Якщо є розбіжності між клінічним анамнезом і результатами провокаційних тестів фізичної кропив’янки, доцільно провести провокаційні тести з іншими фізичними подразниками [62]. За результатами дослідження COLD-CE, а також проспективного дослідження, проведеного Національним інститутом здоров’я США (NIH), чверть пацієнтів із ХК мають негативні результати ПТСХ [51, 62].
Згідно з рекомендаціями EAACI/GA2LEN/EDF/UNEV лабораторне обстеження пацієнтів із ХК передбачає розгорнутий аналіз крові, визначення швидкості осідання еритроцитів або С-реактивного протеїну (СРП) [6]. Додаткове діагностичне обстеження, включно з пошуком основних інфекцій (табл. 2), варто проводити лише за показаннями: відповідний анамнез, потреба диференційної діагностики. Вказівок щодо клінічної значущості позитивної вірусної серології або кріоглобулінів у разі ХК немає. У більшості досліджень кріоглобуліни виявляють у <1% пацієнтів із ХК [8].
Диференційний діагноз
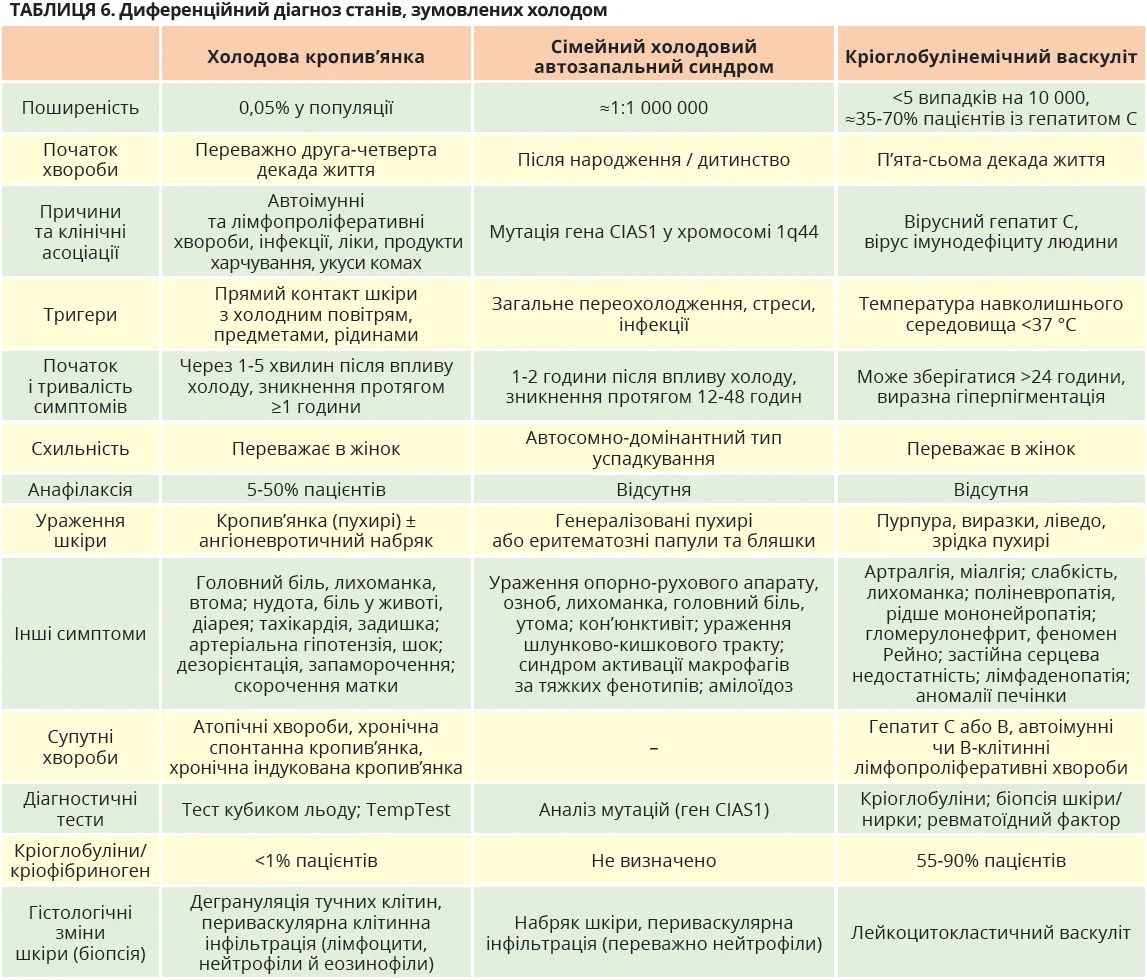
Поява уртикарних елементів у відповідь на холод можлива не тільки при ХК (табл. 6). Диференційна діагностика включає кріопірин-асоційовані періодичні синдроми (CAPS), дефіцит фосфоліпази Cγ2 й імунну дисрегуляцію (PLAID), кріоглобулінемічний васкуліт [63-65].
Кропив’янкоподібний висип у новонароджених характерний для всіх підтипів CAPS, особливо для сімейного холодового автозапального синдрому (табл. 6) [63, 64]. На відміну від CAPS, ХК рідко виникає в ранньому дитинстві, не пов’язана з лихоманкою чи артралгією та не асоціюється з генетичними порушеннями. Крім того, CAPS характеризуються різноманітними ураженнями шкіри, включаючи еритематозні плями та пласкі пухирі, які зазвичай не супроводжуються свербінням [66]. Час появи уражень після впливу холоду також відрізняється (табл. 6). У разі ХК прояви з’являються відразу після впливу холоду та минають безслідно, тоді як шкірні ознаки й симптоми при CAPS зазвичай виникають через 1-2 години та супроводжуються появою гарячки й артралгії через 4-6 годин [66]. Важливо, що при CAPS ураження шкіри не провокуються типовими ПТХС, а виникають після загального впливу холоду.
Діагностичні критерії всіх підтипів CAPS включають підвищені запальні біомаркери (СРП / амілоїд A в сироватці крові) в поєднанні з ≥2 із 6 симптомів: кропив’янкоподібний висип; епізоди, спричинені холодом; сенсоневральна втрата слуху; симптоми з боку опорно-рухового апарату; аномалії скелета; хронічний асептичний менінгіт [67]. Швидка діагностика має вирішальне значення, оскільки дає змогу призначити препарати, які блокують інтерлейкін-1, для лікування та профілактики амілоїдозу АА, що виникає у 2-4% випадків [67].
Зрідка уртикарний висип спостерігається при PLAID. Це спадкова хвороба, що характеризується дефіцитом антитіл, сприйнятливістю до інфекцій і автоімунними станами через геномні делеції в гені PLCG2, що кодує фосфоліпазу Cγ2 – сигнальний месенджер В-клітин, NK-клітин і мастоцитів [65]. Пацієнти демонструють негативний результат тесту з кубиком льоду, але позитивний результат шкірного тесту на охолоджувальне випаровування за допомогою крапель етанолу [68].
Зрідка схожі на ХК шкірні прояви виникають за мастоцитозу, холодового панікуліту та системного червоного вовчака [22]. Пацієнти з мастоцитозом можуть мати кропив’янку, спричинену фізичними тригерами, включаючи холод, але їх слід обстежити відповідно до діагностичних алгоритмів для дітей і дорослих. У разі холодового панікуліту через 6-72 години після контакту з холодом з’являється місцевий болючий глибокий набряк, який після розсмоктування залишає гіперпігментацію. Холодовий вовчак – це рідкісний варіант хронічного шкірного вовчака, який характеризується ураженням акральних ділянок під впливом холоду. Холодовий вовчак діагностується за критеріями Мейо [22, 69].
Принципи лікування
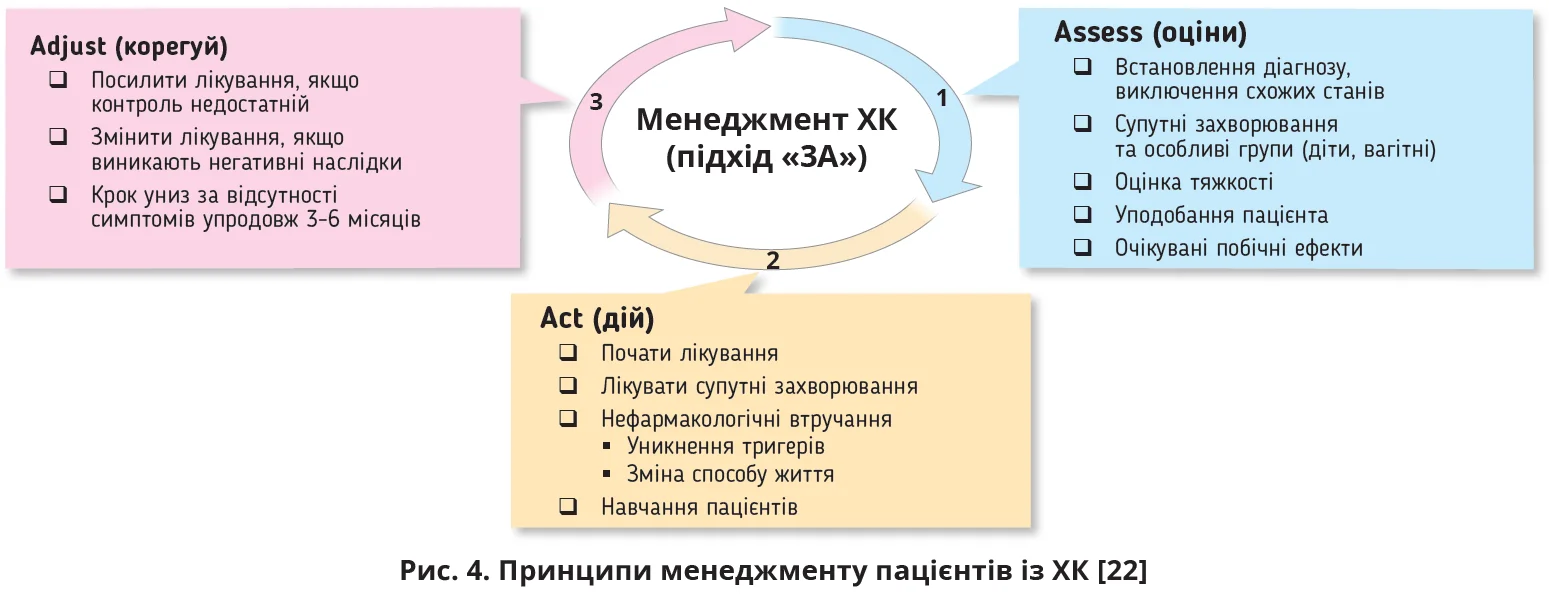
Менеджмент пацієнтів здійснюється за підходом «3А» (рис. 4) [22]. Важливим аспектом є уникнення або пом’якшення впливу тригерів (табл. 7).
Фармакотерапія
За настановами EAACI/GA2LEN/EDF/UNEV щодо кропив’янки, препаратами першої та другої ліній лікування є H1-АГ ІІ покоління у звичайних і високих дозах відповідно (рис. 5) [6, 70]. Біологічний ефект цього класу полягає у зворотному агонізмі H1-гістамінових рецепторів, що забезпечує їхню стабілізацію в неактивному стані; засоби ІІ покоління не мають седативної дії. Їхню ефективність у разі ХК доводять результати метааналізу 9 рандомізованих клінічних досліджень (РКД) [71]; ефективність високих доз – результати 2 систематичних оглядів [71, 72]. У метааналізі 4 РКД відзначено значне зниження СТТ у пацієнтів із ХК при застосуванні високих доз біластину, дезлоратадину та рупатадину порівняно зі звичайними дозами або плацебо [71]. Зважаючи на індивідуальну реакцію пацієнтів, вибір і добову дозу H1-АГ доцільно персоналізувати. Застосування високих доз забезпечує повний контроль симптомів майже в третини пацієнтів із ХК [73]. Проте терапія цим класом навряд чи контролюватиме симптоми після значного впливу холоду; зниження СТТ не досягли ≈20% пацієнтів із ХК навіть у разі застосування високих доз [73]. Механізми резистентності до H1-АГ у разі ХК не з’ясовані.
Пацієнти, які не реагують на терапію першої та другої ліній, можуть отримати користь від терапії омалізумабом (моноклональні анти-IgE-антитіла), дія котрого спрямована на циркулювальний IgE та функцію тучних клітин і базофілів (рис. 5) [6]. Ефективність омалізумабу в пацієнтів із ХК підтверджено результатами метааналізу, що загалом включав 52 пацієнтів, які отримували омалізумаб, і 12 пацієнтів, які отримували плацебо [74].
У плацебо-контрольованому РКД клінічний ефект омалізумабу 150 і 300 мг спостерігався вже на 4-му тижні [26]. Діапазон дозування коливається від 150 до 600 мг на місяць, дозу треба підбирати індивідуально для кожного пацієнта [26, 74].
Мало відомо про стратегію лікування резистентних до омалізумабу пацієнтів, дані щодо ефективності циклоспорину при ХК обмежені [75]. Альтернативні варіанти лікування включають трициклічні антидепресанти (доксепін) та імуносупресивні засоби (азатіоприн, мікофенолату мофетил) [6]. Одна їх використання обмежене потенційною токсичністю та низьким рівнем доказів.
Сучасні настанови рекомендують призначати автоін’єктор адреналіну пацієнтам із ризиком системних реакцій [68]. Існує невизначеність щодо критеріїв призначення автоін’єктора адреналіну при ХК. Нещодавнє опитування лікарів показало, що 48% респондентів призначають автоін’єктори адреналіну менш ніж 10% пацієнтів із ХК [57], хоча частота системних реакцій оцінюється на рівні 26-70%. Така невідповідність указує на потребу формулювання чітких рекомендацій щодо призначення адреналіну при ХК [57]. Окрім того, немає даних щодо ефективності адреналіну й оптимальної кількості ін’єкцій у цій когорті.
Холодова десенсибілізація – це індукція та підтримка толерантності до холоду шляхом тривалого його впливу. Її механізм недостатньо вивчений. Рутинне застосування протоколів холодової десенсибілізації обмежене через ризик кропив’янки, недотримання пацієнтом щоденних рекомендацій і швидку та значну втрату ефекту за відсутності регулярного впливу [68, 73].
Література
- Stepaniuk P., Vostretsova K., Kanani A. Review of cold-induced urticaria characteristics, diagnosis and management in a Western Canadian allergy practice. Allergy Asthma Clin. Immunol. 2018 Dec 18; 14: 85. doi: 10.1186/s13223-018-0310-5.
- Hochstadter E.F., Ben-Shoshan M. Cold-induced urticaria: challenges in diagnosis and management. BMJ Case Rep. 2013 Jul 8; 2013: bcr2013010441. doi: 10.1136/bcr-2013-010441.
- Witherspoon F.G., White C.B., Bazemore J.M., Hailey H. Familial urticaria due to cold. Arch. Derm. Syphilol. 1948; 58 (1): 52-55. doi: 10.1001/archderm.1948.01520200055007.
- Wanderer A.A. Cold urticaria syndromes: historical background, diagnostic classification, clinical and laboratory characteristics, pathogenesis, and management. J. Allergy Clin. Immunol. 1990 Jun; 85 (6): 965-81. doi: 10.1016/0091-6749(90)90037-5.
- Bizjak M., Terhorst-Molawi D., Maurer M., Kosnik M. The UCARE project COLD-CE. 2019. doi: 10.13140/RG.2.2.26512.43526.
- Magerl M., Altrichter S., Borzova E., et al. The definition, diagnostic testing, and management of chronic inducible urticarias – the EAACI/GA2LEN/EDF/UNEV consensus recommendations 2016 update and revision. Allergy. 2016; 71: 780-802.
- Siebenhaar F., Weller K., Mlynek A., et al. Acquired cold urticaria: clinical picture and update on diagnosis and treatment. Clin. Exp. Dermatol. 2007; 32: 241-245.
- Wanderer A.A., Grandel K.E., Wasserman S.I., Farr R.S. Clinical characteristics of cold-induced systemic reactions in acquired cold urticaria syndromes: recommendations for prevention of this complication and a proposal for a diagnostic classification of cold urticaria. J. Allergy Clin. Immunol. 1986; 78: 417-423.
- Kaplan A.P. Unusual cold-induced disorders: cold-dependent dermographism and systemic cold urticaria. J. Allergy Clin. Immunol. 1984; 73: 453-456.
- Wanderer A.A. Systemic cold urticaria (atypical acquired cold urticaria). J. Allergy Clin. Immunol. 1991; 87: 137-138.
- Mathelier-Fusade P., Leynadier F. Localized cold urticaria. Br. J. Dermatol. 1995; 132: 666-667.
- Czarnetzli B.M., Frosch P.J., Sprekeler R. Localized cold reflex urticaria. Br. J. Dermatol. 1981; 104: 83-87.
- Ting S., Mansfield L.E. Localized cold-reflex urticaria. J. Allergy Clin. Immunol. 1985; 75: 421.
- Wanderer A.A., Hoffman H.M. The spectrum of acquired and familial cold-induced urticaria / urticarial-like syndromes. Immunol. Allergy Clin. North Am. 2004; 24: 259-286.
- Bäck O., Larsen A. Delayed cold urticaria. Acta Derm. Venereol. 1978; 58: 369-371.
- Kaplan A.P., Garofalo J. Identification of a new physically induced urticaria: cold-induced cholinergic urticaria. J. Allergy Clin. Immunol. 1981; 68: 438-441.
- Matthews C.N., Warin R.P. Cold urticaria and cold precipitated dermographism. Br. J. Dermatol. 1970; 82: 91.
- Claudy A. Cold urticaria. J. Investig. Dermatol. Symp. Proc. 2001; 6 (2): 141-142.
- Krause K., Zuberbier T., Maurer M. Modern approaches to the diagnosis and treatment of cold contact urticaria. Curr. Allergy Asthma Rep. 2010; 10: 243-249.
- Kulthanan K., Tuchinda P., Chularojanamontri L., Kiratiwongwan R. Cold urticaria: clinical features and natural course in a tropical country. Allergy Asthma Immunol. Res. 2019; 11: 538-547.
- Jain S.V., Mullins R.J. Cold urticaria: a 20-year follow-up study. J. Eur. Acad. Dermatol. Venereol. 2016; 30: 2066-2071.
- Kolkhir P., Giménez-Arnau A.M., Kulthanan K., Peter J., Metz M., Maurer M. Urticaria. Nat. Rev. Dis. Primers. 2022 Sep 15; 8 (1): 61. doi: 10.1038/s41572-022-00389-z.
- Maurer M., Fluhr J.W., Khan D.A. How to approach chronic inducible urticaria. J. Allergy Clin. Immunol. Pract. 2018; 6: 1119-1130.
- Kaplan A.P., Gray L., Shaff R.E., Horakova Z., Beaven M.A. In vivo studies of mediator release in cold urticaria and cholinergic urticaria. J. Allergy Clin. Immunol. 1975; 55: 394-402.
- Schmetzer O., Lakin E., Topal F.A., et al. IL-24 is a common and specific autoantigen of IgE in patients with chronic spontaneous urticaria. J. Allergy Clin. Immunol. 2018; 142 (3): 876-882.
- Metz M., Schutz A., Weller K., et al. Omalizumab is effective in cold urticaria – results of a randomized placebo-controlled trial. J. Allergy Clin. Immunol. 2017; 140 (3): 864-867.
- Kaplan A.P., Garofalo J., Sigler R., Hauber T. Idiopathic cold urticaria: in vitro demonstration of histamine release upon challenge of skin biopsies. N. Engl. J. Med. 1981; 305 (18): 1074-1077.
- Gruber B.L., Baeza M.L., Marchese M.J., Agnello V., Kaplan A.P. Prevalence and functional role of anti-IgE autoantibodies in urticarial syndromes. J. Invest. Dermatol. 1988; 90: 213-217.
- Asero R., Tedeschi A., Lorini M. Histamine release in idiopathic cold urticaria. Allergy. 2002; 57 (12): 1211-1212.
- Tillie-Leblond I., Gosset P., Janin A., et al. Tumor necrosis factor-α release during systemic reaction in cold urticaria. J. Allergy Clin. Immunol. 1994; 93: 501-509.
- Ormerod A.D., Kobza Black A., Dawes J., et al. Prostaglandin D2 and histamine release in cold urticaria unaccompanied by evidence of platelet activation. J. Allergy Clin. Immunol. 1988; 82: 586-589.
- Hessler H.-J., Pufahl C., Christophers E. Decreased releasability of basophils from patients with cold urticaria after cold exposure. Int. Arch. Allergy Appl. Immunol. 1989; 89: 236-241.
- James M.P., Eady R.A.J., Kobza Black A., Hawk J.L.M., Greaves M.W. Physical urticaria: a microscopical and pharmacological study of mast cell involvement. J. Invest. Dermatol. 1980; 74: 451.
- Juhlin L., Michaelsson G. Cutaneous reactions to kallikrein, bradykinin and histamine in healthy subjects and in patients with urticaria. Acta. Derm. Venereol. 1969; 49: 26-36.
- Forsythe P., Bienenstock J. The mast cell-nerve functional unit: a key component of physiologic and pathophysiologic responses. Chem. Immunol. Allergy. 2012; 98: 196-221.
- Metz M., Krull C., Hawro T., et al. Substance P is upregulated in serum of patients with chronic spontaneous urticaria. J. Investig. Dermatol. 2014; 134: 2833-2836.
- Pan Y., Thapa D., Baldissera L., Argunhan F., Aubdool A.A., Brain S.D. Relevance of TRPA1 and TRPM8 channels as vascular sensors of cold in the cutaneous microvasculature. Pflugers Arch. 2018; 470: 779-786.
- Center D.M., Soter N.A, Wasserman S.I., et al. Inhibition of neutrophil chemotaxis in association with experimental angioedema in patients with cold urticaria: a model of chemotactic deactivation in vivo. Clin. Exp. Immunol. 1979; 35 (1): 112-118.
- Haas N., Toppe E., Henz B.M. Microscopic morphology of different types of urticaria. Arch. Dermatol. 1998; 134: 41-46.
- Winkelmann R.K. Immunofluorescent and histologic study of cold urticaria. Arch. Dermatol. Res. 1985; 278: 37-40.
- Lindmark B., Wallengren J. Heterozygous α1-antichymotrypsin deficiency may be associated with cold urticaria. Allergy. 1992; 47: 456-458.
- Maurer M., Altrichter S., Metz M., Zuberbier T., Church M.K., Bergmann K.-C. Benefit from reslizumab treatment in a patient with chronic spontaneous urticaria and cold urticaria. J. Eur. Acad. Dermatol. Venereol. 2018; 32: 112-113.
- Lawlor F., Kobza Black A., Breathnach A.S., et al. A timed study of the histopathology, direct immunofluorescence and ultrastructural findings in idiopathic cold-contact urticaria over a 24-h period. Clin. Exp. Dermatol. 1989; 14: 416-420.
- Hermes B., Prochazka A.-K., Haas N., et al. Upregulation of TNF-α and IL-3 expression in lesional and uninvolved skin in different types of urticaria. J. Allergy Clin. Immunol. 1999; 103: 307-314.
- Roccatello D., Saadoun D., Ramos-Casals M., et al. Cryoglobulinemia. Nat. Rev. Dis. Primers. 2018; 4: 11.
- Soter N.A. Physical urticaria/angioedema as an experimental model of acute and chronic inflammation in human skin. In: I.N. Gigli, P.A. Miescher, H.J. Müller-Eberhard, eds. Immunodermatology. Berlin, Heidelberg: Springer; 1983. 75-83 p.
- Sigler R.W., Evans R. 3rd, Horakova Z., Ottesen E., Kaplan A.P. The role of cyproheptadine in the treatment of cold urticaria. J. Allergy Clin. Immunol. 1980; 65: 209-312.
- Kobza Black A., Keahey T.M., Eady R.A., Greaves M.W. Dissociation of histamine release and clinical improvement following treatment of acquired cold urticarial by prednisone. Br. J. Clin. Pharm. 1981; 12: 327-331.
- Tóth-Kása I., Jancsó G., Obál F., Husz S., Simon N. Involvement of sensory nerve endings in cold and heat urticaria. JID. 1983; 80: 34-36.
- Ulfa N.N. Diagnosis and treatment of typical cold-induced urticaria: a case reports. Bioscientia Medicina: Journal of Biomedicine and Translational Research. 2023; 7 (1): 3043-3047. doi: 10.37275/bsm.v7i1.758.
- Bizjak M., Košnik M., Dinevski D., et al. Risk factors for systemic reactions in typical cold urticaria: results from the COLD-CE study. Allergy. 2022; 77 (7): 2185-2199. doi: 10.1111/all.15194.
- Siebenhaar F., Degener F., Zuberbier T., Martus P., Maurer M. High-dose desloratadine decreases wheal volume and improves cold provocation thresholds compared with standard-dose treatment in patients with acquired cold urticaria: a randomized, placebo-controlled, crossover study. J. Allergy Clin. Immunol. 2009; 123: 672-679.
- Mazarakis A., Bardousis K., Almpanis G., Mazaraki I., Markou S., Kounis N.G. Kounis syndrome following cold urticaria: the swimmer’s death. Int. J. Cardiol. 2014; 176: 52-53.
- Maurer M., Hawro T., Krause K., et al. Diagnosis and treatment of chronic inducible urticaria. Allergy. 2019; 74: 2550-2553.
- Mlynek A., Magerl M., Siebenhaar F., et al. Results and relevance of critical temperature threshold testing in patients with acquired cold urticaria. Br. J. Dermatol. 2010; 162: 198-200.
- Mathelier-Fusade P., Aïssaoui M., Bakhos D., Chabane M.H., Leynadier F. Clinical predictive factors of severity in cold urticaria. Arch. Dermatol. 1998; 134: 106-107.
- Gernez Y., Sicherer S.H., Wang J. Variability in diagnosis and management of acquired cold-induced urticaria. J. Allergy Clin. Immunol. Pract. 2018; 6: 1396-1399.
- Shaker M.S., Wallace D.V., Golden D.B.K., et al. Anaphylaxis – a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J. Allergy Clin. Immunol. 2020; 145 (4): 1082-1123.
- Deza G., Brasileiro A., Bertolin-Colilla M., Curto-Barredo L., Pujol R.M., Giménez-Arnau A.M. Acquired cold urticaria: clinical features, particular phenotypes, and disease course in a tertiary care center cohort. J. Am. Acad. Dermatol. 2016; 75: 918-924.
- Siebenhaar F., Staubach P., Metz M., Magerl M., Jung J., Maurer M. Peltier effect-based temperature challenge: an improved method for diagnosing cold urticaria. J. Allergy Clin. Immunol. 2004; 114: 1224-1225.
- Alangari A.A., Twarog F.J., Shih M.C., Schneider L.C. Clinical features and anaphylaxis in children with cold urticaria. Pediatrics. 2004; 113: 313-317.
- Komarow H.D., Arceo S., Young M., Nelson C., Metcalfe D.D. Dissociation between history and challenge in patients with physical urticaria. J. Allergy Clin. Immunol. Pract. 2014; 2: 786-790.
- Cutts L., Parslew R., Eustace K. Neonatal urticaria: could it be CAPS? Pediatr. Dermatol. 2018; 35: 420-421.
- Hoffman H.M. Familial cold autoinflammatory syndrome. J. Allergy Clin. Immunol. 2001; 108: 615-620.
- Ombrello M.J., Remmers E.F., Sun G., et al. Cold urticaria, immunodeficiency, and autoimmunity related to PLCG2 deletions. N. Engl. J. Med. 2012; 366: 330-338.
- Krause K., Grattan C.E., Bindslev-Jensen C., et al. How not to miss autoinflammatory diseases masquerading as urticaria. Allergy. 2012; 67: 1465-1474.
- Kuemmerle-Deschner J.B., Ozen S., Tyrrell P.N., et al. Diagnostic criteria for cryopyrin-associated periodic syndrome (CAPS). Ann. Rheum. Dis. 2017; 76: 942-947.
- Bernstein J.A., Lang D.M., Khan D.A., et al. The diagnosis and management of acute and chronic urticaria: 2014 update. J. Allergy Clin. Immunol. 2014; 133: 1270-1277.
- Su W.P., Perniciaro C., Rogers R.S. 3rd, White J.W. Jr. Chilblain lupus erythematosus (lupus pernio): clinical review of the Mayo clinic experience and proposal of diagnostic criteria. Cutis. 1994; 54: 395-399.
- Zuberbier T., Aberer W., Asero R., et al. The EAACI/GA2LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy. 2018; 73: 1393-1414.
- Kulthanan K., Hunnangkul S., Tuchinda P., et al. Treatments of cold urticaria: a systematic review. J. Allergy Clin. Immunol. 2019; 143: 1311-1331.
- Dressler C., Werner R.N., Eisert L., Zuberbier T., Nast A., Maurer M. Chronic inducible urticaria: a systematic review of treatment options. J. Allergy Clin. Immunol. 2018; 141: 1726-1734.
- Magerl M., Pisarevskaja D., Staubach P., Martus P., Church M.K., Maurer M. Critical temperature threshold measurement for cold urticaria: a randomized controlled trial of H(1)-antihistamine dose escalation. Br. J. Dermatol. 2012; 166: 1095-1099.
- Maurer M., Metz M., Brehler R., et al. Omalizumab treatment in patients with chronic inducible urticaria: a systematic review of published evidence. J. Allergy Clin. Immunol. 2018; 141: 638-649.
- Marsland A.M., Beck M.H. Cold urticaria responding to systemic ciclosporin. Br. J. Dermatol. 2003; 149: 214-215.