Ефективність перорального застосування комбінації пробіотичних мікроорганізмів (Lactobacillus helveticus, Bifidobacterium longum, Lactobacillus rhamnosus і Saccharomyces boulardii) при атопічному дерматиті в дорослих: результати відкритого плацебо-контрольованого рандомізованого пілотного дослідження
Автори: Н.В. Бойко, О.В. Паллаг, Ужгородський національний університет; Б.В. Литвиненко, Л.В. Коноваленко, Ю.А. Бісюк, В.І. Літус, О.І. Літус, Національний університет охорони здоров’я України ім. П.Л. Шупика (м. Київ)
Мікробіом, наш суперорган, – це складна динамічна система, що може бути означена як сукупність генів мікроорганізмів, які населяють організм людини [1]. Водночас мікробіоту характеризують як установлене експериментально співвідношення культивованих мікроорганізмів із різною функціональною, а отже, й етіологічною роллю, тобто доведеною значущістю у виникненні прямих захворювань чи супутніх або поєднаних патологічних станів, зважаючи на вимоги нової парадигми медицини «3 П» [2].
Відомо, що коменсальні мікроорганізми шкіри беруть безпосередню участь у формуванні захисного бар’єра, який разом із вродженим і набутим імунітетом людини є необхідним для підтримки так званого гомеостатичного незмінного pH- балансу здорової шкіри [3]. Порушення цього балансу ініціює виникнення запальних процесів, що є тригером цілої низки шкірних інфекцій і алергічних проявів [4]. Нами проведено поглиблене дослідження мікробіоти шкіри з видовою ідентифікацією основних груп коменсальних та умовно-патогенних мікроорганізмів, яке дає змогу встановити індивідуальне діагностичне співвідношення та визначити тригерні (ранні маркери) зміни мікробіоти в пацієнтів з ознаками атопічного дерматиту. Для лікування пацієнтів уперше було застосовано комбіновану схему лікування з використанням біопрепарату нового покоління Неофлорум, а також установлено ефективність і механізм його дії.
Нормальна мікробіота шкіри залежить від фізіологічних особливостей певної ділянки, тобто зміна чисельності та якісний склад мікробних таксонів пов’язані з особливостями мікросередовища ділянки шкіри, яке в різних чи навіть в одного й того самого індивідуума може бути вологим, сухим або сальним.
У сальному мікросередовищі зазвичай переважають бактерії роду Propionibacterium, тоді як Staphylococcus і Corynebacterium є типовими представниками шкіри з вологим мікросередовищем (згини ліктів і поверхня стоп). На сухих ділянках трапляються всі три роди бактерій – Propionibacterium, Staphylococcus і Corynebacterium [5].
Шкіра пацієнтів з атопічним дерматитом чутливіша до збудників вірусних, бактеріальних і грибкових інфекцій, оскільки має знижену бар’єрну функцію [6]. Така шкіра має невелику кількість філагрину та кераміду, котрі її захищають, отож, як наслідок, стає сухішою та сприйнятливішою до заселення нетиповими мікроорганізмами, що призводить до дерматиту – алергічної реакції на різні подразники довкілля, в тому числі на власні мікроорганізми шкіри [7].
Останні дослідження продемонстрували, що вирішальну роль у появі атопічного дерматиту відіграє надмірне зростання золотистого стафілокока (Staphylococcus aureus) серед інших представників мікробіоти шкіри. Тому саме вивчення особливостей індивідуального мікробіому є необхідним для виявлення причинно-наслідкових зв’язків, які зумовлюють захворювання шкіри [5], а його відновлення є свідченням ефективності тих чи тих біопрепаратів або інших засобів лікування.
Метою цього дослідження стало вивчення ефективності додавання комбінації пробіотичних бактерій (Lactobacillus helveticus, Bifidobacterium longum, Lactobacillus rhamnosus – не менш ніж 5×109 колонієутворювальних одиниць (КУО), Saccharomyces boulardii – 125 мг) до стандартного лікування (крем 0,1% мометазону фуроату) в дорослих з атопічним дерматитом.
Матеріали та методи
У дослідження було включено 20 дорослих хворих на атопічний дерматит з індексом тяжкості перебігу SCORAD (SCORing Atopic Dermatitis) від 25 до 50 балів і дерматологічним індексом якості життя (DLQI) від 6 до 20 балів. Для діагностики АД використовували критерії затвердженого Міністерством охорони здоров’я України (№ 85 від 11.02.2016) Уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) медичної допомоги «Атопічний дерматит» і заснованих на консенсусі європейських рекомендацій щодо лікування атопічної екземи (атопічного дерматиту) в дорослих і дітей [8].
Клінічне дослідження проводили як відкрите порівняльне рандомізоване пілотне у двох паралельних групах на базі клініки «Євродерм». В основну групу було включено 10 пацієнтів, які отримували комбінацію пробіотичних бактерій B. longum, L. helveticus, L. rhamnosus (не менш ніж 5×109 КУО), S. boulardii по 2 капсули на добу протягом 28 днів і крем 0,1% мометазону фуроату, який наносили тонким шаром на уражені ділянки шкіри 1 раз на добу протягом 7 днів, із продовженням проактивної терапії 2 рази на тиждень протягом наступних 3 тижнів. У групу порівняння було включено 10 пацієнтів, які отримували лікування лише кремом 0,1% мометазону фуроату.
Тяжкість захворювання визначали з використанням шкали SCORAD: тяжкий перебіг – SCORAD >50 (стійка екзема), помірний – SCORAD 25-50 (рецидивна екзема), легкий – SCORAD <25 (транзиторна екзема).
Якість життя пацієнтів оцінювалася за допомогою анкети DLQI (Dermatology Life Quality Index). Значення балів: 0-1 – відсутність впливу на життя пацієнта, 2-5 – незначний вплив на життя пацієнта, 6-10 – помірний вплив на життя пацієнта, 11-20 – дуже великий вплив на життя пацієнта, 21-30 – надзвичайно великий вплив на життя пацієнта.
До складу досліджуваного препарату входить комбінація пробіотичних бактерій B. longum, L. helveticus, L. rhamnosus (не менш ніж 5×109 КУО) та S. boulardii; допоміжні речовини (наповнювачі): крохмаль картопляний, магнію стеарат, аскорбінова кислота (антиоксидант); оболонка капсули: гідроксипропілметилцелюлоза, барвник – титану діоксид.
Досліджуваний препарат рекомендується як дієтична добавка до раціону харчування та є додатковим джерелом пробіотичних лакто- й біфідобактерій, а також дріжджів, застосування котрого забезпечує регулювання діяльності та відновлення природної здорової мікробіоти шлунково-кишкового тракту завдяки вже відомим механізмам дії при пероральному застосуванні біопрепаратів.
Для з’ясування впливу препарату на мікробіоту шкіри при атопічному дерматиті досліджували зразки (зішкріб) уражених ділянок шкіри до та після закінчення лікування (28-ма доба).
Забір матеріалу здійснювали методом глибинного зішкрібу за допомогою стерильного скальпеля та спеціального аплікатора (ТОВ «Волес», Україна) для забору аеробної й анаеробної мікробіоти шкіри. Для цього круговими обертовими рухами з місця зішкрібу відбирали матеріал на тампон протягом 5-10 секунд. Уміст мікроорганізмів у зразках визначали кількісним методом. Для цього кінець аплікатора відривали та поміщали в пробірку типу Eppendorf (Німеччина) з рідким стерильним поживним бульйоном MRS (Ман, Рогоза, Шарп) виробництва HiMedia (Індія) й осаджували за допомогою центрифуги Eppendorf MiniSpin (13 тисяч обертів протягом 15 хвилин).
Після цього отриманий супернатант титрували в бульйоні MRS методом серійних розведень і висівали по 10 мкл відповідного розведення (101, 102, 104, 106, 108, 1010) на відповідні поживні середовища, зокрема: агар MRS, агар Bifidobacterium, м’ясо-пептонний агар, 5% кров’яний агар, середовище Сабуро, середовище Ендо, середовище для культивування ентерококів (Bile), середовище для культивування стрептококів (стрептококовий агар), клостридіальний агар і селективне середовище для вирощування стафілококів із манітолом; ліміт визначення становить 100-101.
Чашки зі зразками інкубували в термостаті при температурі 37±1 °С протягом 24-48 годин за відповідних умов культивування (аеробні й анаеробні). Анаеробні умови забезпечували шляхом вирощування тестованих культур в анаеростаті малого об’єму з використанням анаеропакетів (поглиначів кисню). Зразки інкубували в аеробних і мікроаерофільних умовах (факультативно-анаеробних; за 5% СО2) та при двох температурних режимах (37 і 42 °С) протягом 48 годин.
Культуральні властивості ізольованих бактерій визначали за характером їхнього росту на щільних поживних середовищах, установлюючи морфотипи одержаних колоній. Для попередньої орієнтовної ідентифікації всіх ізольованих культур досліджували їхні морфологічні та тинкторіальні (мікроскопічні) особливості, здійснюючи наступне оцифрування мазка. Остаточну видову ідентифікацію чистих культур мікроорганізмів проводили шляхом використання біохімічних тест-систем Anaerotest і PLIVA-Lachema виробництва Erba LaChema (м. Брно, Чеська Республіка).
Статистичну обробку результатів проводили за допомогою програми Minitab 16. Для перевірки розподілу на нормальність використовували тест Колмогорова – Смірнова. Кількісні змінні представлено у вигляді середніх значень і середньоквадратичних відхилень. Достовірність відмінностей між групами обчислювали з використанням тесту χ2 у таблиці спряженості та порівняння середніх двох незалежних вибірок за критерієм Стьюдента.
На проведення дослідження було отримано дозвіл локального етичного комітету. Усі пацієнти підписали добровільну письмову згоду на участь у цьому дослідженні.
Результати
Середній вік пацієнтів (30,4±9,9 року), які приймали досліджуваний препарат, достовірно не відрізнявся (p=0,73) від групи плацебо (31,9±9,2 року). Групи достовірно не відрізнялися (р=1,0) за гендерним показником (співвідношення чоловіків до жінок в основній групі – 4:6, у контрольній – 3:7). Тривалість хвороби (досліджувана група – 17,1±6,37; група порівняння – 16,3±6,2; p=0,78) і кількість загострень за останній рік (досліджувана група – 3,3±1,6; група порівняння – 3,6±1,5; р=0,67) також достовірно не відрізнялися між групами.
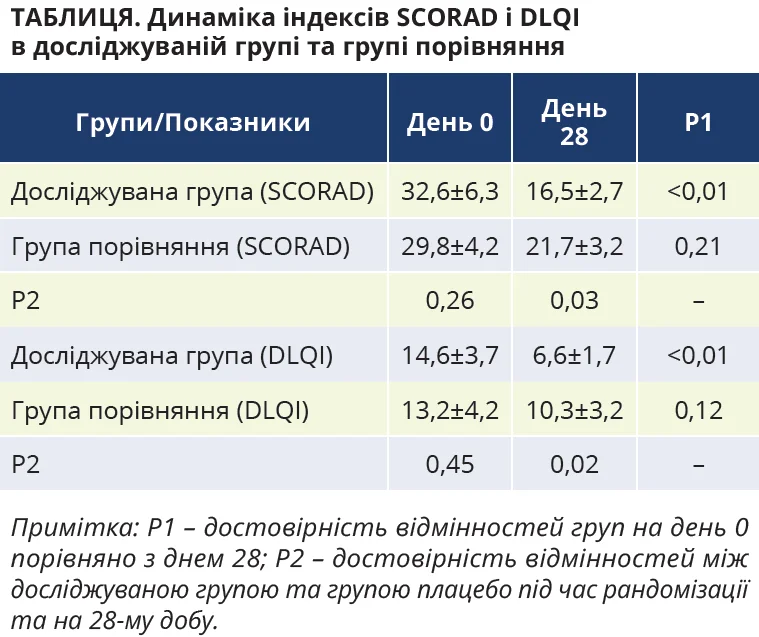
Для з’ясування клінічної ефективності досліджуваного препарату визначали тяжкість захворювання (індекс SCORAD) та якість життя (DLQI) під час рандомізації (день 0) та після закінчення лікування (день 28) (табл.).
Дані таблиці свідчать про відсутність достовірних відмінностей на момент рандомізації (день 0) досліджуваної групи від групи порівняння як за індексом SCORAD (р=0,26), так і за DLQI (р=0,45). Тобто спостерігалася однорідність клінічних характеристик тяжкості атопічного дерматиту в обох групах.
При цьому середнє значення індексу SCORAD достовірно знижувалося наприкінці періоду лікування (день 28) лише в досліджуваній групі (р<0,01).
До того ж для пацієнтів, які отримували комбінацію пробіотиків і дріжджів, зниження індексу SCORAD було достовірно більшим (р=0,03), аніж для учасників групи порівняння. Аналогічну динаміку продемонстрував й індекс якості життя (DLQI).
Дійсно, лише для досліджуваної групи зафіксовано достовірне зниження індексу DLQI на 28-й день (р<0,01). При цьому його кінцеве значення для основної групи виявилося ще й достовірно нижчим (р=0,02), аніж для групи порівняння. Отже, результати клінічних параметрів указують на ефективність використання комбінації пробіотиків і дріжджів у лікуванні атопічного дерматиту.
Наступним етапом роботи став аналіз бактеріологічного дослідження уражених ділянок шкіри пацієнтів до та після лікування.
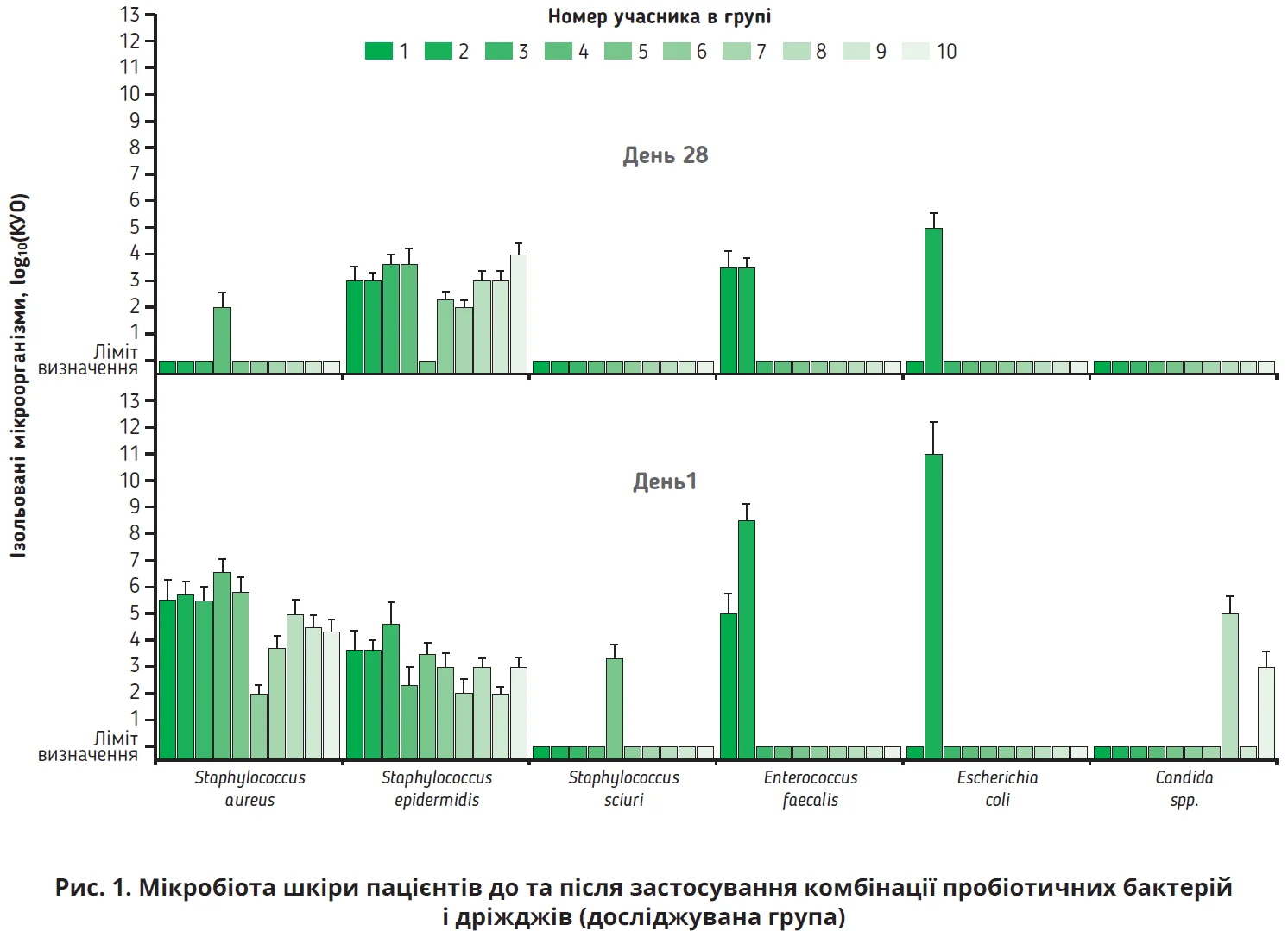
Склад шкірної мікробіоти досліджували в пацієнтів з атопічним дерматитом до початку та після 28 днів лікування. Аналіз шкірної мікробіоти, спрямований на виявлення основних груп умовно-патогенних і коменсальних мікроорганізмів і проведений на початку дослідження у відібраних зразках шкіри, показав наявність грампозитивних мікроорганізмів (S. aureus, Enterococcus faecalis) і грамнегативних бактерій (Acinetobacter lwoffii, Escherichia coli), дріжджоподібних грибів Candida spp., як в основній групі, так і в групі плацебо. На початковому етапі не було виявлено відмінностей у бактеріальному складі між пацієнтами групи порівняння та досліджуваної групи.
До початку лікування в 100% пацієнтів з уражених ділянок шкіри було ізольовано штами бактерій S. aureus, які часто колонізують шкіру при атопічному дерматиті. Також у результаті дослідження було ізольовано такі мікроорганізми: A. lwoffii – в 3 пацієнтів, E. faecalis – у 4, Candida spp. – у 4. Слід зазначити, що в 14 пацієнтів було ізольовано Staphylococcus epidermidis, який є коменсалом шкіри, але в занижених кількостях.
Згідно з отриманими результатами, які представлено на рисунку 1, тестований пробіотичний препарат має сильні антибактеріальні властивості.
У 9 з 10 пацієнтів, які входили до досліджуваної групи, штами S. aureus, ізольовані до початку лікування, не виділяли взагалі, а в 10 пацієнтів (група плацебо) кількість вищезгаданих грампозитивних бактерій зменшилася на 4 порядки.
Досліджуваний препарат не тільки був ефективним щодо грампозитивної біоти (S. aureus, E. faecalis), а й характеризувався протигрибковою дією стосовно умовно-патогенних грибів, які були ізольовані від пацієнтів із діагностованим атопічним дерматитом, а саме до дріжджоподібних грибів Candida spp.
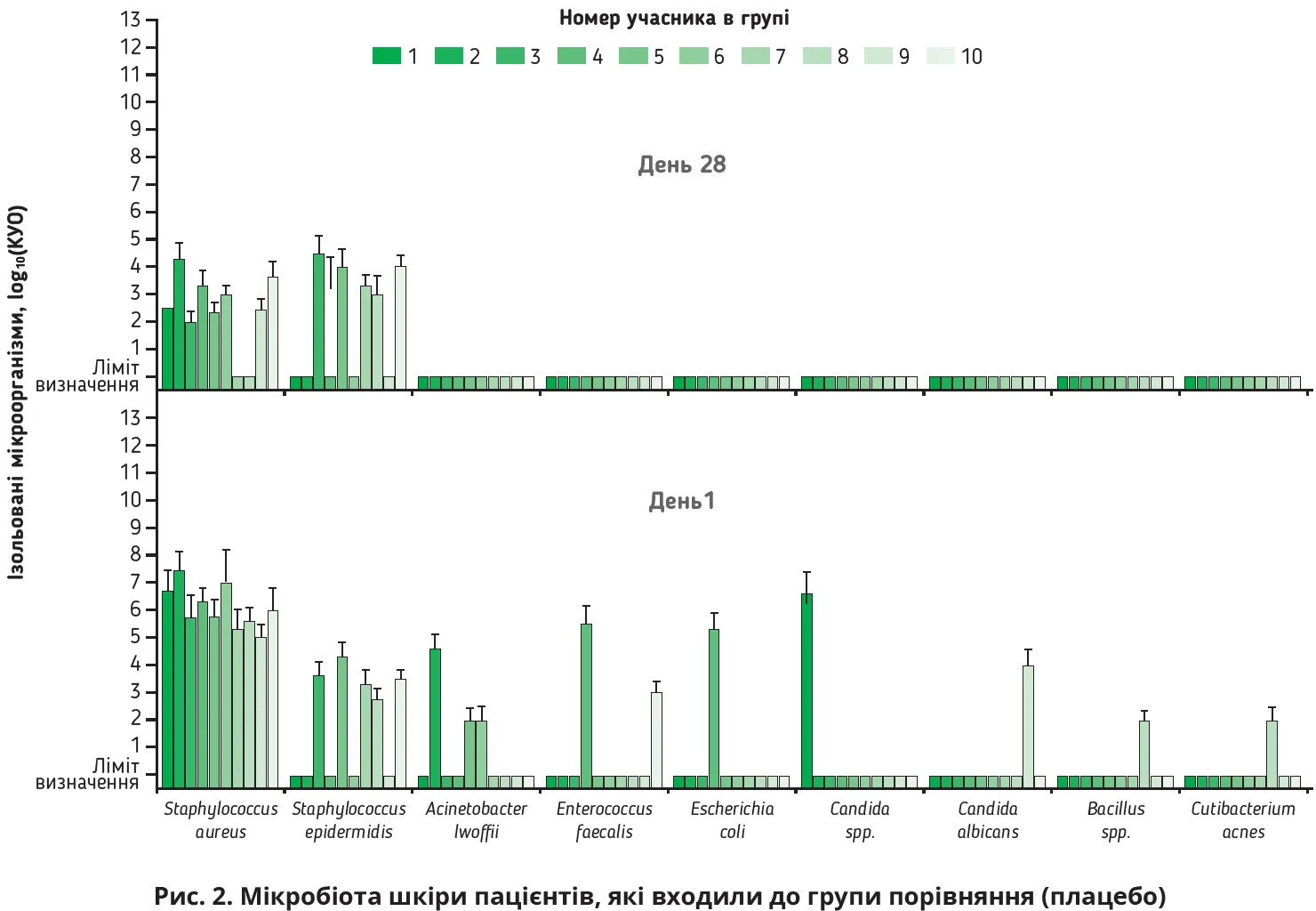
Аналізуючи отримані результати складу мікробіоти шкіри на 28-му добу лікування в групі порівняння (рис. 2), можна дійти висновку, що застосування синтетичного кортикостероїду місцевого застосування 0,1% мометазону фуроату також зумовило зміни складу шкірної мікробіоти. Кількість бактерій виду S. epidermidis не зменшилася, натомість істотно зменшилася кількість умовно-патогенних бактерій, а саме A. lwoffii, C. acnes та E. faecalis.
Обговорення
Додавання комбінації пробіотичних бактерій (L. helveticus, B. longum, L. rhamnosus – не менш ніж 5×109 КУО, S. boulardii – 125 мг), що є активною основою новітнього біопрепарату Неофлорум, протягом 28 днів до стандартної терапії (крем 0,1% мометазону фуроату) підвищує ефективність лікування атопічного дерматиту в дорослих, що підтверджується достовірним зниженням індексів SCORAD (р=0,03) та DLQI (p=0,02) порівняно з контрольною групою. На тлі призначеної комбінованої терапії пацієнти відзначали зменшення сухості шкіри, висипу та свербежу. Застосування саме комбінацій різних пробіотичних штамів, які описані в сучасній науковій літературі [9], є ефективнішим методом лікування атомічного дерматиту в дорослих. Зокрема, показано [10], що суміш Bifidobacterium animalis (підвид – lactis CECT 8145), B. longum (CECT 7347) і Lactobacillus casei (CECT 9104) є ефективнішою, ніж кожен штам окремо; це можна пояснити регуляцією імунної системи, конкурентним придушенням інвазивних мікроорганізмів, модифікацією патогенних токсинів або продуктів господаря та посиленням функції шкірного бар’єра. Також підкреслюється позитивний вплив пробіотичних штамів L. rhamnosus 19070-2 та Lactobacillus reuteri DSM 122460 на зниження тяжкості перебігу атопічного дерматиту [11]. Згідно з даними літератури пробіотичні препарати на основі Bifidobacterium spp. здатні знижувати свербіж шкіри; це може бути пов’язано з тим, що ці бактерії при регулярному надходженні в організм колонізують шкіру та на конкурентній основі мінімізують розмноження S. aureus й інших умовно-патогенних мікроорганізмів [12].
Аналізуючи результати дослідження впливу комбінованого препарату на мікробіоту шкіри, слід відзначити його ефективність не тільки стосовно грампозитивної біоти (S. aureus, E. faecalis), а й щодо умовно-патогенних дріжджоподібних грибів Candida spp., що свідчить про його протигрибкову дію.
За наявності у складі шкірної мікробіоти пацієнта коменсальних бактерій S. epidermidis після застосування комбінації пробіотичних мікроорганізмів спостерігали елімінацію умовно-патогенних бактерій і мікроскопічних грибів роду Сandida, при цьому відзначали суттєве зниження кількості грампозитивних бактерій S. aureus від 5×106 до 1×102 КУО та E. faecalis від 5×106 до 3×103 КУО, тоді як кількість коменсальних представників S. epidermidis не зменшувалася, а в 30% пацієнтів навіть збільшилася. Згідно з даними літератури окремі штами S. epidermidis виробляють протимікробні пептиди, які вибірково пригнічують ріст S. aureus. На сьогодні встановлено також інші механізми такої антагоністичної взаємодії між коменсальними й умовно-патогенними штамами стафілококів [13].
Висновки
Досліджуваний препарат не тільки має антибактеріальні властивості, а й здатний пригнічувати ріст умовно-патогенної грибкової мікробіоти. Нами не було виявлено умовно-патогенних представників мікроскопічних грибів роду Сandida після застосування цього препарату.
Зниження кількості S. aureus, наявність яких свідчить про розвиток атопічного дерматиту, зменшилася в усіх пацієнтів до ліміту визначення. Отже, комбіноване застосування Неофлоруму з кортикостероїдними препаратами для лікування атопічного дерматиту в дорослих є ефективнішим, оскільки дає змогу спрямовано відновлювати (нормалізувати) власний шкірний мікробіом пацієнта.
Література
- Lloyd-price J., Abu-ali G., Huttenhower C. The healthy human microbiome. Genome Medicine. 2016; 8.1: 1-11.
- Golubnitschaja O. Predictive diagnostics and personalized treatment: dream or reality. New York: Nova Biomedical Books, 2009; 147-150.
- Eyerich S., et al. Cutaneous barriers and skin immunity: differentiating a connected network. Trends in Immunology. 2018; 39.4: 315-327.
- Kaczynska A., et al. Promising immunomodulatory effects of bacterial lysates in allergic diseases. Frontiers in Immunology. 2022; 13: 907149.
- Byrd A.L., Belkaid Y., Segre J.A. The human skin microbiome. Nature Reviews Microbiology. 2018; 16.3: 143-155.
- Yue H., et al. Exogenous factors in the pathogenesis of atopic dermatitis: irritants and cutaneous infections. Clinical & Experimental Allergy. 2021; 51.3: 382-392.
- Luger T., et al. Atopic dermatitis: role of the skin barrier, environment, microbiome, and therapeutic agents. Journal of Dermatological Science. 2021; 102.3: 142-157.
- Wollenberg A., et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children:
part I. Journal of the European Academy of Dermatology and Venereology. 2018; 32.5: 657-682. - Li Y., et al. The efficacy of probiotics supplementation for the treatment of atopic dermatitis in adults: a systematic review and meta-analysis. Journal of Dermatological Treatment. 2022; 33.6: 2800-2809.
- Yang H.-J., et al. Efficacy of probiotic therapy on atopic dermatitis in children: a randomized, double-blind, placebo-controlled trial. Allergy, Asthma & Immunology Research. 2014; 6.3: 208-215.
- Rosenfeldt V., et al. Effect of probiotic Lactobacillus strains in children with atopic dermatitis. Journal of Allergy and Clinical Immunology. 2003; 111.2: 389-395.
- Findley K., et al. Topographic diversity of fungal and bacterial communities in human skin. Nature. 2013; 498.7454: 367-370.
- Nurxat N., et al. Commensal Staphylococcus epidermidis defends against Staphylococcus aureus through SaeRS two-component system. ACS Omega, 2023.