Ефективність монотерапії монтелукастом, комбінацією будесонід/формотерол і сполученням цих препаратів за кашльового варіанта бронхіальної астми
Переклала й адаптувала канд. мед. наук Лариса Стрільчук
Кашльовий варіант бронхіальної астми (КВБА) являє собою фенотип астми, який проявляється виключно або переважно кашлем і гіперреактивністю дихальних шляхів, але не свистячими хрипами чи задишкою [4]. Багатоцентрове дослідження показало, що КВБА є найпоширенішою (33% випадків) причиною хронічного кашлю [12]. Патогенетичними ланками КВБА, крім гіперреактивності дихальних шляхів, є їх еозинофільне запалення та ремоделювання [4, 7, 14, 19]. Вагому роль у цьому патогенезі відіграють цистеїнілові лейкотрієни, рівень яких у харкотинні зростає і при КВБА, і при класичній астмі [10, 19].
Як стартове лікування КВБА рекомендовано інгаляційні кортикостероїди (ІКС), за потреби в поєднанні з β2-агоністами [6, 17]. Як альтернативна чи допоміжна терапія рекомендовано також застосування антагоніста цистеїніл-лейкотрієнових рецепторів (АЦЛР) монтелукасту, котрий ефективно зменшує запалення дихальних шляхів і сприяє контролю астми. Рекомендації Європейського респіраторного товариства й Американської колегії лікарів, що спеціалізуються на хворобах грудної клітки, пропонують проводити пацієнтам із КВБА пробне лікування АЦЛР після неповної відповіді або відсутності відповіді на ІКС [6, 17]. Плацебо-контрольоване дослідження показало, що в пацієнтів із КВБА монтелукаст достовірно знижував частоту кашлю та сумарну оцінку інтенсивності кашлю на добу [20]. Проспективне дослідження M. Takemura та співавт. (2012) також виявило, що монтелукаст достовірно знижував інтенсивність кашлю за візуально-аналоговою шкалою (ВАШ) і кількість еозинофілів у харкотинні. Функція легень залишалася незмінною, а це свідчить про те, що протикашльовий ефект монтелукасту при КВБА є наслідком його протизапальної дії.
Це дослідження покликане вивчити та порівняти ефективність монотерапії монтелукастом, комбінацією будесонід/формотерол і сполученням цих препаратів у разі КВБА.
Дослідження було рандомізованим, відкритим і тривало 8 тижнів. До популяції учасників включили пацієнтів із КВБА та тривалим кашлем (>8 тижнів), без істотних відхилень від норми на рентгенограмі грудної клітки та позитивним ефектом бронходилятаторів короткої дії (збільшення об’єму форсованого видиху за першу секунду (ОФВ1) на >12%) чи позитивним провокаційним тестом із метахоліном.
Після скринінгу, який включав збір анамнезу, фізикальне, лабораторне й інструментальне обстеження, пацієнтів рандомізували в групи монтелукасту (група M, 10 мг 1 р/добу), будесоніду/формотеролу (група БФ, 160/4,5 мкг, 1 вдих 2 р/добу) чи монтелукасту та будесоніду/формотеролу (група МБФ). Лікування тривало 8 тижнів, і ще 8 тижнів – подальше спостереження. Із метою контролю результатів застосовувалися ВАШ для інтенсивності кашлю, оцінка інтенсивності кашлю (ОІК), визначення вмісту фракціонального оксиду азоту у видихуваному повітрі (FeNO), підрахунок клітин у індукованому харкотинні, спірометрія, провокаційні тести, в тому числі з капсаїцином, загальний аналіз крові. Через 8 тижнів після завершення лікування з пацієнтами зв’язувалися телефоном,
а за потреби запрошували на консультацію до клініки.
Було проведено скринінг 545 пацієнтів із хронічним кашлем, 99 із яких відповідали критеріям дослідження та були рандомізовані в групи лікування у співвідношенні 1:1:1. Групи були зіставними за демографічними та вихідними клінічними характеристиками. Кілька пацієнтів із різних груп (1 – із групи М, 2 – з групи БФ і 3 – з групи МБФ) припинили лікування в ході дослідження з різних причин.
Зміни інтенсивності кашлю за ВАШ та ОІК
Через 8 тижнів лікування в групі М спостерігалося достовірне зниження інтенсивності кашлю за ВАШ (із 6,0 до 2,0, p<0,001) та ОІК у денний (із 2,0 до 1,0, p<0,001) і нічний період (із 2,0 до 1,0, p=0,001). Достовірне зменшення інтенсивності кашлю спостерігалося також у групах БФ (ВАШ: із 5,0 до 1,0, p<0,001; ОІК у денний період: із 2,0 до 1,0, p<0,001; ОІК у нічний період: із 2,0 до 0,0, p<0,001) і МБФ (ВАШ: із 6,0 до 1,0, p<0,001; ОІК у денний період: із 2,0 до 1,0, p<0,001; ОІК у нічний період: з 1,0 до 0,0, p<0,001). Через 8 тижнів лікування достовірних міжгрупових відмінностей за цими показниками виявлено не було (рис. 1).
Чутливість кашльового рефлексу
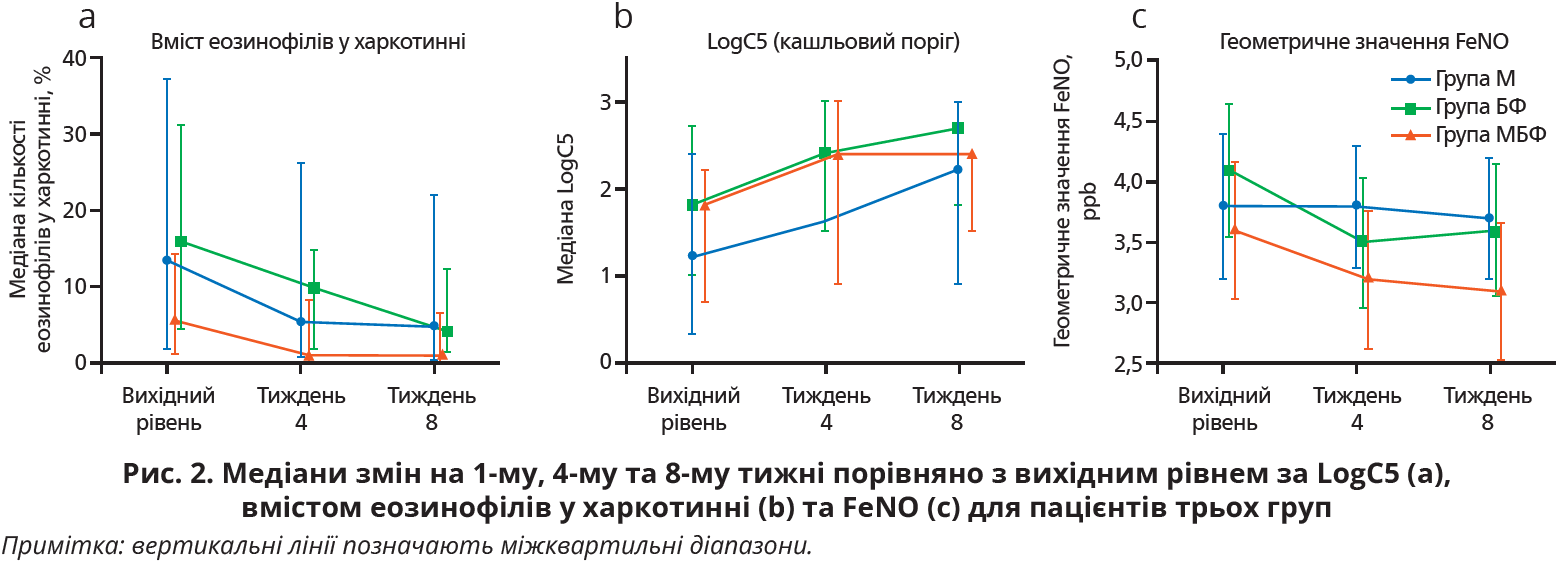
Поріг кашльового рефлексу (логарифмічне вираження найменшої концентрації подразника, яка спричинила ≥5 кашльових поштовхів) у групі М істотно зріс (з 1,2 до 2,2, p=0,017); середня зміна становила 0,6 (95% довірчий інтервал (ДІ) 0,1-1,0). У групі БФ цей поріг підвищився з 1,8 до 2,7 (p=0,033), середня зміна становила 0,5 (95% ДІ 0,0-0,9), а в групі МБФ – з 1,8 до 2,4 (p=0,019), середня зміна була аналогічною. Отже, чутливість кашльового рефлексу та середня зміна протягом лікування були приблизно однаковими в усіх групах (рис. 2).
Зміни вмісту еозинофілів у харкотинні та FeNO
У всіх трьох групах дослідження спостерігалося достовірне зниження вмісту еозинофілів у харкотинні порівняно з вихідним рівнем (група М: із 13,6 до 4,8%, група БФ: із 16,1 до 4,4%, група МБФ: із 5,8 до 1,0%). Слід зауважити, що частка пацієнтів, у яких уміст еозинофілів знизився до нормального рівня (<2,5%), у групі МБФ була достовірно вищою, ніж у групах М і БФ (52,2 проти 16,0 та 30,8% відповідно, обидва p<0,05). Найпотужніше зниження FeNO спостерігалося в групі МБФ і було достовірно вищим порівняно з обома іншими групами. Аналогічно достовірне покращення співвідношення ОФВ1 до форсованого життєвого об’єму легень (у середньому із 77,2 до 79,5%), максимальної швидкості видиху в середній фазі експіраторного акту (з 56,3 до 65,2%) і відсотка еозинофілів крові (з 4,3 до 3,5%) відзначалося лише в групі МБФ. Окрім того, в групі МБФ зменшення інтенсивності кашлю відбулося достовірно швидше, ніж у групах М і БФ, хоча різниця не досягла рівня істотності. Тяжких побічних ефектів не спостерігалося в жодній групі.
Спостереження після лікування
Восьмитижневий період подальшого спостереження повністю пройшли 87 пацієнтів (по 29 у кожній групі). Свистячі хрипи протягом цього періоду спостерігалися в 6,9% учасників групи М та 3,4% учасників групи БФ. Натомість у жодного пацієнта групи МБФ хрипів не виникло. Через 8 тижнів лікування 74 пацієнтам (22 – із групи М і по 26 – із груп БФ і МБФ) удалося повністю припинити протиастматичне лікування. Серед цих пацієнтів рецидиви кашлю виникли у 27,3% осіб групи М, 30,8% осіб групи БФ та 19,2% осіб групи МБФ. Для визначення впливу різних видів лікування на подальший прогноз пацієнтів із КВБА потрібні подальші дослідження з тривалим спостереженням.
Отже, автори виявили, що монотерапія монтелукастом може ефективно зменшувати інтенсивність кашлю за ВАШ та ОІК у денний і нічний періоди, підвищувати поріг чутливості в провокаційних тестах із капсаїцином і зменшувати вміст еозинофілів у харкотинні. Крім того, монотерапія монтелукастом продемонструвала високу протикашльову та протизапальну ефективність, зіставну із застосуванням комбінації ІКС і β-агоніста тривалої дії (БАТД) чи сполучення монтелукасту із цією комбінацією. У пацієнтів, які отримували монтелукаст і комбінацію ІКС/БАТД, спостерігалося достовірне покращення показників функції легень і зменшення вмісту еозинофілів у периферичній крові.
Відповідно до отриманих результатів відмінностей між ступенем зменшення інтенсивності кашлю за ВАШ та ОІК у денний і нічний періоди не спостерігалося. Протикашльовий ефект монтелукасту при КВБА був аналогічним такому комбінації будесонід/формотерол і навіть ефекту поєднання цієї комбінації з монтелукастом. Це свідчить про те, що АЦЛР можуть бути хорошою альтернативою для дітей або пацієнтів похилого віку, не здатних опанувати методику інгаляції, або для осіб, які не можуть приймати ІКС у зв’язку з побічними ефектами. Проте настання покращення було швидшим у групі МБФ, в основі чого може лежати швидке настання ефекту БАТД.
Показано, що монотерапія монтелукастом здатна ефективно зменшувати еозинофільне запалення дихальних шляхів [22, 23], а це дуже важливо, оскільки нещодавні дослідження виявили, що еозинофіли можуть взаємодіяти з чутливими нервовими волокнами дихальних шляхів і сприяти збільшенню їхньої щільності та ремоделюванню. Цей механізм, імовірно, лежить в основі патогенезу гіперчутливості дихальних шляхів і посилення кашлю [1, 3, 5, 8].
Як і в попередніх дослідженнях, виявилося, що 8-тижнева монотерапія монтелукастом достовірно підвищує поріг чутливості кашльового рефлексу в пацієнтів із КВБА, не покращуючи, втім, показники спірометрії. Це може означати, що механізм дії монтелукасту полягає в зменшенні чутливості дихальних шляхів, а не в зменшенні ступеня бронхоконстрикції. Імовірно, це зменшення чутливості опосередковане зниженням вивільнення нейронами субстанції P [13, 15].
У цьому дослідженні зменшення інтенсивності кашлю передувало об’єктивним покращенням (зменшенню вмісту еозинофілів у харкотинні та підвищенню порогу кашльового рефлексу). Через 8 тижнів лікування вже спостерігалися й достовірні зміни об’єктивних показників; це свідчить про те, що така тривалість курсу терапії може бути оптимальною для лікування КВБА. Проте це потребує підтвердження в подальших дослідженнях.
Додавання АЦЛР до ІКС підвищує ефективність лікування порівняно з монотерапією ІКС у веденні класичної астми [24]. Що стосується КВБА, то АЦЛР рекомендовані як додаткові препарати або препарати для ескалації лікування тоді, коли кашель не вдається подолати за допомогою ІКС [6, 17]. Причини відмінностей в ефекті АЦЛР у разі КВБА та класичної астми залишаються невстановленими; ймовірно, вони опосередковані різною вираженістю еозинофільного запалення [21].
У 10 пацієнтів через 8 тижнів лікування так і не було досягнуто повного усунення кашлю. У 3 осіб із цих 10 кашель удалося остаточно зупинити через ще 4 тижні протиастматичної терапії. Рекомендації Європейського респіраторного товариства й Американської колегії лікарів, що спеціалізуються на хворобах грудної клітки, та китайської робочої групи з астми вказують, що КВБА слід лікувати щонайменше 8 тижнів [2, 9, 16]. Однак у цьому дослідженні еозинофілія харкотиння збереглася в понад 60% пацієнтів, які отримували ІКС/БАТД, і приблизно в половини пацієнтів, які отримували комбіноване лікування (ІКС/БАТД й АЦЛР), а отже, 8 тижнів може бути недостатньо для усунення запалення дихальних шляхів у разі КВБА. Тож оптимальна тривалість протиастматичної терапії в цього контингенту пацієнтів залишається невідомою.
Протягом періоду спостереження після лікування було відзначено тенденцію до меншої частоти рецидивів у групі комбінованої терапії порівняно з групами монотерапії монтелукастом чи ІКС/БАТД. Окрім того, в жодного пацієнта групи комбінованої терапії не спостерігалося прогресування хвороби з появою свистячих хрипів. Відомо, що еозинофілія харкотиння є чинником ризику прогресування КВБА до класичної астми [11]. Відповідно до отриманих результатів у групі пацієнтів, які отримували монтелукаст й ІКС/БАТД, через 8 тижнів лікування спостерігалися значно нижча частка осіб із наявністю еозинофілів у харкотинні та достовірне зниження вмісту еозинофілів у крові, хоча відмінностей у оцінці інтенсивності кашлю, порозі кашльового рефлексу чи функції легень не спостерігалося. Автори припускають, що саме зменшення запалення дихальних шляхів, а не повне припинення кашлю, ймовірніше пов’язане з короткотерміновим прогнозом КВБА.
Висновки
- Монтелукаст здатен ефективно зменшувати
кашель, підвищувати поріг чутливості кашльового рефлексу та знижувати вираженість еозинофільного запалення дихальних шляхів у пацієнтів із КВБА.
- Протикашльова та протизапальна ефективність монтелукасту відповідають аналогічним показникам комбінації будесонід/формотерол і сполученої терапії наведеною комбінацією й монтелукастом. Отже, монотерапія монтелукастом може бути хорошою терапевтичною альтернативою для пацієнтів із КВБА.
- Сполучена терапія монтелукастом і комбінацією будесонід/формотерол дає змогу досягти додаткового покращення функції легень і зменшення вмісту еозинофілів периферичної крові.
Література
- Adamko D., Yost B., Gleich G., Fryer A., Jacoby D.J. Ovalbumin sensitization changes the inflammatory response to subsequent parainfluenza infection. Eosinophils. 1999; 190 (10): 1465-78.
- Asthma Workgroup CS, Respiratory, Diseases (CSRD), Chinese Medical Association. The Chinese national guidelines on diagnosis and management of cough (December 2010). Chin. Med. J. (Engl.). 2011; 124: 3207-19.
- Belvisi M., Birrell M., Khalid S., Wortley M., Dockry R., Coote J., et al. Neurophenotypes in airway diseases. Insights from translational cough studies. Am. J. Respir. Crit. Care Med. 2016; 193: 1364-72.
- Corrao W.M., Braman S.S., Irwin R.S. Chronic cough as the sole presenting manifestation of bronchial asthma. N. Engl. J. Med. 1979; 300: 633-7.
- Costello R.W., Schofield B.H., Kephart G.M., Gleich G.J., Jacoby D.B., Fryer A.D. Localization of eosinophils to airway nerves and effect on neuronal M2 muscarinic receptor function.
Am. J. Physiol. 1997; 273 (1, Pt. 1): L93-103.
- Côté A., Russell R., Boulet L., Gibson P., Lai K., Irwin R., et al. Managing chronic cough due to asthma and NAEB in adults and adolescents: CHEST guideline and expert panel report. Chest. 2020; 158: 68-96.
- De Diego A., Martínez E., Perpiñá M., Nieto L., Compte L., Macián V., et al. Airway inflammation and cough sensitivity in cough-variant asthma. Allergy. 2005; 60: 1407-11.
- Gu Q., Wiggers M.E., Gleich G.J., Lee L.Y. Sensitization of isolated rat vagal pulmonary sensory neurons by eosinophil-derived cationic proteins. Am. J. Physiol. Lung Cell Mol. Physiol. 2008; 294: L544-52.
- Irwin R.S., Baumann M.H., Bolser D.C., Boulet L.P., Braman S.S., Brightling C.E., et al. Diagnosis and management of cough executive summary: ACCP evidence-based clinical practice guidelines. Chest. 2006; 129 (1 Suppl.): 1s-23s.
- Kazani S., Sadeh J., Bunga S., Wechsler M.E., Israel E. Cysteinyl leukotriene antagonism inhibits bronchoconstriction in response to hypertonic saline inhalation in asthma. Respir. Med. 2011; 105: 667-73.
- Kim C.K., Kim J.T., Kang H., Yoo Y., Koh Y.Y. Sputum eosinophilia in cough-variant asthma as a predictor of the subsequent development of classic asthma. Clin. Exp. Allergy. 2003; 33: 1409-14.
- Lai K., Chen R., Lin J., Huang K., Shen H., Kong L., et al. A prospective, multicenter survey on causes of chronic cough in China. Chest. 2013; 143: 613-20.
- Lai Y.L., Lee S.P. Mediators in hyperpnea-induced bronchoconstriction of guinea pigs. Naunyn Schmiedebergs Arch. Pharmacol. 1999; 360: 597-602.
- Matsumoto H., Niimi A., Tabuena R.P., Takemura M., Ueda T., Yamaguchi M., et al. Airway wall thickening in patients with cough variant asthma and nonasthmatic chronic cough. Chest. 2007; 131: 1042-9.
- McAlexander M.A.M.A., Undem B.J. Inhibition of 5-lipoxygenase diminishes neurally evoked tachykinergic contraction of guinea pig isolated airway. J. Pharmacol. Exp. Ther. 1998; 285: 6.
- Morice A. The diagnosis and management of chronic cough. Eur. Respir. J. 2004; 24: 481-92.
- Morice A.H., Millqvist E., Bieksiene K., Birring S.S., Dicpinigaitis P., Ribas C.D., et al. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children. Eur. Respir. J. 2020; 2 (55): 1901136.
- Niimi A., Matsumoto H., Minakuchi M., Kitaichi M., Amitani R. Airway remodelling in cough-variant asthma. Lancet. 2000; 356: 564-5.
- Niimi A. Cough, asthma, and cysteinyl-leukotrienes. Pulm. Pharmacol. Ther. 2013; 26: 514-9.
- Sheldon L., Spector M., Ricardo A., Tan M.D. Effectiveness of montelukast in the treatment of cough variant asthma. Ann. Allergy Asthma Immunol. 2004; 93: 232-6.
- Tajiri T., Niimi A., Matsumoto H., Ito I., Oguma T., Otsuka K., et al. Prevalence and clinical relevance of allergic rhinitis in patients with classic asthma and cough variant asthma. Respiration. 2014; 87: 211-8.
- Takemura M., Niimi A., Matsumoto H., Ueda T., Matsuoka H., Yamaguchi M., et al. Clinical, physiological and anti-inflammatory effect of montelukast in patients with cough variant asthma. Respiration. 2012; 83: 308-15.
- Tamaoki J., Yokohori N., Tagaya E., Kirishi S., Miyamoto Y., Ochiai K., et al. Comparable effect of a leukotriene receptor antagonist and long-acting beta(2)-adrenergic agonist in cough variant asthma. Allergy Asthma Proc. 2010; 31: 78-84.
- Vaquerizo M.J., Casan P., Castillo J., Perpiña M., Sanchis J., Sobradillo V., et al. Effect of montelukast added to inhaled budesonide on control of mild to moderate asthma. Thorax. 2003; 58: 204-10.
Освітньо-практичний журнал Allergy Practice №1 2023р.