Діагностика алергії на вкритих шерстю тварин
Частина 1
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
 Діагностика алергії, в тому числі на вкритих шерстю тварин, не завжди є простою, оскільки дуже часто симптоми пацієнта не відповідають результатам діагностичних обстежень. Вибір методу діагностики має ґрунтуватися на індивідуальному підході, тобто забезпечувати якомога більш ранню діагностику та якомога менший стрес для пацієнта. Водночас варто враховувати вартість і доступність методу.
Діагностика алергії, в тому числі на вкритих шерстю тварин, не завжди є простою, оскільки дуже часто симптоми пацієнта не відповідають результатам діагностичних обстежень. Вибір методу діагностики має ґрунтуватися на індивідуальному підході, тобто забезпечувати якомога більш ранню діагностику та якомога менший стрес для пацієнта. Водночас варто враховувати вартість і доступність методу.
Базові діагностичні моделі в алергології
Алергодіагностика передбачає дві базові діагностичні стратегії: висхідну (bottom-up) і низхідну (top-down) (рис.). Звісно, не кожен клінічний випадок можна віднести чітко до тієї чи іншої моделі.
Низхідна діагностична модель передусім фокусується на симптомах, які привели пацієнта до лікаря. На підставі ретельного збору анамнезу та фізикального обстеження лікар обирає діагностичні тести для тих окремих алергенів, які є найімовірнішими етіологічними чинниками хвороби. Першим обстеженням у цій моделі зазвичай є шкірні тести з екстрактами алергенів, що не дають змоги зрозуміти, які конкретно молекули/речовини запускають патогенез алергії та якої крос-реактивності слід очікувати. У цій моделі найбільше значення має досвід лікаря.
Висхідна стратегія розпочинається з максимально детального встановлення профілю специфічних алергенів конкретного пацієнта. Лише після цього лікар збирає докладний анамнез на підставі концентрацій антигенспецифічних імуноглобулінів E (асIgE).
Нещодавно було запропоновано ще третю діагностичну модель: U-подібну молекулярну діагностику. Вона передбачає початок з поєднання клінічних даних з результатами молекулярних тестів і продовження діагностики зі врахуванням потенційної крос-реактивності. Молекулярна діагностика може передбачати виявлення окремих асIgE (синглплекс) або великих молекулярних панелей (мультиплекс).
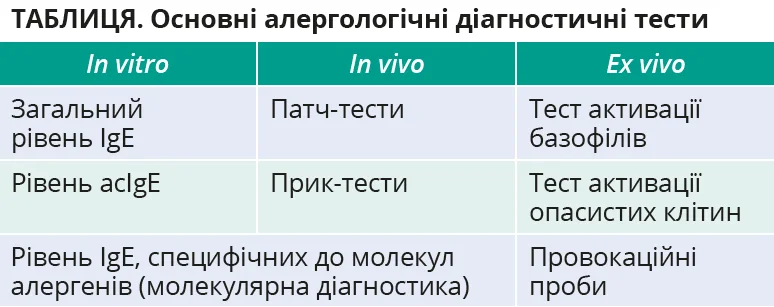
Основні алергологічні діагностичні тести представлено в таблиці.
Шкірні тести є найпоширенішими обстеженнями в алергодіагностиці. До них належать шкірні прик-тести, прик-тести з нативним алергеном (prick-by-prick), інтрадермальні тести та тести з епідермальними патчами.
Шкірні прик-тести проводяться в амбулаторних умовах і забезпечують результат упродовж 15 хвилин, але цей недорогий діагностичний метод має багато недоліків. Передусім він здатен лише підтвердити наявність асIgE до певного джерела алергенів у плазмі пацієнта, однак не здатен виявити, яка конкретно молекула (алергенний компонент) запускає патогенез алергії. Описано також значні відмінності в доступних у продажі екстрактах для прик-тестів, що може призводити до неточностей у результатах.
Велике значення має правильна підготовка пацієнта до цього обстеження, зокрема скасування фармакопрепаратів, які можуть вплинути на результат. У разі підозри на алергію на вкритих шерстю тварин з огляду на анамнез шкірні тести є хорошим вибором як скринінговий метод. Теоретично можна провести шкірні тести з конкретними алергенними компонентами, але для алергії на вкритих шерстю тварин такі реактиви відсутні.
Прик-тести з нативним антигеном (prick-by-prick) являють собою простий діагностичний метод, подібний до звичайного прик-тесту. Єдина відмінність полягає в тому, що спочатку той ланцет, яким проводитиметься прокол шкіри, контактує з антигеном (ним проколюють продукт, який спричиняє алергію, або занурюють у молоко). Протипоказання, обмеження й інтерпретація результатів відповідають параметрам для звичайних прик-тестів. У ході діагностики алергії на вкритих шерстю тварин перед прик-тестом з нативним антигеном ланцет слід потерти об шерсть тварини або, навпаки, спочатку зробити прокол, а потім потерти цю ділянку шерстю тварини. Значним недоліком цього методу є можливість забруднення шерсті алергенами з інших джерел.
Інтрадермальні тести переважно застосовуються для виявлення гіперчутливості до ліків та отрути перетинчастокрилих комах. У діагностиці алергії на вкритих шерстю тварин вони не застосовуються.
Нашкірні патч-тести мають ключове значення в діагностиці антитілонезалежної алергії, в основі якої лежить IV тип гіперчутливості за Джеллом і Кумбсом. Зазвичай ці тести проводяться на шкірі спини, а за неможливості цього – на шкірі плеча чи стегна.
Найпоширенішим методом алергодіагностики in vitro є визначення асIgE. АсIgE можуть зв’язувати екстракти алергенів або алергенні компоненти (нативні чи рекомбінантні). Екстракти алергенів являють собою суміш різних молекул, включно з неалергічними. Склад цих екстрактів може відрізнятися залежно від нативного матеріалу, методу приготування або особливостей зберігання. Визначення асIgE до екстрактів алергенів дають можливість встановити джерело алергену, але не потенційні перехресні реакції, що утруднює надання рекомендацій пацієнту. Подолати це обмеження можна за допомогою молекулярної діагностики із застосуванням алергенних компонентів, тобто молекул з відомим алергенним потенціалом. Багатокомпонентні тести дають змогу з’ясувати індивідуальний молекулярно-алергічний профіль пацієнта за одне обстеження.
У виявленні алергії на вкритих шерстю тварин успішно застосовується тест ImmunoCAP синглплекс (32 параметри). Цьому методу властиві найвищі чутливість і специфічність, що робить його золотим стандартом діагностики. Він також застосовується як референсний метод для інших аналізів. Обираючи найімовірніші причинні екстракти й алергенні компоненти, слід ретельно зібрати анамнез і провести фізикальне обстеження. У разі клінічної підозри на гіперчутливість до якоїсь конкретної тварини мультиплексні тести є недоцільними для встановлення діагнозу, хоча вони можуть надати додаткову інформацію. Тест ImmunoCAP ISAC E112i включає лише алергенні компоненти (нативні та рекомбінантні), 16 з яких стосуються тварин, укритих шерстю. Більшість з них можна визначити окремо у складі тесту ImmunoCAP.
Тест активації базофілів є найсучаснішим методом діагностики IgE-залежної алергії. У сенсибілізованих осіб В-лімфоцити продукують асIgE, які зв’язуються з поверхневими рецепторами різних клітин, у тому числі базофілів. Унаслідок цього відбувається активація цих клітин з вивільненням умісту внутрішньоклітинних гранул. Базофіли можуть активуватися у відповідь на екстракти алергенів або алергенні компоненти. Застосування алергенних компонентів дає змогу виявити конкретну молекулу, відповідальну за симптоми гіперчутливості, та передбачити перехресні реакції, але водночас не дає можливості виявити алергію на інші молекули, включно з тими, які ще не були ізольовані та будуть присутні лише в екстрактах алергенів.
Тест активації базофілів застосовується для діагностики гострих негайних алергічних реакцій переважно на ліки, продукти й отруту перетинчастокрилих комах. Цьому методу притаманні дуже високі чутливість і специфічність; також він відіграє важливе значення в моніторингу імуномодуляторної терапії. Наявні літературні дані вказують, що тест активації базофілів може доповнювати інші обстеження, зменшуючи гіпердіагностику алергії на собак, хоча ефективність і фармакоекономічна доцільність цього методу у виявленні алергії на шерсть тварин остаточно не доведені. Станом на тепер тест активації базофілів використовується в діагностиці цього виду алергії переважно в клінічних дослідженнях
і найчастіше стосується алергії на котів і собак. Очікується, що покращення стандартизації цього тесту, збільшення його доступності та зниження вартості зроблять його цінною альтернативою стандартним провокаційним пробам у діагностиці алергії на шерсть тварин.
Тест активації опасистих клітин є ще одним методом, покликаним удосконалити діагностику IgE-опосередкованих алергій і зменшити кількість хибнопозитивних результатів. У ході виконання цього тесту опасисті клітини, отримані від здорового донора та культивовані в стандартних лабораторних умовах, сенсибілізують сироваткою пацієнта. Після цього асIgE, експресовані в сироватці, зв’язуються з рецепторами на поверхні опасистих клітин. На наступному етапі аналізу сенсибілізовані клітини стимулюють алергеном. Якщо плазма пацієнта містить IgE, специфічні до цього алергену, опасисті клітини активуються з розвитком дегрануляції. Перевагою тесту активації опасистих клітин над тестом активації базофілів є можливість використання свіжозамороженої плазми, яку можна безпечно транспортувати в лабораторні центри. Дані щодо застосування тесту активації опасистих клітин у діагностиці алергії на шерсть тварин відсутні.
Провокаційні проби являють собою інтравітальну оцінку відповіді окремих органів на причинні алергени. Залежно від природи алергена (харчовий, аероалерген, медикамент тощо) та симптомів пацієнта застосовуються різні шляхи введення цього алергена в організм: оральний, назальний, кон’юнктивальний, бронхіальний. Хоча провокаційні тести вважаються золотим стандартом у діагностиці алергії, їх проводять відносно рідко у зв’язку з високим ризиком розвитку побічних ефектів і значними затратами грошей і часу. Провокаційні проби не проводяться для пацієнтів, які мали анафілаксію у відповідь на причинний алерген, оскільки в цій ситуації ризик значно перевищує діагностичну цінність. Слід також зважати, що на результат тесту можуть вплинути препарати, які приймає пацієнт, а також його хронічні та гострі хвороби. Зазвичай провокаційні проби застосовуються в разі суперечливих результатів інших алергологічних аналізів, а також як спроба з’ясувати, чи дало проведене лікування змогу сформувати толерантність до цього алергена.
Наразі стандарти проведення й інтерпретації провокаційних тестів відсутні, а публікацій щодо застосування цього методу в діагностиці алергії на шерсть тварин надзвичайно мало. Імовірно, в цьому контексті найбільшу цінність матимуть назальні та бронхіальні провокаційні тести, оскільки більшість алергенів тварин є аероалергенами, а прояви алергії стосуються дихальної системи.
Золотим стандартом для провокаційних проб на аероалергени є проба в спеціальній камері, в якій формується контрольоване середовище з певною концентрацією аероалергена. Концентрація має бути досить високою для того, щоби спричинити алергічну реакцію незначної тяжкості; крім того, її потрібно підтримувати на стабільному рівні протягом кількох годин. Камера для провокаційних проб дає змогу одночасно провести провокацію симптомів з боку верхніх і нижніх дихальних шляхів, очей і шкіри. У ході обстеження доцільно провести суб’єктивну оцінку стану пацієнта й об’єктивні діагностичні тести (спірометрію, риноманометрію, лабораторні дослідження).
Hossenabaccus і співавт. описали три провокаційні методи виявлення алергії на котів: природне приміщення, де перебуває кіт, застосування камери для провокаційних проб і назальна провокаційна проба. Природний контакт із приміщенням, де перебуває кіт, відіграє важливу роль у виявленні алергічного риніту, асоційованого з алергенами котів. Такі приміщення зазвичай являють собою невеликі кімнати, в яких перебувають 1-2 стерилізовані коти з лотком чи без нього. Безпосередньо під час провокаційної проби коти перебувають у клітках усередині кімнати або вільно рухаються в ній. На жаль, стандартизувати такі кімнати дуже складно, що значно впливає на точність результату.
Література
Rosada T., Lis K., Bartuzi Z., Grześk-Kaczyńska M., Ukleja-Sokołowska N. Diagnostics of allergy to furry animals – possibilities in 2024. Journal of Clinical Medicine. 2024; 13 (11): 3239. doi: 10.3390/jcm13113239.