Біластин: оптимізація контролю кропив’янки
Підготувала лікарка-алерголог Ірина Калікіна
 У матеріалі наведено основні тези лекції професора Torsten Zuberbier «Біластин: оптимізація контролю кропив’янки», яка була представлена в межах Міжнародного міждисциплінарного конгресу «Інноваційні підходи до специфічної діагностики та терапії алергічних захворювань» проєкту «Життя без алергії. INTERNATIONAL». У лекції розглядалися головні підходи до лікування кропив’янки на підставі сучасних міжнародних керівних принципів і останніх наукових досліджень.
У матеріалі наведено основні тези лекції професора Torsten Zuberbier «Біластин: оптимізація контролю кропив’янки», яка була представлена в межах Міжнародного міждисциплінарного конгресу «Інноваційні підходи до специфічної діагностики та терапії алергічних захворювань» проєкту «Життя без алергії. INTERNATIONAL». У лекції розглядалися головні підходи до лікування кропив’янки на підставі сучасних міжнародних керівних принципів і останніх наукових досліджень.
Створення керівних принципів лікування кропив’янки розпочалося 2000 року з ініціативи 6 професорів, на першій зустрічі були присутні 100 учасників з 15 країн. Настанови систематично переглядаються що 4 роки (2004, 2008, 2012, 2020, 2024). На сьогодні ми ще користуємося рекомендаціями перегляду 2020 року [1], проте нові рекомендації вже мають стати доступними широкому колу у вересні – жовтні цього року. Професор Torsten Zuberbier підкреслює, що антигістамінні препарати (АГП) були в центрі уваги від самого початку.
Понад 150 років тому Пауль Ерліх відкрив тучні клітини, які є ключовими в розвитку кропив’янки. Вони можуть активуватися різними шляхами (в нормі для нашого захисту), зокрема й через аномальні механізми (автоалергічні), наприклад:
- тип I: IgE проти власних білків організму;
- тип IIb: антитіла IgG проти IgE або їхніх рецепторів.
Кропив’янка також може запускатися під впливом алергену (IgE-залежний механізм), але це відбувається значно рідше.
Концепція мінімального стійкого запалення. Мінімальне стійке запалення – це явище, за якого повторний вплив низьких рівнів алергену не спричиняє алергічних симптомів, але зумовлює стан підвищеної чутливості до подальшого впливу алергену та субклінічного запалення. Цей тип запалення описував професор Giorgio Walter Canonica в пацієнтів з астмою [2], коли незначний подразник чи легкий контакт з алергеном раптово спричиняє напад. Утім, те саме відбувається при атопічному дерматиті та кропив’янці.
У лікуванні кропив’янки важливо пам’ятати: навіть коли шкіра має здоровий вигляд, можуть залишатися активні клітини, що створюють стан мінімального стійкого запалення. Це робить шкіру більш схильною до повторних спалахів, загострень і вказує на потребу тривалішого лікування, ніж думають пацієнти.
Терапевтичний підхід до лікування хронічної кропив’янки має включати:
- пошук і, якщо можливо, усунення основних причин;
- уникнення провокувальних факторів, зменшення активності хвороби;
- індукцію толерантності, що також сприяє зменшенню активності хвороби;
- застосування фармакологічного лікування для запобігання вивільненню медіаторів тучних клітин та/або впливу їхніх медіаторів.
Професор Torsten Zuberbier наголошує, що не всі принципи можна реалізувати при хронічній спонтанній кропив’янці (наприклад, індукція толерантності або усунення причин), тому основним залишається фармакологічне лікування.
До механізмів псевдоалергічної кропив’янки належать вплив ароматичних речовин харчових продуктів [3], деяких ліків (як-от аспірину), стан шлунка та стравоходу (крім ерадикації гелікобактера важливою є саме відсутність запалення), вираженіша експресія X2-рецептора тучних клітин [4].
Оцінка активності хвороби. Професор рекомендує використовувати щоденну оцінку активності кропив’янки (UAS – Urticaria Activity Score) замість тижневої суми (UAS7), оскільки це дає змогу виявити покращення в окремі дні, які можуть «губитися» в тижневій сумі, а також точніше оцінити вплив конкретних провокувальних факторів на перебіг хвороби.
Принципи лікування кропив’янки, які зберігаються в настановах:
- повний контроль симптомів;
- використання сучасних АГП II покоління як першої лінії терапії.
Torsten Zuberbier категорично не радить використовувати в терапії АГП I покоління через їхню здатність порушувати фази сну, що впливає на навчання та пам’ять. Особливо це шкідливо для дітей шкільного віку.
До 1979 року всі препарати мали седативну дію. У 1980-х з’явилися цетиризин і лоратадин. Найновішими препаратами є дезлоратадин, левоцетиризин, рупатадин і наймолодший у родині – біластин (рис. 1).
Які властивості повинен мати ідеальний АГП?
- Потужна та селективна блокувальна активність H1-рецепторів.
- Швидкий початок і тривала дія.
- Ефективність при алергічному ринокон’юнктивіті проти всіх симптомів.
- Відсутність взаємодії з цитохромом P450.
- Відсутність седативного ефекту, когнітивних або психомоторних порушень.
- Відсутність антихолінергічної активності.
- Безпечність для серцево-судинної системи.
- Відсутність потенціалу до тахіфілаксії (зниження чутливості до препарату).
Професор Torsten Zuberbier зазначає, що ці критерії взято з рекомендацій ARIA (Allergic Rhinitis and its Impact on Asthma), проте є однаково важливими для лікування кропив’янки.
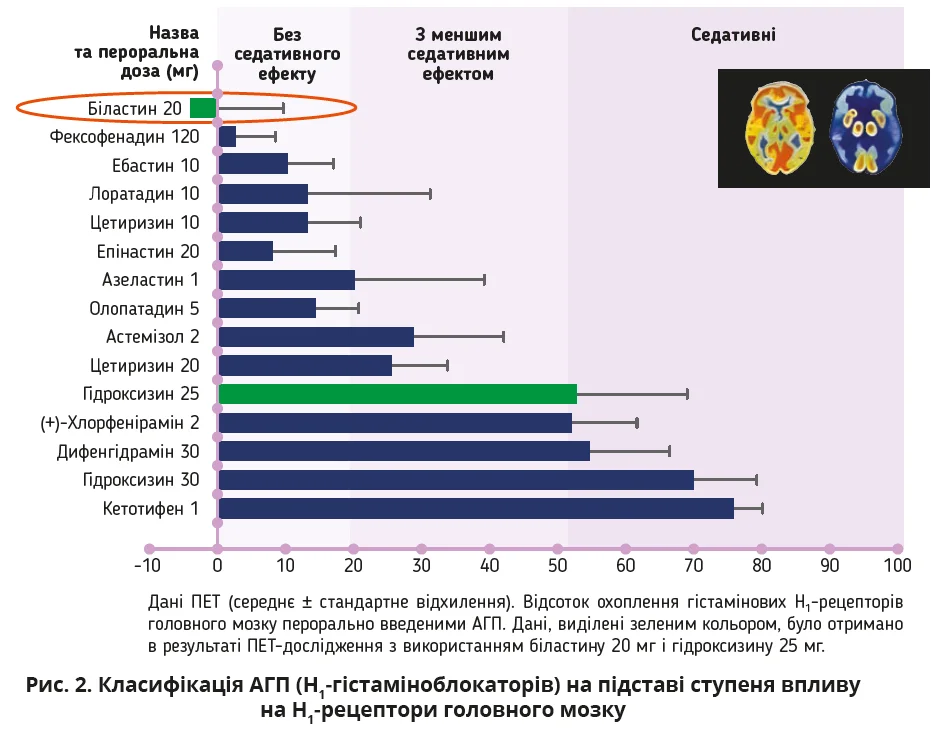
Біластин як препарат вибору. Біластин повністю відповідає всім зазначеним критеріям. Він демонструє найвищу спорідненість до H1-рецепторів серед усіх АГП й активно виводиться з мозку через гематоенцефалічний бар’єр [5, 6].
Здатність АГП проникати крізь гематоенцефалічний бар’єр має критичне значення для розуміння седативних властивостей. Гістамін у мозку відіграє важливу роль у підтриманні стану неспання. Коли АГП блокує гістамінові рецептори в мозку, це призводить до відчуття втоми та седації.
За даними позитронно-емісійної томографії (ПЕТ) біластин демонструє нульовий рівень охоплення H1-гістамінових рецепторів головного мозку при пероральному прийманні в дозі 20 мг. Частота появи сонливості на тлі приймання біластину статистично не відрізнялася від такої при застосуванні плацебо (рис. 2).
Унікальність біластину полягає в тому, що він активно виводиться з мозкової тканини через спеціальні транспортні системи гематоенцефалічного бар’єра та забезпечує максимальний захист від центральних ефектів. Саме ця властивість дає змогу безпечно підвищувати дозування біластину без ризику розвитку седації, на відміну від інших АГП. Біластин не впливає на здатність керувати автомобілем навіть у підвищених дозах [7] і має високий профіль безпеки.
Значною перевагою біластину є можливість безпечного підвищення дози (до 4 таблеток на день). Особливо показовими є результати дослідження при індукованій холодом кропив’янці, оскільки цю форму хвороби зручно вивчати за допомогою стандартизованих холодових провокаційних тестів з визначенням критичної температури (рис. 3). Повна відповідь на лікування (відсутність папул і свербежу при найнижчій температурі 4 °C) зростає з 35% на дозуванні біластину 20 мг до 60% при призначенні біластину в дозі 80 мг [8].
У дослідженні BUCUM використовувалася мікродіалізна техніка для вивчення потоку цитокінів і гістаміну в шкірі, що дало змогу об’єктивно оцінити протизапальні властивості біластину (рис. 4).
За результатами дослідження, підвищені дози біластину демонструють здатність контролювати вивільнення ключових медіаторів запалення з тучних клітин. При порівнянні показників до та після провокаційного холодового тесту виявлено зниження рівнів інтерлейкіну-6 (ІЛ-6) й ІЛ-8 при застосуванні біластину в дозах 20 і 80 мг порівняно з контрольною групою. Ці дані є надзвичайно важливими, оскільки демонструють, що підвищені дози біластину мають додаткові протизапальні властивості, які виходять за межі лише блокади гістамінових рецепторів.
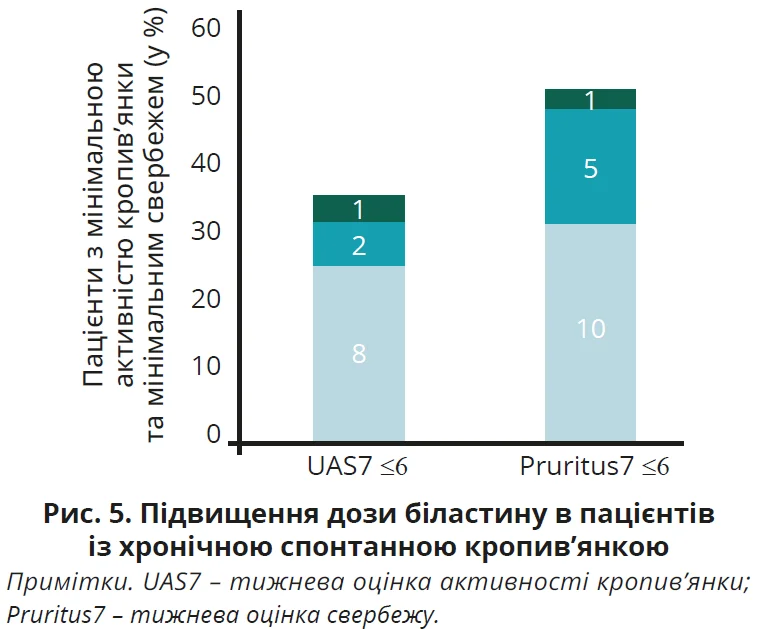
При хронічній спонтанній кропив’янці підвищення дози біластину також сприяє значному збільшенню кількості пацієнтів, що досягають контролю симптомів [9] (рис. 5).
Важливим є й той факт, що за всі роки клінічного застосування не зафіксовано жодного випадку токсичності при підвищенні дозування біластину; це підтверджує його високий профіль безпеки навіть за збільшення стандартної дози.
Підвищені дози біластину мають додаткові протизапальні властивості, контролюючи цитокіни тучних клітин, що робить монотерапію ефективнішою, ніж комбінування різних АГП.
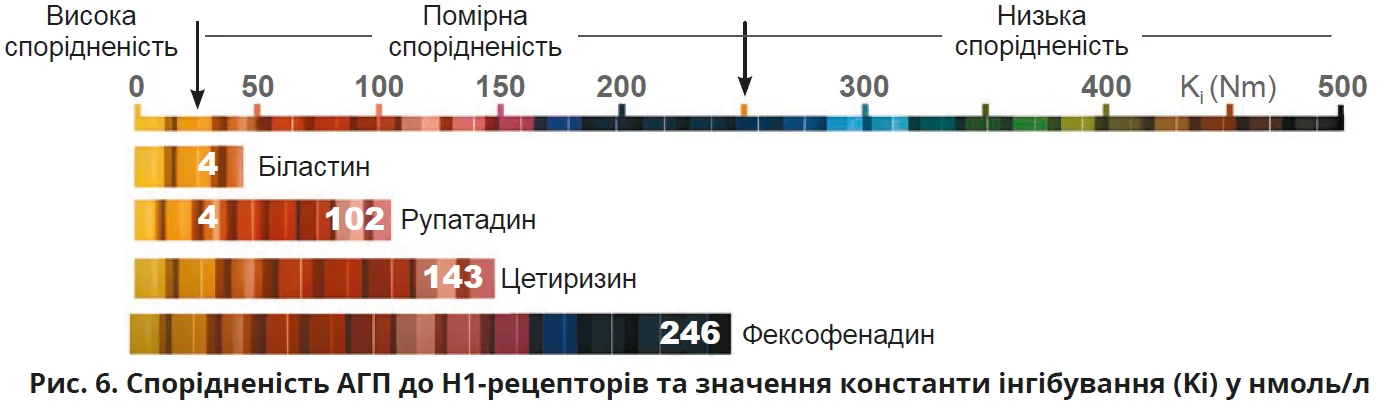
Біластин також демонструє найвищу спорідненість до H1-рецепторів серед АГП 2 покоління з константою інгібування всього 44 нмоль/л [6, 10] (рис. 6). Вища спорідненість до рецептора забезпечує більш ефективну та тривалу блокаду гістамінових рецепторів.
Зважаючи на всі зазначені властивості, біластин є препаратом вибору для лікування кропив’янки, особливо у випадках, що потребують підвищення дозування АГП.
У своїй лекції професор Torsten Zuberbier також представив попередній огляд змін, які очікуються в найближчих рекомендаціях.
Оновлений алгоритм лікування кропив’янки:
- Початок терапії з АГП ІІ покоління та підвищення їх дозування до чотириразового в разі потреби (залишається основою лікування вже 25 років).
- За неефективності лікування додавання біологічної терапії – основним представником лишається омалізумаб (можливе використання інших представників за умови їх реєстрації в країні в майбутньому).
- Циклоспорин А може комбінуватися з іншими препаратами, включно з омалізумабом.
Оновлені принципи ведення кропив’янки базуються на циклічному підході: оцінка стану пацієнта ® корегування терапії ® повторна оцінка.
Оцінка стану охоплює: діагностичні процедури, супутні хвороби, тяжкість, побажання пацієнта та побічні ефекти.
Корегування терапії здійснюється за такими підходами:
- посилення терапії, якщо контроль недостатній;
- зміна терапії, якщо виникають побічні ефекти;
- послаблення терапії, якщо симптоми відсутні протягом 3-6 місяців.
Конфлікт інтересів: професор Torsten Zuberbier на початку доповіді повідомив про отримання гонорару від компанії Menarini.
Література
- Zuberbier T., Abdul Latiff A.H., Abuzakouk M., et al. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022 Mar; 77 (3): 734-766. doi: 10.1111/all.15090.
- Canonica G.W., Compalati E. Minimal persistent inflammation in allergic rhinitis: implications for current treatment strategies. Clin. Exp. Immunol. 2009 Dec; 158 (3): 260-271. doi: 10.1111/j.1365-2249.2009.04017.x. Epub 2009 Aug 25. PMID: 19765020. PMCID: PMC2792821.
- Zuberbier T., Pfrommer C., Specht K., et al. Aromatic components of food as novel eliciting factors of pseudoallergic reactions in chronic urticaria. J. Allergy Clin. Immunol. 2002 Feb; 109 (2): 343-348. doi: 10.1067/mai.2002.121309. PMID: 11842307.
- Fujisawa D., Kashiwakura J., Kita H., et al. Expression of Mas-related gene X2 on mast cells is upregulated in the skin of patients with severe chronic urticaria. J. Allergy Clin. Immunol. 2014 Sep; 134 (3): 622-633.e9. doi: 10.1016/j.jaci.2014.05.004. Epub 2014 Jun 19. PMID: 24954276.
- 5 Farré M., Pérez-Mañá C., Papaseit E., et al. Bilastine vs. hydroxyzine: occupation of brain histamine H1-receptors evaluated by positron emission tomography in healthy volunteers. Br. J. Clin. Pharmacol. 2014 Nov; 78 (5): 970-980. doi: 10.1111/bcp.12421. PMID: 24833043. PMCID: PMC4243871.
- Corcóstegui R., Labeaga L., Innerárity A., Berisa A., Orjales A. Preclinical pharmacology of bilastine, a new selective histamine H1 receptor antagonist: receptor selectivity and in vitro antihistaminic activity. Drugs R. D. 2005; 6 (6): 371-384. doi: 10.2165/00126839-200506060-00005. PMID: 16274260.
- Jáuregui I., Ramaekers J.G., Yanai K., et al. Bilastine: a new antihistamine with an optimal benefit-to-risk ratio for safety during driving. Expert Opin. Drug Saf. 2016 Jan; 15 (1): 89-98. doi: 10.1517/14740338.2016.1112786. Epub 2015 Nov 16. PMID: 26571227.
- Krause K., Spohr A., Zuberbier T., Church M.K., Maurer M. Up-dosing with bilastine results in improved effectiveness in cold contact urticaria. Allergy. 2013 Jul; 68 (7): 921-928. doi: 10.1111/all.12171. Epub 2013 Jun 6. PMID: 23742030. PMCID: PMC3759706.
- Weller K., Church M.K., Hawro T., et al. Updosing of bilastine is effective in moderate to severe chronic spontaneous urticaria: a real-life study. Allergy. 2018 Oct; 73 (10): 2073-2075. doi: 10.1111/all.13494. Epub 2018 Jul 17. PMID: 29869790.
- Shamizadeh S., Brockow K., Ring J. Rupatadine: efficacy and safety of a non-sedating antihistamine with PAF-antagonist effects. Allergo J. Int. 2014; 23 (3): 87-95. doi: 10.1007/s40629-014-0011-7. Epub 2014 May 9. PMID: 26120520; PMCID: PMC4479428.