Антигістамінні препарати для лікування алергічного риніту з погляду неседативних властивостей
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Алергічний риніт (АР) передбачає опосередковане імуноглобулінами (Ig) E запалення, що розвивається внаслідок контакту слизової оболонки носа з алергенами. При зв’язуванні специфічних IgE з рецепторами на поверхні опасистих клітин чи базофілів виділяються гістамін, лейкотрієни, тромбоцит-активувальний фактор, запускаючи алергічну реакцію негайного типу. Назальними симптомами АР є чхання, нежить і закладеність носа.
За розрахунками, кількість пацієнтів з АР у світі перевищує 500 млн. Залежно від тривалості симптомів АР поділяють на постійний та інтермітивний типи, а залежно від періодичності симптомів – на цілорічний і сезонний.
Лікування АР передбачає уникнення алергенів, фармакотерапію, імунотерапію та навіть хірургічні втручання. Фармакотерапія включає антигістамінні препарати (АГП), антагоністи лейкотрієнових рецепторів, топічні глюкокортикоїди, вазоконстриктори тощо. АГП призначаються при будь-якій тяжкості риніту – від незначного до тяжкого ступеня.
Історія АГП є дуже тривалою. Препарати першого покоління мали центральну депресивну/седативну дію, низьку специфічність і велику кількість побічних ефектів (спрага, затримка сечі, тахікардія), натомість засоби другого покоління позбавлені цих недоліків, у зв’язку з чим саме вони входять до поточних рекомендацій із лікування АР.
Цей огляд стосується фармакологічних властивостей різних АГП з акцентом на їхню седативність/неседативність.
Фармакологічні аспекти седативної дії АГП
Гістамін і його рецептори
Гістамін продукують деякі нейрони, ентерохромафіноподібні клітини шлунка, опасисті клітини та базофіли. Дію гістаміну, який бере участь у передачі нервових імпульсів, скороченні гладких м’язів, контролі проникності судин, секреції шлункового соку тощо, опосередковують 4 типи рецепторів (H1, H2, H3 та H4). Рецептори типу H1 експресуються на різних клітинах організму (в центральній нервовій системі, на гладком’язових клітинах, ендотеліоцитах, гепатоцитах, моноцитах, нейтрофілах тощо). Цікаво, що H1-АГП структурно не пов’язані з гістаміном: вони являють собою зворотні агоністи, що зв’язуються з ділянками гістамінових рецепторів, відмінними від тих, з якими зв’язується сам гістамін.
Структуру комплексу, утвореного рецептором H1 і доксепіном – АГП першого покоління, з’ясували лише у 2011 р. Н1-рецептори мають 7 трансмембранних завитків, причому С-термінал розташований у клітині, а N-термінал – поза нею. Більшість амінокислотних залишків, які зв’язуються з тією самою ділянкою рецептора, що й доксепін, зв’язуються і з іншими амінними рецепторами. Натомість амінокислотні залишки, які взаємодіють із фосфат-іоном, зв’язуються лише з H1-рецепторами. Карбоксильна група АГП другого покоління (олопатадину, левоцетиризину, фексофенадину) зв’язується саме з фосфат-іоном, що зумовлює високу специфічність цих препаратів до рецепторів типу H1. Аналогічно з фосфат-іоном зв’язується й біластин, натомість епінастин, дезлоратадин, лоратадин і рупатадин мають низьку специфічність до H1-рецепторів і зв’язуються також з іншими рецепторами такого типу.
Седативний потенціал АГП та їх класифікація на основі окупації H1-рецепторів мозку
Седативні властивості H1-АГП зумовлені пригніченням функцій гістамінергічних нейронів центральної нервової системи. Тіла цих нейронів розташовані в туберомамілярному ядрі гіпоталамуса, а їхні відростки поширюються по всьому головному й частині спинного мозку, формуючи моноамінергічну нервову систему. У стані активації гістамінергічні нейрони вивільняють гістамін, який впливає безпосередньо на H1– і H2-рецептори, а також активує ацетилхолінергічні й норадреналінергічні нейрони стовбура мозку та глютамінергічні нейрони гіпоталамуса.
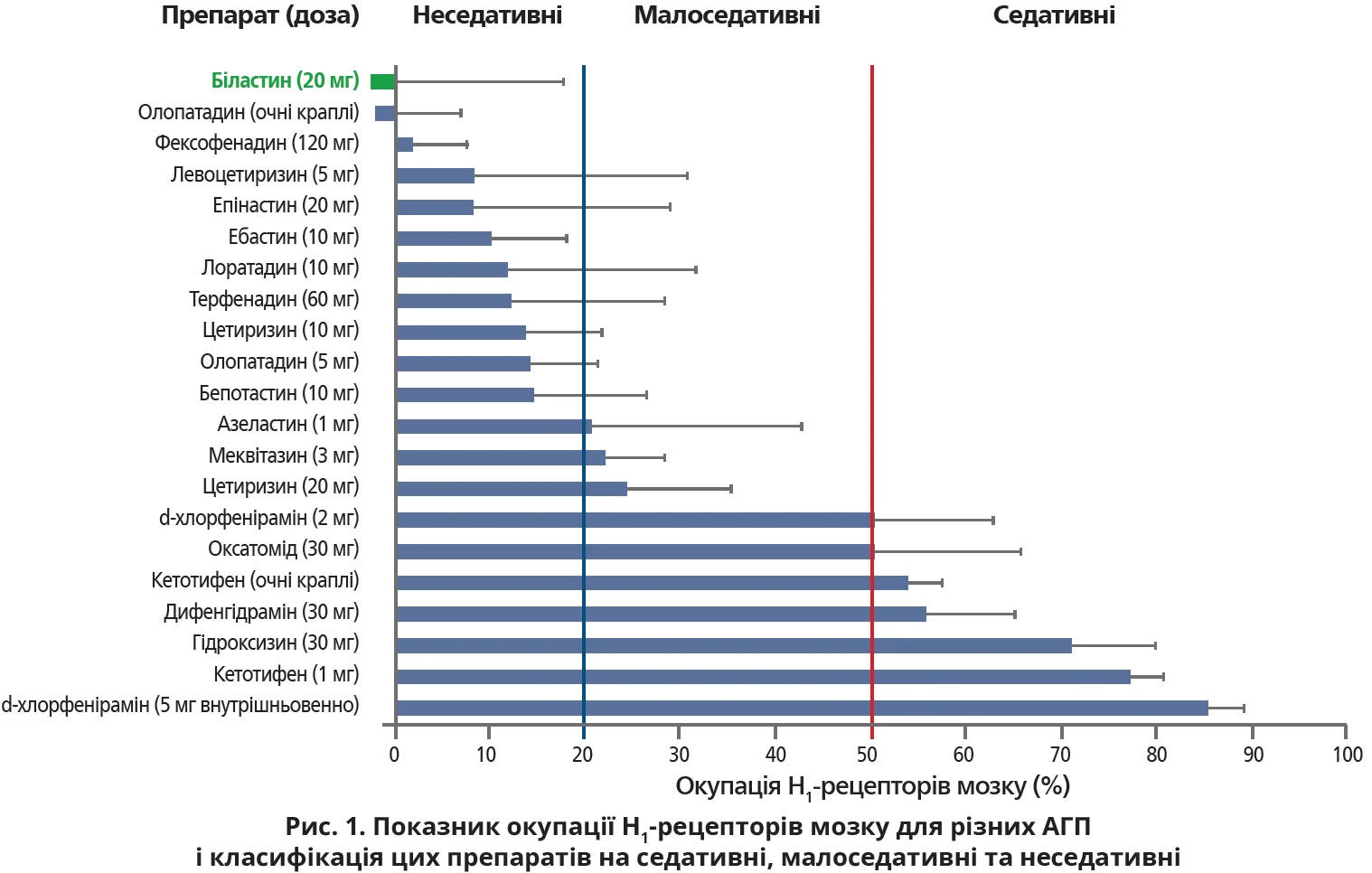
Для реалізації седативної дії АГП повинні проходити крізь гематоенцефалічний бар’єр і зв’язуватися з H1-рецепторами, тому для визначення седативного потенціалу застосовується оцінка ступеня окупації гістамінових рецепторів типу H1 (H1RO). Після визначення H1RO багатьох АГП першого та другого поколінь було запропоновано відповідну класифікацію цих препаратів на неседативні (H1RO після одноразового перорального застосування <20%), малоседативні (20-50%) і седативні (≥50%). До неседативних АГП належать біластин (20 мг), фексофенадин (60-120 мг), левоцетиризин (5 мг), епінастин (20 мг), ебастин (10 мг), лоратадин (10 мг), терфенадин (60 мг), цетиризин (10 мг), олопатадин (5 мг) і бепотастин (10 мг) (рис. 1). Хімічній структурі неседативних АГП притаманна наявність гідрофільних функціональних груп, а саме карбоксильної (-COOH) та/або аміногрупи (-NH2), які протидіють пенетрації в мозок.
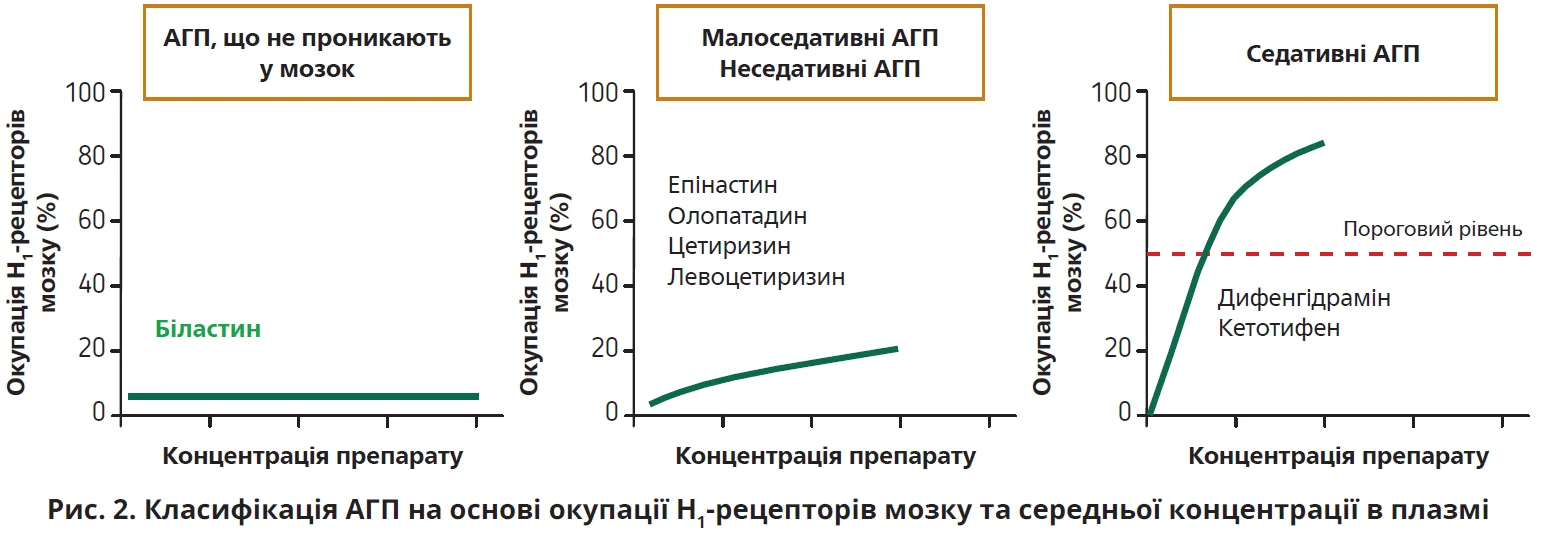
АГП, які не проникають у головний мозок: біластин і фексофенадин
Серед неседативних АГП H1RO біластину та фексофенадину становить близько 0%, тому ці препарати можна вважати такими, які не проникають у мозок (рис. 2). І біластин, і фексофенадин є цвітер- іонами, які мають у своїй молекулі й позитивний (N+), і негативний (COO−) заряд. Ці препарати однаково зв’язуються з H1-рецепторами. Слід зауважити, що молекулярна маса біластину та фексофенадину є більшою за масу інших неседативних АГП, а в умовах пасивної дифузії що більшою є молекулярна маса, то меншим є проникнення в мозок.
Біластину притаманна середня афінність до H1-рецепторів, а фексофенадину – відносно низька, тому для досягнення активності на рівні біластину доза фексофенадину має бути вищою.
Залишкові ефекти седативних АГП
Період напіврозпаду H1-АГП у мозку може бути довшим, аніж у плазмі, тому слід бути обережними. Визначення H1RO через 3-23 години після застосування седативних АГП дифенгідраміну та кетотифену свідчить, що період їх напіврозпаду становить близько 30 та 45 годин відповідно. Натомість період напіврозпаду цих препаратів у плазмі становить 6-8 годин.
Седативні АГП впливають на циркадний цикл сну/неспання, відтерміновуючи настання фази REM – сну зі швидкими рухами очних яблук – або скорочуючи час сну, у зв’язку з чим на наступний день спостерігаються сонливість і порушене функціонування. Слід зауважити, що седативний ефект було зафіксовано й на тлі локального застосування таких АГП, тобто у формі очних крапель і назального спрею.
Клінічні аспекти застосування неседативних АГП
Клінічні профілі еталонних АГП другого покоління
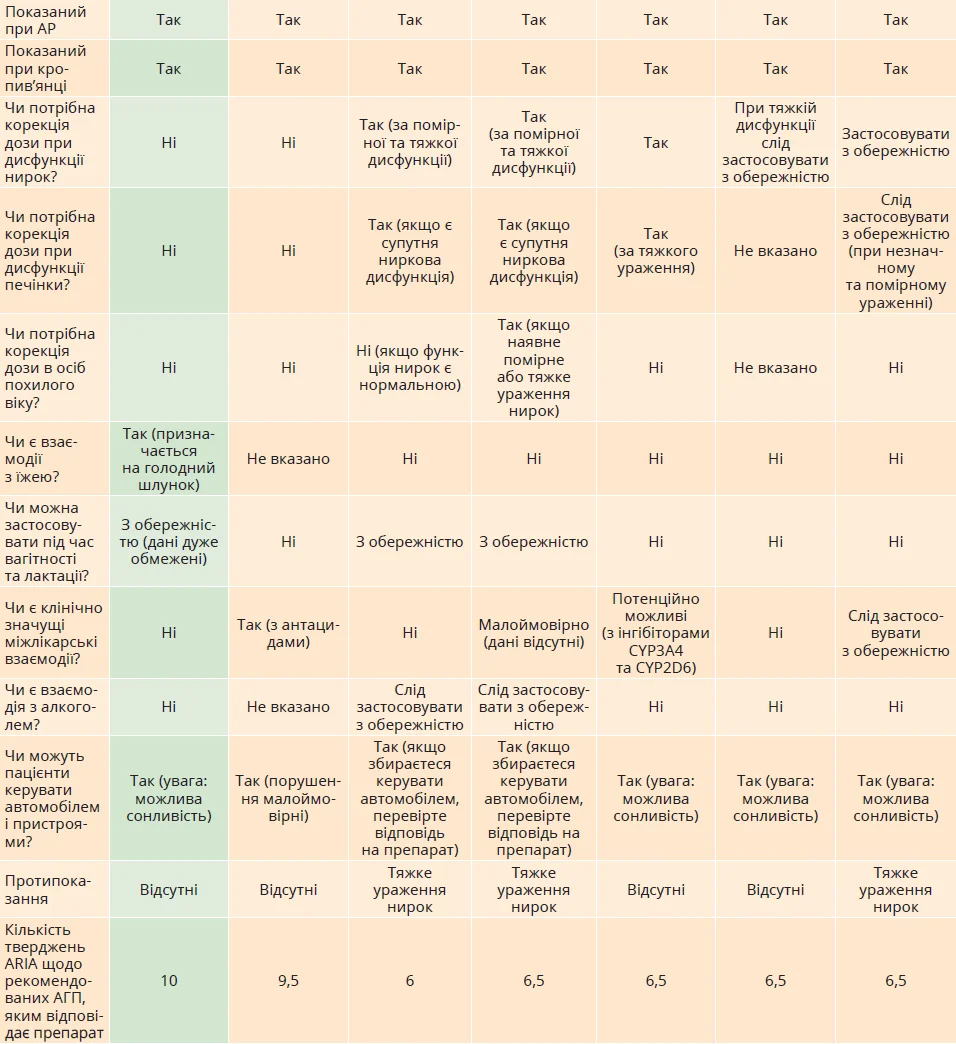
Клінічні профілі біластину, фексофенадину, цетиризину, левоцетиризину, лоратадину, дезлоратадину й ебастину представлено в таблиці. Лоратадин і дезлоратадин, які належать до типу аміногрупи, мають антихолінергічну активність, натомість біластин, фексофенадин, цетиризин, левоцетиризин та ебастин, які належать до типу карбоксигрупи, демонструють високу специфічність до H1– рецепторів і відповідну антагоністичну активність.
Усі ці препарати показані при АР і кропив’янці.
АГП другого покоління властивий короткий час до досягнення максимальної концентрації в плазмі крові – tmax (у межах 3 годин) і тривалий період напіврозпаду (крім левоцетиризину та лоратадину). Біластин, фексофенадин і цетиризин не метаболізуються або метаболізуються мінімально. Біластин і фексофенадин не потребують адаптації дози в пацієнтів із печінковою або нирковою дисфункцією.
АГП, які найточніше відповідають вимогам до пероральних H1-АГП відповідно до рекомендацій ARIA (Allergic Rhinitis and its Impact on Asthma), є біластин і фексофенадин.
Ефективність у разі сезонного АР
У рандомізованому порівняльному дослідженні за участю 683 пацієнтів із сезонним АР застосування й біластину, й цетиризину протягом 14 днів достовірно зменшувало площу під кривою сумарної оцінки назальних (закладеність носа, нежить, чхання, свербіж носа) й екстраназальних (сльозотеча, почервоніння та свербіж очей) симптомів цієї хвороби порівняно з плацебо (р<0,001). Біластин і цетиризин також знижували відчуття загального дискомфорту, асоційоване з АР. Однак ступінь сонливості в групі біластину був достовірно нижчим, аніж у групі цетиризину (1,8 проти 7,5%, р<0,001).
У рандомізованому подвійному сліпому дослідженні ефективності біластину (20 мг), цетиризину (10 мг) і фексофенадину (120 мг) порівняно з плацебо пацієнти із сезонним АР підлягали штучно змодельованому контакту з алергенами. Препарати застосовувалися через 2 години після початку 6-годинного контакту з пилком. Через 4 години після застосування АГП спостерігалося достовірне зменшення вираженості назальних симптомів порівняно з плацебо. При повторному контакті з алергеном (у день 2, через 22-26 годин після введення препарату) зростання інтенсивності цих симптомів у групах лікування було меншим, аніж у групі плацебо. Біластин і цетиризин потужніше знижували назальну секрецію та загальну оцінку симптомів, а тривалість їхньої дії перевищувала показники фексофенадину (Horak F. et al., 2010). У подібному дослідженні K. Hashiguchi та співавт. (2017) застосування біластину (20 мг) забезпечувало достовірно вираженіше зниження оцінки загальних назальних симптомів порівняно з фексофенадином. Інші автори підтвердили, що ефективність біластину при сезонному АР є вищою за показник фексофенадину й що біластин рідше індукує сонливість, аніж цетиризин.
Безпека біластину для центральної нервової системи
C. Garcia-Gea та співавт. (2008) за допомогою низки різних об’єктивних тестів оцінили психомоторні функції здорових осіб, які вживали біластин (20, 40 або 80 мг), гідроксизин (25 мг) і плацебо 1 р/добу протягом 7 днів. Достовірне порушення психомоторних функцій порівняно з плацебо спостерігалося після одноразового застосування гідроксизину та високої дози біластину (80 мг), але для гідроксизину було зафіксовано погіршення цих функцій за трьома тестами, а для біластину – за двома. Після застосування протягом 7 днів для жодного з препаратів не відзначалося значущих психомоторних порушень. На тлі одноразового та багаторазового застосування біластину в дозах 20 і 40 мг порушень психомоторної функції не спостерігалося.
У рандомізованому подвійному сліпому дослідженні S. Conen і співавт. (2011) було з’ясовано, що біластин (у дозі 20 і 40 мг) не мав впливу на здатність здорових добровольців керувати автомобілем на відміну від гідроксизину (50 мг), який значно погіршував цю здатність порівняно з плацебо. Важливо, що здатність керувати автомобілем оцінювали не на думку пацієнтів, а за стандартним відхиленням латерального положення – об’єктивним показником якості керування.
C. Garcia-Gea та співавт. (2014) також оцінили психомоторні функції здорових добровольців, які споживали біластин (20 або 80 мг), цетиризин (10 мг) або гідроксизин (25 мг) разом з алкоголем (0,8 г/кг), лише алкоголь (+ плацебо) та плацебо-комплекс (плацебо алкоголю та плацебо препарату). Будь-яке застосування 80 мг біластину, цетиризину й гідроксизину з алкоголем асоціювалося з погіршенням психомоторної функції, однак застосування біластину в дозі 20 мг разом з алкоголем призводило до такого самого погіршення, як і вживання лише алкоголю, тобто вплив біластину був незначущим.
Отже, біластин у звичайній і подвоєній дозах (20 і 40 мг) не погіршує психомоторних функцій у зв’язку із седативним впливом і не взаємодіє з алкоголем за умови прийому у звичайній дозі (20 мг).
Висновки
Показник H1RO дає змогу класифікувати АГП на седативні, малоседативні та неседативні. Неседативні АГП біластин і фексофенадин у звичайних дозах не окупують H1-рецептори в мозку, тому їх можна називати АГП, які не проникають у мозок.
Хоча ці два препарати є схожими за хімічною природою, біластину притаманна вища афінність до H1-рецепторів порівняно з фексофенадином. Оскільки істотні відмінності між клінічною ефективністю різних АГП другого покоління відсутні, важливим аспектом вибору препарату цього класу є ступінь проникнення в мозок і наявність/відсутність седативного ефекту, які асоціюються з безпекою. Показано, що біластин не впливає на психомоторну функцію та здатність керувати автомобілем навіть у дозі 40 мг, яка вдвічі перевищує стандартну дозу.
Думка експертів
Для лікування АР доцільно застосовувати не просто АГП другого покоління, а АГП із підтвердженою відсутністю седативного ефекту, оскільки поняття «друге покоління» стосується виключно часу розроблення препарату, тому не всі АГП другого покоління є неседативними. Наприклад, кетотифен, який має виражені седативні властивості, належить до другого покоління. Крім того, слід уникати споживання седативних АГП як снодійних препаратів, адже це погіршує якість сну та може забезпечувати несприятливий седативний ефект наступного дня.
Відповідно до класифікації за ступенем окупації H1-рецепторів мозку, фексофенадин і біластин відрізняються від інших АГП другого покоління, оскільки не проникають у тканини головного мозку. Ці два препарати найточніше відповідають критеріям ідеальних АГП за рекомендаціями ARIA. Однак існують певні відмінності: біластину притаманна більша потужність зв’язування H1-рецепторів порівняно з фексофенадином; біластин уживається 1 р/день, а фексофенадин – 2 р/день. На підставі результатів клінічних досліджень і фармакологічного визначення ступеня седативного ефекту можна вважати, що біластин є одним із найкращих АГП для лікування АР. Потенційною проблемою лікування будь-якої хвороби може бути міжлікарська взаємодія, тому доцільно обирати H1-АГП, які не метаболізуються системою цитохрому P450 і не пригнічують її функціонування. Біластин, метаболізм якого є мінімальним, відповідає й цим вимогам.
У лікуванні АР важливе значення має комунікація між лікарем і пацієнтом. Лікар має розуміти не лише суть симптомів хвороби, а і їхній вплив на якість життя кожного конкретного пацієнта, ступінь задоволеності пацієнта лікуванням і побажання щодо вартості препаратів. Призначаючи H1-АГП, лікар повинен обирати неседативні препарати з мінімальною кількістю міжлікарських взаємодій, а також пояснювати пацієнту переваги та ризики обраного препарату.
Література
Kawauchi H., Yanai K., Wang D.Y., Itahashi K., Okubo K. Antihistamines for allergic rhinitis treatment from the viewpoint of nonsedative properties. Int. J. Mol. Sci. 2019; 20 (1): 213. doi: 10.3390/ijms20010213.