Алгоритм діагностики та лікування алергії на отруту перетинчастокрилих (оновлення 2024 року)
Підготувала лікарка-алерголог Ірина Калікіна
Інсектна алергія на отруту перетинчастокрилих (ІАП) проявляється широким спектром симптомів, які можуть бути як помірними (наприклад, шкірні симптоми), так і небезпечними для життя (зомління та зупинка серця). У більшості пацієнтів діагностика ІАП не викликає труднощів, але може бути складною в пацієнтів з подвійним, позитивним і негативним, результатом тесту. Результати тестів іноді можуть уводити в оману, оскільки пацієнти з високою активністю шкірних тестів і високими рівнями специфічного імуноглобуліну E (sIgE) не обов’язково мають ризик розвитку тяжких системних реакцій (СР) на укуси, і навпаки: пацієнти зі слабопозитивними або навіть негативними результатами тестів можуть мати СР. Пацієнти мають бути навчені правильно застосовувати аптечку для невідкладної допомоги на випадок повторної реакції на укус. Водночас усім пацієнтам із середньотяжкими й тяжкими реакціями варто проводити алергеноспецифічну імунотерапію з отрутами перетинчастокрилих (ОІТ), оскільки вона є безпечною та високоефективною. ОІТ також може розглядатися для пацієнтів з генералізованими шкірними симптомами, якщо такі реакції значно погіршують якість їхнього життя.
Укуси перетинчастокрилих комах є найпоширенішою причиною анафілаксії в дорослих у Європі [1]. Основними клінічними проявами ІАП є великі локальні реакції (ВЛР) у місці укусу та СР. ВЛР визначають як набряк, що перевищує 10 см у діаметрі та триває довше 24 годин [2]. СР можуть мати різний ступінь тяжкості. Легкі СР включають генералізовані шкірні симптоми, як-от кропив’янка, ангіоневротичний набряк або почервоніння. До середньотяжких реакцій належать набряк гортані, задишка, нудота, запаморочення й падіння артеріального тиску. Анафілактичний шок, зомління та/або зупинка серця чи дихання є ознаками тяжкої СР.
Клінічний анамнез реакцій, шкірні проби та визначення sIgE до отрути перетинчастокрилих залишаються основою діагностики в разі ІАП. Молекулярна діагностика ІАП усе ще розвивається й наразі має обмежене застосування. Деякі відповідні перехресні алергени бджіл і ос, як-от Api m 12, а також Ves v 3 та 6, до сьогодні недоступні для рутинної діагностики. Крім того, чутливість доступної панелі алергенів бджолиної отрути (Api m 1, 2, 3, 5 і 10), особливо Api m 1, є низькою – 72% [3] і 57-62% [4, 5] відповідно. Тест активації базофілів виявився корисним для пацієнтів з подвійно позитивними [6, 7] або негативними результатами [8]. Однак він має бути виконаний протягом 2 днів після забору крові та потребує спеціальних технічних навичок, оскільки аналіз не є автоматизованим. Тому цей тест усе ще не набув широкого застосування. Аналіз на інгібування IgE є простішим у виконанні й може бути корисним для розрізнення перехресної реактивності та справжньої подвійної сенсибілізації [9, 10], хоча інгібування CAP має певні недоліки з погляду технічної процедури та витрат [11]. Для виявлення пацієнтів з високим ризиком розвитку тяжких СР зазвичай визначають рівень базальної триптази сироватки крові.
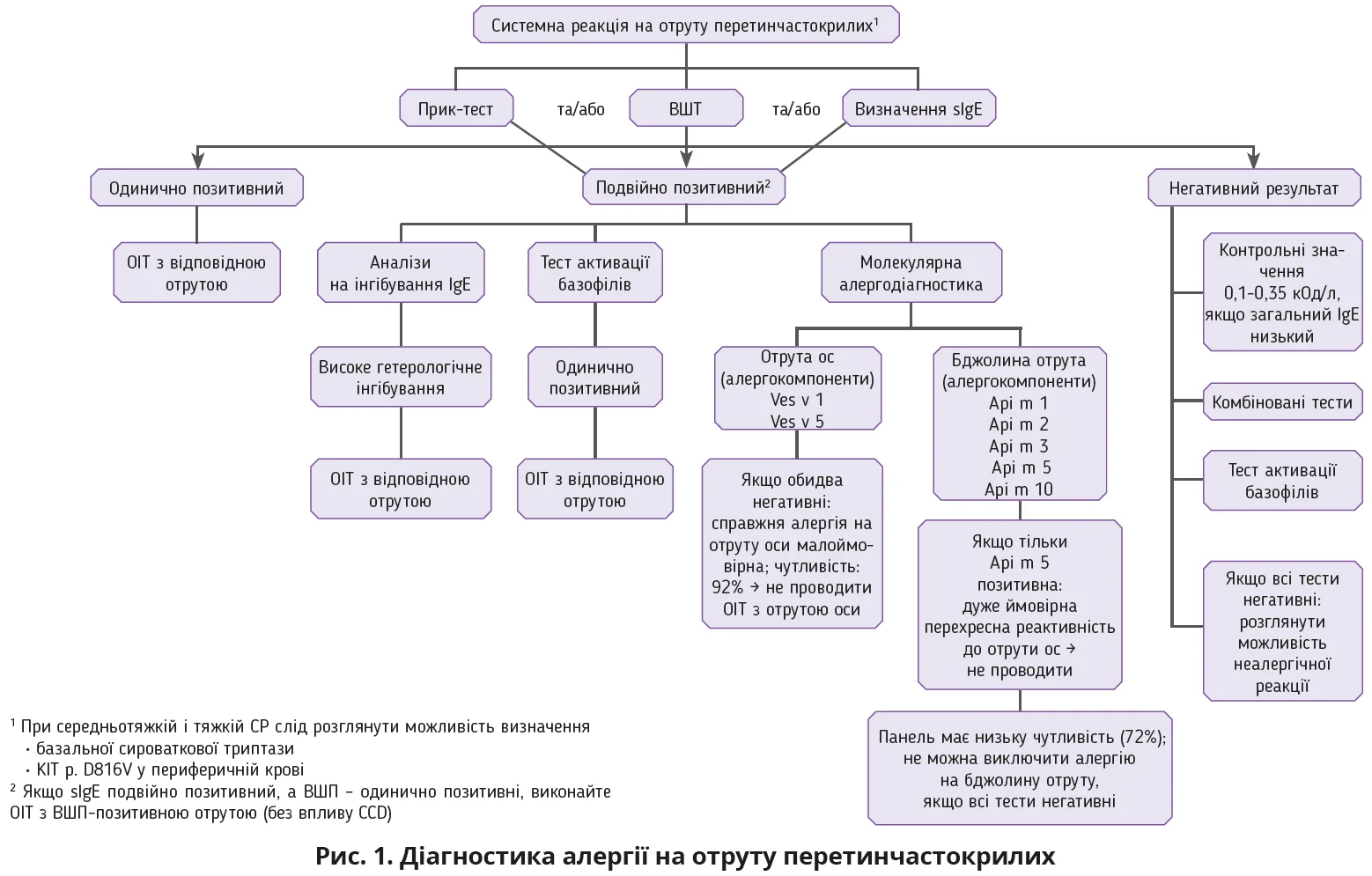
Останні дані вказують на те, що підвищений рівень триптази переважно пов’язаний з наявністю мутації KIT p.D816 і α-триптаземії [12]. Важливо, що 196 із 285 (69%) пацієнтів з мутацією KIT p.D816 мали нормальний рівень триптази [13]. Ці дані свідчать, що крім визначення рівня триптази пацієнти мають бути обстежені на наявність KIT p.D816V з використанням високочутливого алель-специфічного ПЛР-тесту, який дає змогу діагностувати клональні порушення тучних клітин. Доступні тести та підходи до вирішення діагностичних завдань наведено на рисунку 1.
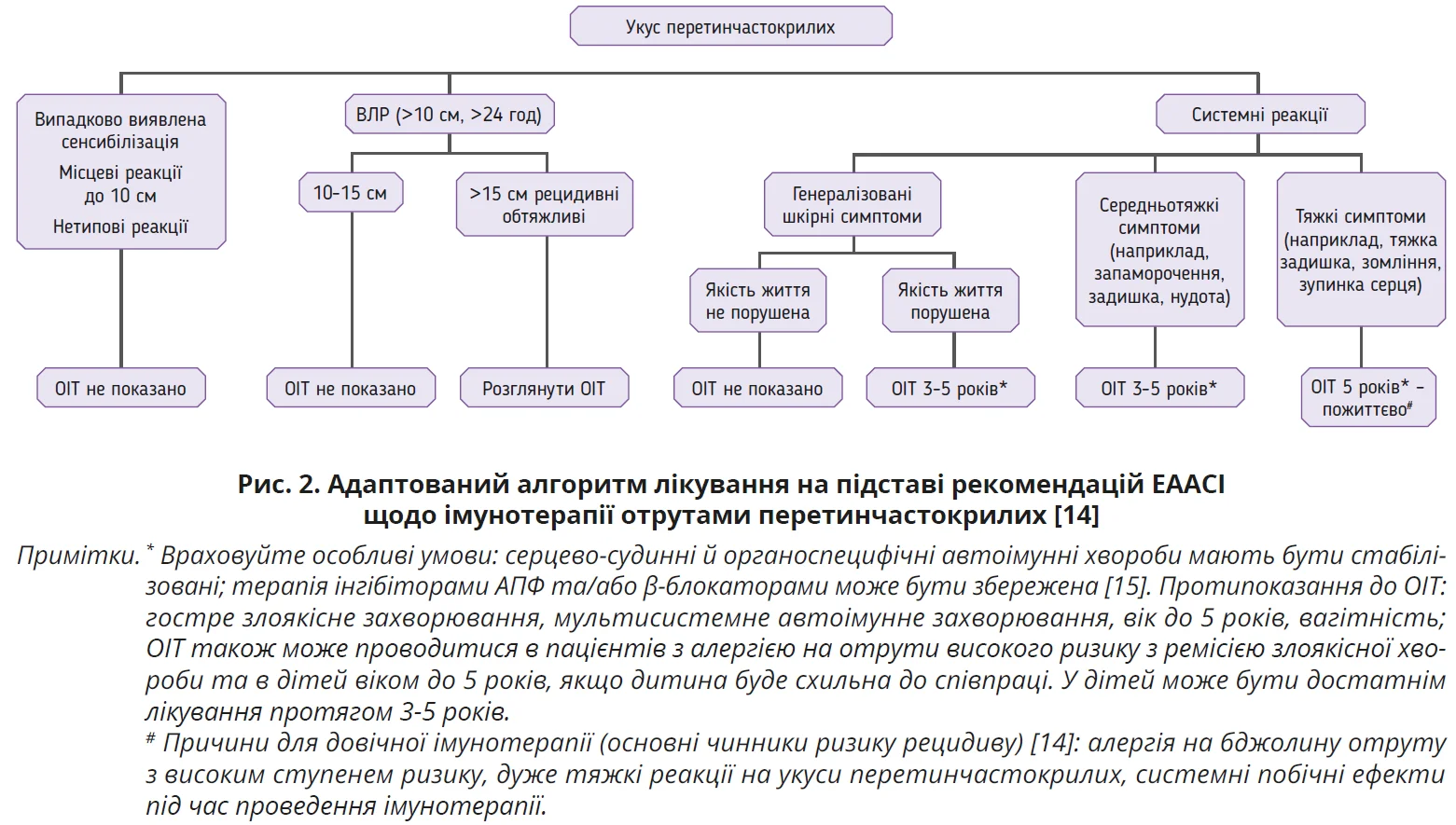
Єдиним методом лікування, що потенційно може запобігти подальшому розвитку СР, є ОІТ, котра, як повідомляється, є ефективною в 77-84% пацієнтів, які отримували ОІТ з алергеном отрути медоносної бджоли, та в 91-96% пацієнтів, які отримували отруту ос [14]. Настанови Європейської академії алергії та клінічної імунології (EAACI) щодо ОІТ були опубліковані 2018 року [14]. Вони мали на меті надати науково обґрунтовані рекомендації щодо застосування ОІТ. Зокрема, ОІТ показана дітям і дорослим з виявленою сенсибілізацією та СР, які перевищують генералізовані шкірні симптоми.
ОІТ також рекомендовано дорослим пацієнтам з СР, що обмежуються генералізованими шкірними симптомами, якщо якість життя через них значно погіршена. У пацієнтів з рецидивними, проблемними ВЛР також можливе зменшення тривалості та розміру майбутніх ВЛР. Від моменту публікації настанови з’явилася низка даних, що сприяли полегшенню проведення процедур ОІТ: після десятиліть дебатів у європейському багатоцентровому дослідженні було переконливо продемонстровано, що застосування β-блокаторів або інгібіторів ангіотензинперетворювального ферменту (АПФ) не призводить до ескалації системних небажаних явищ під час ОІТ і не збільшує СР. Окрім того, ці препарати не впливають на ефективність ОІТ [15]. У контексті подвійної ОІТ бджолиною отрутою й отрутою ос одночасне введення обох отрут також визнано безпечним у великій серії випадків [16]. Алгоритм лікування, представлений на рисунку 2, ґрунтується на рекомендаціях настанов.
Першим кроком у діагностиці ІАП є шкірні прик-тести, внутрішньошкірні тести (ВШТ) та/або визначення специфічних сироваткових IgE до отрути перетинчастокрилих. Ці тести можна комбінувати для підвищення чутливості. Якщо тести є позитивними до одного виду отрути, слід розпочати ОІТ з відповідною отрутою. Якщо sIgE є подвійно позитивним, а ВШТ – одинично позитивним, треба проводити ОІТ з отрутою, яка є позитивною до ВШТ, оскільки на ВШТ не впливають CCD (перехресно-реактивні вуглеводні детермінанти). У разі подвійної позитивної реакції можуть бути проведені аналізи реципрокного IgE-інгібування, тест активації базофілів або молекулярна алергодіагностика. Визначення IgE до CCD MUXF3 на відміну від використання при множинній сенсибілізації до пилку або харчових продуктів обмежено. Оскільки CCD різні за вмістом в отруті комах, чутливість тесту MUXF3 є низькою та становить 52%. Крім того, наявність IgE до CCD не виключає справжньої подвійної сенсибілізації [6]. Молекулярна діагностика ІАП наразі має обмежене застосування, оскільки не всі відповідні алергени доступні. Однак, якщо обидва тести, Ves v 1 і 5, є негативними, алергія на отруту оси малоймовірна [17]. Чутливість наявної панелі алергенів бджолиної отрути є низькою. Використовуючи цю панель, неможливо діагностувати або виключити алергію на бджолину отруту повністю, але моносенсибілізація до Api m 5 може вказувати на перехресну реактивність до отрути ос. Окрім того, було показано, що тест активації базофілів має нижчий ризик виявлення подвійної сенсибілізації. Однак у разі тяжкої СР і чітких подвійно позитивних результатів тесту треба провести тест активації базофілів з обома отрутами. Якщо загальний IgE низький (<30 кОд/л), рівень sIgE від 0,10 до 0,35 кОд/л можна вважати позитивним. Якщо всі тести негативні, слід розглянути можливість неалергічних реакцій, як-от панічна реакція. Важливо, що в пацієнтів з низьким рівнем загального IgE тести можуть бути негативними, навіть за тяжкої СР.
Література
- Worm M., Moneret-Vautrin A., Scherer K., et al. First European data from the network of severe allergic reactions (NORA). Allergy. 2014; 69 (10): 1397-1404.
- Bilo B.M., Rueff F., Mosbech H., Bonifazi F., Oude-Elberink J.N. Diagnosis of Hymenoptera venom allergy. Allergy. 2005; 60 (11): 1339-1349.
- Arzt L., Bokanovic D., Schrautzer C., et al. Questionable diagnostic benefit of the commercially available panel of bee venom components. Allergy. 2017; 72 (9): 1419-1422.
- Sturm G.J., Hemmer W., Hawranek T., et al. Detection of IgE to recombinant Api m 1 and rVes v 5 is valuable but not sufficient to distinguish bee from wasp venom allergy. J. Allergy Clin. Immunol. 2011; 128 (1): 247-248.
- Korosec P., Valenta R., Mittermann I., et al. Low sensitivity of commercially available rApi m 1 for diagnosis of honeybee venom allergy. J. Allergy Clin. Immunol. 2011; 128 (3): 671-673.
- Sturm G.J., Jin C., Kranzelbinder B., et al. Inconsistent results of diagnostic tools hamper the differentiation between bee and vespid venom allergy. PLoS One. 2011; 6 (6): e20842.
- Bokanovic D., Arzt-Gradwohl L., Schwarz I., et al. Possible utility of basophil activation test in dual honeybee and vespid sensitization. J. Allergy Clin. Immunol. Pract. 2020; 8 (1): 392-394.
- Korosec P., Erzen R., Silar M., Bajrovic N., Kopac P., Kosnik M. Basophil responsiveness in patients with insect sting allergies and negative venom-specific immunoglobulin E and skin prick test results. Clin. Exp. Allergy. 2009; 39 (11): 1730-1737.
- Straumann F., Bucher C., Wuthrich B. Double sensitization to honeybee and wasp venom: immunotherapy with one or with both venoms? Value of FEIA inhibition for the identification of the cross-reacting IgE antibodies in double-sensitized patients to honeybee and wasp venom. Int. Arch. Allergy Immunol. 2000; 123 (3): 268-274.
- Caruso B., Bonadonna P., Severino M.G., et al. Evaluation of the IgE cross-reactions among vespid venoms. A possible approach for the choice of immunotherapy. Allergy. 2007; 62 (5): 561-564.
- Quercia O., Cova V., Martini M., et al. CAP-inhibition, molecular diagnostics, and total IgE in the evaluation of Polistes and Vespula double sensitization. Int. Arch. Allergy Immunol. 2018; 177 (4): 365-369.
- Šelb J., Rijavec M., Eržen R., et al. D816V screening identifies clonal mast cell disease in patients with Hymenoptera allergy regularly missed using baseline tryptase levels alone. J. Allergy Clin. Immunol. 2021; 148 (2): 621-626.
- Korošec P., Sturm G.J., Lyons J.J., et al. High burden of clonal mast cell disorders and hereditary α-tryptasemia in patients who need Hymenoptera venom immunotherapy. Allergy. 2024. doi: 10.1111/all.16084.
- Sturm G.J., Varga E.M., Roberts G., et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2018; 73 (4): 744-764.
- Sturm G.J., Herzog S.A., Aberer W., et al. Beta-blockers and ACE inhibitors are not a risk factor for severe systemic sting reactions and adverse events during venom immunotherapy. Allergy. 2021; 76 (7): 2166-2176.
- Čerpes U., Arzt-Gradwohl L., Schrautzer C., et al. Simultaneous up-dosing of bee and vespid venom immunotherapy is safe. Allergy. 2020; 75 (3): 721-723.
- Korosec P., Valenta R., Mittermann I., et al. High sensitivity of CAP-FEIA rVes v 5 and rVes v 1 for diagnosis of Vespula venom allergy. J. Allergy Clin. Immunol. 2012; 129 (5): 1406-1408.