Алергенспецифічна імунотерапія та тренування імунітету. Частина 2
Переклала й адаптувала канд. мед. наук Ольга Королюк
Швидке зростання поширеності алергії пояснюється не лише генетичним дрейфом, а й індустріалізацією та технологічним прогресом, пов’язаним із сучасним способом життя та змінами експосому.
Алергічні хвороби та TRIM
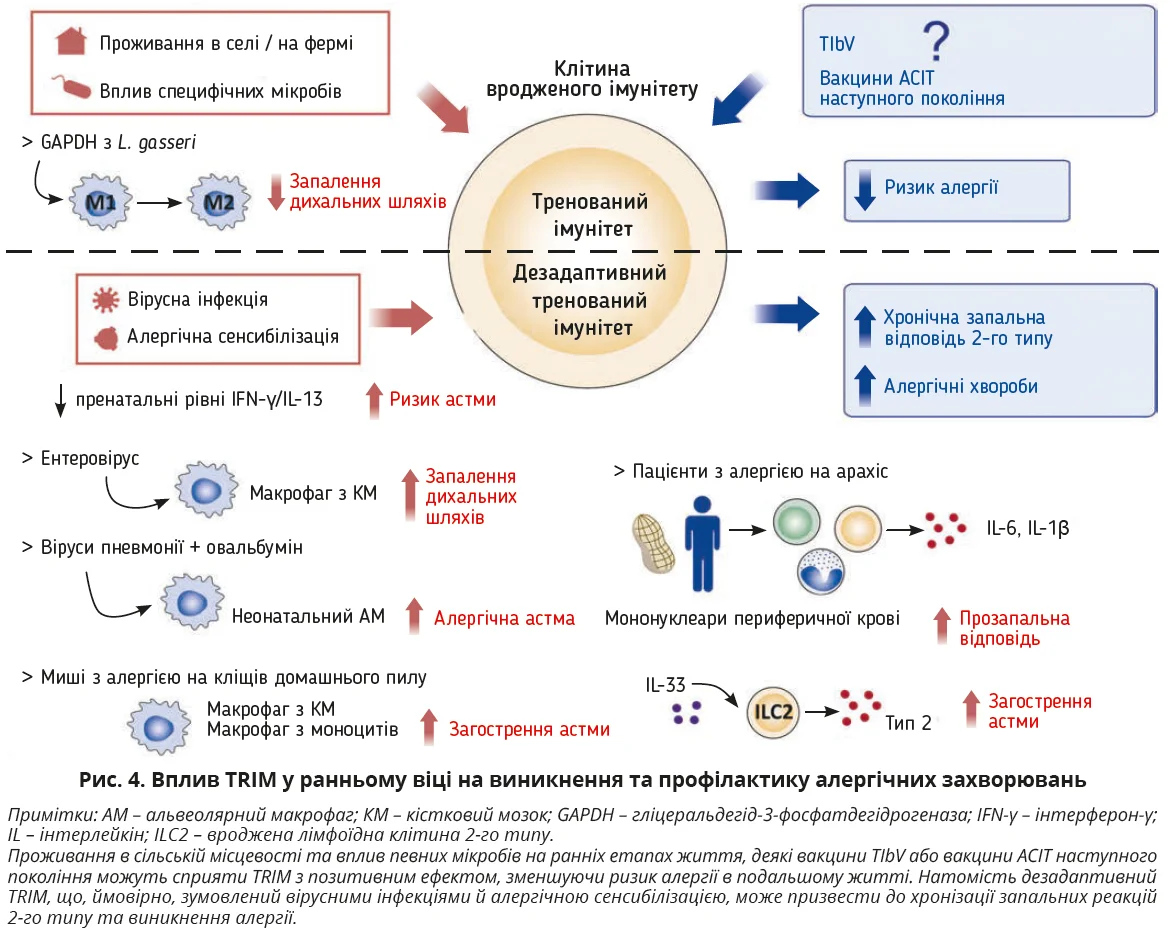
З’являються докази, що зміни довкілля та способу життя сприяють TRIM шляхом імпринтингу метаболічного й епігенетичного перепрограмування в клітинах уродженого імунітету, їхніх попередниках та інших типах клітин; указані зміни пов’язані з появою й погіршенням алергії або, навпаки, індукцією толерантності до алергенів. Експериментальні дослідження й епідеміологічні дані продемонстрували, що проживання в сільській місцевості та вплив певних мікробів або інших чинників у ранньому віці значно знижують ризик алергії, що, ймовірно, пов’язано з TRIM (рис. 4). Інші дослідження показали, що дезадаптація TRIM у ранньому віці може спричиняти хронічні запальні реакції 2-го типу та появу алергії (рис. 4).
Пренатальний імунний ландшафт матері цілком може зумовити появу астми в дитини через епігенетичне перепрограмування при народженні. Нижчі пренатальні рівні IFN-γ/IL-13 у матері асоціювалися з вищим ризиком астми в дітей і зміною мікробіоти верхніх дихальних шляхів у ранньому віці. Вірусні інфекції та сенсибілізація до алергенів є основними чинниками ризику виникнення та загострення астми, а також основними тригерами загострень астми. Макрофаги кісткового мозку мишей, інфіковані ентеровірусом А71, під час неонатального періоду піддаються метаболічному перепрограмуванню та TRIM, що пов’язано з посиленням запалення дихальних шляхів після подальшого контакту з алергеном. Інфікування вірусами пневмонії та сенсибілізація овальбуміном індукують TRIM в альвеолярних неонатальних макрофагах за механізмами перепрограмування метаболізму проліну, зумовлюючи появу алергічної астми. Крім того, різні дослідження продемонстрували потенційну шкідливу або корисну роль тренування макрофагів у контексті астми. Макрофаги кісткового мозку мишей з алергією на кліщів домашнього пилу, а також моноцитарні макрофаги пацієнтів з астмою й алергією на кліщів продемонстрували TNF-опосередковану індукцію TRIM зі збільшенням вироблення прозапальних цитокінів і медіаторів, які спричиняли загострення астми. Тренування макрофагів мишей, які отримували гліцеральдегід-3-фосфатдегідрогеназу з Lactobacillus gasseri, змінювало фенотип M2 на M1 за механізмами метаболічного перепрограмування, що послаблювало спричинене алергеном запалення дихальних шляхів. Відкриття індукції TRIM на ILC2 покращило розуміння впливу алергенів або подразників у ранньому віці, що зумовлює функціональність ILC2 та їхню здатність реагувати на вторинні впливи в дорослому віці. Проте надмірна активація ILC2 призводить до дезадаптивних захворювань 2-го типу. Декілька досліджень переконливо продемонстрували, що активовані IL-33 ILC2 здатні виробляти більшу кількість цитокінів 2-го типу після другої стимуляції, що призводить до загострення астми. Адже IL-33 спричиняє метаболічне й епігенетичне перепрограмування ILC2 з активацією та мітохондріальною транслокацією STAT3, які регулюють утворення АТФ для підживлення циклу метіоніну; як наслідок, підвищується рівень S-аденозилметіоніну й відбувається епігенетична перебудова локусів IL-5 та IL-13. Окрім того, надмірна вроджена імунна відповідь у ранньому віці асоціюється з посиленою імунною відповіддю 2-го типу та появою харчової алергії в дітей. Діти з алергією на яйця або арахіс демонстрували вроджену імунну гіперреактивність зі збільшенням кількості циркулювальних моноцитів і дендритних клітин, але меншою кількістю Tregs порівняно зі здоровими донорами, що вказує на потенційну роль TRIM у харчовій алергії. Цілеспрямований профіль метилювання ДНК виявив, що мононуклеари периферичної крові пацієнтів з алергією на арахіс демонстрували знижені рівні метилювання ДНК у прозапальних генах IL1B й IL6 порівняно зі здоровими донорами; задокументовано також вищі рівні секреції відповідних прозапальних цитокінів у разі стимуляції in vitro. Хоча механізми TRIM і TIbV продемонстрували ефективність проти гетерологічних інфекцій у дітей і дорослих, залишається дискусійною їхня здатність зумовлювати розвиток алергопатології чи запобігати їй у різних вікових періодах.
Отже, дезадаптивний TRIM здатний спричиняти гіперзапальні вроджені імунні реакції на ранньому етапі життя, котрі можуть призводити до виникнення хронізації астми або харчової алергії. З іншого боку, ранній вплив певних мікробів і проживання в сільській місцевості, ймовірно, сприяють TRIM із захисним ефектом проти розвитку алергічних захворювань (рис. 4).
Роль TRIM в АСІТ: до нових алергенних вакцин на основі TRIM
Попри те що АСІТ продемонструвала клінічну безпеку й ефективність для багатьох пацієнтів з алергією, існує декілька недоліків з погляду тривалості лікування, піддатливості пацієнтів, ризику індукції алергічних реакцій або відсутності ефекту в деяких пацієнтів. Поглиблення знань про імунологічні механізми, що лежать в основі успішної АСІТ, дало змогу досліджувати різні стратегії, спрямовані на подолання недоліків, зокрема використання альтернативних шляхів уведення вакцини, розроблення гіпоалергенних вакцин, поєднання АСІТ із ключовими цільовими біологічними препаратами або використання нових ад’ювантів, здатних підвищити поглинання алергену та протиалергічну дію, для створення вакцин АСІТ нового покоління. Успішна АСІТ відновлює патогенні відповіді на алергени шляхом індукції алергеноспецифічних Tregs і Bregs, а також блокування антитіл IgG4 (адаптивні імунні відповіді). Проте останні дані показують, що відновлення належної вродженої імунної відповіді також є ознакою успішної АСІТ.
Аналіз субпопуляцій клітин уродженого імунітету за допомогою проточної цитометрії в пацієнтів з алергією, які проходили передсезонну підшкірну АСІТ з алергоїдами берези та/або трави, показав зниження частоти виявлення циркулювальних ILC2 й ILC3, але підвищення частоти виявлення ILC1 під час АСІТ до рівнів, які спостерігалися в здорових донорів групи контролю. Зумовлене АСІТ системне зниження ILC2 та збільшення ILC1 залишалися стабільними на 3-й рік після початку терапії. Крім того, AСIT індукувала зрушення від прозапального фенотипу (некласичний CD14dimCD16high) до протизапального фенотипу (проміжний CD14highCD16low) циркулювальних моноцитів протягом 1-го року після лікування. Прикметно, що підвищувалася частота виявлення плазмоцитоїдних дендритних клітин (pDC), які беруть участь у генеруванні Tregs та оральної толерантності, а також CD141+ мієлоїдних дендритних клітин (mDC); натомість частота виявлення mDC 2-го типу, які беруть участь у поляризації Th2, зменшувалася, досягаючи рівнів, притаманних здоровим донорам. Інші клінічні дослідження вивчали потенційну здатність АСІТ сприяти епігенетичній регуляції. Після короткочасної та довгострокової підшкірної АСІТ у пацієнтів з алергічним ринітом рівні мікроРНК, отриманої з екзосом (miRNA)-146a-3p, були значно знижені в групі ефективної терапії. Отже, мікроРНК, отримана з екзосом, може брати участь у індукції толерантності до алергену та бути потенційним біомаркером для прогнозування ранньої ефективності сублінгвальної AСIT. Інше дослідження за участю дітей з алергічною астмою показало, що AСIT з використанням Dermatophagoides pteronyssinus (Der p) посилювала метилювання ДНК промотора гена IL4 у мононуклеарах периферичної крові із супутнім зниженням утворення IL-4 в осіб, які отримували лікування, порівняно з дітьми, які не отримували лікування; виявлені зміни здатні запобігти розвитку нової алергічної сенсибілізації.
Дезадаптивний TRIM на ранньому етапі життя може спричиняти алергію, але декілька TIbV продемонстрували захисні впливи. Наприклад, у багатоцентровому клінічному дослідженні ІІІ фази, проведеному в Австралії, оцінювали здатність неонатальної вакцинації БЦЖ запобігати виникненню алергії, інфекцій і астми в немовлят і дітей. Вакцинація БЦЖ забезпечувала специфічний патерн метилювання ДНК у циркулювальних моноцитах, який зберігався понад 12 місяців після неонатальної вакцинації БЦЖ і характеризувався посиленням IFN-γ та противірусної відповіді, що могло асоціюватися з невеликим сприятливим ефектом щодо захворюваності на екзему впродовж 12 місяців після вакцинації. Перинатальні записи в когорті дітей, які отримали першу дозу протикашлюкової вакцини у віці до 4 місяців, показали, що цільноклітинна кашлюкова вакцина зменшувала ризик госпіталізації через анафілаксію, спричинену їжею, на відміну від ацелюлярної кашлюкової вакцини. Потрібно додатково дослідити, з чим саме пов’язана профілактика анафілаксії: з імунними відповідями 1-го типу, опосередкованими IFN-γ, чи з індукцією толерантності. Сублінгвальне призначення MV130, термоінактивованого полібактерійного препарату, який на 90% складається з грампозитивних бактерій (Staphylococcus aureus – 15%, Staphylococcus epidermidis – 15%, Streptococcus pneumoniae – 60%) і на 10% – із грамнегативних бактерій (Klebsiella pneumoniae – 4%, Moraxella catarrhalis – 3%, Haemophilus influenzae – 3%), значно знижувало частоту інфекцій дихальних шляхів і потребу в антибіотиках у дітей, дорослих і пацієнтів з автоімунними хворобами або імунодефіцитами, причому сприятливі ефекти тривали впродовж 3 років після припинення лікування.
Це пояснюється здатністю MV130 індукувати утворення сильних Т-клітин, які виробляють Th1, Th17 та IL-10, забезпечуючи неспецифічний захист від інших інфекцій, зокрема вірусних. У рандомізованому подвійно сліпому плацебо-контрольованому клінічному дослідженні III фази було показано, що сублінгвальне введення MV130 є безпечним методом запобігання рецидивам свистячого дихання в дітей. Порівняно з плацебо в дітей, які отримували MV130, спостерігалися значно нижчі показники кількості днів з нападами свистячого дихання, тривалості нападів, комбінації симптомів і показників застосування ліків; сприятливі впливи зберігалися впродовж 6 місяців після завершення лікування. У дослідженнях на тваринах чітко продемонстровано, що MV130 захищає від вірусних інфекцій за допомогою механізмів TRIM через специфічне метаболічне й епігенетичне перепрограмування вроджених імунних клітин та їхніх попередників. Окрім того, MV130 продемонстрував здатність захищати від інфекції SARS-CoV-2 та підвищувати імуногенність вакцини проти COVID-19. Отже, отримано переконливі докази, що слизова вакцина MV130 індукує TRIM і захищає від рецидивних вірусних інфекцій. Хоча потенційна здатність MV130 запобігати алергічній еозинофільній астмі залишається незрозумілою, є дані, що MV130 запобігає запаленню дихальних шляхів у моделі еозинофільної астми, спричиненої кліщами домашнього пилу; відповідно, цей сублінгвальний препарат також може проявляти протиалергічні властивості.
Нові індуктори толерантності для створення вакцин на основі TRIM
Виявлення індукторів толерантності є надзвичайно важливим у контексті алергії, оскільки може сприяти розробленню нових стратегій утручання. Зокрема, кон’югати алергоїд-манан є вакцинами АСІТ наступного покоління, націленими на дендритні клітини, які продемонстрували безпеку й ефективність у різних клінічних дослідженнях II фази щодо алергії на кліщів домашнього пилу, пилок берези та трав. Націлюючись на дендритні клітини через манозний рецептор і DC-SIGN, кон’югати сприяють утворенню толерогенних дендритних клітин (tolDC), здатних поляризувати функціональні FOXP3+ Tregs in vivo й in vitro. Крім того, кон’югати спонукають моноцити від атопічних і здорових донорів диференціюватися в tolDC за механізмами метаболічного й епігенетичного перепрограмування; зокрема, підвищуються мітохондріальна активність і окисне фосфорилювання та пригнічується гліколіз. Метаболічна перебудова пов’язана зі значним збільшенням позначок активації гістонів (H3K4me3, H3K27ac) у промоторах таких толерогенних маркерів, як IL-10, PD-L1, SOCS1/3, а також значно вищими рівнями miR-146a/b та нижчими рівнями мікроРНК-155. Отже, кон’югати алергоїд-манан сприяють метаболічному й епігенетичному перепрограмуванню клітин уродженого імунітету, що пов’язано з індукцією толерантності до алергену.
У пацієнтів з алергією підвищуються рівні експресії мРНК та білка канабіноїдного рецептора-1 у мигдаликах і циркулювальній крові; відповідно, ендоканабіноїдна система може відігравати певну роль у регуляції алергії. Зокрема, синтетичний канабіноїд WIN55212-2 генерує tolDC людини, здатні запускати функціональні Tregs за механізмами, залежними від індукції автофагії та метаболічного перепрограмування. На тваринних моделях алергії на арахіс продемонстровано здатність WIN55212-2 запобігати алергічній сенсибілізації та послаблювати спричинену арахісом анафілаксію, пригнічувати запальні Т-клітини мигдаликів і перепрограмувати моноцити й макрофаги для пригнічення запалення шляхом індукції метаболічної перебудови. Отже, канабіноїди є потенційним терапевтичним засобом для лікування астми та харчової алергії; канабіноїд WIN55212-2 має найпотужнішу протизапальну й імуномодулювальну здатність. Надалі треба дослідити, чи супроводжується метаболічне перепрограмування, зумовлене WIN55212-2 у дендритних клітинах, моноцитах і макрофагах людини, епігенетичними змінами.
Тож ідентифікація й детальна характеристика нових індукторів толерантності цілком можуть сприяти відкриттю нових шляхів для розроблення вакцин на основі TRIM для профілактики та лікування алергії (рис. 5).
Включення індукторів толерантності до алергенів (вакцина БЦЖ, полібактерійний препарат MV130, алергоїд-манан, канабіноїди тощо) в препаратах, що містять специфічні алергени, може становити перспективну стратегію для розроблення вакцин проти алергенів на основі TRIM. Ці препарати забезпечуватимуть антигеноспецифічні та неспецифічні відповіді, широкі здорові імунні відповіді на споріднені та неспоріднені алергени.
Висновки та майбутні перспективи
Подальші дослідження ролі TRIM цілком можуть допомогти розробити інноваційні стратегії втручання в пацієнтів з алергією. Дезадаптація TRIM на ранніх етапах життя здатна призвести до надмірних запальних уроджених імунних реакцій, які посилюють аномальне запалення 2-го типу та спричиняють виникнення й погіршення алергічних захворювань. Навпаки, вплив сільської місцевості та специфічних мікробів на ранніх етапах життя посилює правильні вроджені імунні реакції, залучаючи механізми TRIM, які запобігають повторним інфекціям і розвитку алергії. Декілька вакцин TIbV та AСIT нового покоління продемонстрували захисну протиалергічну дію й індукцію толерантності за механізмами метаболічного й епігенетичного перепрограмування клітин уродженого імунітету та їхніх попередників. Проте детальніше вивчення потребує подальших досліджень. Краще розуміння механізмів індукції TRIM у ранньому віці, що призводить до дезадаптивних або сприятливих захисних ефектів, розкриття молекулярних механізмів регуляції та взаємозв’язків метаболічних і епігенетичних змін, а також ідентифікація й характеристика нових індукторів толерантності сприятимуть розробленню нових алергенних вакцин на основі TRIM для профілактики та лікування алергічних захворювань.
Література
Martín-Cruz L., Palomares O. Allergen-specific immunotherapy and trained immunity. Allergy. 2024 Dec 6. doi: 10.1111/all.16423.