Алергенспецифічна імунотерапія та тренування імунітету. Частина 1
Переклала й адаптувала канд. мед. наук Ольга Королюк
Алергенспецифічна імунотерапія (AСIT) – єдиний метод лікування алергії з потенційною здатністю модифікувати хворобу. Її ефективність доведено для низки алергічних захворювань: риніту, астми, алергії на отруту перетинчастокрилих комах, IgE-опосередкованої харчової алергії.
Встановлено, що АСІТ індукує швидку десенсибілізацію ефекторних клітин (мастоцитів, базофілів), унаслідок чого виникають імунологічні механізми, які сприяють встановленню довгострокової толерантності до алергену. Ознаками переносимості алергену та клінічного поліпшення після успішної АСІТ є генерування алергенспецифічних регуляторних Т- і В-клітин (Tregs і Bregs відповідно), Th1-клітин, пригнічення алергенспецифічних відповідей Th2 і Th2A, генерування алергенспецифічного блокування антитіл класів IgG4, IgA й IgG2 із супутнім зниженням IgE, а також значне зменшення запальних клітин в уражених тканинах. Регуляція клітин уродженого імунітету, як-от уроджені лімфоїдні клітини 2-го типу (ILC2), моноцити, макрофаги або дендритні клітини, також істотно сприяє відновленню стійкої нормальної імунної відповіді на алергени.
Отже, механізми тренованого імунітету (TRIM) здатні відігравати важливу роль у сприятливих ефектах АСІТ.
Експерименти з інфікування/вакцинації in vitro й in vivo з використанням вакцин Candida albicans або БЦЖ (бацила Кальметта – Ґерена) на тваринних моделях і в людей підтвердили, що імунну пам’ять не варто приписувати виключно адаптивним імунним клітинам. За визначенням, TRIM – це здатність клітин уродженого імунітету набувати механізмів пам’яті-мислення залежно від епігенетичного та метаболічного перепрограмування, що надає підвищений неспецифічний захист від інфекцій. З огляду на цю концепцію виникли вакцини на основі TRIM (TIbV) як нова парадигма у вакцинології. TIbV – це вакцини, здатні індукувати TRIM, забезпечуючи захист як від патогенів, які входять до складу вакцини, так і від неспоріднених патогенів. Декілька звичайних вакцин, наприклад вакцину БЦЖ, можна розглядати як TIbV через доведену здатність забезпечувати захист від інших патогенів, окрім цільових. Отримано переконливі експериментальні докази, що TRIM може відігравати роль не лише при інфекціях, а й при алергії, оскільки дезадаптація TRIM у ранньому віці призводить до тривалих гіперзапальних уроджених імунних реакцій, які спричиняють аномальне запалення 2-го типу з наступним виникненням або погіршенням різних проявів алергії. Відомо також, що тривалий вплив певних мікробів і життя в сільській місцевості захищають від алергії; ймовірно, таким захисним ефектам сприяють механізми TRIM. Отже, декілька вакцин проти TIbV та AСIT нового покоління забезпечуватимуть розвиток толерантності до алергенів за допомогою механізмів, залежних від TRIM. Краще розуміння молекулярних механізмів індукції TRIM, ідентифікація та характеристика нових індукторів толерантності можуть сприяти розробленню нових вакцин для лікування алергічних захворювань.
У цьому огляді обговорюються нові висновки щодо TRIM у контексті АСІТ з акцентом на можливість клінічного застосування для розроблення вдосконалених стратегій профілактики та лікування алергічних захворювань.
Імунологічні механізми успішної АСІТ
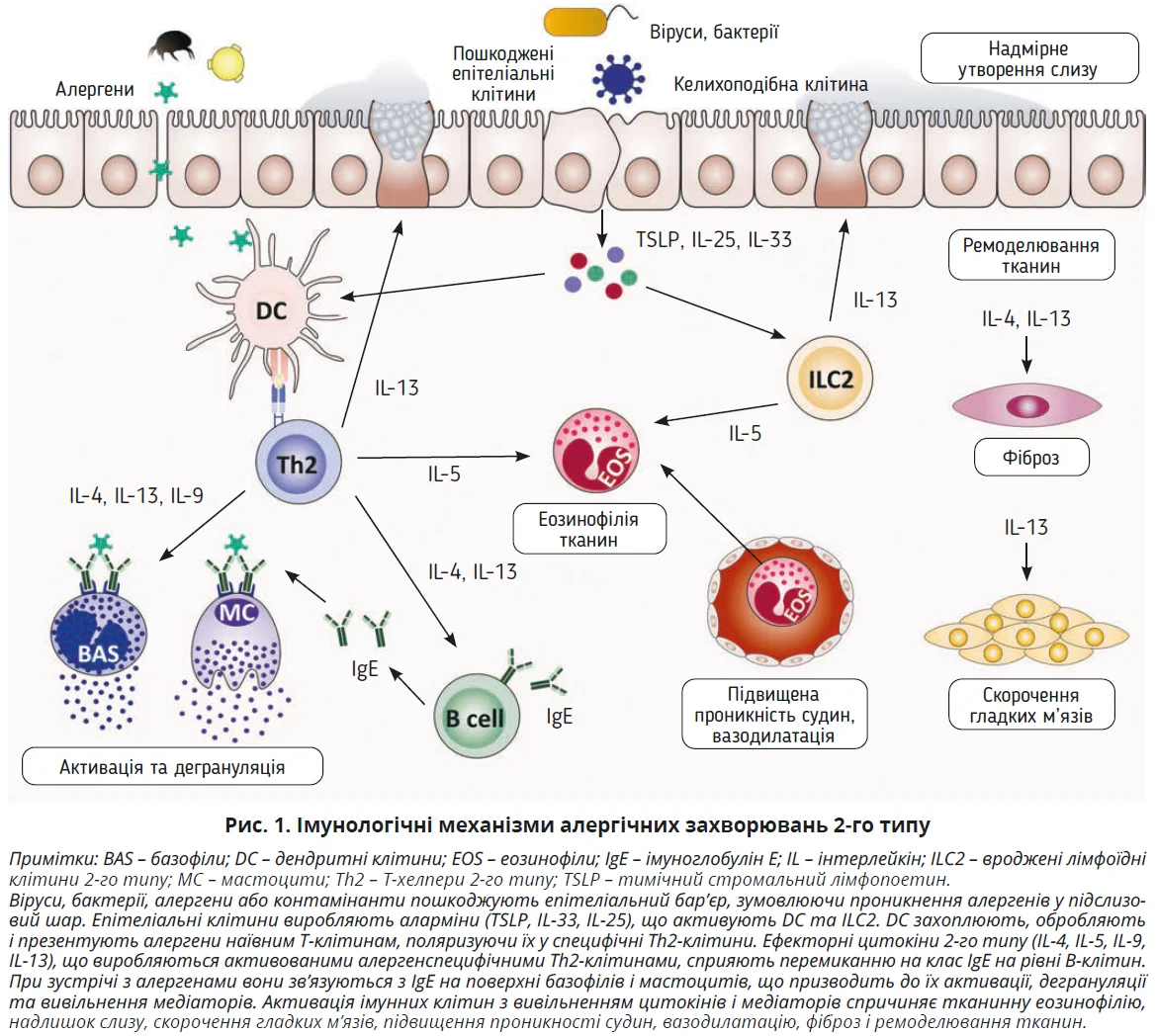
Алергічне запалення виникає в генетично сприйнятливих осіб після сенсибілізації при контакті із зовнішніми причинними алергенами за механізмами, здебільшого пов’язаними з аномальними запальними реакціями 2-го типу. IgE-опосередкована дегрануляція ефекторних клітин (мастоцитів, базофілів), епітеліальні аларміни (TSLP, IL-33 або IL-25) та ефекторні цитокіни 2-го типу (IL-4, IL-5, IL-9, IL-13, IL-31), що виробляються алерген специфічними клітинами Th2 та ILC2, спричиняють тканинну еозинофілію, гіперпродукцію слизу, скорочення гладкої мускулатури, підвищену проникність судин, вазодилатацію, фіброз і ремоделювання тканин, що асоціюються з тяжкими хронічними клінічними проявами алергії (рис. 1).
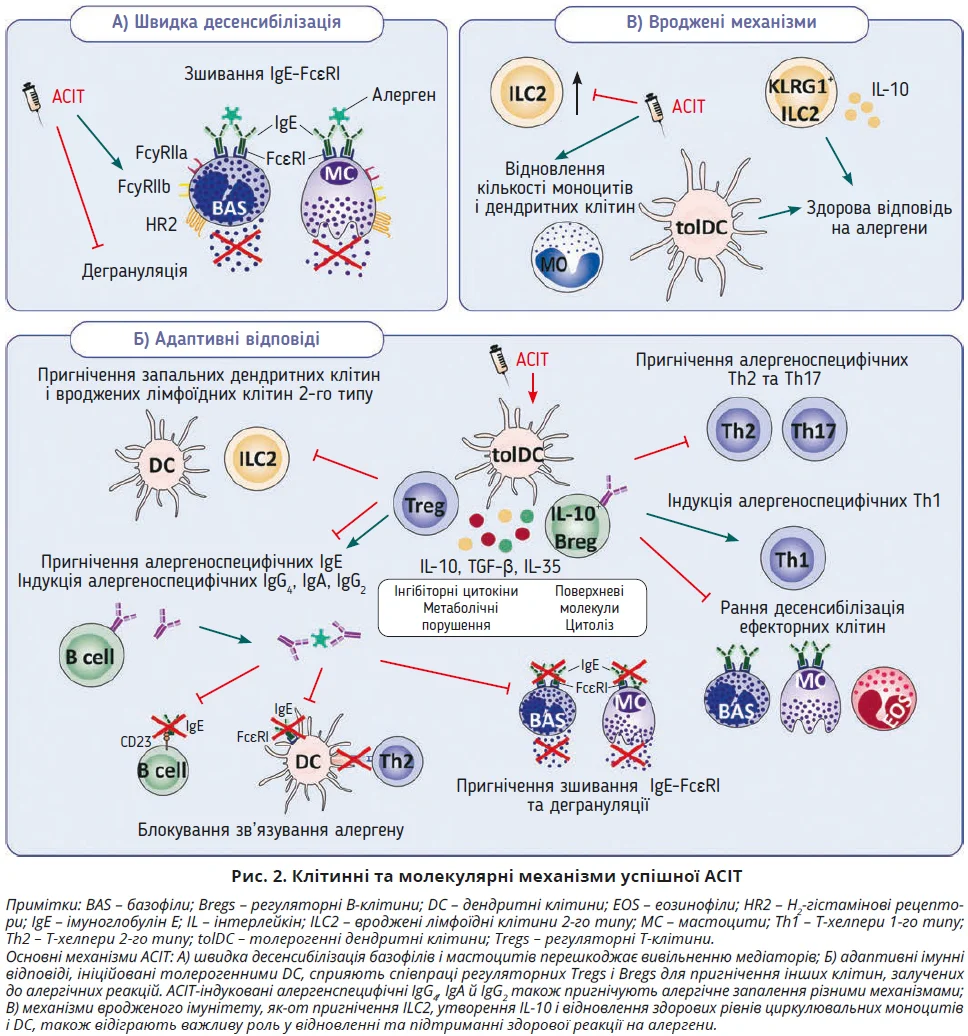
Принципом АСІТ є введення високих доз причинних алергенів підшкірно або сублінгвально для досягнення стійкої толерантності до алергену після припинення лікування. Відразу після першого введення алергену AСIT забезпечує десенсибілізацію мастоцитів і базофілів (рис. 2A). Механізми, відповідальні за швидку десенсибілізацію, охоплюють підвищення експресії кількох супресивних рецепторів на ефекторних клітинах, зокрема рецепторів IgG з низькою спорідненістю (FcγRIIa та FcγRIIb) або Н2-гістамінових рецепторів, які після активації порушують індуковане алергеном зшивання IgE-FcεRI та дегрануляцію ефекторних клітин (рис. 2A).
Досягнення тривалої толерантності до алергенів під час АСІТ виникає внаслідок низки механізмів із залученням різних типів клітин (рис. 2Б). Ключовими чинниками для відновлення нормальної імунної відповіді на алергени є утворення й підтримання функціонування алергенспецифічних Tregs і Bregs. Уведення високих доз алергенів під час АСІТ індукує генерування толерогенних дендритних клітин, здатних виробляти високі рівні IL-10, а також поляризувати й розширювати різні функціональні субодиниці алергенспецифічних Tregs, які пригнічують алергічне запалення. Алергенспецифічні Tregs можна класифікувати на природні клітини з тимуса (tTregs) і периферичні Tregs (pTregs), які охоплюють індуцибельні Tregs з експресією FOXP3+ (iTregs), Tr1-клітини (виробляють IL-10) і Th3-клітини (виробляють TGF-β). Унаслідок успішної АСІТ з’являється значна кількість функціональних Treg у циркулювальній крові та слизовій оболонці носа, що пригнічує алергічне запалення через вплив на різні типи клітин (мастоцити, базофіли, еозинофіли, DC, ILC2, Th2, B-клітини) через різні механізми: 1) утворення інгібіторних цитокінів (IL-10, IL-35, TGF-β); 2) порушення метаболізму в клітинах-мішенях; 3) експресію високих рівнів поверхневих молекул із пригнічувальною здатністю (PD1, CTLA-4, LAG3, ICOS); 4) цитоліз (рис. 2Б). Індуковані АСІТ Tregs відіграють важливу роль в утворенні алергенспецифічних блокувальних антитіл. Зокрема, IL-10 сприяє виробленню антитіл класу IgG4, тоді як TGF-β – антитіл класу IgA на рівні B-клітин. Отже, Bregs, що виробляють IL-10, співпрацюють із Tregs у пригніченні алергічного запалення, а також відіграють важливу роль у досягненні імунної толерантності (рис. 2Б). На підтвердження цієї гіпотези продемонстровано значне збільшення циркулювальних Der p 1-специфічних В-клітин, плазмобластів, IL-10+ та IL-1RA+ Bregs у пацієнтів з алергією на кліщів домашнього пилу, які отримували АСІТ. Алергенспецифічні блокувальні антитіла конкурують з IgE за алерген, безпосередньо пригнічуючи опосередковану алергеном IgE-FcεRI перехресну активацію мастоцитів і базофілів. Окрім того, вони погіршують IgE-спрощену презентацію, блокуючи зв’язування алергену з IgE-CD23 на B-клітинах або IgE-FcεRI на дендритних клітинах, погіршуючи генерацію, експансію й активацію алергенспецифічних Th2-клітин (рис. 2Б). Показано, що алергенспецифічні ізотипи IgG2 й IgG4 пригнічують IgE-опосередковану алергічну відповідь в осіб, які отримували сублінгвальну АСІТ з пилком трав. Проте фактична роль інших підкласів IgG в індукції толерантності досі не з’ясована. Також AСIT посилює утворення алергенспецифічного IgD у пацієнтів з астмою, сенсибілізованих до кліщів домашнього пилу, але для виявлення потенційних клінічних впливів указаних змін потрібні подальші дослідження.
На додаток до шляхів імунної регуляції, які охоплюють адаптивні імунні відповіді, нещодавно встановлено, що індукції толерантності під час АСІТ може сприяти регуляція вроджених імунних клітин: ILC2, DC, моноцитів, макрофагів. Тканинні ILC2 швидко активуються епітеліальними алармінами, що вивільняються під час впливу алергенів або інших зовнішніх впливів (рис. 1), спричиняючи утворення значної кількості цитокінів 2-го типу та появу клінічних симптомів алергії. Існує думка, що AСIT пилком трав пригнічує сезонне збільшення ILC2 та регулює їхні фенотипові й функціональні особливості, сприяючи генеруванню KLRG1+ ILC2, які виробляють IL-10, унаслідок чого відновлюється здорова відповідь на алергени за механізмами, які частково залежать від шляхів ретиноєвої кислоти (рис. 2В). Крім того, АСІТ індукує зміни у складі та гетерогенності різних субпопуляцій циркулювальних моноцитів і дендритних клітин, доводячи їх до рівня, притаманного здоровим людям. У сукупності ці дані засвідчують потенційну роль механізмів TRIM у відновленні стійких нормальних імунних відповідей на алергени після АСІТ.
TRIM: нові відкриття та застосування у вакцинології
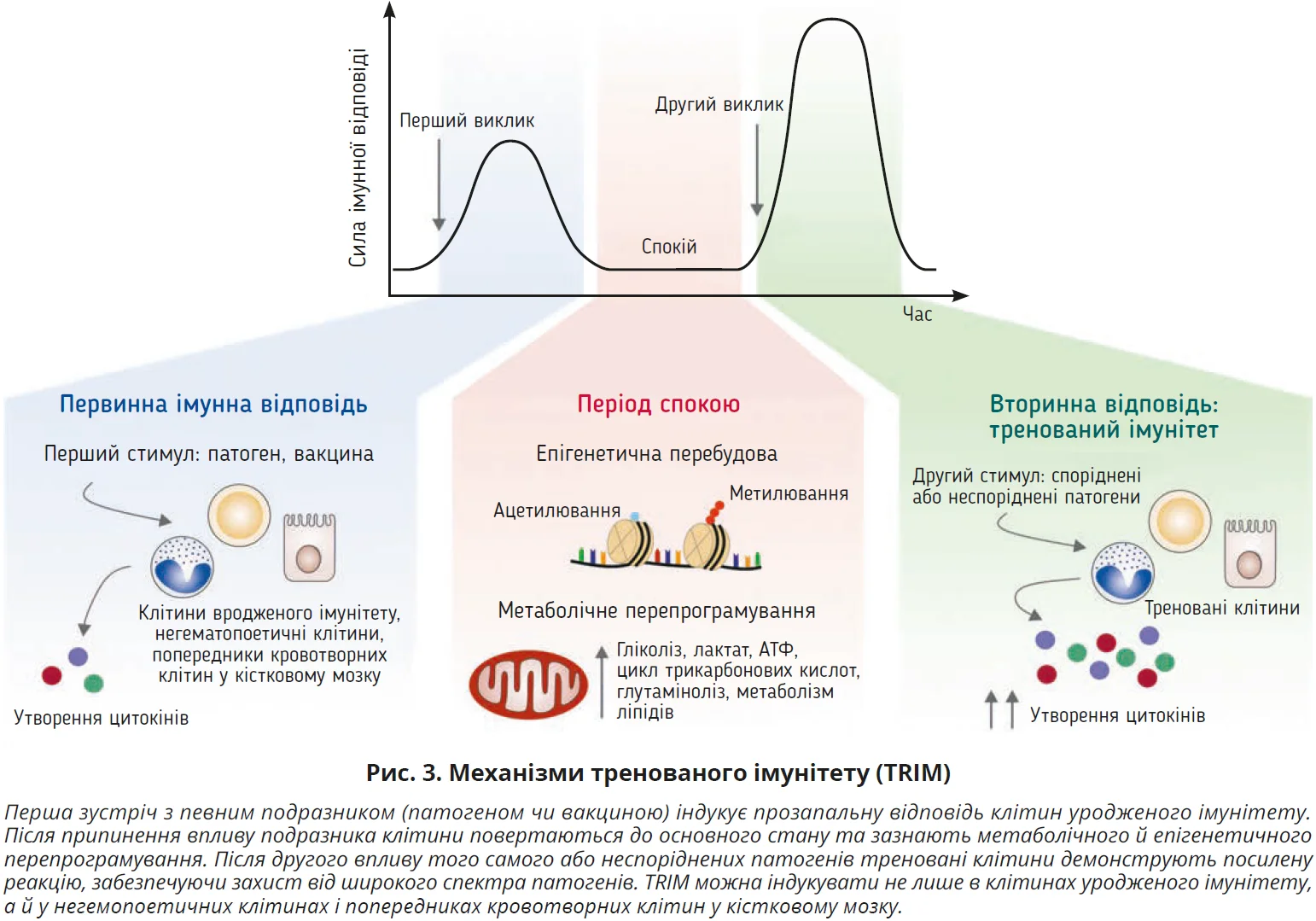
За визначенням, TRIM – це здатність клітин уродженого імунітету набувати пам’яті за механізмами епігенетичної та метаболічної перебудови. Тобто TRIM є механізмом пам’яті клітин уродженого імунітету, що надає неспецифічний захист від інфекцій. Коли клітини вродженого імунітету вперше стикаються з певними подразниками (патогеном або вакциною), вони виробляють першу прозапальну відповідь. Після її припинення та залежно від стимулу клітини вродженого імунітету можуть зазнавати метаболічного й епігенетичного перепрограмування. При повторній зустрічі з тим самим або, що дуже важливо, з іншими неспорідненими патогенами навчені клітини здатні реагувати набагато швидше й ефективніше, забезпечуючи захист від широкого спектра гетерологічних патогенів (рис. 3). Раніше вважалося, що TRIM стосується клітин уродженого імунітету (моноцитів/макрофагів, NK-клітин, ILC2, DC, нейтрофілів) і певних типів негематопоетичних клітин (фібробластів, епітеліоцитів, ендотеліоцитів) – так звана концепція «периферичного TRIM». Нещодавно переконливо продемонстровано, що TRIM відбувається в кістковому мозку, поширюючись на попередники кровотворних клітин – «центральний TRIM», що дає змогу поповнювати циркулювальні вроджені клітини пам’яті, забезпечуючи тривалі відповіді впродовж тижнів-місяців. Незважаючи на певну суперечливість, декілька досліджень показали, що TRIM може передаватися нащадкам різними механізмами, як-от епігенетичне успадкування, передача імунних компонентів від матері або опосередкована мікробіотою передача. Епігенетичне й метаболічне перепрограмування є жорстко регульованими та взаємопов’язаними молекулярними механізмами, що індукують TRIM (рис. 3). Після першого зіткнення з індукторами TRIM придбання активних позначок хроматину,
як-от триметилювання гістону-3 лізину-4 (H3K4me3), ацетилювання гістону-3 лізину-27 (H3K27ac), а також втрата метилювання ДНК на промоторах і підсилювачах генів прозапальних цитокінів (IL6, TNFA, IL1B) забезпечують зміни доступності хроматину, що сприяє транскрипції при повторній стимуляції (рис. 3). Натомість під час індукції толерантності посилюється триметилювання репресивної мітки гістону-3 лізину-9 (H3K9me3) у промоторах, які пригнічують TRIM. Індукція TRIM також пов’язана з епігенетичним переналаштуванням і активною транскрипцією генів, які беруть участь в енергетичному метаболізмі, включно з гліколізом, ферментацією лактату, циклом трикарбонових кислот, глутамінолізом, метаболізмом ліпідів, виробленням аденозинтрифосфату (АТФ), і в процесах, які регулюються шляхом Akt/mTOR/HIF1α (рис. 3).
TIbV індукують TRIM, забезпечуючи захист як від цільових патогенів, які входять до складу вакцини, так і від неспоріднених. TIbV містить два основні компоненти: 1) індуктори TRIM, тобто асоційовані з патогенами молекулярні структури, здатні запускати сигнальні шляхи, що сприяють епігенетичному та метаболічному перепрограмуванню; 2) антигени, які містяться у складі вакцини або пов’язані з патогенами, що несуть індуктори TRIM. TIbV призначені не для заміни звичайних вакцин, а радше як доповнення до них. Фактично як TIbV можна розглядати декілька звичайних вакцин, здатних забезпечувати захист проти інших патогенів, окрім цільових. Прикладом TIbV є жива ослаблена протитуберкульозна вакцина БЦЖ проти Mycobacterium bovis, яка продемонструвала зниження дитячої смертності, забезпечуючи захист від широкого спектра патогенів шляхом TRIM. Іншими прикладами TIbV є пероральні вакцини проти поліомієліту, вакцини проти кору, грипу, жовтої лихоманки або слизові вакцини MV130. Звичайні вакцини надають захист лише від цільової інфекції, але TIbV надає переваги за певних умов, зокрема за відсутності звичайних вакцин (як на початку пандемії COVID-19); для збудників з високою частотою сезонних мутацій (як вірус грипу); для вразливих груп населення, що дуже сприйнятливі до інфекції через погану відповідь на звичайні вакцини (похилий вік, ослаблений імунітет); у випадках, коли численні вірусні й бактерійні інфекції спричиняють прогресування та посилюють тяжкість хвороби (наприклад, загострення астми); в пацієнтів, які страждають від рецидивних інфекцій. Зокрема, було показано, що сублінгвальна вакцина V132 (термоінактивована композиція C. albicans), яка використовується для рецидивного вульвовагінального кандидозу, індукує TRIM в експериментальних моделях in vitro й in vivo та потенціює вроджені й адаптивні імунні відповіді, зумовлені термоінактивованою полібактерійною вакциною MV140, яка показана при рецидивних інфекціях сечовивідних шляхів. Зважаючи на те що рецидивний вульвовагінальний кандидоз і рецидивні інфекції сечовивідних шляхів часто співіснують у сприйнятливих жінок, а також на відсутність надійних методів для їх профілактики та лікування, ці доклінічні дані цілком можуть сприяти розробленню майбутніх альтернативних стратегій з використанням нових TIbV шляхом поєднання V132 та MV140.
Захист, наданий звичайними вакцинами, може тривати десятиліттями; довготривалий вплив TRIM варіює від тижнів до місяців, іноді років, що наразі є предметом інтенсивних досліджень. На досягнення довгострокових ефектів впливають різні чинники, як-от природа індуктора TRIM (живий або інактивований), кількість уведених доз. Цікаво, що нещодавні результати вказують на те, що TRIM може різними механізмами передаватися нащадкам.
Література
Martín-Cruz L., Palomares O. Allergen-specific immunotherapy and trained immunity. Allergy. 2024 Dec 6. doi: 10.1111/all.16423.