Алергеноспецифічна імунотерапія при алергічній астмі й IgE-опосередкованій харчовій алергії
Підготувала канд. мед. наук Ольга Королюк
Принцип алергеноспецифічної імунотерапії (АСІТ) полягає у багаторазовому введенні специфічних алергенів з метою індукції імунологічної толерантності для захисту від симптоматичних алергічних реакцій 1 типу (опосередкованих IgE), зумовлених причинними алергенами. Уперше концепцію АСІТ запропонував Леонард Нун, який у 1911 р. опублікував свої висновки в журналі Lancet, продемонструвавши, що підшкірне застосування водного екстракту пилку трави зменшує сезонні симптоми полінозу й астми. Відтоді сформульовано певні показання до АСІТ (алергія на пилок дерев і амброзії, кліщів домашнього пилу, отруту перетинчастокрилих); проведено дослідження для визначення діапазону доз; запроваджено різні шляхи введення; стандартизовано виробництво вакцин. Хоча сучасні вакцини й режими дозування стали безпечнішими, головна концепція кардинально не змінювалася понад 100 років. Удосконалення розуміння патогенетичних механізмів алергії сприяло розробленню нових вакцин і нових шляхів уведення алергенів. Із клінічного погляду останні докази довгострокової безпеки й ефективності мають стимулювати інновації в цій галузі. Зазначимо, що переважна кількість публікацій присвячена використанню АСІТ при алергічному риніті та інсектній алергії до перетинчастокрилих комах, тому в цій публікації ми зупинилися на використанні АСІТ саме при алергічному фенотипі бронхіальної астми та IgE-опосередкованій харчовій алергії.
Алергічна астма [1]
Механізми алергічних реакцій дихальних шляхів
Здебільшого надмірна імунна відповідь на певні алергени зумовлена комбінованим впливом генетичних і зовнішніх чинників. Алергічні реакції при астмі й алергічному риніті переважно спричинені Т-хелперами 2 типу (Th2) та вродженими лімфоїдними клітинами 2 типу (ILC2), які продукують інтерлейкін-4 (ІЛ-4), ІЛ-5 та ІЛ-13. Перемикання імунної відповіді на відповідь 2 типу насамперед зумовлена бронхіальними епітеліальними цитокінами – алармінами. До них належать тимусний стромальний лімфопоетин (TSLP), ІЛ-33 й ІЛ-25. Вплив цитокінів бронхіального епітелію на поляризацію до відповіді 2 типу опосередковується через ILC2, а також дендритні клітини, які презентують на своїй поверхні алергени. Надалі алергени розпізнають лімфоцити Th0, що диференціюються до Th2. Цитокіни 2 типу (IЛ-4 й IЛ-13) індукують перемикання ізотипу В-клітин на вироблення IgE. Утворені IgE зв’язуються з Fcε-рецепторами на мембранах тучних клітин і базофілів. Повторний контакт з алергенами призводить до їх зв’язування з IgE, що спричиняє дегрануляцію клітин із вивільненням прозапальних медіаторів. Гістамін зумовлює негайні симптоми алергії, тоді як цистеїніллейкотрієни спричиняють місцеве запалення та сильну тривалу бронхоконстрикцію. Постійне алергічне запалення посилює неспецифічну гіперреактивність і призводить до структурних змін дихальних шляхів. ІЛ-5, що виробляється Th2 й ILC2, регулює проліферацію, дозрівання та праймінг/активацію еозинофілів, які домінують на пізніх фазах алергічного запалення. У здорових осіб запальна реакція ефективно пригнічується регуляторними Т-клітинами (Treg), кількість яких істотно зменшена в слизових оболонках людей з алергією.
Захисні механізми, зумовлені АСІТ
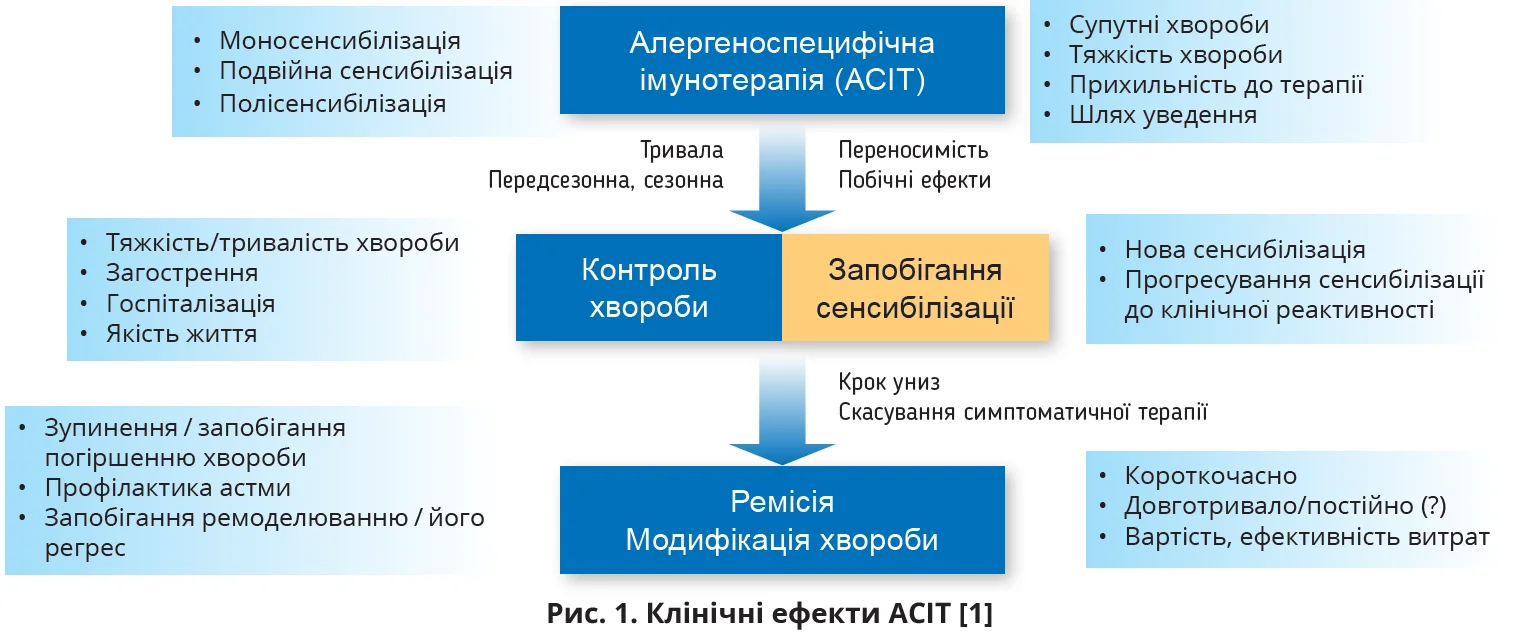
Незважаючи на розроблення й широку доступність багатьох ефективних методів лікування алергії, поки що лише АСІТ впливає на модифікацію хвороби, відновлюючи імунну толерантність до алергену шляхом ослаблення та/або пригнічення ранньої й пізньої алергеноспецифічної гіперреактивності.
Це допомагає досягти контролю хвороби та запобігти подальшій сенсибілізації (рис. 1). За останні десятиліття визначено імунологічні механізми дії АСІТ (табл. 1).
Насамперед АСІТ індукує регуляторні Treg, які пригнічують алергічне запалення шляхом утворення IЛ-10 і трансформувального фактора росту-β (TGF-β). Крім того, пригнічуються відповіді 2 типу й асоційована продукція IgE шляхом перемикання на утворення IgG4 й IgA, посилюються антагоністичні відповіді 1 типу з вивільненням інтерферону-γ. Імовірно, АСІТ також впливає на Т- і В-клітини пам’яті, оскільки клінічні ефекти зберігаються впродовж декількох років після припинення лікування.
Ці ефекти AСIT сприяють ремісії хвороби та/або модифікації в окремих пацієнтів. Отже, успішна AСIT має економічну ефективність.
Настанови Європейської академії алергології та клінічної імунології (EAACI) рекомендують АСІТ пацієнтам із помірним-тяжким алергічним ринітом із підтвердженою причинною алергією, які мають симптоми, незважаючи на фармакотерапію [2, 3]. Схожі рекомендації надає Американська академія алергії, астми й імунології (AAAAI) [4].
Прогностичні біомаркери ефективності АСІТ
Специфічних біомаркерів, які дали би змогу надійно спрогнозувати клінічну ефективність АСІТ або стійкість результату в кожного конкретного пацієнта, поки що немає. Проте клінічна ефективність зазвичай супроводжується певними імунологічними змінами: зменшенням кількості ефекторних клітин (наприклад, еозинофілів) і зниженням їхньої активності, тобто зменшенням утворення медіаторів запалення 2 типу. Крім того, виникають імунологічні зміни, що вказують на Th1-перемикання, індукцію Treg і зниження відповіді Th2 (табл. 1). Під час лікування спостерігалися також зміни експресії широкого спектра імунозалежних генів. Можливо, складніші методи, що поєднують декілька біомаркерів різних рівнів, зможуть допомогти виявляти пацієнтів, які отримали б максимальну користь від АСІТ.
Довгострокова ефективність АСІТ
Упродовж тривалого часу існували певні обмеження щодо застосування АСІТ при астмі внаслідок низки помилкових уявлень. Зокрема, ймовірні проблеми щодо безпеки в пацієнтів із неконтрольованою астмою та/або порушенням функції легень; сумніви щодо ефективності АСІТ через тривалий період лікування (3-5 років); прихильність до терапії; відносно високі витрати з частковим відшкодуванням.
Настанови GINA (2021) рекомендують сублінгвальне застосування ACIT (HDM-SLIT) для пацієнтів з астмою, сенсибілізованих до алергенів кліщів домашнього пилу [5]. Нещодавно оприлюднено результати великого ретроспективного когортного дослідження REACT (Real World Effectiveness In Allergy Immunotherapy), яке оцінювало довгострокову ефективність АСІТ за алергічного риніту й астми. Дослідження включало 46 024 осіб, які були розподілені на групу терапії АСІТ і зіставну за багатьма показниками групу контролю в співвідношенні 1:1. Упродовж 10 років оцінювали призначення ліків, зміни в етапах лікування астми, виникнення загострень і респіраторних інфекцій. Порівняно з контролем у групі АСІТ відзначено менш тяжкі загострення, нижчу частоту респіраторних інфекцій і госпіталізацій, а також можливість послаблення лікування астми [6]. Це дослідження надає високоякісні реальні докази довгострокової ефективності АСІТ, підтверджуючи сучасні клінічні настанови [2-5]. Інше загальнонаціональне епідеміологічне дослідження, проведене в Данії за участю 2688 пацієнтів з астмою віком від 18 до 44 років із сезонною або цілорічною алергією, показало стійку ефективність АСІТ щодо зниження ризику загострень та інфекцій нижніх дихальних шляхів упродовж 3-річного спостереження після AСIT [7].
Окрім досліджень, що підтверджують стійку клінічну ефективність HDM-SLIT при астмі, є докази клінічно значущих переваг AСIT пилковими алергенами як для лікування, так і для профілактики астми. У кількох дослідженнях АСІТ пилковими алергенами зменшувала появу й тяжкість симптомів астми, знижували потребу в засобах для полегшення
й контролю астми, а також покращувала фізіологічні параметри, зокрема об’єм форсованого видиху за 1-шу секунду та неспецифічну й індуковану алергенами гіперреактивність бронхів. Указані клінічні переваги стосуються підшкірної та сублінгвальної АСІТ, хоча деякі дослідження показали відмінності між способами введення й різні клінічні переваги для різних алергенів і досліджуваних популяцій [1]. Отже, потрібні дослідження з великою кількістю пацієнтів, бажано в реальному житті.
Іншим клінічно значущим результатом є здатність АСІТ екстрактами пилку запобігати виникненню астми в дітей і дорослих з алергічним ринітом. Цікаво, що докази щодо профілактики астми є потужнішими для АСІТ з алергенами пилку порівняно з алергенами кліщів домашнього пилу.
Тривалість лікування АСІТ має становити не менш як 3 роки. Перші 2 роки потрібні для досягнення максимального зменшення тяжкості симптомів та/або використання ліків, тоді як упродовж третього року досягаються довгострокова ефективність і підтримка імунної толерантності.
Абсолютні протипоказання до АСІТ включають неконтрольовану (тяжку) астму. У разі відносних протипоказань потрібно індивідуально зважити переваги та можливі ризики й недоліки цього виду терапії.
Алергенні продукти та шляхи введення
Незважаючи на те що доступні на сьогодні екстракти алергенів і схеми дозування є ефективними й безпечними, існує потреба покращення прихильності пацієнтів. Низка чинників негативно впливає на прихильність, зокрема вартість, незручності, побічні ефекти та тривалий термін лікування. Покращити прихильність можуть навчання пацієнтів, регулярні контрольні візити, застосування електронних інструментів охорони здоров’я, а також інноваційні та модифіковані продукти AСIT. На сьогодні в Європі майже всіх пацієнтів лікують необробленими (природними) алергенами. Неочищені екстракти алергенів містять суміш алергенних і неалергенних компонентів. Взаємодія цих компонентів може знижувати імуногенність домінантних алергенів. Щоб подолати недоліки, пов’язані з домішками, розроблено рекомбінантні алергени для in vitro діагностики алергеноспецифічних IgE. Нині вивчається можливість їх використання для розроблення ефективніших вакцин AСIT стабільної якості.
Імуногенність вакцин AСIT можна підсилити ад’ювантами. Крім традиційних ад’ювантів (гідроксид алюмінію), які застосовують у сучасних вакцинах, вивчаються нові ад’юванти. Наприклад, молекулярні структури, пов’язані з патогенами (pathogen associated molecular patterns – PAMP). Тоді як алергени стимулюють адаптивний імунітет, індукуючи довгострокову алергеноспецифічну ефективність, PAMP стимулюють рецептори розпізнавання образів (pattern recognition receptors – RRR) на антигенпрезентувальних клітинах, що призводить до короткострокової алергенонеспецифічної ефективності. Відповідно, комбінація алергенів і PAMP може допомогти досягнути кращої та стійкішої клінічної ефективності за коротший проміжок часу, а отже, покращити прихильність і економічну ефективність. Якщо такий підхід застосовувати на ранньому етапі життя, можна запобігти прогресуванню алергічних захворювань. Окрім того, на модуляцію імунної відповіді може впливати біологічна терапія моноклональними антитілами проти IgE, як-от омалізумаб або дупілумаб. Розглядаються також нові засоби доставки, зокрема використання ліпосом, навантажених алергенами, біорозкладні наночастинки або вірусоподібні частинки.
Активно вивчаються альтернативні шляхи введення вакцин. Наприклад, нашкірна (епікутанна) імунотерапія має сприятливий профіль безпеки, добру прихильність і демонструє певні перспективи лікування окремих форм респіраторної та харчової алегії. Існує також місцева назальна імунотерапія, що зменшує клінічну симптоматику та потребу в антиалергічних засобах. Однак у зв’язку з місцевими побічними ефектами, які потребують назальної премедикації, рутинне клінічне застосування цього методу обмежене. Іншим прикладом інвазивного введення є інтралімфатичний шлях, що може покращити результати завдяки меншій потребі в ін’єкціях.
IgE-опосередкована харчова алергія [8]
Від IgE-опосередкованої харчової алергії потерпає ≈6% людей. Цей вид алергії негативно впливає на якість життя, харчування, соціальну активність і посилює тривогу. Пацієнтам рекомендують уникати алергену та використовувати ліки для полегшення симптомів. Утім, випадковий вплив алергенів доволі поширений, а іноді й небезпечний для життя. Зростає інтерес до АСІТ і біологічної терапії, але повідомлення щодо результатів суперечливі: деякі дослідження виявляють кращу переносимість алергенів, тоді як інші підкреслюють істотне збільшення побічних реакцій. Нещодавно проведено систематичний огляд ефективності й безпеки АСІТ та/або біологічних препаратів [8], щоб інформувати робочу групу GA2LEN (Global Allergy and Asthma European Network) для доповнення настанов новими рекомендаціями.
Цілі систематичного огляду включали розгляд таких питань:
- Яка ефективність, безпека, економічна ефективність АСІТ, АСІТ у поєднанні з біологічною терапією або біологічних препаратів для дітей і дорослих із будь-якою IgE-опосередкованою харчовою алергією порівняно з відсутністю активного лікування?
- Яка ефективність, безпека й економічна ефективність АСІТ, що вводиться різними шляхами, для дітей і дорослих із будь-якою IgE-опосередкованою харчовою алергією?
Огляд проводила робоча група спеціалістів з алергії, представників пацієнтів, лікарів первинної ланки, психологів, інших клініцистів, викладачів і методистів із 19 країн із використанням методів PROSPERO (протокол реєстрації в Міжнародному проспективному реєстрі систематичних оглядів) у шести базах даних – Кокранівська бібліотека, CINAHL, EMBASE, ISI Web of Science, MEDLINE та Scopus. Дослідження включали до огляду за п’ятьма критеріями, підсумованими в таблиці 2. Ризик упередженості незалежно оцінювали чотири методологи та клініцисти за допомогою Кокранівського інструменту ROB2 (Risk of Bias 2). Для синтезу даних про кожен результат використовували підхід GRADE (The Grading of Recommendations, Assessment, Development and Evaluation).
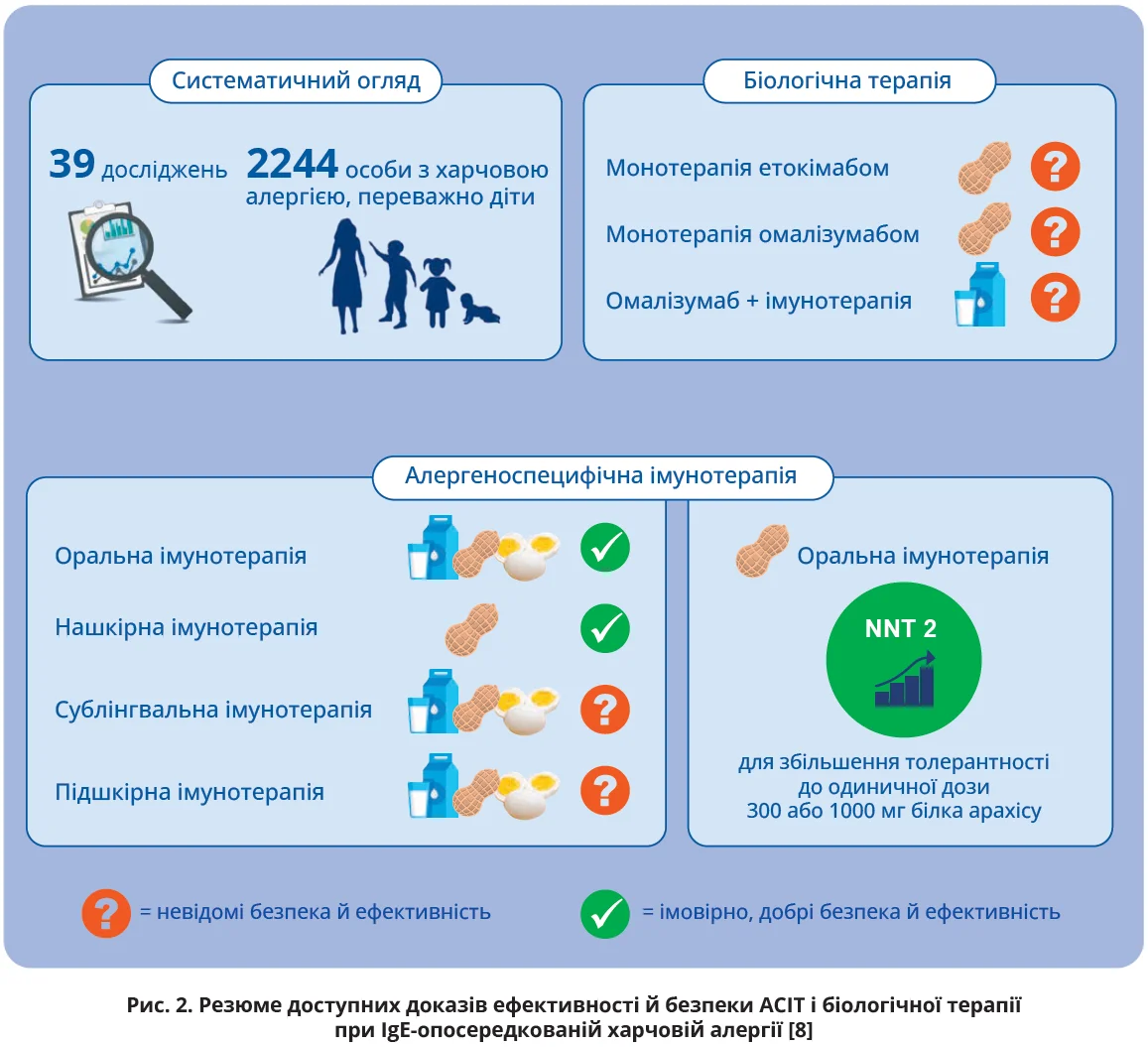
Загалом включено 36 досліджень АСІТ за участю 2126 осіб, здебільшого дітей, і 3 дослідження біологічної монотерапії за участю 118 осіб, переважно підлітків і дорослих (табл. 3).
Алергія на арахіс [8]
Десенсибілізація. Більшість досліджень щодо алергії на арахіс включали дітей. Оральна АСІТ сприяла значному збільшенню частки осіб, здатних переносити арахіс під час терапії (висока вірогідність). Ті, хто отримував оральну АСІТ, ушестеро частіше переносили разову дозу арахісу 300 мг (≈1 арахіс) і в 17 разів частіше переносили разову дозу арахісу 1000 мг порівняно з контрольною групою. До імунотерапії середня максимальна переносима доза арахісу становила ≈34 мг. Нашкірна АСІТ, імовірно, збільшує частку людей, здатних переносити арахіс під час терапії (помірна вірогідність). Ті, хто отримував цей вид АСІТ, мали вдвічі більше шансів перенести разову дозу арахісу 300 мг, аніж особи з групи контролю. Сублінгвальна АСІТ може значно збільшити частку людей, здатних переносити арахіс під час терапії (низька вірогідність). Вплив підшкірної імунотерапії незрозумілий через дуже низьку вірогідність доказів (табл. 4).
Тривала відсутність реакції. Оральна АСІТ арахісом може збільшити частку дітей, здатних переносити арахіс після припинення терапії (низька вірогідність). При застосуванні інших шляхів уведення даних щодо тривалої відсутності реакції немає (табл. 4).
Побічні реакції. Статистично значущого збільшення частки людей, які мали побічні реакції через імунотерапію арахісом, не було незалежно від шляху введення. Проте оральна АСІТ була на межі посилення побічних реакцій (p=0,06; низька вірогідність). Найчастіше спостерігалися шлунково-кишкові симптоми: набряк і свербіж у роті, блювання, біль у животі, діарея. Більшість симптомів (80-90%) були легкого ступеня; припинили лікування <10%. Нечасто спостерігалися респіраторні та шкірні симптоми, як-от риніт, хрипи, задишка, астма, набряк гортані, кропив’янка, ангіоневротичний набряк та еритема. Вони були різного ступеня тяжкості, але зазвичай реагували на лікування.
До рідкісних проявів можна віднести розлади імунної системи, інфекції, очні симптоми, розлади вуха та лабіринту, серцево-судинні події й еозинофільний езофагіт. Зі збільшенням тривалості імунотерапії частота побічних реакцій зменшувалася.
Найпоширенішими побічними реакціями на нашкірну АСІТ арахісом були шкірні реакції. Більшість із них були легкими, обмежувалися місцем накладання пластиру та зазвичай виникали протягом першого місяця лікування. Шкірні прояви, що поширювалися за межі накладання пластиру, виникали нечасто, як і позашкірні реакції (респіраторні, торакальні та середостінні розлади, імунні реакції або очні симптоми). Смертей через імунотерапію, збільшення анафілаксії чи небезпечних для життя реакцій не зареєстровано.
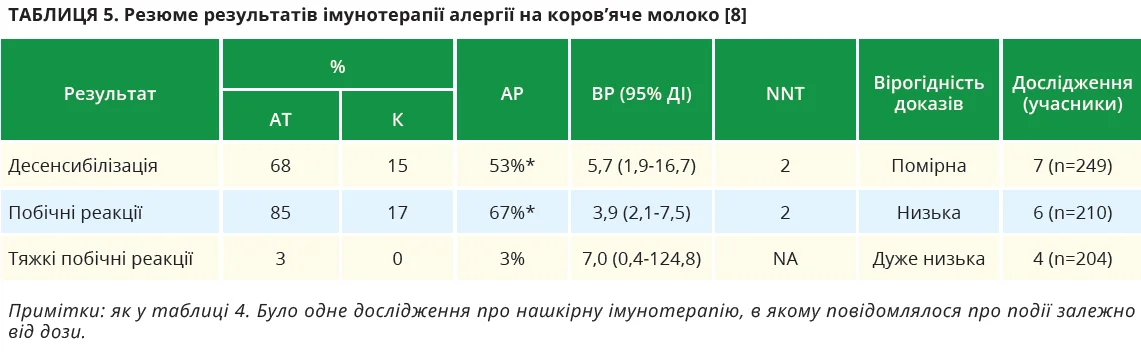
Алергія на коров’яче молоко [8]
В усіх дослідженнях щодо алергії на коров’яче молоко брали участь діти. Оральна АСІТ, імовірно, сприяла вищій частці осіб, здатних переносити білок коров’ячого молока під час терапії (помірна вірогідність) (табл. 5).
У значної частки учасників були побічні реакції (низька вірогідність). Проте лише 3 дослідження зосереджувалися виключно на реакціях, спричинених терапією: суттєвої різниці порівняно з плацебо не виявлено. Найчастіше виникали легкі шлунково-кишкові симптоми. У незначної кількості учасників спостерігалися респіраторні симптоми. Через дуже низьку вірогідність доказів не зрозуміло, чи оральна АСІТ посилює ризик серйозних побічних реакцій. Повідомлення про тяжкі реакції, анафілаксію, застосування адреналіну та припинення прийому були рідкісними.
Про госпіталізацію або смерть унаслідок лікування не повідомлялося. Доказів, які дали би змогу зробити висновки щодо інших шляхів уведення АСІТ при алергії на коров’яче молоко, недостатньо.
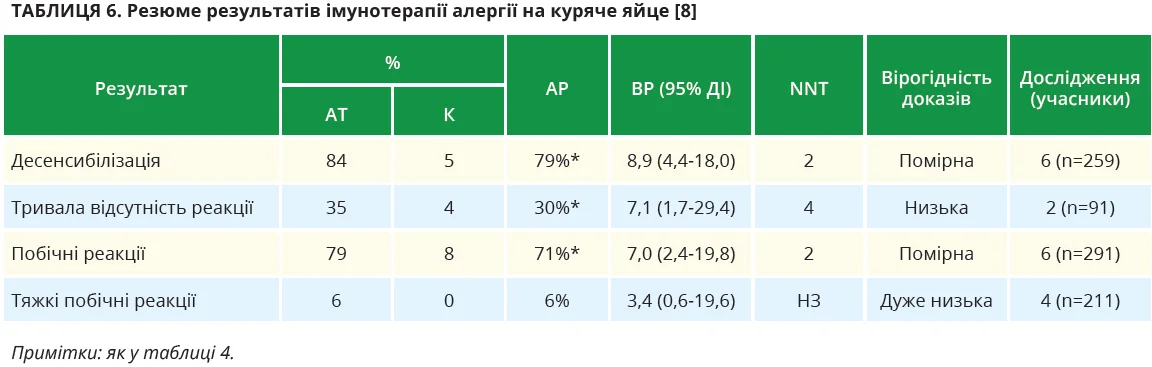
Алергія на куряче яйце [8]
Усі дослідження щодо алергії на курячі яйця проводилися в дітей. Усі, крім одного, порівнювали АСІТ з елімінаційною дієтою. Оральна АСІТ забезпечувала значне збільшення частки дітей, здатних переносити курячі яйця під час терапії (помірна вірогідність) і збільшувала частку людей, здатних переносити курячі яйця після закінчення терапії (низька вірогідність) (табл. 6).
Імовірно, оральна АСІТ значно збільшила частку дітей із побічними реакціями (помірна вірогідність), але лише декілька досліджень зосереджувалися виключно на реакціях, спричинених лікуванням. Одне дослідження не виявило істотної різниці в побічних реакціях порівняно з плацебо. Через дуже низьку вірогідність доказів ризик серйозних реакцій незрозумілий (табл. 6). Близько 95% реакцій були легкими; виникали приблизно в 1 випадку на 20 доз під час фази нарощування, зменшуючись до 1 випадку на 40 доз упродовж перших місяців підтримувальної терапії. Найчастішими симптомами були свербіж ротової порожнини та біль у шлунково-кишковому тракті. Анафілаксія або симптоми, що потребували припинення імунотерапії, спостерігалися рідко.
Інші види харчової алергії [8]
Виявлено лише декілька досліджень, які вивчали інші види харчової алергії або проводили пряме порівняння шляхів імунотерапії для отримання значущих результатів. Також було мало інформації щодо впливу на якість життя, що відіграє вагому роль у мотивації продовження імунотерапії. Жодне зі включених досліджень не повідомило про економічну ефективність. Чіткого зв’язку між тривалістю лікування та десенсибілізацією, стійкою реакцією або безпекою не виявлено.
Біологічна терапія [8]
Через надто малу кількість досліджень зробити значущі висновки щодо біологічних препаратів як монотерапії або в поєднанні з АСІТ неможливо. У пацієнтів віком від 13 років спостерігалася тенденція до покращення переносимості арахісу під час біологічної монотерапії з невеликою кількістю побічних ефектів. Проте вірогідність доказів дуже низька, оскільки знайдено лише 3 дослідження, кожне з яких застосовувало різну терапію (табл. 3).
Отже, оральна АСІТ ефективно й безпечно підвищує толерантність у дітей з алергією на арахіс, коров’яче молоко або куряче яйце. Наприкінці терапії три чверті пацієнтів могли перенести одноразову дозу білка арахісу 300 мг, половина пацієнтів – одноразову дозу 1000 мг, тобто отримати захист від більшості випадків випадкового впливу. Приблизно третина пацієнтів може зберігати толерантність після припинення терапії, принаймні впродовж 3 місяців. Оральна АСІТ зазвичай добре переноситься. Більшість проявів побічної дії легкі (рис. 2).
Нашкірна АСІТ також може бути ефективною й безпечною для дітей з алергією на арахіс, але доказів щодо інших харчових алергенів недостатньо. Менш вивченими є сублінгвальний і підшкірний шляхи АСІТ за будь-якої харчової алергії. Для висновків щодо користі чи шкоди від біологічних препаратів поки що недостатньо доказів (рис. 2).
Висновки
- Незважаючи на понад сторічне клінічне застосування, АСІТ залишається єдиною модифікувальною та потенційно профілактичною терапією при алергічних захворюваннях. Для отримання якісних доказів ефективності та безпеки різних шляхів уведення вакцин за різних типів алергії потрібне подальше вивчення у великих дослідженнях і реальній клінічній практиці.
- АСІТ та/або біологічні препарати можуть бути корисними для ретельно відібраних груп пацієнтів з алергією.
- Недоліками АСІТ можна вважати відносно тривалі періоди лікування й помітні переваги безпосередньо під час терапії та впродовж певного часу після її припинення (декілька місяців за харчової алергії, декілька років при астмі). Проте ці недоліки є доволі відносними, зважаючи на потребу постійного медикаментозного контролю астми та суворого дотримання харчових обмежень за харчової алергії з високим ризиком випадкових впливів із потенційною загрозою для життя.
- Приймаючи орієнтовані на пацієнта спільні рішення про те, чи пропонувати людині АСІТ та/або біологічні препарати, слід ретельно зважити вподобання пацієнта, мотивацію, доступність і вартість, а також докази щодо безпеки й ефективності.
Література
- Diamant Z., van Maaren M., Muraro A., et al. Allergen immunotherapy for allergic asthma: the future seems bright. Respir. Med. 2023; 210: 107125. doi: 10.1016/j.rmed.2023.107125.
- Cox L., Nelson H., Lockey R., et al. Allergen immunotherapy: a practice parameter third update. J. Allergy Clin. Immunol. 2011; 127: S1-S5.
- Greenhawt M., Oppenheimer J., Nelson M., et al. Sublingual immunotherapy: a focused allergen immunotherapy practice parameter update. Ann. Allergy Asthma Immunol. 2017; 118: 276-282.e2.
- Nelson H.S. 2020 updated asthma guidelines: allergen immunotherapy. J. Allergy Clin. Immunol. 2020; 146: 1286-1287.
- GINA Report. Global Strategy for Asthma Management and Prevention. Available at: https://ginaasthma.org.
- Fritzsching B., Contoli M., Porsbjerg C., et al. Long-term real-world effectiveness of allergy immunotherapy in patients with allergic rhinitis and asthma: results from the REACT study, a retrospective cohort study. Lancet Reg. Health. Eur. 2021; 13: 100275.
- Woehlk C., Von Bülow A., Ghanizada M., et al. Allergen immunotherapy effectively reduces the risk of exacerbations and lower respiratory tract infections in both seasonal and perennial allergic asthma: a nationwide epidemiological study. Eur. Respir. J. 2022; 60 (5): 2200446. doi: 10.1183/13993003.00446-2022.
- de Silva D., Rodríguez Del Río P., de Jong N.W., et al.; GA2LEN Food Allergy Guidelines Group. Allergen immunotherapy and/or biologicals for IgE-mediated food allergy: a systematic review and meta-analysis. Allergy. 2022; 77 (6): 1852-1862.