Нові досягнення в лікуванні алергічного риніту в дітей
Переклала й адаптувала лікарка-алерголог Ірина Калікіна
Стаття містить основні положення з огляду Китайської робочої групи з риніту з фокусом на оновлені рекомендації щодо діагностики та лікування алергічного риніту (АР) у дітей.
АР – хронічне неінфекційне запальне захворювання слизової оболонки носа, що переважно є IgE-опосередкованим і виникає під впливом алергенів.
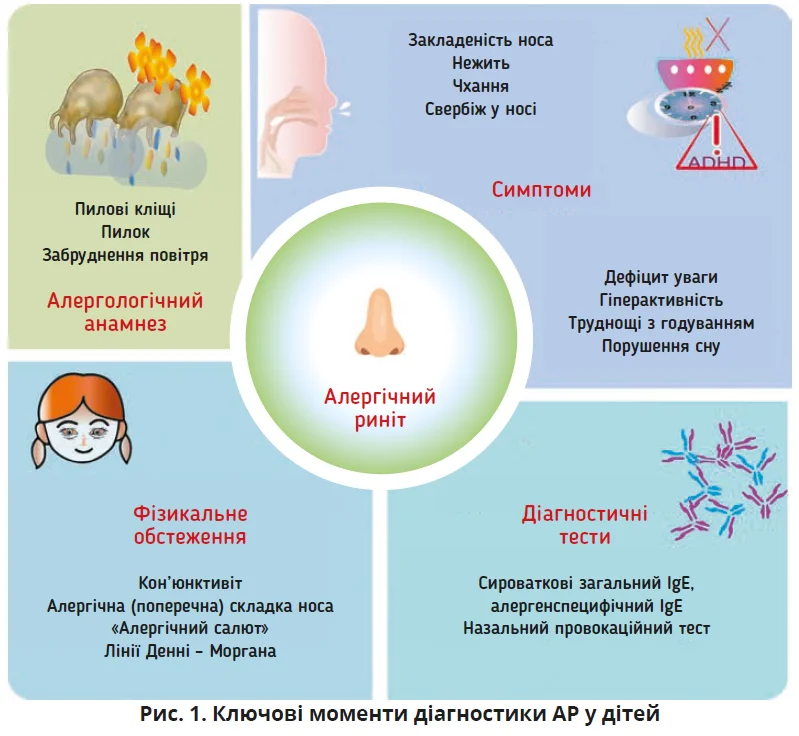
АР належить до найпоширеніших хронічних захворювань у світі, від якого страждає близько 500 млн людей. Основними клінічними проявами є ринорея, закладеність носа, свербіж і чхання. На відміну від дорослих, вплив АР на дитяче життя часто проявляється через утому, зниження концентрації уваги, погіршення навчальних показників і пам’яті, що батьки можуть не одразу помітити або помилково інтерпретувати як поведінкові проблеми.
Міжнародне дослідження астми й алергії в дитячому віці (ISAAC), що охоплює дані з понад 300 країн, демонструє вікову динаміку поширеності АР: від 5% у 3-річному віці до 8,5% у 6-7 років з подальшим зростанням до 14,6% у підлітків 13-14 років. Особливу проблему становить діагностика АР у немовлят і дітей раннього віку через їхню обмежену здатність описувати симптоми. Це призводить до того, що батьки можуть не помічати або неправильно інтерпретувати прояви хвороби.
Основною причиною АР у дітей є вплив алергенів. Додатковими чинниками ризику є генетична схильність, сімейна історія алергії (АР, астма, атопічний дерматит), уживання антибіотиків і пасивне куріння. Виникнення та прогресування АР визначаються складною взаємодією генетичної схильності й чинників довкілля.
У 1989 році D. Strachan сформулював «гігієнічну гіпотезу», виявивши негативну кореляцію між поширеністю сінної лихоманки в дітей і розміром сім’ї. Основний механізм гігієнічної гіпотези полягає в тому, що мікробні антигени сприяють розвитку Th1-відповідей і пригнічують Th2-відповіді.
Сучасні дослідження польських науковців виявили, що діти, які почали відвідувати дитячий садок у 2-річному віці, мають удвічі вищий ризик розвитку АР порівняно з тими, хто пішов у віці 1 року. Масштабний метааналіз за участю понад 2 млн осіб підтвердив, що вищий порядок народження та більша кількість братів і сестер асоціюються з нижчим ризиком розвитку АР. Окрім того, зниження різноманітності мікробіоти кишківника в новонароджених, часто через застосування антибіотиків, також пов’язане з розвитком АР.
Проте гігієнічна гіпотеза не повністю пояснює патогенез АР, недостатньо враховуючи інші важливі чинники, зокрема генетичні. Дослідження генетичних асоціацій виявили численні локуси генетичної схильності до АР. Ген рецептора інтерлейкіну-4 (IL-4Ra) є одним з головних генів-кандидатів, що кодує субодиницю рецептора для IL-4R та IL-13R. У різних популяційних дослідженнях виявлено характерні однонуклеотидні поліморфізми, пов’язані з АР.
Останні роки також принесли нове розуміння етіології АР через концепцію тренованого імунітету – форми довготривалого функціонального перепрограмування вроджених імунних клітин під впливом екзогенних або ендогенних стимулів.
На відміну від гігієнічної гіпотези, ця теорія враховує вплив як мікробних патогенів, так і немікробних антигенів (включно з дієтою й іншими факторами середовища) на регуляцію вродженого імунітету. Різні стимули можуть викликати окремі програми імунного тренування, що проявляються або як посилення імунітету, або як толерантність. Наприклад, нещодавні дослідження Machiels і співавт. показали, що треновані альвеолярні макрофаги, які зберігають «пам’ять» про попередні вірусні інфекції, можуть забезпечити захист від астми, спричиненої алергенами.
На тяжкість АР також впливають частота та час контакту з алергеном. Перехресне дослідження в Індії показало, що медичні працівники, які контактують з пиловими кліщами, та фермери, які зазнають впливу пилку, демонструють вищі показники помірного й тяжкого АР.
Стосовно профілактики АР значна увага приділяється стратегіям грудного вигодовування. Деякі дослідження вказували на його захисну роль, зокрема Codispoti та співавт. повідомляли, що тривале грудне вигодовування серед афроамериканських дітей було пов’язане зі зниженням ризику розвитку АР у 3-річному віці.
Основні симптоми АР охоплюють чхання, свербіж, ринорею та закладеність носа. Характерно, що закладеність носа часто посилюється вночі та може проявлятися двобічно, однобічно або з чергуванням боків. У дітей з АР типово спостерігаються дихання через рот і нічне хропіння, котре при хронічному перебігу може спричинити аномалії розвитку обличчя та порушення прикусу. Очні симптоми частіше трапляються в полісенсибілізованих пацієнтів і корелюють з тяжкістю назальних проявів. Додаткові симптоми можуть охоплювати свербіж піднебіння, постназальне затікання, а в дітей старшого віку – кашель, носові кровотечі, гіперактивність і дефіцит уваги. Для малюків характерні зниження апетиту та труднощі з годуванням.
Особливі ознаки, як-от кон’юнктивіт, алергічна складка носа, «алергічний салют» (характерний жест дитини, яка часто торкається кінчика носа через свербіж) і лінії Денні – Моргана, також мають важливе значення для виявлення та діагностики дитячого АР.
Діагностика АР у дітей становить значні труднощі, оскільки симптоми часто перекриваються з проявами інфекцій верхніх дихальних шляхів, неалергічного риніту й інших патологічних станів.
Найпоширенішими методами виявлення специфічних алергенів є шкірні прик-тести, визначення специфічних IgE в сироватці та назальні провокаційні тести. Шкірні прик-тести демонструють високу чутливість і специфічність (понад 80%), однак у немовлят їхні результати потребують обережної інтерпретації через можливість дрібних висипань, хибнопозитивних результатів і залежність від імунного статусу дитини та процедурних факторів.
Визначення специфічних IgE в сироватці має переваги у вигляді відсутності побічних реакцій і меншої залежності від впливу медикаментів і стану шкіри. Вибір між шкірними прик-тестами та сироватковими тестами має враховувати режим приймання ліків, супутні хвороби, стан шкіри та сімейні вподобання.
Назальний провокаційний тест залишається золотим стандартом для підтвердження клінічної значущості алергену. Дослідження продемонстрували його високу безпеку та відтворюваність як у дорослих, так і в дітей, з мінімальним ризиком системних алергічних реакцій.
Варто зазначити, що рівень загального IgE в сироватці й еозинофілія мають обмежену діагностичну цінність для АР. Останніми роками як біомаркери АР використовуються вимірювання оксиду азоту назального (nNO) та виявлення еозинофілів у мазках з носа. Дослідження показали, що в пацієнтів з АР спостерігався значно вищий рівень nNO порівняно з неалергічним ринітом, що дає змогу ефективно розрізняти ці фенотипи. Однак відсутність стандартизованих референтних значень для nNO обмежує його діагностичну цінність. Інші новітні біомаркери, як-от остеопротегерин слизової оболонки носа й експресія CD203c на поверхні еозинофілів, можуть надати додаткову інформацію про запалення та ремоделювання тканин.
АР часто поєднується з іншими алергічними станами, включно з астмою, атопічним дерматитом і кон’юнктивітом. Подібну коморбідність пов’язують зі спільними генетичними поліморфізмами та патогенетичними механізмами. Крім алергічних коморбідностей, метааналіз продемонстрував значущий зв’язок між АР і симптомами синдрому дефіциту уваги та гіперактивності в дітей. Цікаво, що АР також є найпоширенішою неревматичною супутньою патологією при ювенільному ідіопатичному артриті.
У настановах ARIA (Allergic Rhinitis and its Impact on Asthma – «Алергічний риніт і його вплив на астму») було запропоновано модифіковану систему класифікації АР. За частотою проявів АР класифікують як інтермітивний (епізодичний) і персистивний, де персистенція визначається як наявність симптомів більш ніж 4 дні на тиждень протягом щонайменше 4 тижнів. Відповідно до тяжкості симптомів та їхнього впливу на якість життя ARIA поділяє АР на легку, помірну й тяжку форми.
Система класифікації ARIA визнана та широко прийнята в більшості країн. Однак досі не існує єдиного стандарту для оцінювання тяжкості АР. Китайський експертний консенсус з лікування АР у дітей 2022 року використовує візуальну аналогову шкалу (ВАШ), розрізняючи легку (ВАШ <5) та середньотяжку (ВАШ ≥5) форми АР, а також поділяє його на типи з переважанням чхання/ринореї або назальної обструкції, що допомагає сформувати індивідуальні плани лікування.
Нещодавні дослідження ідентифікували особливий підтип захворювання – локальний АР (ЛАР), який характеризується позитивним результатом назального алергенного тесту за відсутності системної сенсибілізації (негативні шкірні прик-тести та специфічні IgE в сироватці). Хоча ЛАР у дітей рідше прогресує до системних алергічних захворювань, він може погіршуватися з часом і є чинником ризику розвитку астми.
Терапевтичний підхід до АР у дітей передбачає уникнення алергенів, навчання пацієнтів, застосування фармакотерапії, зрошення носа фізіологічним розчином і специфічну імунотерапію.
Епідеміологічні дослідження підтверджують, що забруднення повітря, пилові кліщі та домашні тварини значно впливають на розвиток АР. Тому останніми роками увагу привертають бар’єрні засоби від алергенів – назальні спреї та мазі, що створюють механічний бар’єр, запобігаючи контакту алергену зі слизовою оболонкою носа. Іригація фізіологічним розчином також є безпечним і доступним методом, який дає змогу видалити певні алергени та медіатори запалення зі слизової носа.
Фармакотерапія залишається найпоширенішим методом лікування АР, зважаючи на її ефективність і зручність застосування.
Н1-антигістамінні препарати зазвичай призначають пацієнтам з легкими симптомами або за непереносимості інтраназальних кортикостероїдів (ІнКС). Перевага віддається препаратам другого покоління з меншим седативним ефектом (дезлоратадин, лоратадин, цетиризин, левоцетиризин, рупатадин) і неседативним антигістамінним засобам (фексофенадин, біластин). Пероральні Н1-антигістамінні препарати, що приймаються 1 раз на день, характеризуються швидким початком дії та можуть застосовуватися як переривчасто, так і безперервно, ефективно контролюючи симптоми в багатьох педіатричних пацієнтів. Однак варто враховувати можливі системні побічні ефекти, включно із седативним ефектом, синдромом сухого ока та затримкою сечовипускання.
Інтраназальні антигістамінні препарати, схвалені Управлінням США з контролю продовольства та медикаментів (FDA), наприклад азеластин і олопатадин, ефективніші при закладеності носа й мають швидший початок дії, ніж пероральні антигістамінні препарати, але вони можуть підвищувати ризик місцевих побічних ефектів, як-от епістаксис.
ІнКС залишаються найефективнішою монотерапією АР і є препаратами першої лінії для пацієнтів з персистивними або помірними симптомами. Найчастіше застосовуються беклометазон, будесонід, циклесонід, флутиказону пропіонат, флутиказону фуроат, мометазону фуроат і тріамцинолону ацетонід. ІнКС ефективно контролюють не лише назальні,
але й очні алергічні симптоми. Їхня терапевтична ефективність за регулярного застосування перевершує пероральні антигістамінні препарати, особливо щодо зменшення закладеності носа, а додавання пероральних антигістамінних засобів до ІнКС зазвичай не покращує результатів. Найпоширеніші місцеві побічні реакції (подразнення носа, печіння та носові кровотечі) можна мінімізувати, спрямовуючи спрей якомога далі від носової перегородки.
За недостатньої ефективності монотерапії рекомендовано розглянути фіксовані комбінації інтраназальних антигістамінних препаратів з ІнКС, як-от флутиказону пропіонат / азеластин і мометазон/олопатадин. Дослідження підтверджують, що ці комбіновані препарати ефективніші, ніж окремі компоненти, та добре переносяться.
Крім того, для лікування дитячого АР широко використовується монтелукаст. Діти, які застосовують монтелукаст, зазвичай демонструють добру переносимість, але іноді можуть виникати нейроповедінкові явища. Хоча деякі пацієнти із супутньою астмою можуть отримати користь, загалом його ефективність не перевершує застосування пероральних Н1-антигістамінних препаратів або ІнКС.
Лікування за допомогою алергенспецифічної імунотерапії (АСІТ) рекомендується при підтвердженій наявності алергенспецифічних IgE. Мета АСІТ – полегшити симптоми алергії, покращити якість життя, змінити природний перебіг хвороби та забезпечити стійке полегшення від алергії на тривалий час.
Докази свідчать, що АСІТ також може запобігти появі нових сенсибілізацій і знизити ризик розвитку астми в пацієнтів з АР. Типова тривалість АСІТ становить 3-5 років, що включає фазу індукції та підтримувальну фазу. Сучасні методи АСІТ охоплюють підшкірну та сублінгвальну імунотерапію. Клінічні дані підтверджують ефективність обох методів у разі дитячого АР, причому результати в дітей часто кращі порівняно з дорослими, що підтверджується значним зменшенням потреби в рецептурних препаратах протягом 3-9 років після курсу лікування. Сублінгвальна імунотерапія, порівняно з підшкірною, демонструє вищий комплаєнс і меншу частоту легких побічних реакцій.
Останніми роками досліджуються відносно короткострокові альтернативні підходи, як-от внутрішньолімфатична, епікутанна та внутрішньошкірна імунотерапія, котрі демонструють певну ефективність і відносну безпеку. Однак доказів їхньої переваги над традиційними методами АСІТ у дітей наразі недостатньо. Варто зазначити, що АСІТ може спричиняти серйозні побічні реакції, зокрема системні алергічні реакції, тому має проводитися під ретельним медичним наглядом.
Ефективність різних методів лікування АР значною мірою залежить від довготривалої прихильності пацієнтів і стандартизації терапевтичних підходів. Широке розповсюдження смартфонів і прогрес у галузі штучного інтелекту відкривають нові можливості для розроблення та впровадження мобільних застосунків для охорони здоров’я (mHealth), які забезпечують збір, аналіз і зворотний зв’язок щодо даних пацієнтів у режимі реального часу.
Ініціатива ARIA запропонувала використовувати мобільні технології для розроблення та валідації інформаційно-технологічних інструментів, що посилюють можливості самоконтролю для пацієнтів з АР і сприяють спільному прийняттю рішень з медичними працівниками. Найвпливовішим інструментом електронної охорони здоров’я при АР наразі є Mobile Airways Sentinel Network (MASK).
Література
Cheng M., et al. New progress in pediatric allergic rhinitis. Frontiers in Immunology. 2024 Sep; vol. 15. doi: 10.3389/fimmu.2024.1452410.