Обговорення біластину як істинно неседативного антигістамінного препарату
Підготувала д-р мед. наук Лариса Стрільчук
Незважаючи на розвиток медичної науки, ефективні препарати дотепер вилучають з фармакотерапевтичного ринку у зв’язку з розвитком тяжких побічних ефектів. Наприклад, протидіабетичний засіб розиглітазон було відкликано з ринку через здатність спричиняти виникнення серцево-судинних подій. Саме тому безпека ліків є надзвичайно важливим аспектом лікування й має бути головним пріоритетом фармакотерапії (Alshammari T.M., 2016).
Що стосується антигістамінних препаратів (АГП), то ключовим питанням безпеки залишається відсутність седативної дії та впливу на психомоторну активність. Відомо, що для реалізації седативних властивостей АГП мають проникати в головний мозок і зв’язуватися там з Н1-гістаміновими рецепторами. З метою оцінки цього зв’язування застосовується позитронно-емісійна томографія. Серед усіх АГП, які належать до неседативних, показник захоплення Н1-гістамінових рецепторів мозку прямує до нуля лише для біластину та фексофенадину (рис. 1).
Низький потенціал проникнення цих речовин у головний мозок зумовлений гідрофобністю, високою молекулярною масою та тим, що вони являють собою цвітер-іони, тобто мають у своїй молекулі й позитивний (N+), і негативний (COO−) заряд. Завдяки останній характеристиці у фізіологічних умовах біластин і фексофенадин перебувають у дисоційованому стані, що утруднює проходження крізь гематоенцефалічний бар’єр (Kawauchi H. et al., 2019).
За даними низки психомоторних тестів (оцінювання моторної активності, сприйняття, уваги й асоціативної інтеграції), вживання 20 або 40 мг біластину не асоціювалося із жодним психомоторним порушенням (García-Gea C. et al., 2008). Інші автори оцінювали вплив біластину (20 і 40 мг) і гідроксизину (50 мг) на здатність до керування автомобілем (за оцінкою латеральних відхилень автомобіля після приймання препарату 1 раз на добу протягом 8 діб) порівняно з плацебо. Було з’ясовано, що біластин не чинив достовірного впливу на латеральні відхилення автомобіля. Натомість на тлі застосування гідроксизину цей показник зростав як після повторного застосування протягом тижня, так і після однієї дози (Conen S. et al., 2011).
Для біластину було також оцінено вплив на сонливість за візуально-аналоговою шкалою й опитувальником POMS (Profile of Mood States – «Профіль настроєвих станів»). У дозах 20 і 40 мг біластин узагалі не спричиняв сонливості, а в дозі 80 мг у перший день спостерігалася тенденція до збільшення сонливості, яка, однак, не досягла рівня достовірності (рис. 2). Натомість гідроксизин у дозі 25 мг уже через 1 годину після приймання спричиняв значну сонливість, яка зберігалася й через 8 годин (García-Gea C. et al., 2008).
У нещодавньому матеріалі A. Leceta та K. Yanai (Balanced discussion about bilastine as a truly non-sedating antihistamine. Curr. Med. Res. Opin. 2025; 41 (3): 455-456) коментують опубліковану влітку 2024 року статтю, присвячену фексофенадину (Ansotegui I.J. et al. Why fexofenadine is considered as a truly non-sedating antihistamine with no brain penetration: a systematic review. Curr. Med. Res. Opin. 2024; 40 (8): 1297-1309).
У ній автори на підставі літературних даних наводять докази неседативних властивостей цього засобу. Основним доказом виступає відсутність захоплення цим АГП H1-рецепторів головного мозку за даними позитронно-емісійної томографії; також згадуються результати клінічних досліджень за участю дітей і дорослих з алергічним ринітом і кропив’янкою.
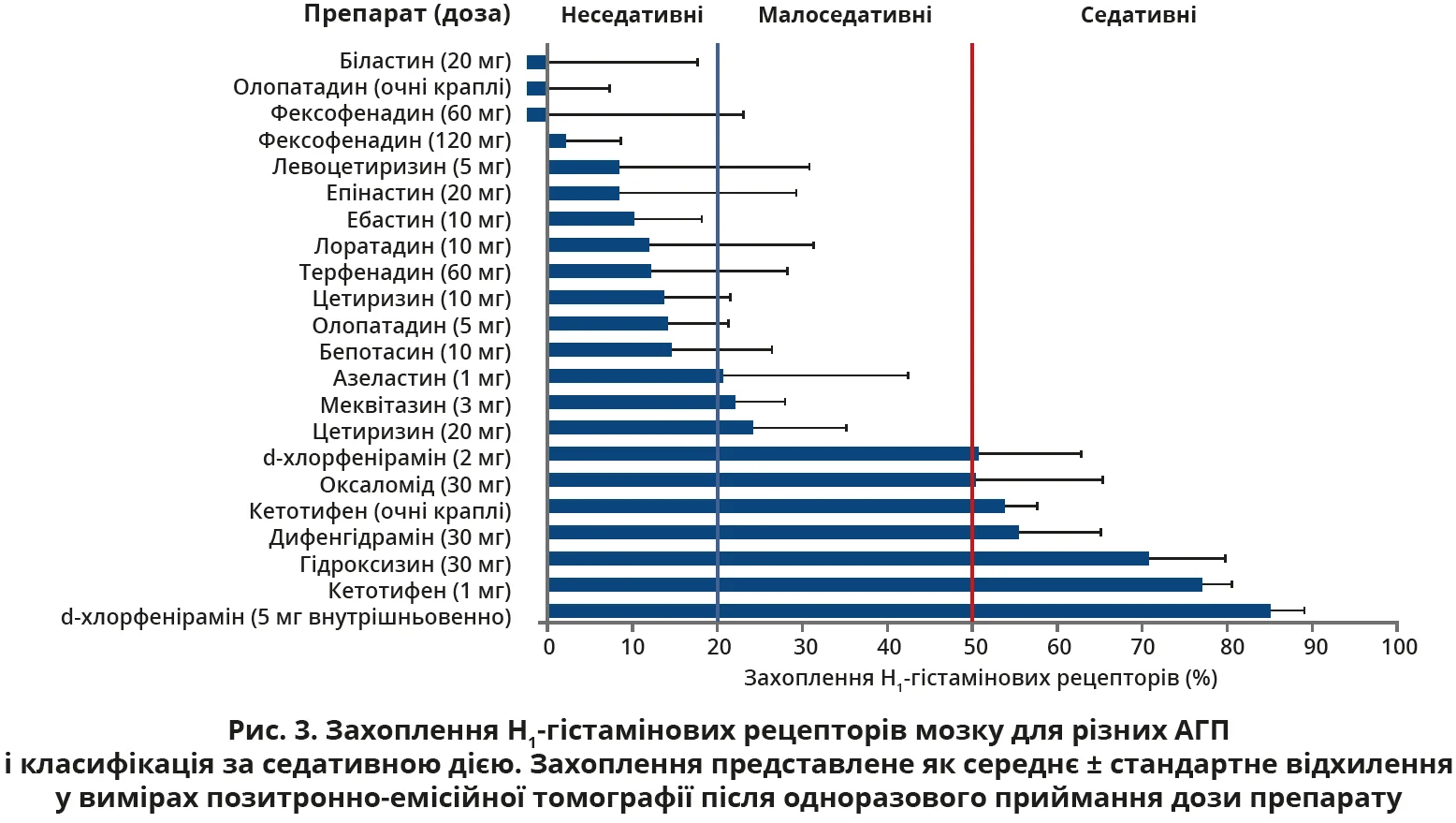
A. Leceta та K. Yanai зауважують, що знайшли певні неточності в згаданій публікації, оскільки її автори не врахували найновіші дані та/або публікації. Передусім у статті згадується класифікація АГП за рівнем захоплення H1-гістамінових рецепторів після одноразового перорального приймання препарату, запропонована K. Yanai та співавт. (2011). Ця класифікація передбачає поділ АГП на неседативні (<20% захоплення рецепторів), малоседативні (20-50%) та седативні (>50%).
Посилаючись на цю публікацію, автори некоректно стверджують, що «фексофенадин – єдиний препарат, який не спричиняє порушень когнітивної та психомоторної функцій».
Той самий науковий колектив під керівництвом K. Yanai 2017 року опублікував оновлення даних, у якому як фексофенадин, так і біластин були класифіковані як справді неседативні H1-АГП згідно з класифікацією за захопленням H1-гістамінових рецепторів. Дослідники припустили, що ймовірною причиною слабкого проникнення цих препаратів у головний мозок є активне виведення крізь гематоенцефалічний бар’єр за допомогою P-глікопротеїну. У цій статті було наведено рисунок, який демонструє, що біластин у дозі 20 мг, а також фексофенадин у дозах 60 і 120 мг можуть вважатися неседативними (рис. 3).
Наступним некоректним твердженням було таке: «Можна побачити, що згідно з даними опублікованих досліджень фексофенадин має найнижче значення захоплення H1-гістамінових рецепторів мозку». Клінічних досліджень, які передбачали би безпосереднє порівняння ступеня захоплення H1-гістамінових рецепторів мозку для біластину й фексофенадину та могли би підтвердити це твердження, не існує.
Наявні клінічні дослідження, згадані в публікації, продемонстрували, що ступінь захоплення H1-гістамінових рецепторів мозку для фексофенадину (120 мг) був мінімальним (-0,1%), а після застосування фексофенадину в дозі 60 мг середній кортикальний показник ступеня захоплення цих рецепторів мав від’ємне значення. Аналогічно в дослідженні з використанням позитронно-емісійної томографії, яке оцінювало захоплення H1-рецепторів мозку біластином (20 мг), не було виявлено істотної відмінності в середньому загальному потенціалі зв’язування з Н1-гістаміновими рецепторами мозку між біластином і плацебо (0,26±0,07 проти 0,26±0,08) (Farre M. et al., 2014).
У добре контрольованих дослідженнях з використанням об’єктивних індексів було показано, що біластин не впливає на психомоторну функцію та здатність до керування транспортними засобами навіть у дозі 40 мг, яка вдвічі перевищує звичайну. Також є дані, що біластин у дозі 20 мг не підсилює гальмівної дії алкоголю на психомоторну активність і що він може бути безпечною альтернативою для пілотів. Ці результати мають значення для лікування алергічних захворювань у осіб, задіяних у видах діяльності з підвищеними вимогами до безпеки. Зокрема, Міністерство земель, інфраструктури, транспорту та туризму Японії схвалило використання біластину пілотами.
Як показано в контрольованих клінічних дослідженнях, біластин також вважається препаратом, що не проникає в головний мозок, і, як і фексофенадин, може розглядатися як істинний неседативний АГП.
На завершення автори підкреслили, що згідно з класифікацією, заснованою на ступені захоплення H1-рецепторів головного мозку, як фексофенадин, так і біластин відрізняються від інших АГП другого покоління тим, що є істинно неседативними та не проникають у головний мозок.
Загалом можна дійти висновку, що різним АГП другого покоління притаманна різна вираженість седативного впливу, що може погіршувати когнітивні та психомоторні функції, а також здатність до керування транспортними засобами. Біластин швидко всмоктується, не підлягає печінковому метаболізму чи взаємодії з цитохромом P450 (що забезпечує йому мінімальну ймовірність міжлікарських взаємодій), а також є гідрофобною речовиною та субстратом АТФ-залежного активного транспортера P-глікопротеїну, що обмежує надходження біластину в центральну нервову систему. Позитронно-емісійна томографія показала, що біластину властива найнижча серед АГП другого покоління здатність до захоплення Н1-гістамінових рецепторів мозку. Терапевтична доза біластину (20 мг 1 раз на добу) є неседативною, не посилює гальмівного ефекту алкоголю або заспокійливих засобів, не погіршує здатності до керування автомобілем і має щонайменше еквівалентну іншим АГП другого покоління ефективність у лікуванні алергічного ринокон’юнктивіту та кропив’янки (Jáuregui I. et al., 2015). Отже, біластин характеризується відмінним профілем безпеки, що робить його пріоритетним препаратом у лікуванні алергічних хвороб.
Литература
- Kawauchi H., Yanai K., Wang D.-Y., Itahashi K., Okubo K. Antihistamines for allergic rhinitis treatment from the viewpoint of nonsedative properties. International Journal of Molecular Sciences. 2019; 20 (1): 213. doi: 10.3390/ijms20010213.
- García-Gea C., Martínez-Colomer J., Antonijoan R.M., Valiente R., Barbanoj M.J. Comparison of peripheral and central effects of single and repeated oral dose administrations of bilastine, a new H1 antihistamine: a dose-range study in healthy volunteers with hydroxyzine and placebo as control treatments. J. Clin. Psychopharmacol. 2008; 28: 675-685.
- Conen S., Theunissen E.L., Van Oers A.C., Valiente, R., Ramaekers J.G. Acute and subchronic effects of bilastine (20 and 40 mg) and hydroxyzine (50 mg) on actual driving performance in healthy volunteers. J. Psychopharmacol. 2011; 25: 1517-1523.
- Jáuregui I., Ramaekers J.G., Yanai K., Farré M., Redondo E., Valiente R., Labeaga L. Bilastine: a new antihistamine with an optimal benefit-to-risk ratio for safety during driving. Expert Opinion on Drug Safety. 2015; 15 (1): 89-98. doi: 10.1517/14740338.2016.1112786.
- Alshammari T.M. Drug safety: the concept, inception and its importance in patients’ health. Saudi Pharm. J. 2016 Jul; 24 (4): 405-412. doi: 10.1016/j.jsps.2014.04.008.