Знову кропив’янка: що призначити цього разу?
Автори: Олеся Михайлівна БЕШ, кандидатка медичних наук, асистентка кафедри внутрішньої медицини № 2 Львівського національного медичного університету ім. Данила Галицького Олена Олександрівна СОРОКОПУД, кандидатка медичних наук, доцентка кафедри внутрішньої медицини № 2 Львівського національного медичного університету ім. Данила Галицького
Однією з найчастіших причин звернення до алерголога є кропив’янка – хвороба шкіри, що клінічно проявляється її почервонінням і свербежем, інколи набряком. Близько 20% людей на планеті хоча б один раз у житті мали прояви кропив’янки, й у 2% населення діагностовано хронічну кропив’янку [2]. Ця хвороба знижує якість життя пацієнтів, негативно впливає на сон і працездатність.
Кропив’янку поділяють на гостру, симптоми якої тривають менш як 6 тижнів, і хронічну, що клінічно турбує пацієнта більш як 6 тижнів. Гостра кропив’янка часто пов’язана з інфекціями верхніх дихальних шляхів, використанням ліків (антибіотики, нестероїдні протизапальні препарати, сиропи), харчовою непереносимістю. Причинами хронічної кропив’янки є контактна алергія, сенсибілізація до побутових, пилкових чи харчових алергенів, хвороби шлунково-кишкового тракту, автоімунні хвороби, хронічні інфекції (Helicobacter pylori, гепатити В і С, герпесвіруси, гельмінтози). У частини пацієнтів (25-30%), незважаючи на всі можливості сучасної діагностики, не вдається визначити провокувальний чинник.
Механізм розвитку кропив’янки пов’язаний з дегрануляцією дермальних тучних клітин і базофілів з подальшим вивільнення численних медіаторів запалення, включаючи гістамін, фактори зсідання крові (наприклад, фактор активації тромбоцитів – ФАТ), серотонін, інтерлейкіни та фактор некрозу пухлин-α. Гістамін зв’язується з Н1– та Н2-рецепторами, які є в багатьох органах і системах [2]. Активація рецепторів H1 на клітинах ендотелію та гладких м’язів призводить до збільшення проникності капілярів, активація ФАТ-рецепторів – до збільшення викиду гістаміну й підвищення чутливості тканин до нього, активація Н2-рецепторів – до артеріолярної та венозної вазодилатації, що клінічно проявляється почервонінням, набряком і свербежем шкіри. Цей процес може тривати декілька хвилин або навіть годин [3]. Активація тучних клітин і базофілів також стимулює виділення ФАТ, лейкотрієнів, простагландинів, тромбоксанів та інших прозапальних медіаторів.
Діагностика кропив’янки
Відповідно до європейських і міжнародних рекомендацій (EAACI/GA²LEN/EDF/WAO) гостра кропив’янка не потребує додаткового обстеження пацієнта. Якщо симптоми виникають повторно впродовж 6 місяців, рекомендовано провести додаткове обстеження (загальний аналіз крові, печінкові та ниркові проби, рівні загального імуноглобуліну Е (IgE), С-реактивного білка (СРБ), гормонів щитоподібної залози, тест з авто-сироваткою, ультразвукове дослідження (УЗД) внутрішніх органів). За допомогою цих базових обстежень ми можемо виключити певні хвороби, що клінічно проявляються кропив’янкою, а також визначити активність запального процесу. Як додатковий маркер еозинофільного запалення можна використовувати еозинофільно-катіонний білок (ЕКБ) [4, 5].
Принципи лікування пацієнтів із кропив’янкою
Кінцевою метою терапії є досягнення тривалої ремісії симптомів і покращення якості життя пацієнтів. Уникнення провокувального чинника, лікування хронічних інфекційних і автоімунних захворювань сприяють зменшенню симптомів кропив’янки. Коли неможливо повністю забрати причину, рекомендовано поетапну терапію. Згідно з рекомендаціями Європейської й Американської асоціацій алергологів препаратами вибору для лікування пацієнтів із кропив’янкою є блокатори Н1-рецепторів (першого та другого поколінь). Препаратами першого вибору є блокатори Н1-рецепторів другого покоління.
Н1-антигістамінні препарати першого покоління є менш селективними, ніж засоби другого покоління, щодо взаємодії з іншими типами рецепторів (мускаринові, α-адренергічні, рецептори серотоніну) в головному мозку й інших органах і системах. Із цим пов’язана більшість побічних дій цієї підгрупи препаратів: парадоксальне збудження, дратівливість, галюцинації, запори, сухість у роті, затримка сечі, тахікардія. Крім того, H1-антигістамінні препарати першого покоління можуть проникати крізь гематоенцефалічний бар’єр і діяти на H1-рецептори в центральній нервовій системі, спричиняючи сонливість, седацію, втому та головний біль. H1-антигістамінні препарати першого покоління (дифенгідрамін, доксепін, доксиламін і піриламін) часто використовують для профілактики та полегшення безсоння [6]. У медичних закладах ці препарати призначають у поєднанні з іншими ліками для свідомої седації та знеболення. Вони також застосовуються для лікування серотонінового синдрому, тривоги, гострого збудження, акатизії та мігрені [2]. Міжнародні нормативні документи не рекомендують використовувати ці препарати в рутинній практиці, однак у пацієнтів із вираженими клінічними симптомами, порушенням сну, підвищеною збудливістю та неефективністю інших груп препаратів можливий прийом нетривалими курсами.
Хоча гістамін відіграє важливу роль у патогенезі хронічної кропив’янки, це не єдиний медіатор запалення, котрий зумовлює симптоми. З огляду на це не дивно, що близько 61% пацієнтів із хронічною кропив’янкою є резистентними до лікування антигістамінними препаратами в стандартній дозі, тому для них рекомендовано збільшувати дозування навіть до 4 разів. Це може підвищити рівень успіху терапії приблизно до 45-55% [1]. Отже, частина пацієнтів потребує додаткового лікування. Рекомендації EAACI/GA²LEN/EDF/WAO наполягають на введені до схеми лікування таких пацієнтів глюкокортикоїдів короткими курсами, омалізумабу чи антилейкотрієнових препаратів [10].
Додавання глюкокортикоїдів є дискусійним. Більшість досліджень показують швидкий ефект від комбінації Н1-блокаторів і системних глюкокортикоїдів порівняно з монотерапією Н1-блокаторами. Однак відомо, що глюкокортикоїди зменшують кількість тучних клітин, але не гальмують їх дегрануляцію. Після скасування системних глюкокортикоїдів почервоніння та свербіж шкіри можуть навіть посилитися [7]. Зважаючи на побічні дії (підвищення артеріального тиску, відчуття жару та неспокою, загострення гастриту чи пептичної виразки, зниження імунітету тощо), цю групу препаратів доцільно використовувати лише за тяжких поширених форм кропив’янки з ознаками ангіоневротичного набряку.
Омалізумаб – рекомбінантне антитіло до IgЕ, що широко використовується в лікуванні хронічної кропив’янки. Препарат знижує рівень вільного IgЕ й експресію високоафінних рецепторів IgE, FcєRI на тучних клітинах і базофілах [10]. Тобто омалізумаб застосовується тільки в пацієнтів з IgЕ-залежними реакціями. Доза препарату вираховується залежно від вихідного рівня загального IgЕ (від 150 до 600 мг) що 4 тижні.
Як додаткову терапію в деяких випадках (найчастіше за непереносимості препаратів першої лінії, в пацієнтів із холодовою й автоімунною кропив’янкою) можливо використовувати антилейкотрієнові препарати [9], наприклад монтелукаст, переважно в пацієнтів із кропив’янкою, які також мають алергічний риніт чи бронхіальну астму. У монотерапії кропив’янки монтелукаст є малоефективним.
Мета дослідження
Порівняння ефективності рупатадину, біластину та фексофенадину в лікуванні пацієнтів із кропив’янкою.
Матеріали та методи
У дослідженні взяли участь 32 пацієнти із симптомами загострення хронічної кропив’янки (почервоніння, свербіж і набряк шкіри). Усім пацієнтам проведено додаткове лабораторне (загальний аналіз крові з лейкоцитарною формулою, печінкові та ниркові проби, визначення рівнів загального IgЕ, ЕКБ, СРБ, гормонів щитоподібної залози) й інструментальне обстеження (УЗД органів черевної порожнини та щитоподібної залози). Для з’ясування ефективності антигістамінних препаратів використовувати тест оцінювання активності кропив’янки (UAS7) і повторне визначення СРБ та ЕКБ.
Результати й обговорення
Впродовж 8 місяців дослідження в клініку на консультацію до алерголога звернулися 76 пацієнтів із симптомами гострої та хронічної кропив’янки.
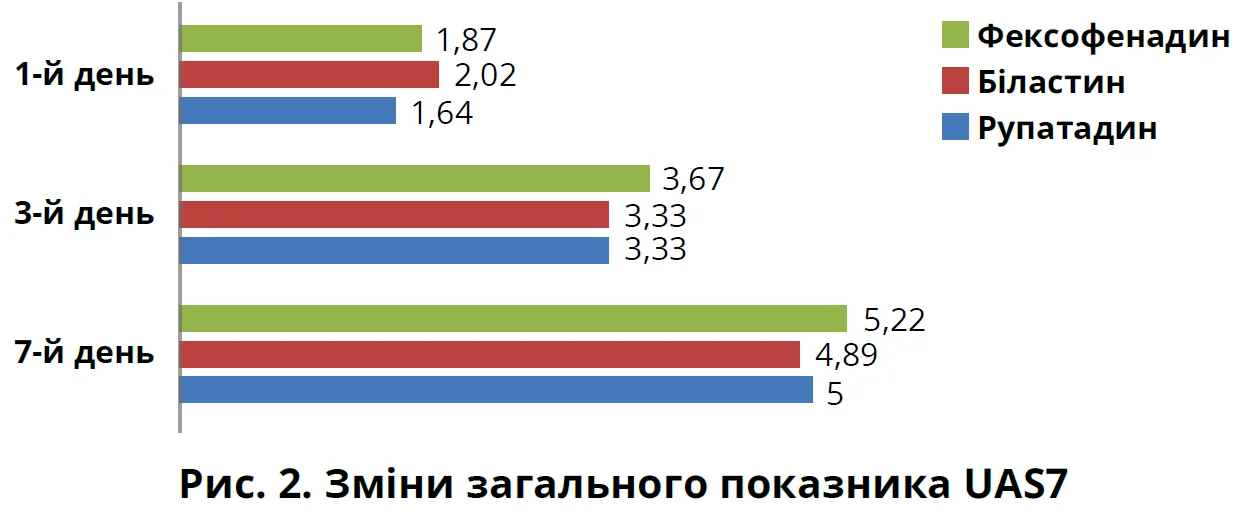
У дослідження увійшли 32 пацієнти з хронічною кропив’янкою віком від 18 до 58 років, які дали згоду на обробку персональних і медичних даних, виконали лабораторні й інструментальні обстеження. На першому візиті проводили УЗД органів черевної порожнини та щитоподібної залози, забір крові для лабораторного обстеження (загальний IgЕ, гормони щитоподібної залози, печінкові та ниркові проби, загальний аналіз крові). Рівні СРБ й ЕКБ визначали на першому та другому візитах. Додатково після ретельного збору анамнезу й огляду пацієнтам було визначено рівень діаміноксидази, виконано ПЛР-тест на парвовірус. Згідно з протоколом лікування препаратами вибору для початку терапії були блокатори Н1-рецепторів у стандартних дозах (рупатадин 10 мг, біластин 20 мг, фексофенадин 180 мг). Перше оцінювання ефективності терапії та корекція схеми лікування проводилися на 7-й день. Для цього використовували тест UAS7. Щовечора впродовж 7 днів пацієнти оцінювали кількість висипань та інтенсивність свербежу шкіри в балах від 0 до 3 (де 0 – симптоми відсутні, 3 – дуже сильні). Щоденна оцінка UAS7 коливалася від 0 до 6, а також підсумовувалися бали через 7 днів (від 0 до 42). Відповідно до запропонованої класифікації бал UAS7 від 7 до 15 вказує на легку активність хвороби, від 16 до 27 – на помірну, від 28 до 42 – на тяжку. Також оцінювали зміну показників СРБ й ЕКБ.
Пацієнтів було розподілено на три групи залежно від препарату, що вони приймали. У першу групу увійшли 11 пацієнтів, які отримували рупатадин 10 мг 1 раз на добу, до другої групи були включені пацієнти, які приймали біластин у дозі 20 мг 1 раз на добу, а третя група пацієнтів отримувала фексофенадин у дозі 180 мг на добу.
Зважаючи на результати тесту UAS7, ми порівняли ефективність блокаторів Н1-рецепторів на 1-й, 3-й і 7-й дні лікування. Позитивна динаміка спостерігалася в трьох групах пацієнтів щодо зменшення кількості висипань та інтенсивності свербіння шкіри.
На підставі отриманих результатів можна зробити висновок, що рупатадин, навіть у добовій дозі 10 мг, має хороший вплив на зменшення кількості й інтенсивності висипань на шкірі, а також свербежу. Такий його ефект, можливо, пов’язаний із подвійною дією – антигістамінною й анти-ФАТ, що зменшує проникність судин і, відповідно, набряк. Фексофенадин мав кращий вплив на зменшення симптомів свербежу шкіри. На рисунках 1 і 2 показано динаміку симптомів кропив’янки відповідно до результатів тесту UAS7.
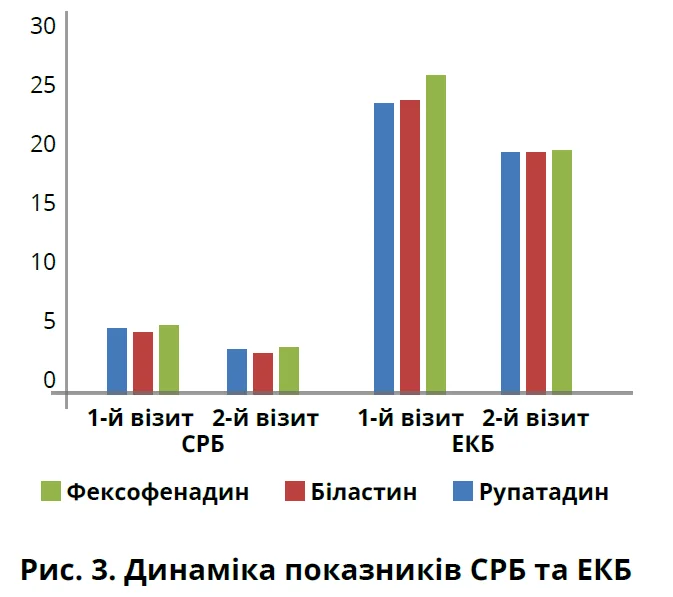
Активність алергічного запалення також можна контролювати за допомогою лабораторних показників, як-от СРБ та ЕКБ. Останній виділяється внаслідок дегрануляції еозинофілів і тому є маркером активації цих клітин [11]. СРБ – неспецифічний маркер запалення, що може підвищуватися при багатьох хворобах. У разі кропив’янки, коли ми спостерігаємо ураження шкіри, цей показник також підвищується.
Ми порівнювали зміни рівнів СРБ та ЕКБ у плазмі пацієнтів на тлі прийому різних препаратів із групи блокаторів Н1-рецепторів. Не було виявлено істотної різниці між групами пацієнтів, які приймали рупатадин, біластин і фексофенадин, у показниках СРБ та ЕКБ. Однак у всіх групах відзначалася позитивна динаміка щодо зменшення рівнів цих маркерів запалення (рис. 3).
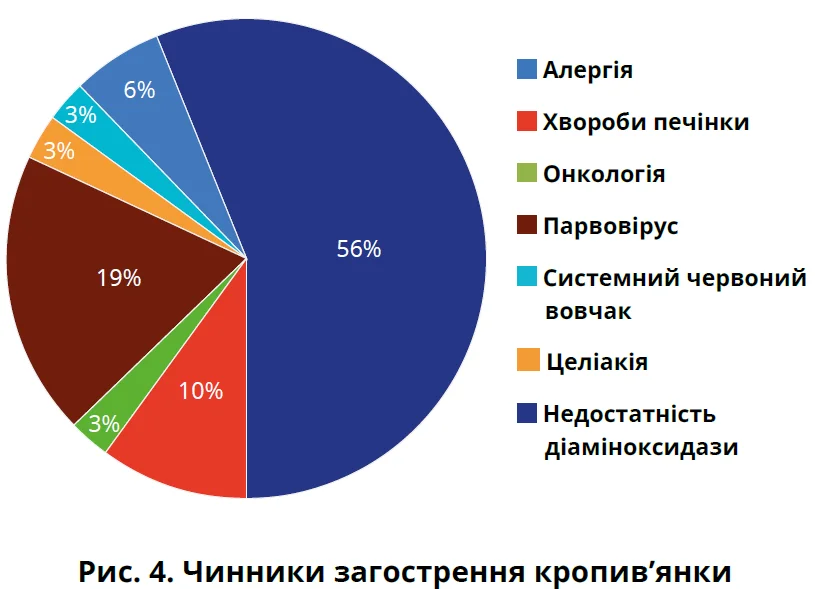
Найчастіше причиною ураження шкіри була алергічна реакція на побутові чи пилкові алергени – 18 пацієнтів (56,3%). Це молоді люди віком від 18 до 32 років. Цій групі рекомендовано шкірне тестування для визначення алергену-винуватця й обрання подальшої тактики лікування. У 3 пацієнтів виявлено підвищення рівня печінкових проб (γ-глутамілтранспептидази й загального білірубіну) та рекомендовано консультацію гастроентеролога. В 1 пацієнта під час УЗД щитоподібної залози виявлено новоутворення, а також підвищення рівнів Т3, Т4 й антитіл до тиреопероксидази та тиреоглобуліну. У 6 пацієнтів отримано позитивний ПЛР-тест на парвовірус. Однак у цієї групи хворих вірус був чинником загострення, для визначення причини основного захворювання рекомендовано дообстеження. Також були пацієнти з підозрою на системний червоний вовчак, целіакію та недостатність діаміноксидази, що можуть бути причинами загострення кропив’янки (рис. 4).
Чотири пацієнти з позитивним тестом на парвовірус приймали рупатадин, щоби зменшити свербіж і почервоніння шкіри. Хворі відзначали швидке зменшення симптомів. Це, мабуть, пов’язано зі зменшенням активності ФАТ, що має прозапальний ефект.
Висновки
Хронічна кропив’янка є складною та поширеною проблемою, що знижує якість життя пацієнтів. Препаратами першої лінії лікування є блокатори Н1-рецепторів другого покоління, оскільки вони мають високу специфічність до рецепторів і менше побічних дій. Рупатадин (10 мг на добу), біластин (20 мг на добу) та фексофенадин (180 мг на добу) показали свою ефективність у зменшенні симптомів кропив’янки. Проте навіть у нашій невеликій групі відповідно до результатів тесту UAS7 потребу в збільшенні дози препарату або заміні блокатора Н1-рецепторів через недостатню клінічну ефективність мали 5 пацієнтів.
Література
- Kaplan A., Lebwohl M., Giménez-Arnau A.M., Hide M., Armstrong A.W., Maurer M. Chronic spontaneous urticaria: focus on pathophysiology to unlock treatment advances. Allergy. 2023; 78; 389-401.
- Salman A., Porras N.M., Giménez-Arnau A.M. Acute and chronic urticaria diagnosis and management taking into account their differences. Allergy. 2023; 10; 130-147.
- Ansotegui I.J., Bernstein J.A., Canonica G.W., et al. Insights into urticaria in pediatric and adult populations and its management with fexofenadine hydrochloride.Allergy Asthma Clin. Immunol. 2022; 18 (1): 41.
- Sánchez J., Sánchez A., Munera M. Presence of IgE autoantibodies against eosinophil peroxidase and eosinophil cationic protein in severe chronic spontaneous urticaria and atopic dermatitis. Allergy Asthma Immunol. Res. 2021; 13 (5): 746-761.
- Karstarli Bakay O.S., Demir B., Cicek D., et al. In chronic spontaneous urticaria, IgE and C-reactive protein are linked to distinct microRNAs and interleukin-31. Clin. Transl. Allergy. 2023; 13 (8): e12290.
- Navarro-Triviño F.J. Pruritus in dermatology: part 2 – diseases and their treatment. Actas Dermosifiliogr. 2023; 114 (7): 613-626.
- Javaud N., Soria A., Maignan M., et al. Glucocorticoids for acute urticaria: study protocol for a double-blind non-inferiority randomized controlled trial. BMJ Open. 2019; 9 (8): e027431.
- de Silva N.L., Damayanthi H., Rajapakse A.C., Rodrigo C., Rajapakse S. Leukotriene receptor antagonists for chronic urticaria: a systematic review. Allergy Asthma Clin. Immunol. 2014; 10 (1): 24.
- Alkeraye S., Alruhaimi D.K. The addition of montelukast for the treatment of chronic idiopathic urticaria. Cureus. 2021; 13 (7): e16137.
- Zuberbier T., Abdul Latiff A.H., Abuzakouk M., et al. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022 Mar; 77 (3): 734-766.
- Terhorst-Molawi D., Fox L., Siebenhaar F., Metz M., Maurer M. Stepping down treatment in chronic spontaneous urticaria: what we know and what we don’t know. Am. J. Clin. Dermatol. 2023; 24 (3): 397-404.