Оновлені дані щодо призначення антигістамінних препаратів для лікування хронічної кропив’янки
Переклала й адаптувала канд. мед. наук Світлана Опімах
Кропив’янка – це опосередковане переважно мастоцитами захворювання шкіри, що характеризується сверблячими пухирцями та/або ангіоневротичним набряком. Кропив’янка є гострою, якщо триває 6 або менше тижнів, і хронічною, якщо триває понад 6 тижнів. Хронічна кропив’янка (ХК) може бути спонтанною, коли з’являється без певного тригера, чи індукованою, коли симптоми спричинені специфічними та відтворюваними чинниками, як-от тертя, тепло, холод, сонячне світло, тиск, фізичні навантаження або вібрація.
Міжнародні рекомендації пропонують індивідуальний підхід до лікування ХК. Він включає диференційну діагностику, виявлення причин і можливих тригерів ХК, супутніх захворювань, визначення наслідків (тривога, депресія, сексуальна та когнітивна дисфункції, розлади сну), виявлення можливих біомаркерів і предикторів відповіді на лікування, спостереження за активністю хвороби.
Оскільки гістамін є основним медіатором, який вивільняється при активації тучних клітин, антигістамінні препарати (АГП) є першим вибором фармакологічного лікування ХК. Лікування АГП проводиться за принципом «стільки, скільки потрібно, та якомога менше, наскільки це можливо», зважаючи на активність і контроль хвороби. Метою терапії є безперервне та безпечне лікування з повним контролем симптомів і стійкою нульовою активністю хвороби.
Усі міжнародні настанови рекомендують починати лікування ХК з H1-АГП ІІ покоління. АГП І покоління не показані через побічні ефекти та взаємодію з лікарськими засобами. Стандартні дози АГП є неадекватними приблизно в 60% пацієнтів. У цьому випадку рекомендують підвищення стандартної дози вчетверо (друга лінія). Пацієнти, які не реагують на АГП (і їх збільшені дози), потребують лікування третьої лінії анти-IgE-антитілами (омалізумаб). Коли відповіді на омалізумаб немає, призначають циклоспорин (четверта лінія терапії).
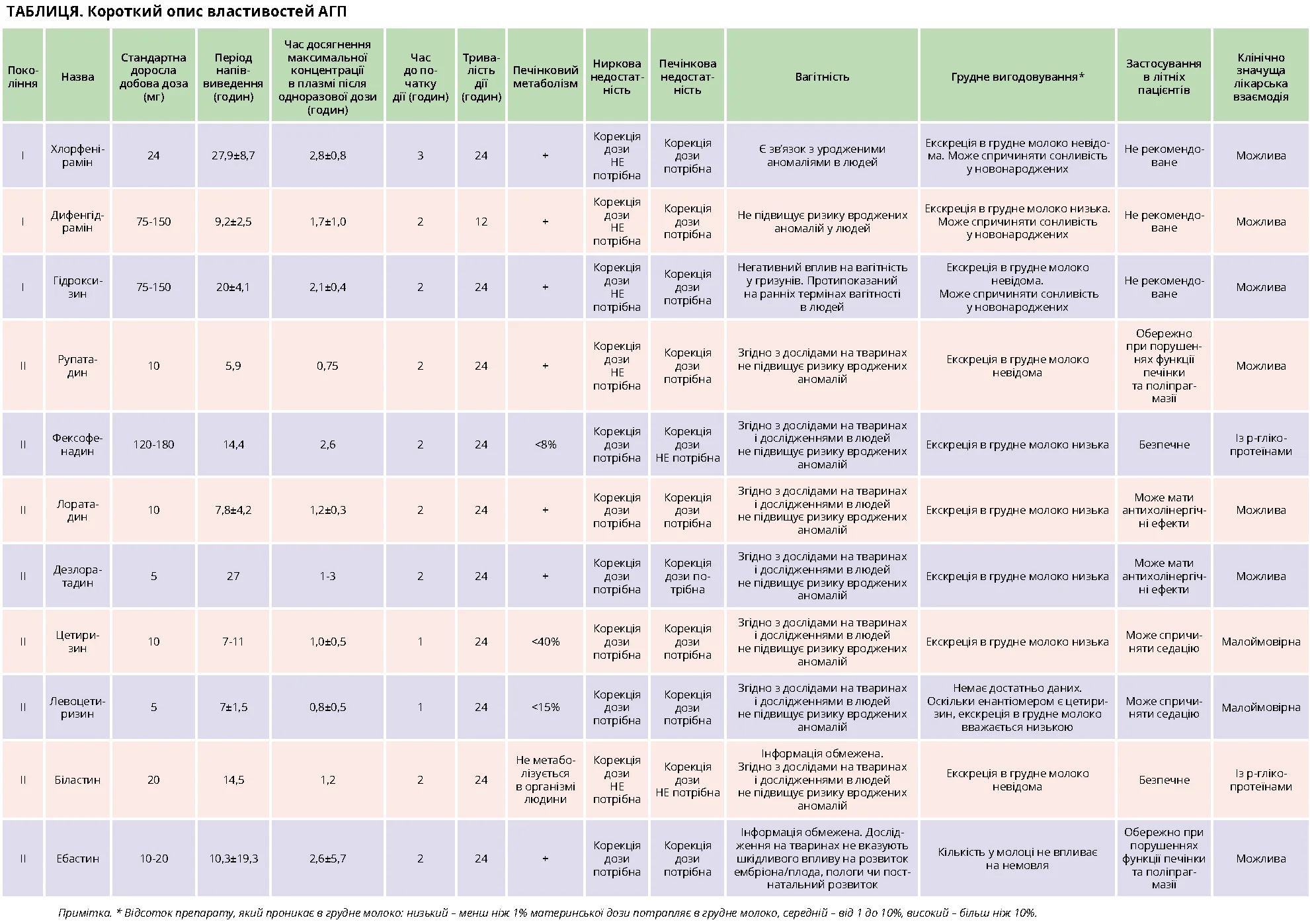
Фармакологічні властивості та класифікація АГП
Гістамін синтезується й вивільняється з тучних клітин і базофілів. Він чинить як прозапальну, так і протизапальну дію, яка визначається підтипом гістамінового рецептора та стимульованими клітинами. Існує чотири типи гістамінових рецепторів: Н1, Н2, Н3 та Н4. Н1-рецептори відповідають за захисну й імунорегуляторну дії гістаміну, а також за гостре та хронічне алергічне запалення. Н1-рецептори експресуються в багатьох тканинах і клітинах, включаючи нерви, ендотелій, гладкі м’язи судин, респіраторний епітелій, гепатоцити, дендритні клітини та лімфоцити. При зв’язку гістаміну з Н1-рецепторами дрібних капілярних венул відбуваються розширення та підвищення проникності судин, виток плазми в інтерстицій, що призводить до утворення еритематозних пухирів або набряків з незміненим кольором шкіри (ангіоневротичний набряк). Гістамін залучає еозинофіли, базофіли, нейтрофіли й інші імунні клітини в інфільтрат пухирів, а також стимулює сенсорні нейрони, що спричиняє свербіння.
Поняття «антигістамінний» стосується тільки препаратів, які діють на Н1-рецептори, антагоністи інших рецепторів не є АГП. АГП є зворотними агоністами H1-рецепторів, знижують конституційну активність гістаміну й антагонізують вплив гістаміну на Н1-рецептори шляхом стабілізації Н1-рецептора в неактивній конформації. Тому їх переважно називають «H1-АГП», а не «антагоністи гістаміну».
АГП блокують вплив гістаміну на рецептори дрібних судин і сенсорних нейронів, усувають вазодилатацію та збільшену проникність судин, а також пригнічують імунну відповідь на антигени й накопичення запальних клітин у тканинах, що опосередковано зменшує алергічне запалення.
АГП І покоління малоселективні до Н1-рецепторів, мають спорідненість до мускаринових, серотонінергічних і α-адренорецепторів, а також до К+-каналів серця, що спричиняє побічні ефекти, як-от розмитість зору, сухість у роті, закреп. Передозування АГП І покоління, наприклад дифенгідраміну, може призвести до антихолінергічних ефектів, як-от лихоманка, тахікардія, гіпотензія, судоми, сонливість, марення, мідріаз, затримка сечі, пригнічення дихання та кома. АГП І покоління є ліпофільними, проникають крізь гематоенцефалічний бар’єр і можуть пригнічувати центральну нервову систему, спричиняти психомоторні порушення, сонливість, погіршення якості сну, симптоми похмілля наступного дня, коматозний стан і навіть смерть. Вони були пов’язані з аваріями при керуванні транспортними засобами. Навпаки, АГП ІІ покоління є більш селективними до H1-рецепторів і позбавлені цих ефектів.
У 1980-х роках виникла проблема кардіотоксичності АГП. Деякі АГП І покоління (прометазин, бромфенірамін, хлорфенірамін) можуть подовжувати інтервал QTc і при прийомі у великих дозах або передозуванні спричиняти аритмії. Астемізол і терфенадин також можуть подовжувати інтервал QT. Клінічно значущі серцеві ефекти біластину, цетиризину, левоцетиризину, ебастину, фексофенадину, лоратадину, дезлоратадину, мізоластину та рупатадину, навіть у разі застосуванні вищих доз, відсутні.
Через побічні ефекти та короткий період напіввиведення деякі АГП І покоління були вилучені з ринку за винятком кількох показань. Натомість у разі ХК показані АГП ІІ покоління з обмеженим проникненням крізь гематоенцефалічний бар’єр, довшим періодом напіввиведення та легким дозуванням (табл.).
Порівняння ефективності стандартних доз АГП у разі ХК
Поточні настанови EAACI/WAO/GA2LEN рекомендують призначати АГП ІІ покоління для лікування ХК, проте не дають вказівок, який АГП вибрати, через відсутність якісних клінічних випробувань з порівняння сучасних АГП у разі ХК. Автори цього огляду проаналізували результати 30 рандомізованих випробувань, загалом дані 5144 пацієнтів, серед яких 3992 особи отримували АГП ІІ покоління в стандартній дозі, тоді як решта 1152 отримували плацебо для лікування ХК.
Усі плацебо-контрольовані дослідження доводять значну перевагу АГП ІІ покоління в стандартній дозі над плацебо. При порівнянні різних АГП ІІ покоління між собою їхні ефективність і безпека не відрізнялися в парах біластин 20 мг / левоцетиризин 5 мг, біластин 20 мг / фексофенадин 180 мг, левоцетиризин 5 мг / фексофенадин 180 мг (або ебастин 10 мг). Однак у 10 дослідженнях було продемонстровано, що рупатадин 10 мг переважає лоратадин 10 мг (а також цетиризин і левоцетиризин) у показниках безпеки, ефективності та покращенні якості життя. Біластин 20 мг є ефективнішим за левоцетиризин 5 мг. Левоцетиризин є ефективнішим, аніж лоратадин і дезлоратадин у стандартних дозах. Також перший препарат у парах порівняння олопатадин/рупатадин, олопатадин/левоцетиризин і цетиризин/фексофенадин є ефективнішим.
Порівняння ефективності підвищених доз АГП і комбінацій АГП
Коли стандартні дози АГП ІІ покоління недостатні для контролю симптомів ХК, наявні дані підтверджують стратегію збільшення дози АГП ІІ покоління вчетверо з високою ефективністю та безпекою. Цей підхід застосовується до низки АГП ІІ покоління, включаючи біластин, цетиризин, левоцетиризин, ебастин, фексофенадин, лоратадин, дезлоратадин, мізоластин і рупатадин. У міжнародній настанові EAACI/GA2LEN/EuroGuiDerm/APAAACI поєднання різних АГП ІІ покоління не рекомендується, оскільки не є кращим, аніж підвищення дози того самого АГП у 4 рази. Попри це деякі дослідження показали, що комбінація різних АГП ІІ покоління в лікуванні другої лінії може досягти порівнянної ефективності та безпеки з практикою збільшення доз АГП.
У дослідженні з вивчення комбінованої терапії двома АГП у стандартних дозах (левоцетиризин + ебастин порівняно з левоцетиризином) комбінована терапія виявилася ефективнішою. В інших дослідженнях підвищення дози одного з АГП мало тенденцію до кращих результатів, аніж додавання іншого АГП до лікування стандартними дозами. Ще в одному дослідженні підвищення дози
одного АГП у 4 рази порівняно з комбінованою терапією чотирма різними препаратами не тільки продемонструвало значну перевагу в контролі симптомів ХК,
але й не вплинуло на частоту побічних реакцій.
Фармакогеноміка АГП і біомаркери антигістамінної відповіді при ХК
Індивідуальні відмінності в ефективності та чутливості до АГП можна пояснити генетичним чинником. Фармакогеноміка – дослідження зв’язку між генетикою пацієнта та його реакцією на ліки, є перспективною для оптимізації антигістамінної терапії при ХК у майбутньому.
Також існує потреба в специфічних біомаркерах для прогнозування відповіді на АГП. У зв’язку з цим вивчаються специфічні клінічні та біохімічні маркери (тяжкість хвороби, асоційована індукована кропив’янка, рівні С-реактивного білка та D-димеру), які спрямовані на прогнозування відповіді на лікування АГП.
Висновок
Основою лікування ХК є АГП ІІ покоління, профіль ефективності та безпеки яких перевершують препарати I покоління. Знижений седативний ефект і вибіркова дія на гістамінові рецептори роблять АГП ІІ покоління кращими варіантами для довгострокового лікування. На другій ліній терапії ХК застосовують підвищення дози АГП ІІ покоління вчетверо.
Література
Xiang Y.K., Fok J.S., Podder I., Yücel M.B., Özkoca D., Thomsen S.F., Kocatürk E. An update on the use of antihistamines in managing chronic urticaria. Expert Opin. Pharmacother. 2024; 25 (5): 551-569. doi: 10.1080/14656566.2024.2345731.