Застосування пероральних антигістамінних засобів для лікування алергічних станів: акцент на левоцетиризин
Підготувала канд. мед. наук Ольга Королюк
На сьогодні від алергії потерпає принаймні третина населення планети. Алергічні хвороби уражають різні органи та системи, зазвичай мають хронічний прогресивний перебіг і несуть потенційну загрозу для життя. Симптоми алергії тривалі й неприємні, суттєво погіршують якість життя пацієнтів. Поширеність алергії та витрати на лікування неухильно зростають в усьому світі. Отже, це вагома медико-соціальна проблема, яка потребує особливої уваги медичної спільноти, адекватної діагностики та індивідуального підходу в лікуванні. Чітке розуміння патогенетичних механізмів різних алергічних станів й особливостей впливу різних препаратів є запорукою ефективної терапії. Цей огляд присвячений ролі антигістамінних засобів (АГЗ) у лікуванні різних алергічних станів з акцентом на препарат третього покоління левоцетиризин.
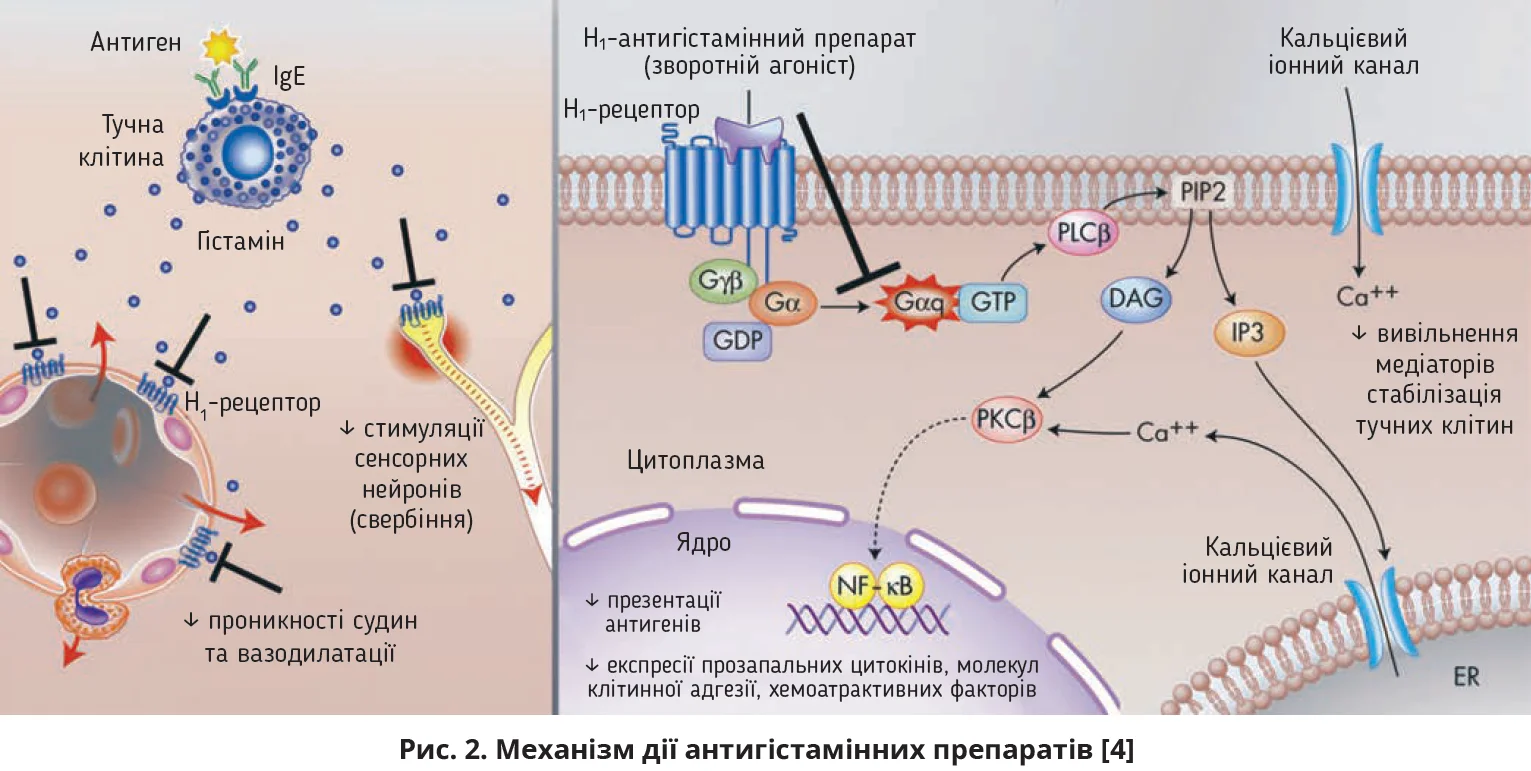
Гістамін – один з основних медіаторів алергічних реакцій, що вивільняється внаслідок дегрануляції тучних клітин, яка здебільшого опосередкована імуноглобуліном E (IgE). Вивільнений гістамін зв’язується з гістаміновими (H) рецепторами 4 типів, які експресуються на різних тканинах і клітинах.
Понад 90% гістаміну в організмі міститься в тучних клітинах і базофілах; решта гістаміну присутня в ентерохромафінних клітинах, тромбоцитах, ендотеліальних клітинах і нейронах [1]. У мозку гістамін може діяти як нейромедіатор. Клітинні тіла гістамінергічних нервів розташовані в магноцелюлярному ядрі заднього гіпоталамуса, проте їхні аксони є в більшості ділянок переднього мозку. Більшість ефектів гістаміну при алергічному запаленні опосередковані Н1-рецепторами, зокрема свербіння, звуження бронхів, вазодилатація та міграція клітин (рис. 1) [2].
Основні характеристики АГЗ
Діючи як зворотні агоністи H1-рецепторів, АГЗ блокують прозапальні впливи гістаміну на H1-рецепторах сенсорних нейронів і дрібних кровоносних судин, здебільшого посткапілярних венул. Вони також знижують регуляцію алергічного запалення через вплив на ядерний фактор-κB (NF-κB) й іонні кальцієві канали (рис. 2) [3, 4].
Залежно від здатності долати гематоенцефалічний бар’єр АГЗ класифікують на препарати першого та нового поколінь (табл. 1).
Препарати першого покоління зв’язують Н1-рецептори на нейронах, зумовлюючи седативний ефект, погіршення концентрації, пам’яті та когнітивних функцій [6]. Іншою причиною виникнення небажаних ефектів є здатність блокувати передачу через мускаринові, α-адренергічні та серотонінові рецептори, а також вплив на іонні канали. Ці блокади призводять до різноманітності та помітної тяжкості небажаних ефектів із боку різних органів і систем, деякі з яких представлено на рисунку 3 [4].
Крім того, АГЗ першого покоління пригнічують печінкові ферменти CYP2D6, що потенційно змінює метаболізм інших препаратів, зокрема трамадолу, деяких антибіотиків, трициклічних антидепресантів, антипсихотиків, β-блокаторів і антиаритмічних засобів [7]. Тому сучасні практичні настанови не рекомендують призначати АГЗ першого покоління для лікування алергічних станів [8]. Натомість АГЗ нового покоління демонструють високу селективність до Н1-рецепторів, тривалішу дію, низьку проникність крізь гематоенцефалічний бар’єр і меншу ймовірність побічних ефектів [6].
Місце АГЗ у лікуванні алергічних станів: рекомендації міжнародних протоколів лікування
- Алергічний риніт
Поширеність алергічного риніту (АР) коливається від 20 до 25,7% [9, 10]. До клінічних проявів АР відносять чхання, закладеність носа та виділення слизу, що виникають внаслідок впливу причинних алергенів у сенсибілізованих осіб через імунологічний каскад, опосередкований IgE. Рання стадія імунологічного каскаду триває декілька хвилин, пізня стадія – 4-8 годин. Класифікація АР ґрунтується на тривалості та повторюваності симптомів. Тривалість симптомів менш як 4 дні на тиждень або менш як 4 тижні поспіль є критерієм інтермітивного АР.
За довшої тривалості симптомів установлюється діагноз персистивного АР [11]. Окрім того, АР класифікують як сезонний, коли симптоми наявні лише в певні періоди впливу причинних алергенів, і цілорічний, коли симптоми спостерігаються впродовж року. Рекомендації щодо лікування АР пропонують декілька міжнародних настанов і позиційних документів (табл. 2). Усі настанови підкреслюють важливість використання АГЗ нового покоління як терапію першої лінії АР.
- Кропив’янка
Кропив’янка – запальне захворювання шкіри, що характеризується пухирями з навколишнім ангіоневротичним набряком. За тривалістю симптомів кропив’янку класифікують як гостру (≤6 тижнів) і хронічну (>6 тижнів). Хронічну кропив’янку поділяють на індуковану (спричиняється певним тригером) або спонтанну, коли тригер не ідентифікується. Існує переконливий консенсус, заснований на доказах (табл. 3), що АГЗ нового покоління слід використовувати як терапію першої лінії на регулярній основі [21].
Для пацієнтів, які не відповідають на стандартні дози АГЗ нового покоління, як терапію другої лінії рекомендовано поступове збільшення дози АГЗ, не перевищуючи 4-разову стандартну дозу [22]. З’являються докази ефективності та безпеки високих доз АГЗ для лікування хронічної спонтанної кропив’янки. Систематичний огляд і метааналіз 7 досліджень указують, що лікування високими дозами АГЗ нового покоління асоціюється зі значно вищою частотою відповіді порівняно зі стандартним дозуванням (відносний ризик 1,13; 95% довірчий інтервал (ДІ) 1,02-1,26; p=0,02), але вищою частотою сонливості (різниця ризиків 0,05; 95% ДІ 0,01-0,09; p=0,02). Істотної різниці щодо інших побічних ефектів між стандартним і високим дозуванням не виявлено [23].
У дітей, вагітних і жінок, які годують грудьми, застосовують аналогічні принципи лікування з урахуванням індивідуальних особливостей – дозування з поправкою на масу тіла й оцінка співвідношення користь/ризик [21]. Люди похилого віку можуть бути особливо сприйнятливими до седативної дії АГЗ за умови застосування високих доз або за наявності супутніх захворювань нирок, печінки чи серця [24, 25].
- Анафілаксія
Анафілаксія – це гостра системна, загрозлива для життя реакція на тригер із залученням ≥2 систем організму. За підрахунками, будь-яка людина має 2% ризик пережити епізод анафілаксії впродовж життя [26]. Найчастіше анафілаксія опосередкована IgE. Клінічні прояви включають гіпотензію, бронхоспазм, задишку, ангіоневротичний набряк і набряк через системну дію гістаміну. Терапією першої лінії є адреналін [27]. Додаткове лікування включає АГЗ, які здебільшого використовуються для терапії шкірних симптомів (свербіж, кропив’янка). Незважаючи на те що гістамін бере участь у патогенезі анафілаксії, АГЗ не полегшують загрозливих для життя симптомів, як-от гіпотензія та бронхоспазм. Дія АГЗ не настільки швидка, як дія адреналіну, тому цей клас препаратів не є засобом першої лінії в лікуванні анафілаксії [28]. Через відсутність явних переваг настанови 2020 року не рекомендують призначення АГЗ для запобігання двофазній анафілаксії (табл. 4) [27]. Хоча АГЗ не є ключовими засобами в лікуванні анафілаксії, їх можна використовувати для усунення вторинних симптомів, щоб забезпечити пацієнтам більший комфорт [12].
- Алергічна астма
Алергічна астма – це запалення нижніх дихальних шляхів унаслідок впливу аероалергенів, яке вражає 60% хворих на астму. Основним патогенетичним механізмом цього стану є опосередкована тучними клітинами імунна відповідь із вивільненням гістаміну й інших медіаторів, що призводить до звуження бронхів із гіперсекреції слизу. Клінічними проявами алергічної астми є задишка, кашель, хрипи та дискомфорт у грудній клітці. Незважаючи на певну роль гістаміну, АГЗ зазвичай не фігурують в алгоритмі лікування алергічної астми [29]. Терапією першої лінії є інгаляційні кортикостероїди, що забезпечують швидку бронходилатацію.
Друга лінія включає β-агоністи тривалої дії й антагоністи лейкотрієнових рецепторів. Настанови GINA (Глобальна ініціатива з астми) 2022 року не містять рекомендації щодо застосування АГЗ у схемі лікування астми [30]. Проте багато пацієнтів з астмою мають супутні хвороби (АР, алергічний кон’юнктивіт), здатні погіршувати якість життя та наслідки астми. У таких випадках призначення АГЗ можна розглядати у світлі рекомендацій щодо менеджменту вказаних станів [12].
АГЗ нового покоління
АГЗ нового покоління мають низку переваг над АГЗ першого покоління: вища ефективність, довша тривалість дії, відсутність побічних ефектів, зумовлених впливом на інші рецептори (рис. 3), й істотно менший седативний ефект, що особливо важливо для людей працездатного віку та дітей. Ідеєю створення АГЗ третього покоління було покращення профілів ефективності та безпеки наявних засобів другого покоління. До АГЗ третього покоління відносять дезлоратадин і фексофенадин, які є активними метаболітами лоратадину та терфенадину відповідно, а також левоцетиризин – препарат, синтезований після революційного відкриття хіральної ізомерії. Хіральні ізомери (енантіомери) –
це дзеркально симетричні форми, однакові за хімічним складом і послідовністю хімічних зв’язків, але з різною активністю. Усі рецептори та метаболічні системи людського організму пристосовані до лівообертальних молекул, а білки людини складаються з лівообертальних амінокислот. Отже, лікарські засоби, які складаються з лівообертальних ізомерів, є ефективнішими, що дає змогу досягти бажаного ефекту при застосуванні менших доз й істотно знижує ризик небажаних ефектів. Порівняння найуживаніших пероральних АГЗ нового покоління підсумовано в таблиці 5.
Фармакодинамічні ефекти левоцетиризину – АГЗ третього покоління
Левоцетиризин – лівообертальний ізомер і активний R-енантіомер цетиризину [33]. Як відомо, цетиризин складається з рацемічної суміші двох енантіомерів – R- і S-цетиризину, які різняться за фармакологічною активністю, спорідненістю до H1-рецепторів і константою дисоціації. Фармакологічна активність і вища спорідненість до Н1-рецепторів зумовлені саме R-енантіомером [34]. Отже, спорідненість левоцетиризину до H1-рецепторів людини удвічі вища порівняно з цетиризином і приблизно в 30 разів вища порівняно з декстроцетиризином [35]. Спорідненість левоцетиризину до Н1-рецепторів у 600 разів вища, ніж до інших рецепторів (H2/3-, холінергічних, мускаринових, серотонінових, адренорецепторів), що суттєво обмежує ймовірність небажаних ефектів (рис. 3) [34].
Висока потужність і специфічність левоцетиризину як зворотного агоніста H1-рецепторів підтверджені на рівні як ендотеліальних клітин, так і фіброзних клітин гладкої мускулатури мікроциркуляторного русла [36, 37]. Антагонізм гістаміну на цих ділянках відповідає за пригнічення вазодилатації та надмірної проникності судин. Дія левоцетиризину на шкіру зменшує набряк, а вплив на слизові оболонки дихальних шляхів знижує секрецію слизу. Вказані фармакологічні властивості пояснюють терапевтичну ефективність левоцетиризину при АР і кропив’янці [33].
Експресія Н1-рецепторів на поверхні Т-лімфоцитів, дендритних клітин і макрофагів у легенях індукує експресію молекул адгезії та синтез прозапальних цитокінів і хемокінів [38]. Установлено, що левоцетиризин пригнічує синтез інтерлейкіну-6 (IЛ-6) макрофагами легень та індуковане гістаміном утворення IЛ-8 дендритними клітинами; блокує секрецію хемокінів і гранулоцитарно-моноцитарного колонієстимулювального фактора (GM-CSF) на кератиноцитах; знижує експресію молекул активації (CD134 й ICAM-1) і фактора транскрипції GATA-3, який бере участь у диференціації Th2- лімфоцитів [33]. Індуковане левоцетиризином пригнічення комплексу фактора транскрипції NF-κB зменшує утворення еотаксину клітинами ендотелію, пригнічує спричинену еотаксином трансендотеліальну міграцію еозинофілів, модулює вивільнення прозапальних цитокінів IЛ-1β й IЛ-7 з активованих ліпосахаридами еозинофілів, а також сприяє синтезу тканинних інгібіторів металопротеїнази-1, -4 та матриксної металопротеїнази-9 [39, 40]. Указані протизапальні й антиалергічні властивості левоцетиризину не пов’язані з його впливом на Н1-рецептори та проявляються під час стандартного дозування 5 мг [41]. Інші АГЗ нового покоління продемонстрували такі ефекти лише in vitro в концентраціях, недосяжних in vivo [42]. Здатність левоцетиризину зменшувати відсоток клітин, які спричиняють запальне пошкодження тканин (еозинофіли, CD4+CD29+, CD4+CD212+ і CD4+CD54+), і збільшувати відсоток CD4+CD25+, які включають захисні імунорегуляторні клітини (Treg), свідчить про протизапальну дію in vivo, не пов’язану з безпосереднім пригніченням Н1-рецепторів [43].
У результаті досліджень левоцетиризину in vitro виникла інноваційна концепція про можливість позитивної взаємодії між протизапальними ефектами й антагонізмом H1-рецепторів. Ця гіпотеза ґрунтується на спостереженні високої динамічності H1-рецепторів: їхня експресія на клітинах швидко модулюється – збільшується або пригнічується. Певні цитокіни (фактор некрозу пухлин-α, IЛ-8, IЛ-13) або фактори росту (GM-CSF) посилюють експресію H1-рецепторів на моноцитах, макрофагах і дендритних клітинах [44, 45]. Шляхом пригнічення утворення згаданих вище цитокінів і факторів росту, а також рекрутування клітин, залучених до алергічного імунофлогозу, фармакологічне блокування Н1-рецепторів левоцетиризином може змінити патогенез і клінічну еволюцію алергічних захворювань [45].
Ефективність левоцетиризину в лікуванні АР
Метааналіз, що включав 140 853 пацієнтів з АР, які брали участь у 9 проспективних обсерваційних дослідженнях, порівнював 4 різні АГЗ – дезлоратадин, ебастин, фексофенадин і левоцетиризин. Установлено, що монотерапія левоцетиризином виявилася значно ефективнішою щодо зниження загальної оцінки симптомів (p<0,001) і загальної оцінки назальних симптомів (p<0,05) порівняно з іншими АГЗ. На наступному етапі продемонстровано значний позитивний ефект левоцетиризину на клінічні симптоми в пацієнтів із тяжким АР (розмір ефекту -0,09) [46]. Інший метааналіз (1603 учасники, 7 подвійно сліпих плацебо-контрольованих досліджень) порівнював ефективність левоцетиризину та лоратадину. Левоцетиризин значно ефективніше покращував показник загальної оцінки симптомів: величина ефекту порівняно з плацебо для левоцетиризину -0,59 (95% ДІ -0,89; -0,29), для лоратадину -0,21 (95% ДІ -0,31; -0,1), p<0,01 [47]. Отже, є достатньо доказів високої якості, котрі підтверджують ефективність левоцетиризину в лікуванні АР.
Ефективність левоцетиризину в лікуванні кропив’янки
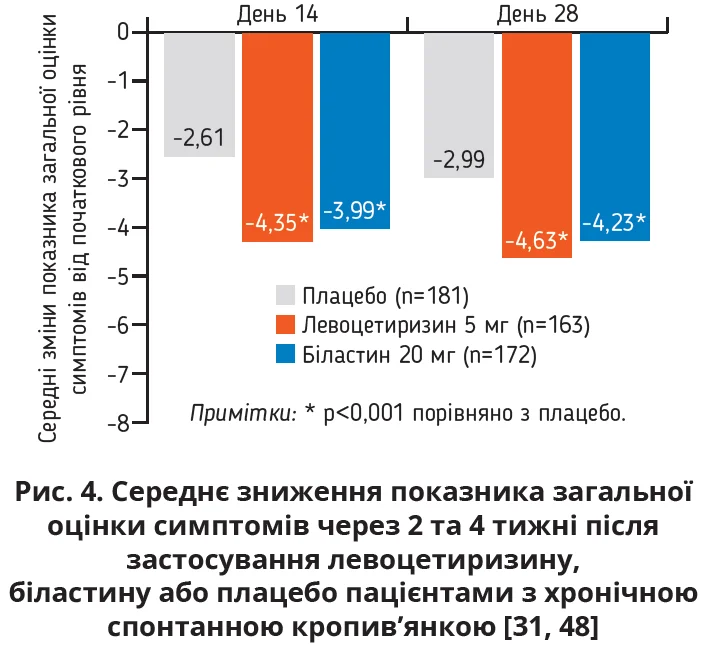
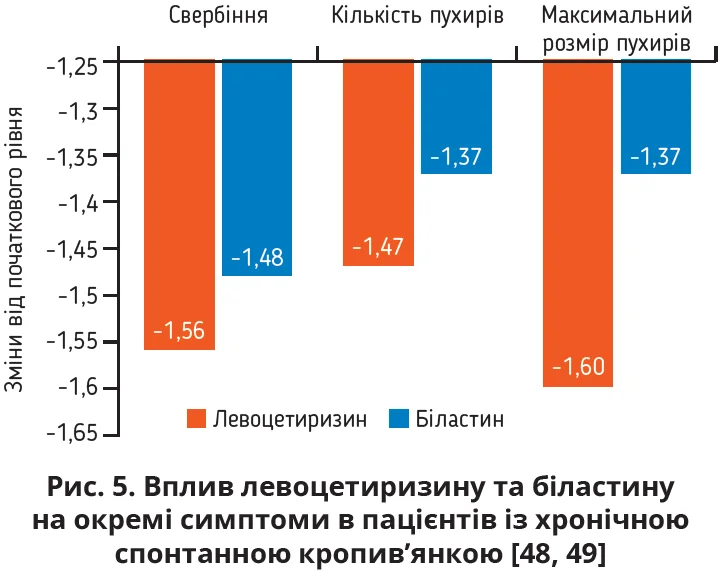
Багатоцентрове рандомізоване подвійно сліпе плацебо-контрольоване дослідження тривалістю 4 тижні порівнювало ефективність левоцетиризину та біластину в 525 пацієнтів із хронічною ідіопатичною кропив’янкою. Обидва препарати суттєво покращили якість життя та продемонстрували практично однакові ефекти щодо зниження середнього показника загальної оцінки симптомів (інтенсивність свербіння, кількість і максимальний розмір пухирів) протягом 2 і 4 тижнів і значуще (p<0,001) перевищували відповідні показники в групі плацебо (рис. 4) [48]. Впливи левоцетиризину та біластину на кожен із симптомів, який оцінювали в цьому дослідженні, ілюструє рисунок 5 [48, 49].
Нещодавній огляд указує, що левоцетиризин є одним із найефективніших АГЗ для лікування кропив’янки в дорослих і дітей [49]. Насамперед це зумовлено швидким початком дії та тривалістю ефекту впродовж 24 годин. Порівняння впливів левоцетиризину й іншого АГЗ третього покоління фексофенадину на індуковані гістаміном пухирі, набряк і свербіння в здорових добровольців указує на суттєво більший інгібіторний ефект (p<0,005) і фармакокінетичні переваги левоцетиризину: швидший початок дії (30-90 хвилин проти 2 годин), досягнення максимального ефекту за коротший проміжок часу (3-4 години проти 3-6 годин) і вдвічі довша тривалість дії (принаймні 24 години проти ≈12 годин) [50]. В іншому дослідженні встановлено більшу ефективність левоцетиризину порівняно з АГЗ третього покоління дезлоратадином щодо впливу на симптоми хронічної ідіопатичної кропив’янки. Обидва препарати застосовувалися в дозах 5 мг 1 раз на добу. Лікування левоцетиризином значно ефективніше зменшувало свербіння вже протягом першого тижня лікування: середні показники вираженості свербіння становили 1,02 й 1,18 для левоцетиризину та дезлоратадину відповідно (p<0,001). Результат спостерігався впродовж усього періоду лікування, що тривало 4 тижні (p=0,004). Крім того, левоцетиризин зменшував тривалість свербіння, середній сумарний показник хронічної ідіопатичної кропив’янки та загальну задоволеність пацієнтів значущо більшою мірою, ніж дезлоратадин, як упродовж першого тижня (р=0,002, р=0,005, p=0,012 відповідно), так і впродовж усього дослідження (р=0,009, р<0,05, p=0,021 відповідно). Безпека та переносимість були подібними в обох групах [51]. Левоцетиризин також продемонстрував кращу ефективність порівняно з лоратадином і рупатадином, які вважаються безпечними та ефективними неседативним АГЗ другого покоління [52, 53].
Стосовно ефективності та безпеки 4-разового підвищення дози левоцетиризину до 20 мг на добу при рефрактерній хронічній спонтанній кропив’янці, то нещодавно проведений огляд указує на ефективність у більшості випадкі за відсутності будь-яких клінічно значущих побічних ефектів [32]. Безпеку для серця продемонстровано при 6-разовому підвищенні стандартної дози без появи аритмій або подовження інтервалу QT [54].
Фармакокінетика та профіль безпеки левоцетиризину
Фармакокінетика левоцетиризину лінійно корелює з дозою, не залежить від часу та мало варіабельна для різних суб’єктів. За перорального прийому левоцетиризин швидко всмоктується; його зв’язування з білками плазми становить 95%, але обсяг розподілу низький (0,3 л/кг), що є суттєвою перевагою, яка детермінує ефективність і безпеку. Це пероральний АГЗ нового покоління з однією з найшвидших дій (табл. 5). Після всмоктування та розподілу левоцетиризин переважно концентрується на Н1-рецепторах клітинних мембран, а не всередині клітини [55]. Через обмежений метаболізм (<14%) фармакокінетика препарату практично не змінюється при супутньому застосуванні інших лікарських засобів. Левоцетиризин не пригнічує метаболізм печінкових ізоферментів і не взаємодіє з еритроміцином, азитроміцином, кетоконазолом, псевдоефедрином, теофіліном і циметидином [56]. Виводиться левоцетиризин переважно із сечею шляхом клубочкової фільтрації й активної канальцевої секреції; тому в пацієнтів із хронічною нирковою недостатністю рекомендовано подовжити час між дозами [33]. Протипоказань до призначення препарату небагато: індивідуальна непереносимість і термінальна стадія ниркової недостатності (кліренс креатиніну <10 мл/мл) або гемодіаліз [56].
Клінічні дослідження не виявили негативного впливу левоцетиризину на пильність, реакційні здібності або здатність керувати транспортними засобами після застосування однієї або кількох рекомендованих доз 5 мг на добу. Вивчення впливу левоцетиризину в дозі 5 мг і дифенгідраміну в дозі 50 мг на пам’ять, психомоторні здібності та настрій у 48 здорових добровольців (чоловіки/жінки 1:1) продемонструвало, що разова доза чи повторні дози левоцетиризину не впливали на пам’ять, увагу й моторику, тоді як димедрол спричиняв значне зниження уваги та моторики вже після першої дози [57]. Оцінка впливу на навички водіння в тій самій когорті не показала статистично значущих змін
у групі, яка отримувала левоцетиризин, порівняно з плацебо, на відміну від групи, яка отримувала дифенгідрамін [58]. Відсутність седативного ефекту підтверджено двома іншими подвійно сліпими плацебо-контрольованими клінічними дослідженнями, які оцінювали вплив на когнітивні та психомоторні функції в групах лікування левоцетиризином або АГЗ першого покоління (прометазин, дифенгідрамін) і нового покоління (цетиризин і лоратадин) [59, 60]. Потенційні седативні ефекти левоцетиризину оцінювалися в нещодавньому мета аналізі 48 досліджень, які загалом включали 18 014 учасників. Седативний ефект левоцетиризину був дещо вищим порівняно з плацебо (відносний ризик 1,67; 95% ДІ 1,17-2,38), але значно меншим, аніж у АГЗ першого покоління (середня різниця зміни часу реакції 250,76 секунди; 95% ДІ 162,98-338,53). Суттєвої різниці між седативними ефектами левоцетиризину й інших АГЗ нового покоління не виявлено [61].
Під час плацебо-контрольованого дослідження 6-тижневе лікування левоцетиризином у дозі 5 мг на день не призвело до появи значущих побічних ефектів. У групах левоцетиризину та плацебо повідомлення про принаймні одну побічну реакцію зафіксовано в практично однакової частки пацієнтів – 60,0 та 68,1% відповідно; випадків подовження інтервалу QT не було [62]. Відсутність кардіотоксичності або здатності подовжувати інтервали QT/QTc підтверджено в дослідженні за участю 52 здорових добровольців, яким проводили динамічний моніторинг електрокардіограми впродовж 24 годин після прийому левоцетиризину в дозах 5 і 30 мг [63]. Дослідження за участю 17 638 осіб підтвердило добру переносимість левоцетиризину з частотою легких-помірних побічних реакцій 1,6%; серед побічних реакцій були втома, головний біль, шлунково-кишкові розлади, запаморочення та сухість у роті [64].
Левоцетиризин – один із найширше досліджених Н1-антигістамінних препаратів щодо фармакологічних властивостей, безпеки й ефективності в дітей віком від 2 до 12 років. Це єдиний АГЗ, який не має клінічно значущих негативних впливів на результати рутинних лабораторних тестів, фізичний і психомоторний розвиток упродовж тривалого періоду застосування (18 місяців) у дітей віком від 1 до 3 років, схильних до алергічних захворювань. Наявні дані свідчать про те, що левоцетиризин підходить для лікування АР і хронічної індукованої кропив’янки в дітей віком від 6 місяців до 12 років [65].
Висновки
- АГЗ нового покоління рекомендовані як терапія першої лінії для пацієнтів з АР і кропив’янкою. Їх призначення при анафілаксії й алергічній астмі можна розглядати лише як допоміжну терапію для полегшення симптомів.
- Левоцетиризин, R-енантіомер цетиризину, має низку позитивних характеристик: швидкий початок дії, високу біодоступність, значну спорідненість до H1-рецепторів, обмежений розподіл, мінімальний метаболізм у печінці, відсутність взаємодії з іншими ліками та сприятливий профіль безпеки. Ефективність левоцетиризину в лікуванні АР і кропив’янки підтверджено якісними рандомізованими клінічними дослідженнями в дорослих і дітей. Окрім впливу на негайні прояви алергії, левоцетиризин успішно використовується для довгострокової терапії. У клінічно значущих концентраціях препарат демонструє протизапальну дію.
Серед препаратів левоцетиризину, які представлені на фармацевтичному ринку України, на особливу увагу заслуговує препарат L-Цет® виробництва компанії «Кусум Хелтхкер», який випускається у формі таблеток, що містять 5 мг левоцетиризину, та сиропу виробництва компанії ТОВ «Кусум Фарм», що містить 2,5 мг левоцетиризину на 5 мл. Такі форми випуску дають змогу застосовувати препарат для лікування дорослих і дітей. Виробництво L-Цет® відповідає світовим стандартам. Окрім цього, це один із найдоступніших препаратів левоцетиризину в Україні, що часто визначає прихильність пацієнтів до лікування.
Література
- Hill S.J., Baker J.G. Histaminergic system. In: Offermanns S., Rosenthal W. (eds). Encyclopedia of molecular pharmacology. Springer, 2008. Berlin, Heidelberg. doi: 10.1007/978-3-540-38918-7_74.
- Thangam E.B., Jemima E.A., Singh H., et al. The role of histamine and histamine receptors in mast cell-mediated allergy and inflammation: the hunt for new therapeutic targets. Front. Immunol. 2018; 9: 1873. doi: 10.3389/fimmu.2018.01873.
- Leurs R., Church M.K., Taglialatela M. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects. Clin. Exp. Allergy. 2002; 32 (4): 489-98. doi: 10.1046/j.0954-7894.2002.01314.x.
- Simons F.E., Simons K.J. Histamine and H1-antihistamines: celebrating a century of progress. J. Allergy Clin. Immunol. 2011; 128 (6): 1139-1150.e4. doi: 10.1016/j.jaci.2011.09.005.
- Olasińska-Wiśniewska A., Olasiński J., Grajek S. Cardiovascular safety of antihistamines. Postepy Dermatol. Alergol. 2014; 31 (3): 182-6. doi: 10.5114/pdia.2014.43191.
- Church M.K. Allergy, histamine and antihistamines. Handb. Exp. Pharmacol. 2017; 241: 321-331. doi: 10.1007/164_2016_85.
- Wise S.K., Lin S.Y., Toskala E., et al. International consensus statement on allergy and rhinology: allergic rhinitis. Int. Forum Allergy Rhinol. 2018; 8 (2): 108-352. doi: 10.1002/alr.22073.
- Fein M.N., Fischer D.A., O’Keefe A.W., Sussman G.L. CSACI position statement: newer generation H1-antihistamines are safer than first-generation H1-antihistamines and should be the first-line antihistamines for the treatment of allergic rhinitis and urticaria. Allergy Asthma Clin. Immunol. 2019; 15: 61. doi: 10.1186/s13223-019-0375-9.
- Keith P.K., Desrosiers M., Laister T., Schellenberg R.R., Waserman S. The burden of allergic rhinitis (AR) in Canada: perspectives of physicians and patients. Allergy Asthma Clin. Immunol. 2012; 8 (1): 7. doi: 10.1186/1710-1492-8-7.
- Ng A.E., Boersma P. Diagnosed allergic conditions in adults: United States, 2021. NCHS Data Brief. 2023; 460: 1-8.
- Bousquet J., Khaltaev N., Cruz A.A., et al.; World Health Organization; GA(2)LEN; AllerGen. Allergic Rhinitis and its Impact on Asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008; 63 Suppl. 86: 8-160. doi: 10.1111/j.1398-9995.2007.01620.x.
- Linton S., Hossenbaccus L., Ellis A.K. Evidence-based use of antihistamines for treatment of allergic conditions. Ann. Allergy Asthma Immunol. 2023; 131 (4): 412-420. doi: 10.1016/j.anai.2023.07.019.
- Zuberbier T., Bachert C., Bousquet P.J., et al. GA²LEN/EAACI pocket guide for allergen-specific immunotherapy for allergic rhinitis and asthma. Allergy. 2010; 65 (12): 1525-30. doi: 10.1111/j.1398-9995.2010.02474.x.
- Seidman M.D., Gurgel R.K., Lin S.Y., et al.; Guideline Otolaryngology Development Group. AAO-HNSF. Clinical practice guideline: allergic rhinitis. Otolaryngol. Head Neck Surg. 2015; 152 (1 Suppl.): S1-43. doi: 10.1177/0194599814561600.
- Dykewicz M.S., Wallace D.V., Amrol D.J., et al.; Joint Task Force on Practice Parameters; Dinakar C., Ellis A.K., Golden D.B.K.; Workgroup Contributors. Rhinitis 2020: a practice parameter update. J. Allergy Clin. Immunol. 2020; 146 (4): 721-767. doi: 10.1016/j.jaci.2020.07.007.
- Wise S.K., Damask C., Roland L.T., et al. International consensus statement on allergy and rhinology: allergic rhinitis – 2023. Int. Forum Allergy Rhinol. 2023; 13 (4): 293-859. doi: 10.1002/alr.23090.
- Leonardi A., Bogacka E., Fauquert J.L., et al. Ocular allergy: recognizing and diagnosing hypersensitivity disorders of the ocular surface. Allergy. 2012; 67 (11): 1327-37. doi: 10.1111/all.12009.
- Brozek J.L., Bousquet J., Baena-Cagnani C.E., et al.; Global Allergy and Asthma European Network; Grading of Recommendations Assessment, Development and Evaluation Working Group. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision. J. Allergy Clin. Immunol. 2010; 126 (3): 466-76. doi: 10.1016/j.jaci.2010.06.047.
- Bielory L., Lien K.W., Bigelsen S. Efficacy and tolerability of newer antihistamines in the treatment of allergic conjunctivitis. Drugs. 2005; 65 (2): 215-28. doi: 10.2165/00003495-200565020-00004.
- Abelson M.B., McLaughlin J.T., Gomes P.J. Antihistamines in ocular allergy: are they all created equal? Curr. Allergy Asthma Rep. 2011; 11 (3): 205-11. doi: 10.1007/s11882-011-0188-5.
- Zuberbier T., Abdul Latiff A.H., Abuzakouk M., et al. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022; 77 (3): 734-766. doi: 10.1111/all.15090.
- van den Elzen M.T., van Os-Medendorp H., van den Brink I., et al. Effectiveness and safety of antihistamines up to fourfold or higher in treatment of chronic spontaneous urticaria.Clin. Transl. Allergy. 2017; 7: 4. doi: 10.1186/s13601-017-0141-3.
- Xiao X., Xue P., Shi Y., et al. The efficacy and safety of high-dose nonsedating antihistamines in chronic spontaneous urticaria: a systematic review and meta-analysis of randomized clinical trials. BMC Pharmacol. Toxicol. 2023; 24 (1): 23. doi: 10.1186/s40360-023-00665-y.
- Ventura M.T., Cassano N., Romita P., et al. Management of chronic spontaneous urticaria in the elderly. Drugs Aging. 2015; 32 (4): 271-82. doi: 10.1007/s40266-015-0249-x.
- Kolkhir P., Giménez-Arnau A.M., Kulthanan K., et al. Urticaria. Nat. Rev. Dis. Primers. 2022; 8 (1): 61. doi: 10.1038/s41572-022-00389-z.
- Chinn D.J., Sheikh A. Epidemiology of anaphylaxis. In: Pawankar R., Holgate S.T., Rosenwasser L.J. (eds). Allergy frontiers: epigenetics, allergens and risk factors. Allergy Frontiers. 2009. Vol. 1. Springer, Tokyo. doi: 10.1007/978-4-431-72802-3_8.
- Shaker M.S., Wallace D.V., Golden D.B.K., et al.; Joint Task Force on Practice Parameters Reviewers. Anaphylaxis – a 2020 practice parameter update, systematic review, and Grading of Recommendations, Assessment, Development and Evaluation (GRADE) analysis. J. Allergy Clin. Immunol. 2020; 145 (4): 1082-1123. doi: 10.1016/j.jaci.2020.01.017.
- Fineman S.M. Optimal treatment of anaphylaxis: antihistamines versus epinephrine. Postgrad. Med. 2014; 126 (4): 73-81. doi: 10.3810/pgm.2014.07.2785.
- Yamauchi K., Ogasawara M. The role of histamine in the pathophysiology of asthma and the clinical efficacy of antihistamines in asthma therapy. Int. J. Mol. Sci. 2019; 20 (7): 1733. doi: 10.3390/ijms20071733.
- Levy M.L., Bacharier L.B., Bateman E., et al. Key recommendations for primary care from the 2022 Global Initiative for Asthma (GINA) update. NPJ Prim. Care Respir. Med. 2023; 33 (1): 7. doi: 10.1038/s41533-023-00330-1.
- Wang X.Y., Lim-Jurado M., Prepageran N., Tantilipikorn P., Wang de Y. Treatment of allergic rhinitis and urticaria: a review of the newest antihistamine drug bilastine. Ther. Clin. Risk Manag. 2016; 12: 585-97. doi: 10.2147/TCRM.S105189.
- Podder I., Dhabal A., Chakraborty S.S. Efficacy and safety of up-dosed second-generation antihistamines in uncontrolled chronic spontaneous urticaria: a review. J. Clin. Aesthet. Dermatol. 2023; 16 (3): 44-50.
- Nettis E., Calogiuri G.F., Di Leo E., et al. Once daily levocetirizine for the treatment of allergic rhinitis and chronic idiopathic urticaria. J. Asthma Allergy. 2008; 2: 17-23. doi: 10.2147/jaa.s3022.
- Gillard M., Van der Perren C., Moguilevsky N., et al. Major role for the carboxylic function of cetirizine and levocetirizine in their binding characteristics to human H1-histamine-receptors. Inflamm. Res. 2002; 51 Suppl. 1: S79-80. doi: 10.1007/pl00022458.
- Tillement J.P., Testa B., Brée F. Compared pharmacological characteristics in humans of racemic cetirizine and levocetirizine, two histamine H1-receptor antagonists. Biochem. Pharmacol. 2003; 66 (7): 1123-6. doi: 10.1016/s0006-2952(03)00558-6.
- Simons F.E. Advances in H1-antihistamines. N. Engl. J. Med. 2004; 351 (21): 2203-17. doi: 10.1056/NEJMra033121.
- Gillard M., Chatelain P. Changes in pH differently affect the binding properties of histamine H1 receptor antagonists. Eur. J. Pharmacol. 2006; 530 (3): 205-14. doi: 10.1016/j.ejphar.2005.11.051.
- Triggiani M., Gentile M., Secondo A., et al. Histamine induces exocytosis and IL-6 production from human lung macrophages through interaction with H1 receptors. J. Immunol. 2001; 166 (6): 4083-91. doi: 10.4049/jimmunol.166.6.4083.
- Thomson L., Blaylock M.G., Sexton D.W., et al. Cetirizine and levocetirizine inhibit eotaxin-induced eosinophil transendothelial migration through human dermal or lung microvascular endothelial cells. Clin. Exp. Allergy. 2002; 32 (8): 1187-92. doi: 10.1046/j.1365-2745.2002.01444.x.
- Hasala H., Janka-Junttila M., Moilanen E., Kankaanranta H. Levocetirizine and cytokine production and apoptosis of human eosinophils. Allergy Asthma Proc. 2007; 28 (5): 582-91.doi: 10.2500/aap2007.28.3045.
- Benedetti M.S., Plisnier M., Kaise J., et al. Absorption, distribution, metabolism and excretion of [14C]levocetirizine, the R enantiomer of cetirizine, in healthy volunteers. Eur. J. Clin. Pharmacol. 2001; 57 (8): 571-82. doi: 10.1007/s002280100364.
- Marshall G.D. Jr. Therapeutic options in allergic disease: antihistamines as systemic antiallergic agents. J. Allergy Clin. Immunol. 2000; 106 (5 Suppl.): S303-9. doi: 10.1067/mai.2000.110165.
- Mahmoud F., Arifhodzic N., Haines D., Novotney L. Levocetirizine modulates lymphocyte activation in patients with allergic rhinitis. J. Pharmacol. Sci. 2008; 108 (2): 149-56. doi: 10.1254/jphs.08037fp.
- Wang K.Y., Arima N., Higuchi S., Shimajiri S., Tanimoto A., Murata Y., Hamada T., Sasaguri Y. Switch of histamine receptor expression from H2 to H1 during differentiation of monocytes into macrophages. FEBS Lett. 2000; 473 (3): 345-8. doi: 10.1016/s0014-5793(00)01560-x.
- Triggiani M., Petraroli A., Loffredo S., et al. Differentiation of monocytes into macrophages induces the upregulation of histamine H1 receptor. J. Allergy Clin. Immunol. 2007; 119 (2): 472-81. doi: 10.1016/j.jaci.2006.09.027.
- Mösges R., König V., Köberlein J. The effectiveness of modern antihistamines for treatment of allergic rhinitis – an IPD meta-analysis of 140,853 patients. Allergol. Int. 2013; 62 (2): 215-22. doi: 10.2332/allergolint.12-OA-0486.
- Mösges R., König V., Köberlein J. The effectiveness of levocetirizine in comparison with loratadine in treatment of allergic rhinitis – a meta-analysis. Allergol. Int. 201; 60 (4): 541-6. doi: 10.2332/allergolint.10-OA-0300.
- Zuberbier T., Oanta A., Bogacka E., et al.; Bilastine International Working Group. Comparison of the efficacy and safety of bilastine 20 mg vs levocetirizine 5 mg for the treatment of chronic idiopathic urticaria: a multi-centre, double-blind, randomized, placebo-controlled study. Allergy. 2010; 65 (4): 516-28.doi: 10.1111/j.1398-9995.2009.02217.x.
- Prasad G., Thomas J., Mohan M., Murugan S., Sampath V., Buddhadeo S., Kulkarni U. Levocetirizine – one of the most effective antihistamines in urticaria. Int. J. Sci. Stud. 2021; 9 (2): 16-21.
- Schoepke N., Church M.K., Maurer M. The inhibition by levocetirizine and fexofenadine of the histamine-induced wheal and flare response in healthy Caucasian and Japanese volunteers. Acta Derm. Venereol. 2013 May; 93 (3): 286-93. doi: 10.2340/00015555-1490.
- Potter P.C., Kapp A., Maurer M., Guillet G., Jian A.M., Hauptmann P., Finlay A.Y. Comparison of the efficacy of levocetirizine 5 mg and desloratadine 5 mg in chronic idiopathic urticaria patients. Allergy. 2009 Apr; 64 (4): 596-604. doi: 10.1111/j.1398-9995.2008.01893.x.
- Anuradha P., Maiti R., Jyothirmai J., Mujeebuddin O., Anuradha M. Loratadine versus levocetirizine in chronic idiopathic urticaria: a comparative study of efficacy and safety. Indian J. Pharmacol. 2010 Feb; 42 (1): 12-6. doi: 10.4103/0253-7613.62399.
- Johnson M., Kwatra G., Badyal D.K., Thomas E.A. Levocetirizine and rupatadine in chronic idiopathic urticaria. Int. J. Dermatol. 2015; 54 (10): 1199-204. doi: 10.1111/ijd.12733.
- Cataldi M., Maurer M., Taglialatela M., Church M.K. Cardiac safety of second-generation H1-antihistamines when updosed in chronic spontaneous urticaria. Clin. Exp. Allergy. 2019; 49 (12): 1615-1623. doi: 10.1111/cea.13500.
- Tillement J.P. A low distribution volume as a determinant of efficacy and safety for histamine (H1) antagonists. Allergy. 1995; 50 (24 Suppl.): 12-6. doi: 10.1111/j.1398-9995.1995.tb04258.x.
- Levocetirizine Prescribing Information Medically reviewed by Drugs.com. Last updated on Oct 3, 2023. Available at: https://www.drugs.com/pro/levocetirizine.html.
- Verster J.C., Volkerts E.R., van Oosterwijck A.W., Aarab M., Bijtjes S.I., De Weert A.M., Eijken E.J., Verbaten M.N. Acute and subchronic effects of levocetirizine and diphenhydramine on memory functioning, psychomotor performance, and mood. J. Allergy Clin. Immunol. 2003; 111 (3): 623-7. doi: 10.1067/mai.2003.63.
- Verster J.C., de Weert A.M., Bijtjes S.I., et al. Driving ability after acute and sub-chronic administration of levocetirizine and diphenhydramine: a randomized, double-blind, placebo-controlled trial. Psychopharmacology (Berl.). 2003; 169 (1): 84-90. doi: 10.1007/s00213-003-1462-6.
- Hindmarch I., Johnson S., Meadows R., et al. The acute and sub-chronic effects of levocetirizine, cetirizine, loratadine, promethazine and placebo on cognitive function, psychomotor performance, and weal and flare. Curr. Med. Res. Opin. 2001; 17 (4): 241-55. doi: 10.1185/0300799019117011.
- Gandon J.M., Allain H. Lack of effect of single and repeated doses of levocetirizine, a new antihistamine drug, on cognitive and psychomotor functions in healthy volunteers. Br. J. Clin. Pharmacol. 2002; 54 (1): 51-8. doi: 10.1046/j.1365-2125.2002.01611.x.
- Snidvongs K., Seresirikachorn K., Khattiyawittayakun L., Chitsuthipakorn W. Sedative effects of levocetirizine: a systematic review and meta-analysis of randomized controlled studies. Drugs. 2017; 77 (2): 175-186. doi: 10.1007/s40265-016-0682-0.
- Potter P.C.; Study Group. Levocetirizine is effective for symptom relief including nasal congestion in adolescent and adult (PAR) sensitized to house dust mites. Allergy. 2003; 58 (9): 893-9. doi: 10.1034/j.1398-9995.2003.00171.x.
- Hulhoven R., Rosillon D., Letiexhe M., et al. Levocetirizine does not prolong the QT/QTc interval in healthy subjects: results from a thorough QT study. Eur. J. Clin. Pharmacol. 2007; 63 (11): 1011-7. doi: 10.1007/s00228-007-0366-5.
- Klimek L., Hundorf I. Levocetirizine in allergic diseases: an open multicentre practice study of efficacy and tolerability. Allergologie. 2002; 25: S1-S7.
- Pampura A.N., Papadopoulos N.G., Spičák V., Kurzawa R. Evidence for clinical safety, efficacy, and parent and physician perceptions of levocetirizine for the treatment of children with allergic disease. Int. Arch. Allergy Immunol. 2011; 155 (4): 367-78. doi: 10.1159/000321181.