Оцінка ефективності та переносимості монтелукасту натрію в базисній терапії пацієнтів із вірус-індукованою бронхіальною астмою
Автори: С.В. Зайков, доктор медичних наук, професор, Національний університет охорони здоров’я України ім. П.Л. Шупика (м. Київ). І.В. Гогунська, докторка медичних наук, професорка, ДУ «Інститут отоларингології ім. проф. О.С. Коломійченка НАМН України» (м. Київ). Т.Р. Уманець, докторка медичних наук, професорка, ДУ «Інститут педіатрії, акушерства і гінекології ім. акад. О.М. Лук’янової НАМН України» (м. Київ)
Бронхіальна астма (БА) традиційно належить до найважливіших медико-соціальних проблем у всіх країнах [22]. У світі сьогодні налічується 350 млн хворих на астму, а згідно з прогнозами фахівців до 2025 р.їх кількість може сягнути 400 млн [6, 11].
Незважаючи на наявність і доступність сучасних засобів терапії, що контролює БА, відсутність її контролю чи частковий контроль, на жаль, є звичним явищем серед пацієнтів з астмою в усьому світі [46]. З-поміж численних причин, що обмежують досягнення контролю, обтяжуючи перебіг астми (спричиняючи її загострення), виокремлюють респіраторні вірусні інфекції (РВІ) [24, 28, 32].
За даними епідеміологічних і клінічних досліджень, найпоширенішою причиною загострень БА у 85% випадків у дітей і 75% – у дорослих є гострі РВІ [63].
Загострення БА, що зумовлюються вірусами, зазвичай супроводжуються вираженішими респіраторними симптомами [12], оскільки РВІ порушують різні ланки локального захисту легень, негативно впливають на мукоциліарний кліренс, призводячи до посилення алергічного й інфекційного запалення, бактеріальної колонізації слизових оболонок і таким чином істотно збільшуючи ризик розвитку загострення астми [34]. Саме тому, незважаючи на досягнуті успіхи в лікуванні пацієнтів із БА, загострення цього захворювання трапляються досить часто та спричиняються вірусною інфекцією у 80-85% дітей і 60-75% дорослих [28, 32, 42, 70].
Асоціюються з розвитком загострення БА в дітей переважно риновіруси, респіраторно-синцитіальний вірус, метапневмовірус, віруси грипу та парагрипу, коронавіруси, адено- й бокавіруси. У дорослих і дітей старшого віку також найчастіше спричиняють загострення БА риновіруси (до 80% випадків), віруси грипу (близько 15%), ентеровіруси (4%), а також метапневмовірус і респіраторно-синцитіальний вірус (до 2% випадків усіх вірус-індукованих загострень захворювання). Також причиною посилення бронхообструкції при астмі можуть бути аденовіруси, віруси пара-грипу типів 1-3, коронавіруси [32, 56, 70, 72].
Дійсно, респіраторні віруси є вкрай важливими тригерами запалення дихальних шляхів, механізми якого в осіб із БА є складними. Респіраторний епітелій відіграє головну роль у реплікації вірусів як у верхніх, так і в нижніх дихальних шляхах, ступінь ураження котрого змінюється залежно від типу вірусу, а також активації вродженої противірусної імунної відповіді. Розвиток РВІ традиційно асоціюється з деструкцією бронхіального епітелію, підвищенням проникності слизової оболонки дихальних шляхів, порушеннями мукоциліарного транспорту та нейрогенною регуляцією тонусу гладкої мускулатури бронхів, посиленням продукції прозапальних цитокінів і додатковим розвитком гіперреактивності дихальних шляхів [53, 55, 57, 59]. При цьому РВІ не тільки є тригером загострення астми, але й негативно впливають на її подальшій перебіг, значно ускладнюючи та пролонгуючи його. У пацієнтів із БА на тлі РВІ спостерігають тяжчий ступінь порушення вентиляційної функції легень.
Окрім того, виявлено безпосередній зв’язок між РВІ та летальним результатом унаслідок загострення БА, зокрема в тих випадках, коли пацієнт не отримує необхідної терапії [31, 37].
Респіраторний епітелій є також головною детермінантою запальної відповіді з продукцією прозапальних цитокінів і хемокінів із залученням до запального процесу багатьох ефекторних клітин, зокрема еозинофілів (Еоз), базофілів, мастоцитів, нейтрофілів, дендритних клітин, моноцитів, макрофагів, Т- і В-лімфоцитів [54, 55]. Ці клітини також продукують певну кількість медіаторів запалення, результатом чого є його посилення та додаткове загострення алергічного запалення, пригнічення противірусної відповіді, яка в осіб із БА й так порушена внаслідок недостатньої продукції інтерферону (INFβ та INFλ) у відповідь на дію вірусних антигенів [20].
Окрім того, порушення противірусної імунної відповіді в пацієнтів з астмою можна пояснити дефіцитом CD56 bright (натуральних кілерів) клітин, які продукують INFγ й інтерлейкін-10, оскільки активація цих клітин пригнічує алергічне запалення та має противірусний ефект [23, 35, 47, 49]. Також слід зазначити, що респіраторні віруси підвищують чутливість пацієнтів з астмою й до бактеріальної інфекції, що може додатково призводити до інвазивних бактеріальних інфекцій дихальних шляхів й асоціюватися з низькими показниками легеневої функції, довшим періодом і більшою тяжкістю загострення астми, а також розвитком її ускладнень [56, 73].
Національні й міжнародні настанови рекомендують для осіб із БА та її загостреннями терапію, яка ґрунтується на використанні протизапальних препаратів, насамперед інгаляційних кортикостероїдів (ІКС) у поєднанні з бронхолітиками (інгаляційними β2-агоністами короткої або пролонгованої дії), теофілінами, модифікаторами лейкотрієнів тощо [7, 8, 22]. При цьому обсяг лікувальних заходів визначається лише ступенем тяжкості перебігу астми та її загострення, без урахування етіологічних чинників. Але за наявності інфекційної етіології, насамперед вірусної, загострення БА може пролонгувати лікування, знижувати його ефективність, зумовлювати виникнення ускладнень. Ці обставини потребують пошуку додаткових терапевтичних рішень щодо лікування хворих із вірус-індукованим загостренням астми [16].
Хоча механізми, що лежать в основі вірус-індукованих загострень БА, досі до кінця не встановлені, роль багатьох молекулярних факторів і запальних клітин у цьому процесі є безсумнівною [67]. Одними з найважливіших ефекторів запалення виступають цистеїнілові лейкотрієни, які зв’язуються з відповідними рецепторами CysLT1 і реалізують бронхоспазм, активацію виділення мокротиння, підвищення проникності судин, збільшення кількості Еоз. Показано, що під час спровокованих РВІ загострень БА кількість цистеїнілових лейкотрієнів у дихальних шляхах значно зростає [15, 21, 52]. Ефективно усунути вплив цистеїнілових лейкотрієнів на пацієнтів із БА й алергічним ринітом можливо завдяки використанню специфічних антагоністів їхніх рецепторів, зокрема монтелукасту. Саме ця група лікарських засобів здатна підсилити протизапальні ефекти ІКС, які не гальмують продукцію лейкотрієнів, і знижувати побічні ефекти останніх завдяки зменшенню їх кумулятивної дози [62].
У реальній клінічній практиці доведено, що селективний антагоніст лейкотрієнових рецепторів (АЛТР) монтелукаст запобігає вірус-індукованим загостренням БА в дітей і дорослих [5, 10, 33, 60]. За даними N. W. Johnston і співавт. (2007), додавання монтелукасту до комплексного лікування БА в дітей сприяло дворазовому зниженню кількості днів із симптомами астми порівняно з плацебо та значному зменшенню кількості незапланованих відвідувань лікаря з приводу БА (4 відвідування в групі монтелукасту проти 18 – у групі плацебо). Переваги монтелукасту було зафіксовано як у осіб, які вживали ІКС, так і в пацієнтів, які не лікувалися ними. Навіть короткий курс монтелукасту (в межах 7 днів), розпочатий одразу після появи симптомів РВІ чи ознак загострення БА, здатен зменшити кількість відвідувань лікаря та госпіталізацій, тривалість захворювання, застосування β-агоністів і пероральних кортикостероїдів (преднізолону) [5, 60].
Масштабне дослідження PREVIA продемонструвало, що монтелукаст запобігає вірус-індукованим загостренням БА в дітей віком 2-5 років з інтермітивною астмою. Спостереження за учасниками протягом 12 місяців дало змогу встановити, що в групі осіб, які приймали перорально монтелукаст (4 або 5 мг залежно від віку), відзначалося зменшення частоти загострень БА на 31,9% порівняно з групою осіб, які приймали плацебо. Середня кількість загострень на тлі прийому монтелукасту становила 1,6 епізоду на рік, натомість у разі застосування плацебо – 2,34 епізоду. Монтелукаст також відтерміновував час настання першого загострення астми та зменшував потребу пацієнтів у ІКС. Автори відзначили хорошу переносимість монтелукасту [10].
Подібні результати нещодавно отримали й O. Keskin і співавт. [36], які виявили, що порівняно з плацебо призначення монтелукасту дітям віком до 3 років дає змогу зменшити кількість днів без симптомів астми, вираженість у них свистячих хрипів, а також кількість інгаляцій сальбутамолу.
Поєднане застосування АЛТР та ІКС є дієвішим у лікуванні вірус-індукованих загострень, аніж монотерапія ІКС [50]. Метааналіз 11 рандомізованих контрольованих досліджень за участю 1097 дітей із кашльовим варіантом БА продемонстрував, що порівняно з монотерапією будесонідом призначення комбінації IКС і монтелукасту забезпечувало вищі показники відповіді на лікування, вираженіше зменшення частоти епізодів БА та покращення функції легень, у тому числі зростання об’єму форсованого видиху за першу секунду (ОФВ1). Частота побічних ефектів у групах монотерапії та комбінованого лікування не відрізнялася [71].
Терапія АЛТР асоціюється з меншою частотою виникнення симптомів РВІ не тільки в дітей з астмою, але й у дорослих із БА [29]. Автори цього дослідження встановили, що АЛТР достовірно зменшують частоту РВІ незалежно від уживання ІКС (0,3±0,7 випадку на рік у групі осіб, що приймали АЛТР, проти 1,6±4,2 випадку на рік у групі пацієнтів, які їх не приймали; р<0,05). У групі осіб, які лікувалися АЛТР, також фіксувалася достовірно менша частота загострень БА та випадків госпіталізації пацієнтів.
У дослідженні Н. Matsuse та співавт. [51] вивчався профілактичний вплив АЛТР на вірус-індуковані загострення БА. Критеріями РВІ виступала наявність щонайменше двох із таких симптомів: чхання, кашель, закладеність носа, гарячка (>38 °C); а критеріями загострення БА були посилення свистячих хрипів, відчуття стискання грудної клітки, задишка чи свистячі хрипи під час обстеження. Вірус-індуковані загострення БА визначались як поєднання симптомів РВІ та БА. При аналізі даних 321 учасника було з’ясовано, що в групі пацієнтів, які приймали АЛТР, у тому числі монтелукаст, виявлялося достовірно менше випадків як РВІ, так і загострень БА. Крім того, прийом АЛТР значно скорочував як тривалість РВІ, так і загострення астми. На підставі цього автори зробили висновок, що профілактика РВІ за допомогою АЛТР може бути ефективною тактикою в тих пацієнтів із БА, в яких у стабільній фазі хвороби визначається підвищений рівень лейкотрієнів у дихальних шляхах.
В іншому дослідженні ефективності монтелукасту в пацієнтів із БА після експериментальної інокуляції їм людського риновірусу-16 [40] узяли участь хворі з нетяжким перебігом БА. Аналіз вторинної кінцевої точки продемонстрував, що застосування монтелукасту здатне ефективно запобігати зменшенню показників функції легень і підвищенню вмісту Еоз у мокротинні пацієнтів із гострим респіраторним захворюванням на тлі вірусної інфекції. Крім того, в дослідженні in vitro доведено, що монтелукаст може впливати саме на нейтрофільне запалення за механізмом, який не пов’язаний із блокадою цистеїнілових лейкотрієнових рецепторів, завдяки неспецифічному інгібуванню циклічних нуклеотидних фосфодіестераз, результатом якого є цАМФ-залежне пригнічення прозапальної активності нейтрофілів [58].
Загалом монтелукаст є добре вивченим і найширше застосовуваним АЛТР у низці європейських і азійських країн [9, 27, 44]. Селективний АЛТР монтелукаст призначається для лікування БА, в тому числі її кашльового варіанта [14, 38, 64, 66], а також алергічного риніту в дорослих і дітей [43, 69]. Ефективність монтелукасту засвідчена багатьма світовими рекомендаціями, зокрема Ініціативи «Алергічний риніт і його вплив на астму» (ARIA) та Глобальної ініціативи з БА (GINA). Важливо також те, що монтелукаст не лише чинить негайну протизапальну та протиалергійну дії, але й запобігає ремоделюванню дихальних шляхів, як було підтверджено достовірним зниженням одного з маркерів такого ремоделювання – C-кінцевого пептиду проколагену 1-го типу. Монтелукасту властиві також плейотропні ефекти, як-от блокування Еоз-індукованої трансформації епітеліальних клітин у мезенхімальні, зменшення маси непосмугованої м’язової тканини дихальних шляхів, зниження рівнів прозапальних цитокінів у бронхіальному дереві, протидія фіброзу легень [26, 30, 39, 61].
Отже, АЛТР монтелукаст має широкий спектр фармакологічних властивостей, що дає йому змогу в пацієнтів із БА знижувати частоту виникнення РВІ та загострень астми. Виражене гальмування еозинофільного запалення в нижніх дихальних шляхах під дією монтелукасту зумовлює доцільність його застосування в профілактиці та лікуванні епізодів БА різного походження, в тому числі різноманітних сезонних загострень, опосередкованих як пилком рослин, так і РВІ [29, 45]. При цьому слід підкреслити, що основний масив доказових даних щодо ефективності та безпечності застосування монтелукасту натрію було отримано при використанні оригінального препарату Сингуляр.
Оскільки монтелукаст є перспективним препаратом для лікування пацієнтів із вірус-індукованими загостреннями БА, метою нашого дослідження стала оцінка ефективності та переносимості оригінального препарату монтелукасту натрію Сингуляр у пацієнтів із вірус-індукованою БА. Відповідно до мети було сформульовано такі завдання дослідження:
- Оцінити денні та нічні симптоми БА (кількість на тиждень) у пацієнтів із вірус-індукованою БА з додаванням до терапії Сингуляру з оцінкою лабораторних даних:
- показники функції зовнішнього дихання (ФЗД);
- концентрація фракційного оксиду азоту в повітрі, що видихається (FeNO);
- кількість Еоз у периферичній крові та концентрація еозинофільного катіонного білка (ЕКБ) у сироватці крові.
- Комплексна оцінка ефективності застосування Сингуляру (визначається наприкінці лікування) на підставі аналізу таких показників:
- частота випадків РВІ (за 6 місяців до лікування та за 6 місяців спостереження);
- тривалість епізоду РВІ;
- частота загострень БА (за 6 місяців до лікування та за 6 місяців спостереження);
- тривалість загострення БА;
- частота потреби в засобах «швидкої допомоги» (на тиждень на початку та наприкінці дослідження);
- частота потреби в системних кортикостероїдах (за 6 місяців до лікування та за 6 місяців спостереження);
- частота звернень у відділення невідкладної допомоги (за 6 місяців до лікування та за 6 місяців спостереження);
- частота госпіталізацій (за 6 місяців до лікування та за 6 місяців спостереження);
- значення ОФВ1 (на початку та наприкінці дослідження);
- значення пікової швидкості видиху – ПШВ (на початку та наприкінці дослідження);
- концентрація FeNO (на початку та наприкінці дослідження);
- кількість Еоз (на початку та наприкінці дослідження);
- концентрація ЕКБ (на початку та наприкінці
дослідження); - оцінка контролю БА до лікування з використанням Сингуляру та після (контрольований перебіг, частковий контроль, неконтрольований перебіг) – на початку та наприкінці дослідження.
- Комплексна оцінка переносимості Сингуляру (визначається наприкінці лікування) на підставі аналізу випадків небажаних проявів побічної дії препарату, змін у зв’язку із цим режиму терапії, а також оцінки переносимості лікування пацієнтом і лікарем.
Матеріали та методи
Це було спостережне одноцентрове відкрите проспективне дослідження пацієнтів із БА тривалістю 6 місяців, у яке увійшло 60 пацієнтів із вірус-індукованими загостреннями БА. Усі пацієнти отримали консультацію й амбулаторне лікування на клінічній базі кафедри фтизіатрії і пульмонології Національного університету охорони здоров’я України ім П.Л. Шупика, що розташована в ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф.Г. Яновського НАМН України» (м. Київ).
Дизайн дослідження:
- Група пацієнтів із вірус-індукованими загостреннями БА (n=30), які у складі базисної терапії отримували АЛТР (АЛТР+) Сингуляр, таблетки 10 мг 1 раз на день (вечірній прийом).
- Група пацієнтів із вірус-індукованими загостреннями БА (n=30), які отримували базисну терапію без включення АЛТР (АЛТР-).
- Ефективність і безпечність лікування пацієнтів із вірус-індукованою БА оцінювалася протягом 6 місяців на 4 візитах до лікаря таким чином: 1-й візит – рандомізація, включення пацієнта в дослідження; 2-й візит – через 1 місяць від початку спостереження; 3-й візит – через 3 місяці спостереження; 4-й візит – через 6 місяців спостереження.
Критерії включення в дослідження:
- ознайомлення пацієнта з протоколом дослідження та підписання ним форми поінформованої згоди на участь;
- вік пацієнта ≥18 років;
- діагноз БА, встановлений відповідно до критеріїв Наказу № 868 Міністерства охорони здоров’я (МОЗ) України від 08.10.2013 «Про затвердження та впровадження медико-технічних документів зі стандартизації медичної допомоги при БА» та поточної редакції міжнародної настанови GINA (2023), не менш ніж за 1 рік до початку дослідження;
- значення показника ОФВ1 <80% від належного;
- зворотність показника ОФВ1 у пробі з 400 мкг сальбутамолу ≥12% (або ≥200 мл);
- частково контрольований або неконтрольований перебіг БА: денні симптоми БА понад 2 рази на тиждень, нічні – понад 1 раз на 2 тижні; потреба в бронхолітиках швидкої дії понад 2 рази на тиждень, можливе обмеження фізичної активності внаслідок захворювання;
- перебування пацієнта на 2-4-му кроці лікування БА згідно з рекомендаціями GINA (2023);
- анамнестичний зв’язок попередніх загострень БА в пацієнта під час епідемії/спалаху РВІ;
- критерії РВІ: наявність щонайменше двох із таких симптомів, як чхання, кашель, закладеність носа, ринорея, біль у горлі, гарячка (>38 °C);
- критерії загострення БА: посилення свистячих хрипів, відчуття стискання грудної клітки, задишка чи свистячі хрипи під час обстеження;
- критерії РВІ-індукованих загострень БА: поєднання симптомів РВІ та БА.
Критерії виключення з дослідження:
- вагітність, період лактації;
- наявність у пацієнта інших захворювань легень, які могли би вплинути на результати дослідження;
- прийом системних кортикостероїдів, інших протизапальних препаратів, антибіотиків, противірусних засобів в останні 3 місяці перед початком дослідження;
- використання алергеноспецифічної імунотерапії, біологічної терапії в процесі дослідження;
- зміни в базисній терапії БА в останні 4 тижні перед початком дослідження;
- тяжкі неконтрольовані супутні захворювання серцево-судинної системи, печінки, нирок, неврологічні, психіатричні, алкоголізм, наркоманія;
- медикаментозна алергія на препарат, що досліджується, або його складові;
- відмова від участі в дослідженні;
- порушення режиму лікування;
- розвиток серйозної непередбачуваної побічної дії досліджуваного препарату.
Отже, відповідно до мети дослідження пацієнти були розподілені на дві репрезентативні групи: дослідження – 30 осіб, які отримували лише стандартну терапію (пацієнти групи АЛТР-), і порівняння – 30 осіб, які поряд зі стандартною терапією додатково отримували лікування АЛТР Сингуляр (пацієнти групи АЛТР+), таблетки 10 мг 1 раз на день (вечірній прийом). Діагноз БА встановлювався за загальноприйнятими критеріями згідно з Наказом МОЗ України № 868 від 08.10.2013 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при БА» [4]. Тяжкість і контрольованість БА визначено за критеріями, що ґрунтуються на міжнародних рекомендаціях (GINA, 2014) і наведені в Уніфікованому клінічному протоколі первинної, вторинної (спеціалізованої) медичної допомоги «Бронхіальна астма» й адаптованій клінічній настанові з БА [8, 22]. Усі пацієнти отримували стандартну терапію: базисну – ІКС (будесонід або флутиказон) у низьких або середніх дозах у комбінації з β2-агоністами (формотерол або салметерол) тривалої дії (БАТД) [22, 48, 68].
Серед обстежених обох груп дещо переважали жінки (56,7% проти 43,3% у групі дослідження та 60,0% проти 40,0% у групі порівняння). Середній вік обстежених в обох групах становив 38,92+7,51 та 41,43+8,34 року відповідно. Тривалість періоду від моменту встановлення діагнозу БА становила 11,45+5,32 року в групі дослідження та 13,16+4,91 року в групі порівняння. Серед супутніх захворювань у обстежених переважали хронічний риносинусит (у 16,7 та 33,3% осіб) і алергічний риніт (у 20,0 та 26,7% осіб), із метою лікування котрих пацієнти отримували назальні іригації сольовими розчинами й антигістамінні препарати. Ніколи не курили 56,7% осіб із групи дослідження та 50,0% осіб із групи порівняння, продовжують курити на момент дослідження 10,0 та 16,7% обстежених. Індекс курця людини в обстежених становив 13,82+3,74 пачка-року в групі дослідження та 11,26+3,63 пачка-року в групі порівняння. Переважна більшість пацієнтів в обох групах перебувала на 2-3-му кроці лікування БА (76,7 та 80,0% спостережень відповідно), інші обстежені (23,3 та 20,0% випадків) – на 4-му кроці. Частково контрольований перебіг БА мали 63,3% осіб із групи дослідження та 60,0% обстежених із групи порівняння, а неконтрольований її перебіг – 36,7 та 40,0% пацієнтів відповідно. Отже, за статево-віковим складом, тяжкістю перебігу, характером лікування до початку дослідження, рівнем контролю астми, індексом курця людини, супутньою патологією, тривалістю періоду встановлення діагнозу БА групи обстежених осіб були репрезентативними (p>0,05 для всіх випадків).
Результати лікування пацієнтів обох груп оцінювали за динамікою даних клініко-функціонального й лабораторного обстежень. Було враховано верифіковані діагнози та дані консультацій суміжних спеціалістів, наявні результати загальноклінічних, функціональних і лабораторних обстежень. Дослідження проведені за згодою хворих, а методика їх виконання відповідала перегляду Гельсінської декларації 1983 р. Протокол дослідження було схвалено локальною етичною комісією, учасники були ознайомлені з погоджувальним листом і підписали його при включенні в дослідження, структура якого відповідала офіційно прийнятій.
Усім пацієнтам виконувалася спірометрія з аналізом основних показників ФЗД, які характеризують наявність і вираженість бронхообструкції, а саме: форсованої життєвої ємності легень (ФЖЄЛ), ОФВ1, максимальної об’ємної швидкості видиху при 25%, 50%, 75% ЖЄЛ (FEV25, FEV50, FEV75), ПШВ. Дослідження проводилося зранку, після 12-14-годинної перерви в прийманні ліків із використанням апарату Master Screen PFT (SN 675125, 2008 р.) фірми Cardinal Health (Німеччина) [1, 2].
Концентрація FeNO визначалася неінвазивним методом за допомогою портативного пристрою NIOX VERO® FеNО. За норму була прийнята величина до 25 ppb. Визначення концентрації ЕКБ проводилося за допомогою хемілюмінесцентного імуноаналізу. Показники вважалися нормальними, якщо концентрація ЕКБ становила 0,2-24,0 нг/мл. Кількість Еоз у периферичній крові визначали традиційним методом і виражали у відсотках. За норму була прийнята така їх кількість, яка дорівнювала 0,5-5% усіх лейкоцитів у формулі крові.
Для моніторування перебігу астми хворі щодня заповнювали щоденники індивідуального спостереження [13, 25]. Враховувалися такі показники: задишка, нічні пробудження через симптоми БА, ранкова скутість (відчуття стискання в грудній клітці зранку), денні симптоми захворювання, загальний астмарахунок, додаткова потреба в короткотривалих β2-агоністах або комбінації будесонід/формотерол, а також побічна дія комбінації препаратів у вигляді шлунково-кишкових, шкірних проявів і симптомів загострення БА. Ступінь вираженості симптомів оцінювався пацієнтами за 5-бальною шкалою (GINA, 2002): 0 – відсутність симптомів; 1 – легкий ступінь прояву; 2, 3 – помірний; 4, 5 – виражений [25]. Також проводився облік числа збільшення використання дози β2-агоністів короткої дії або комбінації будесонід/формотерол за потреби, системних кортикостероїдів, загострень та їхньої тяжкості, в тому числі пов’язаних із РВІ, викликів швидкої медичної допомоги з приводу астми, госпіталізацій з її приводу за період спостереження та днів перебування хворого в стаціонарі [13].
Статистична обробка виконувалася за допомогою математичних і статистичних можливостей MS Excel із використанням методу дисперсійного аналізу, F-критерію, а також t-критерію Стьюдента. За рівень вірогідності приймалися значення показника вірогідності між групами (р), які дорівнювали або були меншими за 0,05 [3].
Результати та їх обговорення
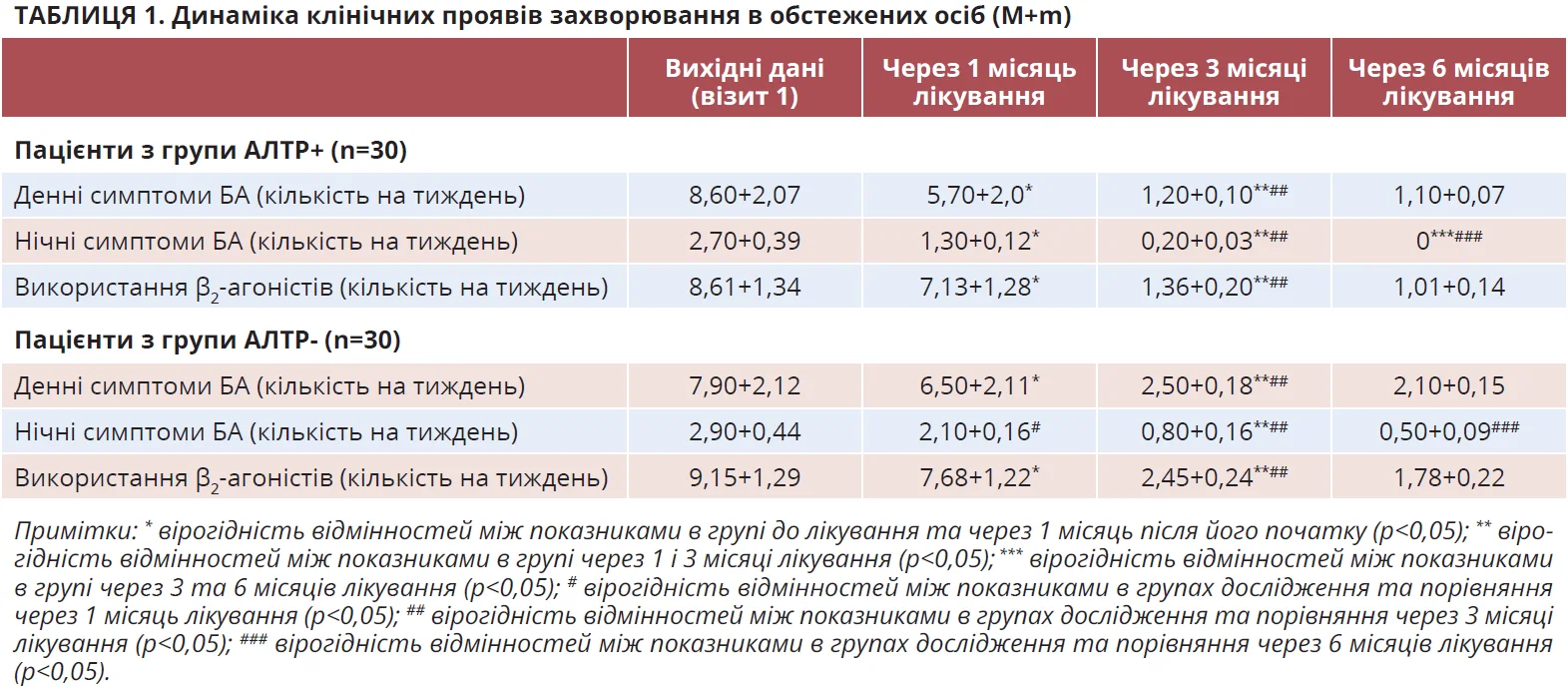
Важливим критерієм оцінки ефективності лікування пацієнтів із БА є оцінка основних її клінічних проявів, які дають змогу судити про наявність або відсутність контролю цього захворювання. Відповідні дані в динаміці спостереження наведено в таблиці 1.
Дані, наведені в таблиці 1, демонструють, що в обох групах терапія з використанням комбінації ІКС і БАТД із/без АЛТР виявила позитивну динаміку проявів астми в обстежених, що проявилося зниженням частоти денних і нічних симптомів астми, а також використання β2-агоністів на вимогу.
У процесі терапії пацієнтів обох груп позитивна динаміка клінічних проявів БА визначилася вже через 1 місяць, але в групі дослідження вона виявилася достовірно кращою за показником «нічні симптоми БА (кількість на тиждень)». Указана позитивна динаміка клінічних симптомів астми виявилася ще показовішою в обох групах обстежених через 3 та 6 місяців лікування, проведення котрого дало змогу досягти контролю над перебігом БА в переважної кількості пацієнтів. При цьому ефективнішим за оцінкою клінічної симптоматики виявилося лікування пацієнтів із групи дослідження через 3 місяці за всіма 3 критеріями, що оцінювалися, а через 6 місяців – за критерієм «нічні симптоми БА (кількість на тиждень)». Слід окремо зауважити, що на тлі лікування монтелукастом у осіб із групи дослідження більшою мірою, ніж у пацієнтів із групи порівняння, відбулася й регресія симптомів алергічного риніту.
Для об’єктивної оцінки ефективності обраних режимів терапії в обстежених пацієнтів було вивчено динамічні показники легеневої функції.
У всіх із них перед початком терапії відзначалися обструктивні порушення ФЗД (значення показника ОФВ1 <80% від належного) зі зворотним характером бронхообструкції (зворотність показника ОФВ1 у пробі з 400 мкг сальбутамолу ≥12%, або ≥200 мл), що характерно для перебігу БА в дорослих осіб молодого та середнього віку. Відповідні дані наведено в таблиці 2.
Дані, наведені в таблиці 2, також демонструють, що в обох групах обстежених проведена терапія з використанням комбінації ІКС із БАТД у поєднанні з АЛТР і без них виявила позитивну динаміку показників ФЗД. Через 1 місяць лікування вже простежувалася тенденція до покращення показників ФЗД в обох групах обстежених, причому достовірно кращою стала прохідність бронхів різного калібру за даними FEV75-50-25. Ця тенденція стала ще вираженішою через 3 та 6 місяців лікування пацієнті із БА. Причому якщо через 3 місяці терапії показники ФЗД у групі дослідження були потенційно кращі, то через 6 місяців спостереження ця тенденція стала ще вираженішою, особливо за показниками прохідності бронхів дрібного та середнього калібру за даними FEV75-50. Варто відзначити також той факт, що наприкінці 6-місячного курсу терапії вказані параметри ФЗД зберігалися на достатньо високому рівні, а деякі з них навіть демонстрували тенденцію до подальшого покращення. Важливо, що під впливом монтелукасту в обстежених зростала прохідність бронхів дрібного та середнього калібру більшою мірою, ніж в осіб у групі порівняння.
Отже, за результатами дослідження в динаміці клінічної симптоматики та вентиляційних показників у пацієнтів із вірус-індукованою астмою можна відзначити, що застосування монтелукасту в базовій терапії дає змогу надійно контролювати бронхіальну прохідність, а за рівнем дії на показники ФЗД він здатний потенційно посилювати відповідний ефект комбінації ІКС із БАТД. Функціональні показники легень зростали під впливом терапії монтелукастом уже після першого місяця його використання, досягаючи максимального значення через 3-6 місяців, і зберігалися на цьому рівні протягом подальшого спостереження.
Вимірювання концентрації FeNO відіграє важливу роль у дослідженні респіраторних симптомів за довготривалого кашлю невстановленого генезу, визначення еозинофільного фенотипу БА, оцінювання ефективності протизапальної терапії IКС, моніторингу динаміки стану пацієнта з персистивною БА, а також для визначення потреби в зміні дози протизапальних препаратів, для контролю за виконанням пацієнтом рекомендацій щодо лікування, оцінювання ступеня алергічного запалення при супутніх захворюваннях тощо; тому з 2011 р. вимірювання FeNO рекомендоване Американським торакальним товариством як складова діагностичного алгоритму при астмі [17, 74]. Рівень Еоз периферичної крові та концентрація ЕКБ також вважаються важливими маркерами алергічного запалення, що дають змогу непрямим шляхом оцінювати його тяжкість у разі БА, алергічного риніту, IgE-опосередкованого атопічного дерматиту. Зокрема, рівень ЕКБ корелює з клінічними симптомами астми та показниками функції дихання (спірометрія), даючи змогу оцінити ступінь запальних процесів у дихальних шляхах бронхіального дерева та корегувати лікування пацієнтів [18]. Результати вимірювання в обстежених осіб концентрації FeNO, а також кількості Еоз периферичної крові та концентрації ЕКБ сироватки крові наведено в таблиці 3.
Динаміка маркерів алергічного запалення (табл. 3) в осіб із БА під впливом лікування в обох групах обстежених мала односпрямований характер. У всіх пацієнтів простежувалися відсутність вірогідних змін умісту Еоз периферичної крові й поступове зниження показників концентрації FeNO та рівня ЕКБ сироватки крові вже через 1 місяць після початку дослідження. Через 3 та 6 місяців ця тенденція набула ще показовішого характеру, оскільки вказані показники або знизилися до норми, або наблизилися до неї. Проте вагоміший ефект на вказані показники мала терапія із застосуванням комбінації ІКС із БАТД і монтелукастом. Цей факт став особливо помітним через 3 місяці (за показниками FeNO й ЕКБ) і 6 місяців (за показником FeNO). Отже, швидша та вираженіша позитивна динаміка маркерів алергічного запалення спостерігалася на тлі використання ІКС у комбінації з БАТД і монте лукастом.
Важливе значення в оцінці результатів лікування пацієнтів із БА має оцінка ефективності лікування з боку пацієнта та лікаря, що проводилася за допомогою критеріїв, які наведені в таблиці 4. Слід зазначити, що переважна кількість пацієнтів в обох групах обстежених наприкінці дослідження, на їхню думку, почувалися набагато краще: 21 із 30 (70,0%) у групі дослідження та 17 із 30 (56,7%) у групі порівняння. Значно менше число пацієнтів почувалися ненабагато краще: 8 із 30 (26,7%) у групі дослідження та 11 із 30 (36,7%) у групі порівняння. Лише 1 пацієнт із групи дослідження та 2 особи з групи порівняння відзначили, що почуваються так, як було. При цьому жоден пацієнт з обох груп не став почуватися гірше або набагато гірше.
На думку ж лікарів, значне покращення відзначено у 23 із 30 (76,7%) осіб із групи дослідження та у 20 з 30 (66,7%) обстежених із групи порівняння. Незначне покращення стану відзначили лікарі в 6 з 30 (20,0%) осіб і в 7 з 30 (23,3%) пацієнтів відповідно. Стан «без змін» відзначено лише в 1 пацієнта з групи дослідження та в 3 осіб із групи порівняння. Незначне або значне погіршення стану обстежених не відзначено лікарями в жодному випадку. Отже, результати лікування в обох групах пацієнтів були подібними, але все ж таки простежувалася тенденція до кращих його результатів у групі осіб, що додатково отримували монтелукаст.
Наприкінці дослідження було проведено комплексну оцінку ефективності обох режимів терапії пацієнтів із вірус-індукованою БА, результати якої відображено в таблиці 5. При такій комплексній оцінці результатів лікування пацієнтів обох груп з’ясувалося, що обидва режими терапії були ефективними за клінічними, функціональними та лабораторними даними, але все ж таки додаткове призначення монтелукасту дало змогу досягти кращих результатів за такими показниками: частота випадків РВІ (зменшення у 2,8 раза в групі дослідження проти 1,4 раза в групі порівняння), частота загострень БА (зменшення у 2,5 раза проти 1,3 раза), частота госпіталізацій (зменшення з 5,32+0,45 до 0 проти з 6,13+0,53 до 2,13+0,34), результати вимірювання концентрації FeNO (зниження у 2,3 раза в групі дослідження проти 1,8 раза в групі порівняння). При цьому слід підкреслити, що в пацієнтів обох груп відзначено зменшення вираженості симптомів коморбідної патології – хронічного риносинуситу й алергічного риніту.
Оскільки однією з найважливіших цілей ведення пацієнта з БА є досягнення контролю захворювання, нами проведено його оцінку наприкінці періоду дослідження. Відповідні результати представлено в таблиці 6. Наведені в ній дані показують, що додавання до режиму терапії пацієнтів із вірус-індукованою БА монтелукасту дає змогу в більшому числі випадків досягти часткового й особливо повного контролю захворювання.
Важливе значення в оцінці результатів лікування пацієнтів із БА має оцінка не лише ефективності, але й переносимості з боку пацієнта та лікаря, що проводилася за допомогою критеріїв, які наведені в таблиці 7. Оцінка переносимості лікування пацієнтами обох груп з акцентом на переносимість саме монтелукасту була проведена за весь період дослідження та катамнестичного спостереження. Добра (дуже хороша) або задовільна (хороша) переносимість лікування, на думку пацієнтів, була у 28 з 30 (93,3%) осіб із групи дослідження та у 29 з 30 (96,7%) осіб із групи порівняння.
На думку лікарів, добра переносимість лікування була у 27 з 30 (90,0%) та у 28 з 30 (93,3%) пацієнтів відповідно. Побічні дії монтелукасту (тимчасові болі в животі в перші 1-2 дні лікування) відзначили лише 2 пацієнти, проте це не стало перешкодою для подальшого прийому препарату ними, оскільки надалі на такі прояви вони вже не скаржилися. Усі пацієнти відзначили простоту та зручність користування монтелукастом (пероральний прийом препарату 1 раз на день) порівняно з інгаляційними засобами, що забезпечило високий рівень комплаєнсу.
Слід зауважити, що отримані нами дані стосовно ефективності застосування монтелукасту натрію (оригінальний препарат Сингуляр) у лікуванні пацієнтів із вірус-індукованою БА загалом відповідають даним інших дослідників. Зокрема, в рандомізованому контрольованому дослідженні PREVIA доведено ефективність Сингуляру в зменшенні вірус-індукованих загострень БА в дітей 2-5 років [10]. Окрім того, порівняно з плацебо препарат дав змогу знизити в обстежених частоту використання ІКС на 39,8%, а системних кортикостероїдів – на 17,5%. У дослідженні MOSAIC за участю дітей із легкою астмою Сингуляр протягом 12 місяців продемонстрував таку саму ефективність, як й інгаляційний флутиказон, за клінічними даними та показниками легеневої функції [19]. У відкритому рандомізованому багатоцентровому дослідженні з порівняння ефективності інгаляційного будесоніду (суспензія 0,5 мг) і монтелукасту (Сингуляр 4 або 5 мг) у дітей раннього віку з легкою персистивною астмою протягом 52 тижнів показано зіставні результати терапії пацієнтів [65]. У багатоцентровому подвійному сліпому рандомізованому дослідженні в паралельних групах продемонстровано зіставні результати щодо позитивної дії на клінічну симптоматику БА в дітей при застосуванні Сингуляру й інгаляційного флутиказону протягом 3 місяців [41]. Подібні результати аналогічної, а за деякими показниками навіть вищої ефективності Сингуляру порівняно з інгаляційним флутиказоном щодо впливу на клінічні, функціональні та лабораторні показники дітей з астмою наведено в роботі О.М. Охотнікової [5].
Висновки
- Одними з найбільш значущих тригерів загострень астми та втрати її контролю є РВІ.
- Використання АЛТР монтелукасту завдяки впливу на лейкотрієновий шлях розвитку запалення дає змогу покращити клінічний перебіг, функцію легень, зменшити запалення в дихальних шляхах, частоту загострень астми й епізодів РВІ, потребу в β2-агоністах і системних кортикостероїдах.
- Монтелукаст особливо показаний у разі вірус-індукованих загострень астми, переважання нічних ознак хвороби, при астмі фізичного та психоемоційного навантаження, поєднанні цього захворювання з алергічним ринітом, ожирінням, тютюновою залежністю.
- У комбінації з ІКС монтелукаст дає змогу знизити їх дози, досягти в переважної кількості пацієнтів контролю астми та підтримувати його надалі.
- Монтелукаст за тривалого прийому демонструє не лише ефективність, але й добру переносимість.
Список літератури – в редакції.