Алергічний риніт і вагітність. Як діагностувати та лікувати? Розбір клінічного випадку
Автори: О.О. Наумова, кандидат медичних наук, Центр алергічних захворювань верхніх дихальних шляхів ДУ «Інститут отоларингології ім. О.С. Коломійченка НАМН України» (м. Київ). В.І. Опришко, доктор медичних наук, професор кафедри загальної та клінічної фармації Дніпровського державного медичного університету. А.В. Прохач, кандидат медичних наук, асистент кафедри онкології та медичної радіології Дніпровсього державного медичного університету, лікар-онколог першої кваліфікаційної категорії
На сьогодні алергічні захворювання є одними з найпоширеніших хвороб. Вони вражають від 18 до 30% жінок дітородного віку. У підлітковому віці спостерігається зсув ризику алергічних захворювань у бік жінок, хоча в дитинстві він вищий у чоловіків. Для діагностики алергії під час вагітності слід застосовувати переважно анамнестичне дослідження, а також тестування in vitro, тоді як шкірні або провокаційні тести варто відкласти до народження дитини. Лікування алергічного риніту (АР) під час вагітності не відрізняється від такого в загальній популяції. Уникнення тригерів є першим найважливішим кроком для лікування АР у вагітних. Основними засобами лікування є назальні кортикостероїди, пероральні антигістамінні препарати та їх комбінації.
На алергічні захворювання страждають від 18 до 30% жінок дітородного віку [1]. Близько 20% вагітних страждають на алергію, особливо на риніт і астму. Ці два стани часто присутні в однієї пацієнтки [2, 3]. Іншими захворюваннями, що часто ускладнюють вагітність, є алергічний кон’юнктивіт, гостра кропив’янка, анафілаксія, харчова алергія й алергія на ліки.
Найчастіше ми можемо діагностувати алергічні захворювання, зокрема АР, у жінок іще до вагітності, але можливий варіант, коли АР розвивається й під час вагітності, що накладає відбиток на його клінічний перебіг і зумовлює специфічні підходи до діагностики та лікування [4]. Оптимальне лікування цих розладів під час вагітності є життєво важливим для забезпечення добробуту матері й дитини.
Для докладнішого висвітлення діагностики та лікування АР у вагітних пропонуємо розібрати клінічний випадок.
До алергоцентру в серпні звернулася жінка 29 років на 6-му місяці вагітності зі скаргами на висипання на кшталт кропив’янки, які виникли в неї після того, як вона готувала варення із зелених волоських горіхів. Від початку серпня турбує закладеність носа. Під час ретельнішого збору анамнезу з’ясувалося, що цьогоріч вона сильно обмежила себе у фруктах, бо почала помічати, що з’явилися неприємні відчуття в роті (свербіж піднебіння, відчуття припухлості) після вживання персика.
З анамнезу захворювання
До вагітності симптоми АР були вже 3 роки й починалися в серпні у вигляді закладеності носа, нежитю, чхання. Виражені симптоми АР були також під час контакту з котами. Проходила обстеження в алергоцентрі у 2020 р., виявлено сенсибілізацію до амброзії й епідермісу котів. Пацієнтці запропоновано алергеноспецифічну імунотерапію, але вона відмовилася від лікування, оскільки планувала вагітність.
Цьогоріч, зі слів пацієнтки, вона перехворіла на початку вагітності в березні. Були рясні виділення й закладеність носа, проте вона не застосовувала жодних препаратів, оскільки це був 1-й місяць вагітності.
Діагностика алергії під час вагітності
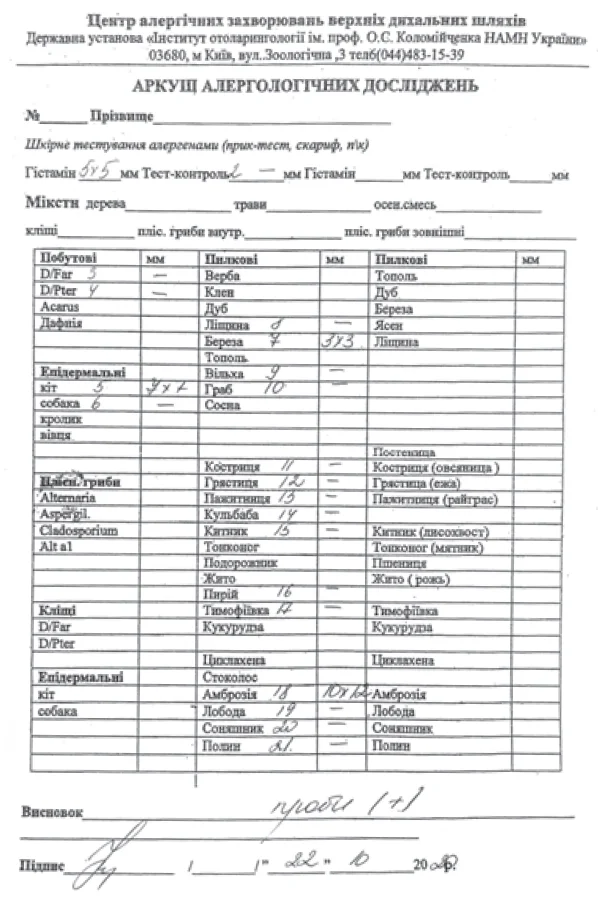
Діагностика АР під час вагітності має низку особливостей, оскільки не всі традиційні методи алергологічного обстеження можуть бути використані в повному обсязі. Вона може спиратися на дані анамнезу та фізикального обстеження. Проведення шкірних і провокаційних тестів із причинно-значущими алергенами протипоказано у зв’язку з можливістю розвитку системних проявів алергічної реакції. Як перший етап діагностики АР можна запропонувати проведення мікроскопії носового секрету (назоцитограма) для виявлення еозинофілії цих біологічних рідин. Провівши дослідження, ми підтвердили, що в нашої пацієнтки спостерігалося загострення АР, про що свідчив рівень еозинофілів у назоцитограмі – 56%.
Коли симптоми АР уперше проявляються під час вагітності, для виявлення спектра причинно-значущих алергенів ми можемо використовувати лабораторні методи специфічної алергодіагностики, як-от sIgE до конкретних алергенів, наприклад Immuno-CAP, або, якщо пацієнтка має полісенсибілізацію та прояви харчової алергії, можна запропонувати мультиплексний тест Immuno-CAP ISAC [5].
Попередній діагноз: гостра контактна кропив’янка, АР, загострення
Чи треба проводити подальшу діагностику алергії, чи достатньо призначити лікування й обстежити жінку вже після пологів?
З огляду на те що в пацієнтки розвинулася кропив’янка під час контакту з волоським горіхом, ми можемо припустити сенсибілізацію до білків PR-10 або до LTP-білків, які дають тяжкі алергічні реакції. Ідентифікація алергену може допомогти запобігти тим чи іншим потенційно небезпечним реакціям, які можуть негативно вплинути як на жінку, так і на плід. Зважаючи на те що сезон фруктів і овочів іще попереду й вагітній потрібно отримати достатню кількість вітамінів і мікроелементів для майбутньої дитини, ми маємо ретельніше підходити до призначення елімінаційної дієти в пацієнток такої категорії. Тому ми рекомендували жінці пройти молекулярну алергодіагностику. Пацієнтці було призначено Immuno-CAP ISAC (табл. 1).
У результаті проведеного дослідження в пацієнтки діагностовано сенсибілізацію до пилку дерев. Тобто ті симптоми, які турбували її на початку вагітності (березень), не були пов’язані з вірусною інфекцією, як думала пацієнтка, а були проявами сенсибілізації до пилку дерев.
Так само підтверджено сенсибілізацію до пилку бур’янів (амброзії, полину) й епідермісу тварин (кіт, собака) (табл. 2).
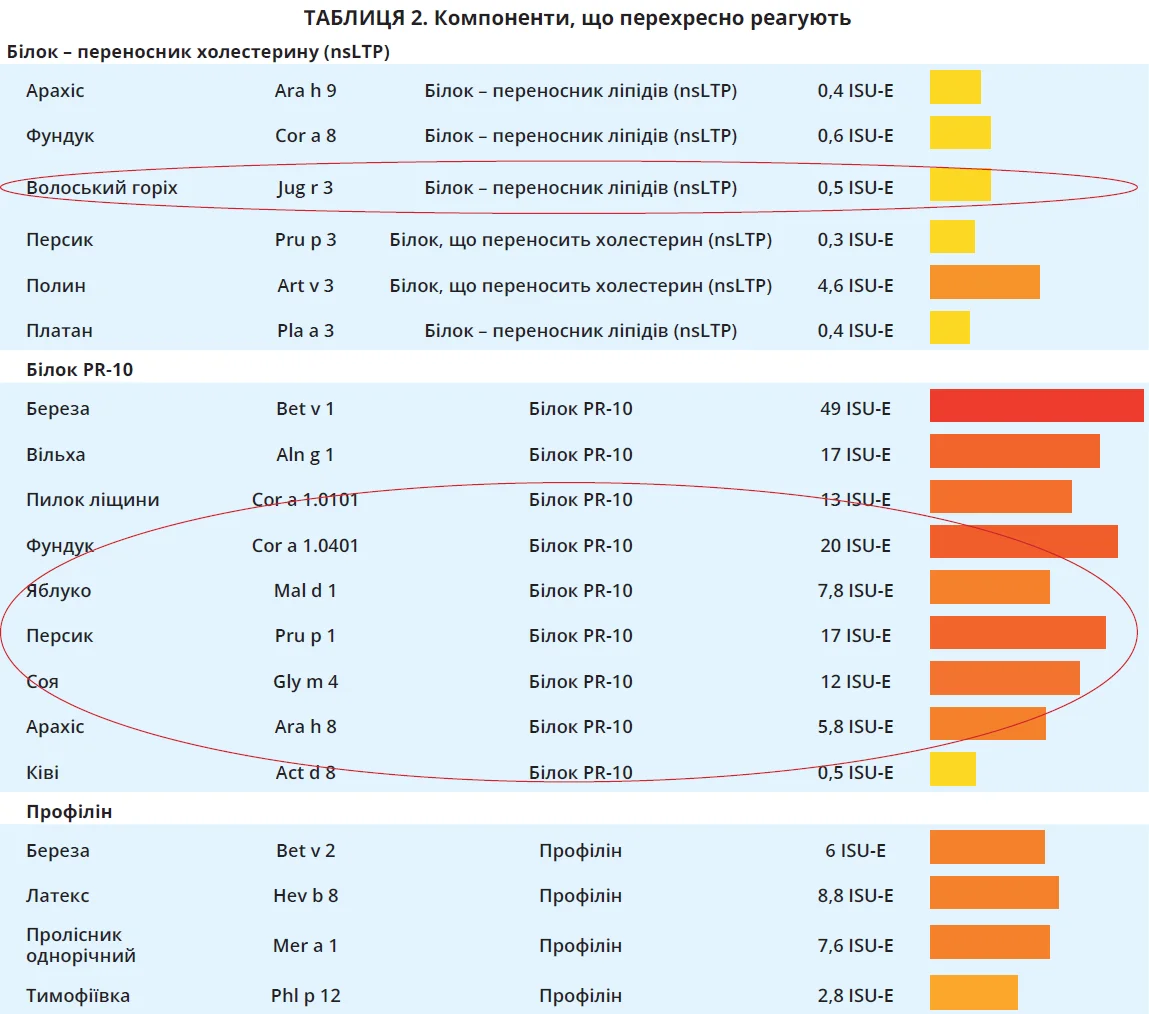
У пацієнтки діагностовано сенсибілізацію до Art v 3 (LTP-білків) полину, а також до LTP-білків горіхів, зокрема волоського. Саме ця сенсибілізація могла бути причиною розвитку кропив’янки в пацієнтки після того, як вона чистила зелений волоський горіх для варення.
Білки – переносники ліпідів (LTP) належать до стабільних паналергенів, стійкіх до нагрівання та розщеплення пепсином. Вони містяться в багатьох рослинних продуктах, як-от фрукти, овочі, зернові, арахіс, горіхи та насіння, а також у пилку (полин) [6].
Частота формування цієї сенсибілізації вища в населення південної частини Європи (38% в Італії) та знижується до 10% у північній Європі. Білки – переносники ліпідів (nsLTP) вважають головними алергенами персика (Рru p 3), яблука (Mai d 3) й абрикосів (Рru а 3) [7]. Сенсибілізація до nsLTP є надзвичайно варіабельною в своїх клінічних проявах, які можуть коливатися від легкої контактної кропив’янки до анафілаксії [8].
З анамнезу відомо, що після контакту із зеленим волоським горіхом у хворої розвинулася кропив’янка. В ISAC-тесті ми бачимо сенсибілізацію до Jug r 3 – LTP волоського горіха. Сенсибілізація до цього компонента волоського горіха може спричиняти виникнення контактної кропив’янки.
Крім того, LTPs також були запропоновані як основна причина харчової залежної анафілаксії, спричиненої фізичним навантаженням (FDEIA) [9].
Наявність кофакторів, як-от фізичні вправи, голодування та застосування нестероїдних протизапальних препаратів, може посилити клінічну значущість сенсибілізації до LTP [10].
Діагностика харчової алергії, пов’язаної із сенсибілізацією LTP, може бути особливо складною, враховуючи те що спектр рослинних продуктів надзвичайно широкий. У клінічній практиці це складний клінічний синдром, зумовлений спектром клінічної реактивності. Фактично пацієнти можуть реагувати на деякі рослинні продукти та переносити інші.
З іншого боку, спільна сенсибілізація до лабільних рослинно-харчових алергенів (родини PR-10 і профілінів) може зменшити тяжкість алергії на LTP [11].
Що ми й бачимо в нашої пацієнтки. Спільна сенсибілізація до PR-10 і профілінів може захистити її від розвитку тяжких алергічних реакцій.
Остаточний діагноз: інтермітивний АР, сенсибілізація до пилку дерев і бур’янів. Пилково-харчовий синдром – оральний алергічний синдром на яблуко, персик, горіхи. Гостра контактна кропив’янка, пов’язана із сенсибілізацією до волоського горіха.
Рекомендації: враховуючи анамнез, скарги та сенсибілізацію, ми рекомендували нашій пацієнтці уникати вживання горіхів і персика, а яблуко –тільки в запеченому вигляді. Для усунення симптомів кропив’янки й АР рекомендовано лоратадин (Кларитин®).
Чому ми призначили нашій пацієнтці Кларитин®?
Вибір антигістамінного препарату для лікування алергічних захворювань на тлі вагітності є непростим завданням, оскільки в цієї групи пацієнток препарат має бути досить ефективним, а також мати високий профіль безпеки. У цьому випадку значення принципу Non nocere стає абсолютним, тому що згідно зі статистичними даними в 1/3 немовлят спостерігаються різні несприятливі реакції організму в результаті лікування жінок під час вагітності [4].
На фармацевтичному ринку України представлено досить багато різних препаратів антигістамінної групи. Для лікування алергічних захворювань у вагітної рекомендується використовувати антигістамінні препарати II покоління, що відрізняються від препаратів I покоління менш вираженими седативним і холінергічним ефектами. Крім того, антигістамінні лікарські засоби II покоління характеризуються високим афінітетом і селективністю до HRH1 і після внутрішнього прийому швидко досягають пікової концентрації в тканинах [12, 13].
Призначаючи ці препарати вагітній, лікар має обрати серед них не просто ефективний для матері, а саме той, який буде найбезпечнішим для плода. У цій ситуації вагітній було рекомендовано приймати Кларитин® (лоратадин) по 10 мг 1 раз на день. За даними літератури, лоратадин – препарат, який має доведену ефективність у клінічних дослідженнях як у разі респіраторних алергічних захворювань [14], так і при алергодерматозах [15]. Він показав свою ефективність і безпеку при лікуванні таких захворювань, як АР, алергічний кон’юнктивіт, хронічна ідіопатична кропив’янка
й інші шкірні захворювання алергічного походження. Відомо, що в основі більшості випадків АР і алергічного кон’юнктивіту лежить алергічна реакція 1 типу, найчастіше IgE-залежна. У зв’язку із цим рекомендації щодо призначення блокаторів гістамінових H1-рецепторів за вказаної патології мають чітку патогенетичну основу [16].
Лоратадин є блокатором H1-гістамінових рецепторів тривалої дії, пригнічує вивільнення гістаміну та лейкотрієну С4 з опасистих клітин, запобігає розвитку й полегшує перебіг алергічних реакцій, має протиалергічну, протисвербіжну, протиексудативну дії, а також зменшує проникність капілярів, запобігає розвитку набряку тканин, знімає спазм гладкої мускулатури. Порівняльна характеристика лоратадину з іншими антигістамінними препаратами II покоління показала, що лоратадин відрізняється швидким проявом антигістамінного ефекту, достатньою тривалістю дії, не спричиняє збільшення маси тіла [17].
Препарат позбавлений антихолінергічної активності, не чинить кардіотоксичної дії. Показано, що навіть тривала (протягом 90 днів) терапія лоратадином дозами, які перевищують у 4 рази середні терапевтичні, не призводить до значного збільшення інтервалу QT на електрокардіограмі, появи синдрому піруету (torsade de pointes) – двоспрямованої веретеноподібної шлуночкової аритмії, яка може бути притаманна іншим антигістамінним препаратам [18].
Вік, порушення функції печінки, нирок, їжа не впливають на показники фармакокінетики лоратадину. Його застосування характеризується високим профілем безпеки: дуже рідко (<1/10 000) трапляються стомлюваність, головний біль, сухість у роті, нудота, серцебиття. Він не проникає крізь гематоенцефалічний бар’єр і не впливає на центральну нервову систему, не спричиняє сонливості, не впливає на швидкість психомоторних реакцій у разі застосування в рекомендованих дозах [19-23]. Не порушує виконання психометричних тестів і здавання стандартного іспиту з водіння на дорозі [24].
Тобто цей лікарський засіб не погіршуватиме якості життя при лікуванні алергії, що й було доведено в проспективному рандомізованому подвійному сліпому дослідженні, проведеному в Бразилії. У ньому брали участь 73 пацієнти віком від 18 до 63 років, з яких 36 отримували лоратадин 10 мг і 37 – біластин 20 мг 1 раз на добу протягом 10 днів [25]. Згідно з опитувальником (RQLQm), який застосовувався на початковому етапі та через 10 днів лікування, лоратадин значно покращував якість життя хворих на алергію, був ефективним і безпечним.
Безпеку застосування лоратадину у вагітних було підтверджено цілою низкою клінічних досліджень. Зокрема, дослідження, що включало 1769 вагітних, які приймали лоратадин, не виявило підвищеного ризику серйозних вад розвитку порівняно із загальною популяцією (Шведський медичний реєстр) [26]. Дослідження Motherisk, у якому вивчали результати вагітності в 161 жінки, які приймали лоратадин на-віть у першому триместрі вагітності, також підтвердило безпеку цього препарату для плода [27]. Інше дослідження, під час якого порівнювалася група з 210 вагітних, які приймали лоратадин, із групою з 267 жінок, які приймали інші антигістамінні препарати, та групою контролю з 929 жінок, також не виявило негативних ефектів лоратадину [28].
Водночас аналіз Шведського медичного реєстру показав підвищений ризик виникнення гіпоспадії в хлопчиків [29]. Однак ці дані не було підтверджено подальшими дослідженнями [30, 31].
Докладний метааналіз, проведений у 2008 р., не підтвердив зв’язку між лоратадином і виникненням гіпоспадії [32]. Метою метааналізу була оцінка кореляції прийому лоратадину вагітними з ризиком розвитку гіпоспадії в потомства. Дослідники вивчили статті, опубліковані в період із січня 1989 р.
по серпень 2007 р. Пошук здійснювали в базах даних MEDLINE, Ovid, Embase, Scopus та ін. Серед 1402 потенційно відповідних заголовків статей автори знайшли 3 публікації досліджень «випадок – контроль» і 7 когортних досліджень, у яких повідомлялося про випадки гіпоспадії або інших уроджених вад розвитку в потомства жінок, які приймали під час вагітності лоратадин; було включено дані про 453 053 новонароджених хлопчиків у Бразилії, Канаді, Данії, Ізраїлі, Італії, Швеції, Великій Британії та США. Показано, що з 2694 немовлят чоловічої статі, що народилися в жінок, які приймали лоратадин, лише в 39 (1,4%) відзначалася гіпоспадія. Водночас із 450 413 немовлят чоловічої статі, що народилися в жінок, які не приймали лоратадин, гіпоспадія реєструвалася в 4231 (0,9%). Потрібно зазначити, що при цьому було недосить даних для визначення тяжкості випадків гіпоспадії й дослідження не контролювали взаємопов’язані змінні (наприклад, сімейний анамнез гіпоспадії або вік матері). Отже, цей метааналіз показав, що застосування лоратадину в період вагітності не призводить до значного збільшення ризику виникнення гіпоспадії в потомства чоловічої статі [32].
Для виявлення та порівняння ризиків розвитку гіпоспадії на тлі прийому різних антигістамінних препаратів, у тому числі лоратадину, під час вагітності було проведено популяційне дослідження типу «випадок – контроль» у чотирьох округах Данії, на які припадає 30% населення цієї країни (приблизно 1,6 млн). Було ідентифіковано 227 випадків гіпоспадії на тлі прийому різних антигістамінних препаратів і 2270 випадків у жінок, які ці препарати не отримували (контроль). Потрібно зауважити, що скорегований коефіцієнт шансів (OR) для гіпоспадії серед користувачок лоратадину порівняно з тими, хто його не застосовував, становив 1,4 (95% довірчий інтервал 0,2-11,2), а відповідний OR для інших антигістамінних препаратів становив 1,9 (95% довірчий інтервал 0,7-5,7). Було зроблено висновок, що прийом лоратадину вагітними не був пов’язаний із підвищеним ризиком гіпоспадії порівняно з іншими антигістамінними препаратами [33]. Крім того, проспективне дослідження, проведене у 2003 р.
з використанням даних із чотирьох країн, показало, що жодне немовля, народжене від жінок, які приймали лоратадин під час вагітності, не мало гіпоспадії [27].
Дуже важливим є також те, що згідно з даними мультицентрового дослідження застосування лоратадину (Кларитин®) навіть під час першого триместру не пов’язане з ризиком серйозних вад розвитку [27].
Відповідно до класифікації Управління з контролю продовольства та медикаментів США (FDA) цей препарат належить до категорії В та визнаний безпечним для використання під час вагітності [34].
За даними Національної служби охорони здоров’я Великої Британії (NHS), Американської колегії акушерів і гінекологів (ACOG), Королівського жіночого госпіталя Австралії, лоратадин (Кларитин®) можна застосовувати при вагітності [35-37]. Як неседативний антигістамінний препарат лоратадин (Кларитин®) є одним із найбажаніших препаратів для лікування алергії під час вагітності [38].
Отже, достатня активність, тривалість антигістамінної дії, хороші фармакокінетичні властивості, відсутність серйозних побічних ефектів і профіль співвідношення «користь/ризик» лоратадину (Кларитин®) дають змогу рекомендувати його при лікуванні алергічних захворювань у вагітних. Використання цього препарату в пацієнтки з АР і контактною кропив’янкою під час вагітності дало можливість домогтися повного усунення алергічних проявів захворювання та значно покращити якість її життя.
Література
- Incaudo G.A. Diagnosis and treatment of allergic rhinitis and sinusitis during pregnancy and lactation. Clinical Reviews in Allergy & Immunology. 2004; 27 (2): 159-177.
- Pali-Schöll I., Namazy J., Jensen-Jarolim E. Allergic diseases and asthma in pregnancy. World Allergy Organization, Allergic Diseases Resource Center, Updated 2016.
- Bousquet J., Schunemann H.J., Samolinski B., Demoly P., Baena-Cagnani C.E., Bachert C., et al. Allergic Rhinitis and its Impact on Asthma (ARIA): achievements in 10 years and future needs. J. Allergy Clin. Immunol. 2012; 130 (5): 1049-62. doi: 10.1016/j.jaci.2012.07.053.
- Зайков С.В., Михальчук Н.А. Рациональная терапия аллергических заболеваний у беременных. Клінічна імунологія. Алергологія. Інфектологія. 2008: 3/1. Спецвипуск. – С. 54-60.
- Simons F.E.R., Schatz M. Anaphylaxis during pregnancy. Journal of Allergy and Clinical Immunology. 2012; 130 (3): 597-606.
- Asero R., Pravettoni V. Anaphylaxis to plant-foods and pollen allergens in patients with lipid transfer protein syndrome. Curr. Opin. Allergy Clin. Immunol. 2013; 13: 379-385.
- Наумова О. Прогностичне значення визначення сенсибілізації до білків-переносників ліпідів у пацієнтів із сезонним алергічним ринітом. Патологія. 2015; 2 (34).
- Skypala I.J. The diagnosis and management of allergic reactions in patients sensitized to non-specific lipid transfer proteins. Allergy. 2021; 76: 2433-2446.
- Romano A., Scala E., Rumi G., Gaeta F., Caruso C., Alonzi C., et al. Lipid transfer proteins: the most frequent sensitizer in Italian subjects with food-dependent exercise-induced anaphylaxis. Clin. Exp. Allergy. 2012; 42: 1643-1653.
- Arena A. Anaphylaxis to apple: is fasting a risk factor for LTP-allergic patients? Eur. Ann. Allergy Clin. Immunol. 2010; 42: 155-158.
- Pastorello E.A., Farioli L., Pravettoni V., Scibilia J., Mascheri A., Borgonovo L., et al. Pru p 3-sensitised Italian peach-allergic patients are less likely to develop severe symptoms when also presenting IgE antibodies to Pru p 1 and Pru p 4. Int. Arch. Allergy Immunol. 2011; 156: 362-372.
- Camelo-Nunes I.C. New antihistamines: a critical view. J. Pediatr. (Rio J). 2006; vol. 82, № 5 (Suppl.): S173-S180.
- Опришко В.І., Прохач Г.В., Курт-Аметова Г.С. Особливості клінічної фармакології у вагітних і безпека застосування у них антигістамінних препаратів. AllergyPractice. 2023; 3: 14-32.
- Kaiser H.B., Gopalan G., Chung W. Loratadine provides early symptom control in seasonal allergic rhinitis. Allergy Asthma Proc. 2008; 29 (6): 654-8.
- Roman I.J., Kassem N., Gural R.P., et al. Suppression of histamine-induced wheal response by loratadine (SCH 29851) over 28 days in man. Ann. Allergy. 1986; 57: 253-256.
- Bousquet J., Schünemann H.J., Togias A., Bachert C., Erhola M., Hellings P.W. Next-generation Allergic Rhinitis and Its Impact on Asthma (ARIA) guidelines for allergic rhinitis based on Grading of Recommendations Assessment, Development and Evaluation (GRADE) and real-world evidence. J. Allergy Clin. Immunol. 2020; 145 (1): 70-80.
- Абатуров А.Е. Лоратадин – антигистаминное средство II поколения. Здоровье ребенка. 2008: 3 (12).
- Dаvila I., Sastre J., Bartra J., del Cuvillo A., Jаuregui I., Montoro J., Mullol J., Valero A.L. Effect of H1 antihistamines upon the cardiovascular system. J. Investig. Allergol. Clin. Immunol. 2006; vol. 16, suppl. 1: 13-23.
- Salmun L.M., Gates D., Schati M., Greiding L., Ramon F., Heithoff K. Loratadine versus cetirizine: assessment of somnolence and motivation during the workday. Сlincal Therapevtics. 2000; vol. 22, No. 5.
- Bradley C.M., Nicholson A.N. Studies on the central effects of the H1-antagonist, loratadine. Eur. J. Clin. Pharmacol. 1987; 32: 419-421.
- Hindmarch I., Johnson S., Meadows R., Kirkpatrick T., Shamsi Z. The acute and sub-chronic effects of levocetirizine, cetirizine, loratadine, promethazine and placebo on cognitive function, psychomotor performance, and weal and flare. Curr. Med. Res. Opin. 2001; 17: 241-255.
- Hindmarch I., Shamsi Z., Stanley N., Fairweather D.B. A doubleblind, placebo-controlled investigation of the effects of fexofenadine, loratadine and promethazine on cognitive and psychomotor function. Br. J. Clin. Pharmacol. 1999; 48: 200-206.
- Kay G.G., Berman B., Mockoviak S.H., Morris C.E., Reeves D., Starbuck V., Sukenik E., Harris A.G. Initial and steady-state effects of diphenhydramine and loratadine on sedation, cognition, mood, and psychomotor performance. Arch. Intern. Med. 1997; 157: 2350-2356.
- Ramaekers J.G., Uiterwijk M.M.C., O’Hanlon J.E. Effects of loratadine and cetirizine on actual driving and psychometric test performance, and EEG during driving. Eur. J. Clin. Pharmacol. 1992; 42: 363-369.
- Locks R.B., Santos K.J. Quality of life in patients with allergic rhinitis: a clinical trial comparing the use of bilastine versus loratadine. Clin. Otolaryngol. 2017; 42: 218-224.
- Kаllеn B. Use of antihistamine drugs in early pregnancy and delivery outcome. J. Matern. Fetal. Neonatal. Med. 2002; 11 (3): 146-52.
- Moretti M.E., Caprara D., Coutinho C.J., Bar-Oz B., Berkovitch M., Addis A., et al. Fetal safety of loratadine use in the first trimester of pregnancy: a multicentre study. J. Allergy Clin. Immunol. 2003; 111 (3): 479-83.
- Diav-Citrin O., Shechtman S., Aharonovich A., Moerman L., Arnon J., Wajnberg R., et al. Pregnancy outcome after gestational exposure to loratadine or antihistamines: a prospective controlled study. J. Allergy Clin. Immunol. 2003; 111 (6): 1239-43.
- Kallen B., Olausson P.O. Monitoring of maternal drug use and infant congenital malforma tions. Does loratadine cause hypospadias? Int. J. Risk Saf. Med. 2001; 14: 115-9.
- So M., Bozzo P., Inoue M., Einarson A. Safety of antihistamines during pregnancy and lactation. Canadian Family Physician. 2010; 56: 427-9.
- Gilboa S.M., Strickland M.J., Olshan A.F., Werler M.M., Correa A., National Birth Defects Prevention Study. Use of antihistamine medications during early pregnancy and isolated major malformations. Birth Defects Res. A Clin. Mol. Teratol. 2009; 85 (2): 137-50.
- Schwarz E.B., Moretti M.E., Nayak S., Koren G. Risk of hypospadias in offspring of women using loratadine during pregnancy: a systematic review and metaanalysis. Drug Saf. 2008; 31 (9): 775-88.
- Maternal use of loratadine during pregnancy and risk of hypospadias in offspring. Int. J. Med. Sci. 2006; 3 (1): 21-5.
- Yau W.P., Mitchell A.A., Lin K.J., et al. Use of decongestants during pregnancy and the risk of birth defects. Am. J. Epidemiol. 2013; 178: 198. DOI: 10.1093/aje/kws427.
- https://www.acog.org/womens-health/experts-and-stories/ask-acog/what-medicine-can-i-take-for-allergies-while-im-pregnant
- https://www.thewomens.org.au/images/uploads/fact-sheets/Medicines-in-pregnancy-171018.pdf
- https://www.nhs.uk/medicines/loratadine
- Tırmıkсıoglu Z. Pharmacological treatment of asthma and allergic diseases in pregnancy. J. Surg. Med. 2022; 6 (2): 213-217. DOI: 10.28982/josam.964092.