Роль дієтичних чинників у виникненні астми
Переклала й адаптувала канд. мед. наук Ольга Королюк
Астма – це захворювання з гетерогенними фенотипами, спричинене поєднаним впливом генетичних і зовнішніх чинників. Її поширеність стрімко зростає в більшості країн світу, що пояснюється дією саме зовнішніх модифікованих факторів, вплив на які створює можливості первинної профілактики.
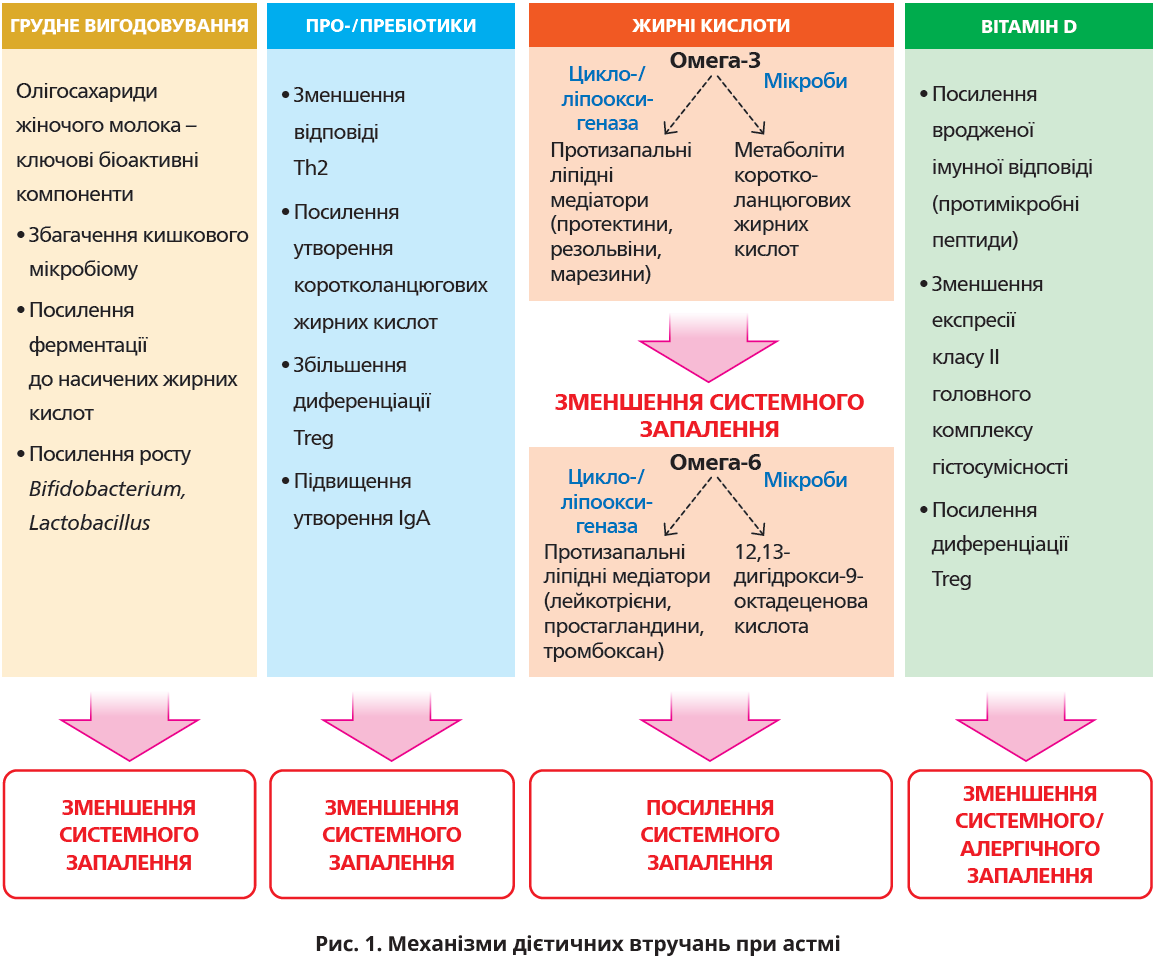
Значний інтерес становлять дієтичні втручання, котрі можна впроваджувати на популяційному рівні. До потенційних механізмів модифікаційного впливу відносять зменшення системного й алергічного запалення та нормалізацію мікробіому (рис. 1).
Цей огляд описує впливи дієтичних втручань на патофізіологію астми, оцінює докази клінічних досліджень, які вивчали зв’язки харчових чинників із виникненням хвороби, коментує методологічні проблеми оцінки та порівнює настанови й рекомендації різних організацій, щоб допомогти лікарям-практикам покращити догляд за пацієнтами.
Дієтичні чинники
Грудне вигодовування
Грудне молоко – це джерело енергії та живлення впродовж перших місяців життя. Крім основних нутрієнтів і мікроелементів, воно містить біоактивні речовини – імуноглобуліни (Ig), протизапальні цитокіни, фактори росту, гормони тощо. Важливим компонентом олігосахаридів грудного молока є неперетравлюваний цукор 2’-фукозиллактоза, що модулює імунну систему, сприяє збагаченню кишкової мікробіоти та протидіє адгезії патогенів. У кишківнику олігосахариди ферментуються в коротколанцюгові жирні кислоти (ЖК) – ацетат, бутират і пропіонат, які посилюють ріст Bifidobacterium і Lactobacillus, сприяють розвитку регуляторних Т-клітин (Treg), індукують утворення IgA та зменшують запалення.
Рандомізація до виключно грудного вигодовування проблематична через автономність немовлят і право вибору матері. Отже, довести ефект лікування в рандомізованому контрольованому дослідженні (РКД) доволі складно. У літературі описано лише 2 тривалі спостереження за результатами 1 РКД. Втручання заохочувало тривале виключно грудне вигодовування, чого не проводилося в групі порівняння; кінцевим результатом було виникнення астми в дитини в будь-якому віці, про що повідомляли учасниці. Суттєвих відмінностей у відносному впливі на кінцевий результат у віці 6,5 та 11,5 років не виявлено (відношення шансів (ВШ) 1,20; 95% довірчий інтервал (ДІ) 0,70-1,90 проти 0,76; 0,47-1,23 відповідно). Проте ці дослідження мали низку обмежень: неможливість сліпої оцінки учасників щодо кінцевого результату, опосередкованість обох втручань, проблематичність кількісної оцінки грудного вигодовування, нестандартизований кінцевий результат, оскільки про астму повідомляли опікуни (докладний щоденник симптомів або документально підтверджений лікарський діагноз не вимагалися). Тобто ці дослідження відповідають дуже низькому рівню доказів.
За останнє десятиліття опубліковано 4 систематичні огляди з метааналізами, присвячені цій тематиці. Останній огляд значною мірою збігається з попередніми за включеними дослідженнями, але має суворіші критерії включення щодо їхньої методологічної якості. Метааналіз включав лише когортні дослідження, де результатом була астма, встановлена фахівцем. Грудне вигодовування як таке не показало суттєвої зворотної асоціації з астмою (ВШ 0,87; 95% ДІ 0,72-1,04; I2=76%) серед 89 861 діади мати – немовля у 18 дослідженнях; але виключно грудне вигодовування серед 30 587 діад мати – немовля в 17 дослідженнях і переважно грудне вигодовування серед 116 649 діад мати – немовля в 36 дослідженнях показало значущі зворотні зв’язки (0,81; 0,72-0,91; 44,0% та 0,84; 0,75-0,93; 62,4% відповідно). Аналіз підгруп 12 досліджень показав, що зворотний зв’язок між грудним вигодовуванням і виникненням астми стає невизначеним після 7 років.
Два обсерваційні когортні дослідження вивчали вплив грудного вигодовування на виникнення астми в дітей із високим ризиком. Проспективне когортне дослідження серед 624 діад мати – немовля (матері мали встановлену фахівцем астму) виявило, що грудне вигодовування понад 6 місяців було в значущій оберненій кореляції з ризиком появи хрипів у віці до 6 місяців (корегований відносний ризик 0,54; 95% ДІ 0,30-0,96). Зв’язок між меншою тривалістю грудного вигодовування та хрипами у віці до 12 місяців не був значущим. Утім, це дослідження було відкритим нерандомізованим, а кінцевий результат не був специфічним – про хрипи / свистяче дихання повідомляли опікуни. Нещодавнє австралійське когортне дослідження HealthNuts серед міського населення за участю 5276 діад мати – немовля вивчало, чи впливає захворюваність на екзему впродовж першого року життя на зв’язок між грудним вигодовуванням і поширеністю встановленої фахівцем астми у віці до 6 років. Виявлено слабкі докази того, що тривалість грудного вигодовування в місяцях корелює зі зниженням поширеності астми у віці до 6 років за відсутності екземи; в дітей з екземою значущого зв’язку не було (кореговане ВШ 0,98; 95% ДІ 0,95-1,00 проти 1,03; 0,98-1,08 відповідно).
Отже, дані клінічних досліджень указують на зв’язок між грудним вигодовуванням і виникненням астми. Як виключно, так і переважно грудне вигодовування мають невеликий захисний вплив на кшталт «доза – відповідь», що підтверджено об’єднаним аналізом великої вибірки високоякісних когортних досліджень. Тому для більшого захисного ефекту бажаним є тривале грудне вигодовування. Немає остаточного висновку щодо збереження захисного ефекту у віці понад 7 років. Навіть незначний захисний ефект у дітей молодшого віку має суттєву користь для громадського здоров’я на популяційному рівні. Слабкі докази з великого популяційного когортного дослідження вказують, що захисний ефект тривалого грудного вигодовування може втрачатися в немовлят із вищим ризиком атопічних захворювань.
Рекомендації щодо практики грудного вигодовування підсумовано в таблиці 1. Вони призначені для запобігання алергічним захворюванням загалом і не стосуються виключно астми. Більшість із них ґрунтуються на загальній користі для здоров’я матері та дитини, а не на профілактиці алергії.
Пробіотики
Пробіотики – це мікроорганізми, які приносять користь для здоров’я організму-господаря, якщо їх уживати в достатній кількості. Пребіотики – це вибірково ферментовані інгредієнти, які зумовлюють певні зміни складу мікробіоти, корисні для здоров’я. Продукти, що містять про- та пребіотики, називаються синбіотиками. Мікроорганізми, що колонізують організм людини, формують мікробіом, який впливає на імунну систему. Мікробіом впливає на метаболом близьких і віддалених ділянок тіла, а метаболом може впливати на мікробіом. Нормальний склад кишкового мікробіому модулює вроджений і адаптивний імунітети. Пробіотики можуть індукувати системну толерантність, знижуючи відповіді Т-хелперів 2 типу (Th2) та збільшуючи Treg. Індукувати Treg і їхні функції здатні декілька пробіотиків, як-от Clostridium, Bifidobacterium, Lactobacillus, Escherichia coli Nissle 1917 і пробіотична суміш VSL#3 (4 види Lactobacillus, 3 види Bifidobacterium та 1 вид Streptococcus). Окрім того, пробіотики посилюють продукцію IgА. Що стосується вродженого імунітету, то пробіотики сприяють активації слизового бар’єра, що покращує утворення слизу, збільшують кількість циркулювальних моноцитів і посилюють активність дендритних клітин. Пробіотики також збільшують утворення метаболітів коротколанцюгових ЖК, що сприяє активації Treg у легеневій тканині.
Останній метааналіз пренатального прийому пробіотиків матір’ю для запобігання астмі в нащадків повідомляє про 2 плацебо-контрольовані дослідження, що не виявили значущих результатів. У першому 415 жінок приймали пробіотики з 36-го тижня гестації до 3 місяців після народження, спостереження тривало до 6 років після народження, кінцевим результатом були численні епізоди свистячого дихання, застосування інгаляційних глюкокортикоїдів або ознаки гіперреактивності без супутньої інфекції верхніх дихальних шляхів у віці 2 років. В іншому дослідженні прийом пробіотиків здійснювався з 14-16 тижнів вагітності до 6 місяців після народження серед 423 жінок. Результат включав появу будь-яких хрипів у дітей віком 6 і 12 місяців. Незважаючи на добру методологічну якість обох досліджень, їхні результати не були об’єднані для метааналізу через методологічну неоднорідність.
Що стосується обсерваційних доказів зв’язку між пробіотиками й атопією/хрипами в дітей, то 1 перехресне дослідження показало, що в дітей з атопією та хрипами у віці 1 року популяції Bifidobacterium, Ruthie, Faecalibacterium, Lachnospira та Veillonella в кишківнику у віці 3 місяців були значно нижчими. Останній метааналіз 6 плацебо-контрольованих досліджень за участю 1659 дітей показав, що постнатальний прийом пробіотиків не запобігає появі астми. Цілком можливо, що великі частки включених дітей із високим ризиком астми становлять особливу популяцію, тому ці висновки не можна переносити на загальну популяцію.
Отже, докази клінічних досліджень про застосування пробіотиків у пренатальному періоді вказують на непереконливий ефект, що ґрунтується на дослідницькому аналізі підгруп, які не вдалося об’єднати. Потрібні подальші високоякісні РКД із чітко визначеними специфічними первинними кінцевими точками. Результати постнатального прийому пробіотиків дітьми також непереконливі, оскільки більшість досліджень включало дітей із високим ризиком астми. Потрібні подальші дослідження в ширших популяціях. Відповідно, рекомендації щодо про- та пребіотиків, які використовуються для профілактики алергії, ґрунтуються на недостатніх доказах. Рекомендації з настанов різних організацій підсумовано в таблиці 2.
Жирні кислоти
Це важливі компоненти рослинних і тваринних ліпідів. За хімічною структурою відповідають класу аліфатичних карбонових кислот, за характером подвійних зв’язків класифікуються на насичені, мононенасичені та поліненасичені ЖК (ПНЖК). Жирні сорти риби, водорості та деякі рослинні продукти багаті на ω-3-ПНЖК, тоді як ω-6-ПНЖК переважно містяться в маргарині й рослинних оліях. Медіатори, що регулюють запалення, походять як з ω-3, так і з ω-6 та їхніх метаболітів (рис. 1). За тяжкої астми їх регуляція порушується.
Високий рівень ПНЖК у плазмі крові в 4986 вагітних протягом ІІ триместру асоціюється з істотно меншим ризиком астми / постійних хрипів у дітей до 6 років. Пренатальну профілактику астми добавками ω-3-ПНЖК вивчали 2 нещодавні метааналізи, які виявили суперечливі результати. У 1743 діадах мати – немовля з 4 РКД не було суттєвої різниці щодо ризику астми/хрипів у дітей від 6 місяців до 16 років між групами, які приймали та не приймали ω-3 (ВШ 0,70; 95% ДІ 0,45-1,08; I2=51%). Інший метааналіз виявив значне зниження частоти хрипів/астми в дітей того самого віку (ВР 0,81; 95% ДІ 0,66-0,99; I2=41,8%) серед 2047 діад мати – немовля в 6 РКД.
Щодо постнатального застосування ПНЖК, то когортне дослідження виявило значущий зворотний зв’язок між астмою / рецидивними хрипами й атопією у 235 дітей віком 3 роки. В іншому дослідженні «випадок – контроль» за участю 84 дітей учасники, які не мали астми у віці 6 років, споживали значно більше необробленого фермерського молока з високим умістом ω-3-ПНЖК. Отримано суперечливі результати між метааналізом, який включав лише РКД, та метааналізом, який включав когортні дослідження, щодо впливу споживання ПНЖК (капсули риб’ячого жиру або ω-3) на появу астми/хрипів у дітей. У метааналізі 5 РКД за участю 2415 дітей не виявлено суттєвого зменшення хрипів/астми (ВШ 0,97; 95% ДІ 0,65-1,47; I2=52%); проте 4 РКД включали дітей із високим ризиком атопічних захворювань. Натомість метааналіз 3 когортних досліджень за участю 9212 дітей показав, що риб’ячий жир може мати захисний ефект (ВШ 0,76; 95% ДІ 0,61-0,94; I2=11,5%).
Відповідно, загальний ефект добавок ЖК у вагітних непереконливий. Використання моделі фіксованого ефекту замість моделі випадкового ефекту в метааналізі зі значущими результатами створило антиконсервативні ДІ, що виключає узагальнення. Розмір вибірки РКД був надто малим для впевненої оцінки ДІ й узагальнення. Для моделювання випадкових ефектів і правильного охоплення ДІ треба принаймні 5 досліджень, що потребує якісніших РКД. Для підтвердження захисної ролі постнатального прийому ЖК у дітей із високим ризиком також потрібні якісніші РКД. Результати метааналізу великих когорт краще відображають приблизний ефект споживання ЖК у дітей без високого ризику астми, оскільки зведені результати були скореговані з урахуванням чинників ризику. Проте аналіз включав надто мало досліджень для впевненої оцінки, тому докази непереконливі. Сучасні рекомендації щодо продуктів, багатих на ЖК, та схеми харчування для профілактики алергії підсумовано в таблиці 3.
Середземноморська дієта
Це традиційне харчування країн, які межують із Середземним морем. Включає велику кількість овочів, фруктів, бобових, горіхів, бобів, круп, зерна, риби та ненасичених жирів, але низьке споживання м’ясних і молочних продуктів. Визнана корисною для здоров’я, насамперед унаслідок зниження ризику неінфекційних метаболічних захворювань – цукрового діабету 2 типу, серцево-судинних і нейродегенеративних хвороб. Проте висновки досліджень щодо гіперреактивних захворювань дихальних шляхів суперечливі. Овочі, фрукти та цільні зерна мають антиоксидантні властивості, що може зменшити системне запалення та запалення дихальних шляхів, пом’якшити ефекти імунної відповіді Th2 та ядерного фактора каппа B (NF-κB). Високий уміст клітковини додатково ферментується мікробіомом кишківника, утворюючи коротколанцюгові ЖК. Бутират є найпотужнішим інгібітором деацетилювання гістонів, що стимулює транскрипційний фактор FOXP3, який поляризує Т-клітини до Treg. Менше споживання енергії внаслідок споживання здорової їжі сприяє зниженню маси тіла та покращенню контролю астми.
Зв’язок між споживанням середземноморської дієти під час вагітності або дитинства та захворюваністю на астму продемонстрований лише нерандомізованими дослідженнями. Останній метааналіз вивчав пренатальне застосування середземноморської дієти на виникнення астми в дітей. Загалом включено 2852 діади мати – немовля з 2 обсерваційних досліджень, які не виявили істотного зв’язку. Коли визначеним результатом були хрипи у віці 1 місяців, зворотний зв’язок був значущим (5089 діад мати – немовля, 3 обсерваційні дослідження, ВШ 0,92; 95% ДІ 0,88-0,95; I2=0%). У тому самому метааналізі порівнювали високу та низьку прихильність до середземноморської дієти в дитинстві щодо виникнення астми в 78 587 дітей за результатами 5 перехресних досліджень, 1 дослідження типу «випадок – контроль» та 1 когортного дослідження. Значущого захисного ефекту не виявлено.
Проте, коли результатом була поява хрипів, встановлено значущий захисний ефект, за даними 3 перехресних досліджень (ВШ 0,51; 95% ДІ 0,37-0,70; I2=0%).
Отже, здатність середземноморської дієти під час вагітності захистити дитину від виникнення астми в майбутньому непереконлива через відсутність РКД, результатів метааналізу обсерваційних дослідень із використанням чітко визначеного наслідку, надто малу кількість досліджень для перевіркиДІ та велику частку перехресних досліджень, які посилюють ризик зворотного причинно-наслідкового зв’язку впливу й ефекту. Невідповідність між визначеними результатами астми та хрипів може бути наслідком неправильної класифікації в неосліплених обсерваційних дослідженнях. Потрібні високоякісні дослідження з чітко визначеним наслідком. Докази щодо постнатального застосування середземноморської дієти в дітей також непереконливі через відсутність РКД та суперечливі результати метааналізу обсерваційних досліджень.
Вітамін D
Це жиророзчинний нутрієнт, що відіграє важливу роль у багатьох системних функціях, зокрема засвоєнні кальцію, регуляції вроджених і адаптивних імунних реакцій. Його природними джерелами є інсоляція та меншою мірою їжа. Принаймні 1 млрд жителів планети мають дефіцит або недостатність вітаміну D, поширеність цих станів дещо вища в жителів Азії. Активний вітамін D пригнічує дендритні клітини, стимулює утворення інтерлейкіну-10 (ІЛ-10) і сприяє функціонуванню Treg, що призводить до пригнічення ефекторних клітин (Th1, Th2, Th17), мастоцитів, базофілів, еозинофілів, зменшення утворення алергеноспецифічного IgE та посилення секреції IgG. Рецептор вітаміну D (VDR) належить до надродини стероїдних рецепторів. Дані щодо зв’язку поліморфізму гена VDR з астмою суперечливі. У мишей із нокаутом VDR астми не виникає.
У клітинах гладких м’язів бронхів людини нещодавно виявлено VDR і встановлено, що вітамін D регулює експресію багатьох генів, які беруть участь у скороченні клітин гладких м’язів, запаленні, регуляції простагландинів і глюкокортикоїдів.
Метааналіз 3 РКД за участю 1513 діад мати – немовля показав, що вітамін D3 під час вагітності знижує ризик виникнення хрипів/астми в нащадків віком до 6 років (ВШ 0,72; 95% ДІ 0,56-0,92; I2=0%). Метааналіз 6 обсерваційних досліджень, які вивчали додавання вітаміну D під час вагітності в 16 527 діадах мати – немовля продемонстрував обернений зв’язок із ризиком виникнення астми в дітей від 2 до 10 років (ВШ 0,78; 95% ДІ 0,69-0,89; I2=63%). Обернений зв’язок зберігався тоді, коли результат визначали як «астма/хрипи» (ВШ 0,65; 95% ДІ 0,54-0,79; I2=79%).
Що стосується ефекту постнатальних добавок вітаміну D, то докази обмежуються 2 обсерваційними дослідженнями, які не були об’єднані та не дали значущих результатів. Однак 1 подвійне сліпе плацебо-контрольоване РКД за участю 300 недоношених темношкірих немовлят показало, що тривале введення вітаміну D знижує ризик повторних хрипів через 12 місяців.
Тож у метааналізі обсерваційних досліджень була достатня узгодженість між більш і менш специфічними визначеннями наслідків астми. Цілком імовірно, що прийом вітаміну D під час вагітності має невеликий захисний ефект. Розширити впевненість у цьому можуть майбутні метааналізи більших когорт із високоякісних РКД. Докази щодо постнатального прийому вітаміну D у дітей непереконливі. Незважаючи на високу методологічну якість 1 доступного РКД, це було одноцентрове дослідження середнього розміру в ретельно відібраній вибірці, що не дає змоги узагальнити висновок для ширшої популяції. Рекомендації щодо споживання вітаміну D для профілактики астми підсумовано в таблиці 4.
Вітамін С
Аскорбінова кислота – потужний водорозчинний антиоксидант із протизапальними властивостями, що міститься у фруктах та овочах. Асоціюється зі зниженням ризику серцево-судинних захворювань, інсульту та раку, нормалізацією рівня С-реактивного протеїну. Завдяки пригніченню простагландинів, антиоксидантній і протизапальній дії можливий сприятливий вплив при астмі. В експериментальних моделях продемонстровано здатність знижувати чутливість дихальних шляхів і зменшувати запальну інфільтрацію навколо бронхіол і судин.
Щодо профілактики астми, то останній метааналіз обсерваційних випробувань не показав зв’язку між добавками вітаміну С у вагітних і астмою (2 дослідження) або хрипами (5 досліджень) у дітей. Натомість добавки вітаміну С у постнатальному періоді не продемонстрували жодних захисних ефектів, на що вказує систематичний огляд РКД й обсерваційних досліджень.
Отже, високоякісних доказів щодо впливу пренатального прийому вітаміну С на ризик астми недостатньо, потрібні якісніші дослідження.
Вітамін Е
Це набір жиророзчинних сполук, які містяться в багатьох харчових продуктах, зокрема горіхах, насінні, зелених овочах і рослинних оліях. Природний вітамін Е існує у 8 хімічних формах (α-, β-, γ-
та δ-токоферол, а також α-, β-, γ- та δ-токотрієнол), але найбільшу біодоступність і найкращі характеристики має α-токоферол. Завдяки антиоксидантним і протизапальним властивостям вітамін Е впливає на імунну систему. Іншим важливим ефектом вітаміну Е є вплив на головний транскрипційний фактор, який регулює антиоксидантні та детоксикаційні ферменти.
Відповідно, докази щодо добавок вітаміну Е під час вагітності непереконливі. Кількість РКД недостатня, в останньому метааналізі щодо наслідку астми домінує 1 когортне дослідження без об’єктивної перевірки вимірювання експозиції. Немає жодних доказів щодо постнатального застосування добавок вітаміну Е для профілактики астми, оскільки єдиний негативний результат ґрунтується на асоціації між середніми рівнями α- та γ-токоферолу в сироватці крові немовлят і виникненням астми.
Цинк
Важливий мікроелемент і кофактор для функціонування багатьох білків. Його вплив на імунну систему полягає в післятрансляційній модифікації білків під впливом протеїнкіназ і фосфатаз; регуляції внутрішньоклітинних сигнальних шляхів, зокрема NF-kB та Т-клітинного рецептора; пригніченні еозинофільного запалення в дихальних шляхах. Дефіцит цинку знижує імунну відповідь Th1 і сприяє відповіді Th2.
Нещодавній метааналіз не показав суттєвої різниці між середніми рівнями цинку в дітей-астматиків порівняно з групою контролю. Метааналіз обсерваційних досліджень дієтичного споживання цинку вагітними виявив значущість щодо появи свистячого дихання до віку 1-2 роки (ВШ 0,57; 95% ДІ 0,40-0,81; I2=0%), але виникнення астми до 5 років не було значущим серед 3694 діад мати – немовля. Значущість встановлено у 2 дослідженнях – плацебо-контрольованому РКД за участю 881 діади мати – немовля та когортному дослідженні за участю 763 діад мати – немовля. Повідомлень про постнатальний прийом цинку дітьми для профілактики астми на сьогодні немає.
Отже, немає достатніх доказів щодо пренатального споживання цинку матір’ю для профілактики астми в дітей. Докази непереконливі через надто малу кількість досліджень для оцінки достовірного охоплення ДІ в метааналізі й суперечливі результати між астмою та хрипами. Немає доказів щодо постнатального споживання цинку дітьми для профілактики астми.
Висновок
За результатами клінічних досліджень, грудне вигодовування, особливо тривале, та додавання вітаміну D вагітним, імовірно, запобігає виникненню астми в дітей. Немає переконливих доказів захисного впливу пренатального прийому вагітними чи постнатального прийому дітьми пребіотиків, пробіотиків, вітамінів С та Е, цинку, дієтичних ЖК або інтенсивності дотримання середземноморської дієти. Це зумовлено недостатньою кількістю чи відсутністю досліджень або встановленим позитивним впливом лише в певних популяціях (рис. 2).
Література
Takkinsatian P., Mairiang D., Sangkanjanavanich S., Chiewchalermsri C., Tripipitsiriwat A., Sompornrattanaphan M. Dietary factors associated with asthma development: a narrative review and summary of current guidelines and recommendations. J. Asthma Allergy. 2022 Aug 24; 15: 1125-1141. doi: 10.2147/JAA.S364964.
Освітньо-практичний журнал Allergy Practice №1 2023р.