Зв’язок між хворобою Альцгеймера та захворюваннями травного тракту. Частина 1
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Нейродегенеративні захворювання (НДЗ) є невиліковними й виснажливими розладами, що призводять до прогресивної дегенерації та загибелі нейронів. НДЗ є однією з провідних причин смертності й інвалідності у світі, та, як очікується, в наступні десятиліття їх поширеність зростатиме.
Відоме НДЗ – хвороба Альцгеймера (ХА) – є найпоширенішим типом деменції (60-80% усіх випадків). Вважається, що це захворювання вражає понад 50 млн людей у всьому світі. Деякі з найперших симптомів ХА (депресивні симптоми, апатія, тривожність і порушення сну) можуть проявлятися задовго до встановлення клінічного діагнозу деменції. Симптоми пізніх стадій включають порушення судження, дезорієнтацію, агресію, збудження, марення та галюцинації. Нейропатологічними маркерами ХА є накопичення β-амілоїду (βА) в паренхімі мозку та судинній системі, наявність внутрішньонейрональних нейрофібрилярних клубків і втрата синапсів. Проте досі залишається незрозумілим, що саме є першопричиною та рушійним механізмом прогресування хвороби.
Численні дослідження виявили позитивну асоціацію між ХА та розладами кишкової мікрофлори, вживанням ліків із приводу гастриту (зумовленого Helicobacter pylori), виразковою хворобою, запальними захворюваннями кишківника та гастроезофагеальною рефлюксною хворобою. Припускається, що важливу роль у патогенезі ХА відіграють імунна система, дисбіоз кишківника, накопичення βА в кишківнику, стимуляція блукливого нерва, запальні процеси та метаболізм ліпідів. Деякі препарати, котрі використовуються для лікування розладів з боку шлунково-кишкового тракту (ШКТ), можуть підвищувати ризик розвитку ХА. Наприклад, спазмолітик скополамін у дослідженнях на тваринах використовується для моделювання ХА, оскільки він легко проникає крізь гематоенцефалічний бар’єр (ГЕБ), спричиняє накопичення βА та холінергічну дисфункцію.
Епідеміологічний зв’язок між ХА та розладами ШКТ продовжує вивчатися. За оцінками експертів, у пацієнтів віком понад 50 років, які зазнали впливу H. pylori, ризик розвитку ХА збільшується на 11%. З метою подальшого вивчення впливу розладів ШКТ на ХА автори провели бібліографічний пошук серед статей англійською мовою, опублікованих у базі даних PubMed за останні 6 років, і узагальнили отримані результати.
Helicobacter pylori
H. pylori – це грамнегативна бактерія, що асоціюється із захворюваннями слизової оболонки шлунка та вважається одним з канцерогенів для людини, проте дослідження також продемонстрували участь гелікобактера в патогенезі позакишкових захворювань, включаючи неврологічні розлади. Станом на сьогодні припускається, що патогенний вплив H. pylori включає системне запалення низького ступеня, молекулярну мімікрію та кишковий дисбіоз. Фактори вірулентності цього патогену – VacA й онкопротеїн CagA – стимулюють імунні шляхи, спричиняючи розвиток пухлин і запалення. Інфекція H. pylori є глобальною проблемою, а її поширеність залежить від соціально-економічного статусу населення: в країнах, що розвиваються, інфіковані понад 80% дорослих, у промислово розвинених країнах – 20-50%.
Своєю чергою, ХА являє собою НДЗ, яке характеризується когнітивними порушеннями та розвивається внаслідок накопичення βА в нейронах, що призводить до їх апоптозу. H. pylori та його токсичні метаболіти можуть проникати в центральну нервову систему (ЦНС) через орофарингеальну нюхову систему, ретроградним шляхом через шлунково-кишкові нерви, шляхом інфікування моноцитів крові та в разі порушення ГЕБ. Дисфункція й дегенерація нюхової системи є одними з найперших ознак ХА, які спостерігаються приблизно в 90% пацієнтів.
Дослідження А. Douros і співавт. (2024) показало, що клінічно виражена гелікобактерна інфекція асоціюється з помірним підвищенням ризику ХА (відношення ризиків 1,11; 95% довірчий інтервал 1,01-1,21). Ризик ХА підвищувався через 7,3-10,8 року після початку інфекції. Зокрема, серед осіб віком від 50 років спостерігалося підвищення ризику ХА на 11%, яке досягало піку у 24% через 10 років після початку клінічно вираженої гелікобактерної інфекції.
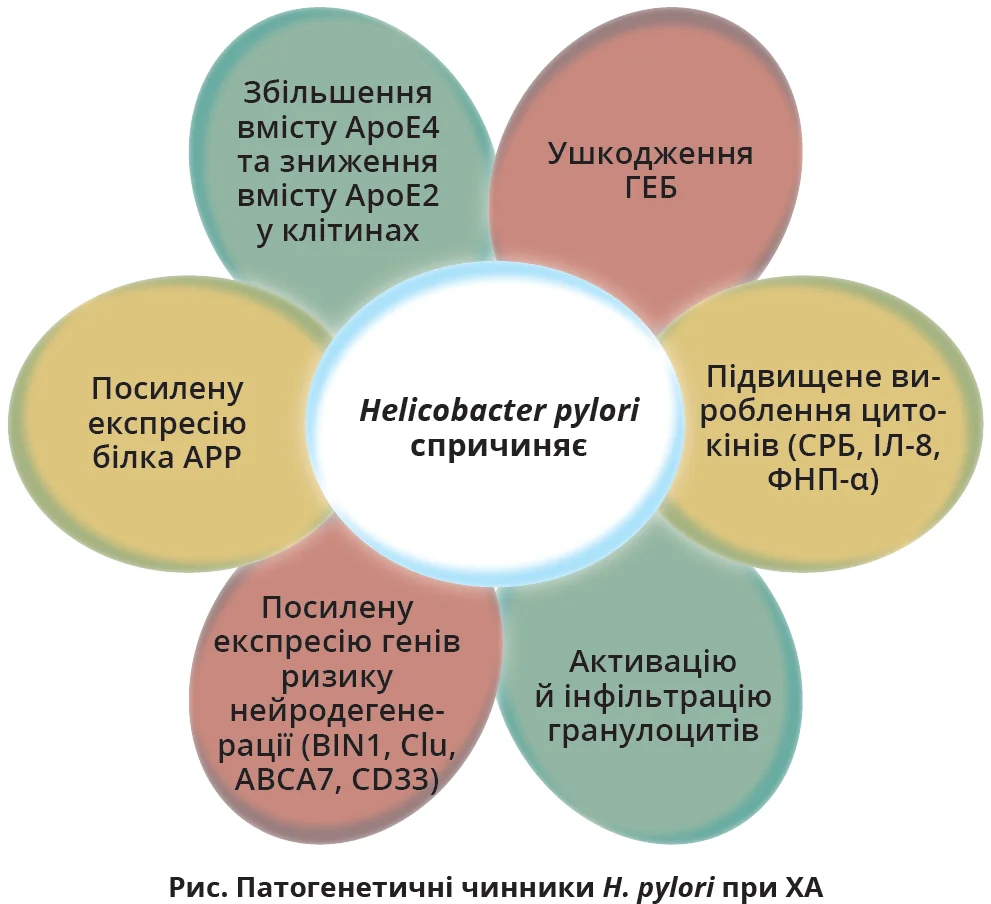
Накопичення амілоїду є наслідком протеолізу білка АРР. H. pylori може спричиняти відкладання βА в ЦНС шляхом підвищення експресії цього білка. Крім того, за гелікобактерної інфекції збільшується експресія ApoE4, який підвищує ризик ХА, та зменшується експресія ApoE2, що знижує ризик цього НДЗ. Цей дисбаланс може призводити до порушення функціонування мікроглії, синапсів і виникнення розладів ліпідного та глюкозного гомеостазу.
H. pylori підвищує експресію генів, пов’язаних з ризиком нейродегенерації, як-от BIN1, Clu, ABCA7 і CD33. Активація рецептора TRL-4, який розпізнає молекулярні патерни, також спричиняє запалення в ЦНС, а H. pylori значно підвищує експресію цього рецептора в інфікованих клітинах. Окрім того, гелікобактерна інфекція зумовлює підвищення рівня прозапальних цитокінів, як-от С-реактивний білок (СРБ), інтерлейкін-8 (ІЛ-8) і фактор некрозу пухлин-α (ФНП-α). Останній регулює синтез інших гострофазових білків, які спричиняють атеросклероз, підвищення проникності ГЕБ та опосередковано нейродегенерацію.
У зв’язку з молекулярною мімікрією між гелікобактером і білками організму людини антитіла до H. pylori можуть перехресно реагувати з антигенами організму-господаря, ушкоджуючи їх.
Гомологічні H. pylori епітопи містяться й на нейронах, що пришвидшує ураження ЦНС.
Іще один механізм несприятливого впливу гелікобактерної інфекції опосередкований галектинами – надродиною гліканозв’язувальних білків, які взаємодіють із глікозильованими рецепторами, експресованими на певних імунних клітинах. Галектин-3, який регулює активацію макрофагів і нейтрофілів за умов інфекції H. pylori, зумовлює підвищення проникності ГЕБ і накопичення в мозку βА. Надлишок галектину-3 також знижує фагоцитарну здатність макрофагів, уповільнюючи регенерацію нейронів.
Отже, H. pylori спричиняє численні системні та нейрональні порушення, котрі потенційно прискорюють розвиток ХА (рис.). Вплив цієї інфекції на запалення, генетичну експресію та бар’єрні системи організму є важливими патогенетичними механізмами, що потребують подальшого вивчення.
Окрім гелікобактерної інфекції, існують інші інфекційні агенти, пов’язані з ХА, зокрема вірус простого герпесу 1-го типу, інші герпесвіруси, Borrelia burgdorferi, Chlamydia pneumoniae та Porphyromonas gingivalis. Деякі дослідники також припускають, що з патогенезом ХА можуть бути пов’язані цитомегаловірус і вірус оперізувального герпесу.
Пародонтит і оральний мікробіом
Пародонтит – це хронічне захворювання ясен, яке спричинене імунною відповіддю на грампозитивні та передусім грамнегативні анаеробні бактерії, як-от Treponema denticola, Aggregatibacter actinomycetemcomitans, P. gingivalis і Tannerella forsythia. Пародонтит здатен зумовити системне запалення низької інтенсивності, що призводить до розвитку захворювань інших органів і систем. Порівняно зі здоровими особами пацієнтам з пародонтитом властиві підвищені рівні прозапальних медіаторів (ІЛ-1 і -6, СРБ, фібриноген) і більша кількість нейтрофілів у крові.
Пошук модифікованих чинників ризику ХА триває, і дослідження показують, що існує зв’язок між цією хворобою та хронічним пародонтитом. Цей зв’язок є двостороннім: особам з пародонтитом властивий підвищений ризик розвитку деменції, а пацієнти з ХА нехтують гігієною рота через когнітивний занепад. Пародонтит асоціюється з приблизно 1,7-разовим підвищенням ризику розвитку нейродегенерації. Бактерії, що спричиняють запалення ясен, можуть проникати через епітелій пародонтальних кишень у кровотік під час чищення зубів, використання зубної нитки чи жування їжі. Ці бактерії виробляють ендо- й екзотоксини, які транспортуються кров’ю, зокрема в мозок, де зумовлюють запалення ЦНС – один з можливих механізмів розвитку ХА.
Показано, що ліпополісахарид (ЛПС) – компонент мембрани грамнегативних бактерій – у мозку пацієнтів з ХА виявляється у вищій кількості, ніж у здорових осіб. ЛПС також міститься в β-амілоїдних бляшках і навколо мозкових судин у осіб з ХА. ЛПС активує мікроглію, спричиняє запалення ЦНС і перетворення попередника βА на нерозчинні відкладення.
У пацієнтів з ХА та пародонтитом спостерігається підвищений рівень ФНП-α й антитіл до P. gingivalis, A. actinomycetemcomitans і T. forsythia. P. gingivalis являє собою патоген, здатний мігрувати в мозок і збільшувати вироблення βА й τ-білка. Крім того, P. gingivalis виробляє гінгіпаїни – протеолітичні ферменти, які розщеплюють білки організму-господаря, активують запальні клітини та спричиняють утворення нерозчинних бляшок у разі ХА. Ці ферменти було виявлено в понад 90% препаратів мозку, ураженого ХА, передусім у ділянках, пов’язаних з пам’яттю (гіпокампі). Вважається, що пригнічення активності гінгіпаїнів може сповільнити прогресування ХА, тому нині тривають клінічні випробування ліків з таким профілем дії.
Слід зауважити, що пародонтит зумовлює тимчасову бактеріємію та, відповідно, системну запальну відповідь, що призводить до пошкодження цілісності ГЕБ і підвищеної його проникності. Наслідком цього процесу може бути дисфункція синапсів і загибель нейронів.
Розглядаючи мікробіом, важливо пам’ятати, що він не обмежується лише ШКТ. Бактерії колонізують й інші ділянки тіла людини: шкіру, піхву, порожнину рота. Мікробіом порожнини рота подібний до кишкової мікрофлори як за складом, так і за різноманіттям. Мікробіом здорової порожнини рота включає такі види, як Gemella, Streptococcus, Granulicatella, Veillonella, Streptococcus mitis. Їх домінування в ротовій порожнині зумовлене роллю в утворенні біоплівки (нальоту) на поверхні зубів. Хоча цю біоплівку часто розглядають як шкідливу, за умови збалансованого мікробіому вона відіграє важливу захисну та регуляторну роль. Натомість у разі порушень балансу ротову порожнину колонізують патогенні організми та посилено розмножується P. gingivalis, яка в нормі присутня в ротовій порожнині в незначних кількостях, однак у великій кількості призводить до пародонтиту. Пацієнти з пародонтитом можуть заковтувати зі слиною до 1012 бактерій на день. У здорової людини бактерії-коменсали, наприклад Streptococcus й Actinomyces, демонструють фізіологічний симбіоз і не спричиняють хвороб. Проте будь-яке порушення природного стану ротової порожнини може призвести до виникнення дисбіотичної мікробної спільноти, яка включає Firmicutes, Spirochaetes, Bacteroidetes і Proteobacteria. Ці мікроорганізми беруть участь у патогенезі низки системних захворювань, а також зумовлюють системну запальну відповідь, нейрозапалення та ХА.
Пародонтальні патогени, як-от A. actinomycetemcomitans, P. gingivalis і T. forsythia, також були виявлені в пацієнтів з ХА. Пародонтит слід розглядати як модифікований чинник ризику ХА у зв’язку з наявністю таких бактеріальних молекул, як флагелін, пептидоглікан, ЛПС тощо. Оральне запалення може призвести до дисбалансу кишкової мікрофлори та загострити системну імунну відповідь. Пероральне введення P. gingivalis мишам (імітація пародонтиту) змінювало мікробіом їхнього кишківника, спричиняло ендотоксемію та провокувало запальну відповідь у печінці. Крім того, дослідження виявило значні когнітивні порушення, більші відкладення βА та вищі рівні прозапальних цитокінів (ІЛ-1β, ФНП-α) в мозку цих тварин порівняно з контрольною групою. У нейронах і глії мишей групи експериментального пародонтиту було виявлено гінгіпаїни, що підтверджує транслокацію бактерій з ротової порожнини в мозок. Отже, пародонтит може призвести до хронічного системного запалення низької інтенсивності, яке, своєю чергою, здатне індукувати або посилювати нейродегенеративні процеси. Інші дослідження також виявили порушення здатності до навчання та розлади пам’яті в щурів з пародонтитом. Ризик ХА, асоційований з пародонтитом, також пов’язаний зі втратою зубів у ході хвороби: втрата зубів може призвести до порушень жування, що, впливаючи на харчовий статус, зумовлює погіршення кровообігу в головному мозку та, відповідно, дефіцит пам’яті.
У намаганні зрозуміти патогенез спорадичної ХА науковці ізолювали низку мікроорганізмів, здатних спричиняти відкладення βА та нейрофібрилярну дегенерацію. Більшість із цих мікроорганізмів здатна долати механізми захисту організму-господаря та виживати в його внутрішньому середовищі з періодичною реактивацією запального процесу. Провідна роль одного патогена малоймовірна, проте може бути, що потрапляння в мозок одного мікроорганізму відкриває шлях для інших патогенів, збільшуючи їхню вірулентність і стимулюючи сильнішу імунну відповідь.
Література
Kuźniar J., Kozubek P., Czaja M., Leszek J. Correlation between Alzheimer’s disease and gastrointestinal tract disorders. Nutrients. 2024; 16 (14): 2366. doi: 10.3390/nu16142366.
