Втома у хворих на метаболічно-асоційовану стеатотичну хворобу печінки: як корегувати?
Автор: Ігор Миколайович СКРИПНИК, доктор медичних наук, професор, президент ГО «Українська гастроентерологічна асоціація», проректор із науково-педагогічної роботи та післядипломної освіти, професор кафедри внутрішньої медицини № 1 Полтавського державного медичного університету
 Перелік найпоширеніших захворювань у світі періодично оновлюється. Протягом багатьох років на першому місці утримується ішемічна хвороба серця, а ось друге нещодавно зайняли захворювання печінки. Ці дані наведено в дослідженні The EASL-Lancet Liver Commission, проведеному за ініціативою провідних гепатологів Європейської асоціації з вивчення печінки (EASL) і під патронатом вельми авторитетного журналу The Lancet, у якому аналізували реальні можливості захисту наступних поколінь від ускладнень патології печінки та зниження передчасної смертності [19]. Експерти б’ють на сполох, адже нині в Європі захворювання печінки є другою основною причиною втрати років працездатного життя [19], а перші сходинки в рейтингу найрозповсюдженішої гепатологічної патології міцно зайняли стеатотична хвороба печінки (СХП) та її провідна форма – метаболічно-асоційована стетатотична хвороба печінки (МАСХП).
Перелік найпоширеніших захворювань у світі періодично оновлюється. Протягом багатьох років на першому місці утримується ішемічна хвороба серця, а ось друге нещодавно зайняли захворювання печінки. Ці дані наведено в дослідженні The EASL-Lancet Liver Commission, проведеному за ініціативою провідних гепатологів Європейської асоціації з вивчення печінки (EASL) і під патронатом вельми авторитетного журналу The Lancet, у якому аналізували реальні можливості захисту наступних поколінь від ускладнень патології печінки та зниження передчасної смертності [19]. Експерти б’ють на сполох, адже нині в Європі захворювання печінки є другою основною причиною втрати років працездатного життя [19], а перші сходинки в рейтингу найрозповсюдженішої гепатологічної патології міцно зайняли стеатотична хвороба печінки (СХП) та її провідна форма – метаболічно-асоційована стетатотична хвороба печінки (МАСХП).
Сьогодні вже ні в кого не виникає сумнівів, що природний перебіг СХП і МАСХП не лише тісно пов’язаний з різноманітними супутніми хворобами та станами (метаболічним синдромом, серцево-судинною патологією, цукровим діабетом, ожирінням, хронічними захворюваннями нирок, колоректальним раком тощо), але й спричиняє їх розвиток і прогресування [11, 15, 46]. Раніше ці повідомлення не сприймали всерйоз; нині подібним чином ставляться до наявності такого взаємозв’язку між втомою, тривогою, депресією та МАСХП, але численна доказова база переконливо підтверджує правомочність цього твердження [24].
Гепатогенна втома: що ми знаємо про неї сьогодні?
Згідно із сучасними уявленнями втома являє собою комплекс симптомів, який складається з млявості, виснаження та нездужання [2]. Розрізняють центральну та периферичну втому.
Остання виникає, коли м’язи не здатні ефективно функціонувати через накопичені метаболіти, ацидоз і механічне напруження, тоді як центральна втома проявляється нездатністю ініціювати або підтримувати виконання інтелектуальних завдань / фізичної активності внаслідок зміни функціонування мозку [2]. Виявляється, що найчастішою скаргою у хворих на МАСХП, на яку звертають увагу самі пацієнти, є втома [4]. Саме прогресивна втома робить значний внесок в економічний тягар захворювання та спричиняє суттєве зниження якості життя, продуктивності праці [46]. Надзвичайно виражена втома здатна призвести до появи відчуття ізоляції [37] та самотності [38], що, своєю чергою, може негативно вплинути на психічне здоров’я й зумовлювати виникнення тривоги, депресії, а також прогресування кардіометаболічних розладів, асоційованих з МАСХП, включаючи ожиріння, цукровий діабет 2-го типу, метаболічний синдром, серцево-судинні хвороби [8, 18].
Гепатогенну втому не виділяють в окремий синдром і розглядають як неспецифічну ознаку, притаманну різним станам і патологіям, у тому числі депресії та СХП, особливо за наявності супутнього внутрішньопечінкового холестазу (ВПХ). Сучасні опитувальники, зокрема найпоширеніші CLDQ-NAFLD та CLDQ-NASH, за допомогою яких оцінюють емоційний стан хворих на СХП і наявність у них ознак тривоги або депресії, містять різноманітні групи тверджень, у тому числі присвячені оцінюванню наявності та вираженості втоми [17].
Один із цих опитувальників використовували у всесвітньому анкетуванні, проведеному членами Global NASH Council, у якому взяли участь 2895 хворих на неалкогольну жирову хворобу печінки (НАЖХП)* із 24 країн [45]. Це дослідження відрізняє незвичайна мета: в ньому вперше вивчали стигматизацію, тобто негативне ставлення суспільства до хворих на НАЖХП, за допомогою двох опитувальників – LDB (n=2117) і CLDQ-NASH (n=778), кожен з яких містив розділ щодо втоми. Стигматизація виявлена у 35% респондентів; 9% з них відчули негативне ставлення через наявність НАЖХП, 26% опитаних – через ожиріння. Найвираженішу втому відчували хворі на НАЖХП, які мешкали в Європі (5,34±1,23 бала), мінімальну – громадяни США (4,30±1,41 бала), тоді як респондентів із країн Близького Сходу, Північної Африки й Азії турбувала помірна втома. Учасники, які повідомили про стигматизацію через надмірну вагу / ожиріння, мали найнижчі показники у сферах активності, емоційного здоров’я та найвираженішу втому й занепокоєння (p<0,05) [45]. На думку дослідників, прогресивна втома разом зі стигматизацією може спричиняти виникнення депресії в пацієнтів з НАЖХП.
Виникнення ВПХ та його швидке наростання супроводжуються значним посиленням втоми; саму наявність ВПХ в осіб з МАСХП розглядають як чинник, що ускладнює перебіг захворювання [10, 12, 23].
Від епідеміології до умов виникнення
Поширеність втоми в популяції хворих на НАЖХП варіює в межах 19,7-85% залежно від причини [10, 14, 23, 31, 47]. Предиктори виникнення втоми в цій когорті пацієнтів уже добре відомі: до появи цього симптому призводять тривожність і розлади сну [10], значні фізичні навантаження, суб’єктивна якість сну, латентність і тривалість сну, денна дисфункція [10]. Хворим на НАЖХП, які страждають від втоми, притаманні вищий рівень тривоги та депресії, а також гірша загальна якість сну порівняно з пацієнтами без НАЖХП (p<0,001) [10].
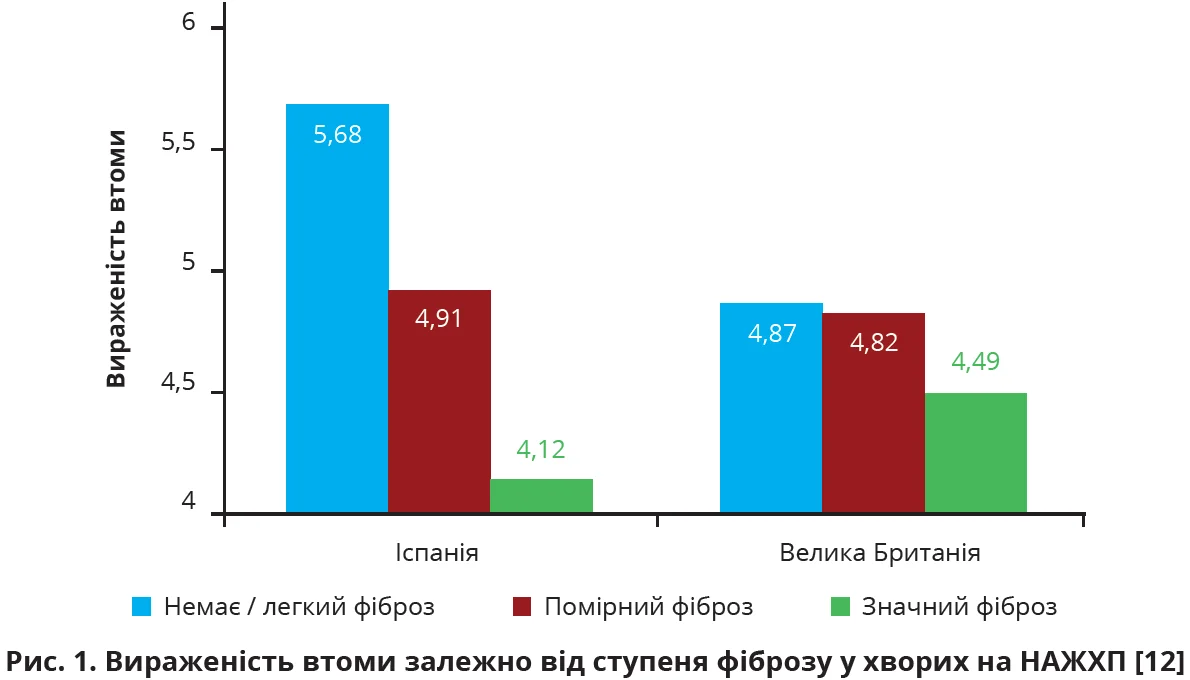
За даними перехресного дослідження, проведеного в Іспанії (n=513) і Великій Британії (n=224), інтенсивність втоми залежить від тяжкості фіброзних змін у печінці на тлі НАЖХП (рис. 1). Виявляється, іспанські пацієнти з НАЖХП і вираженим фіброзом відчували вираженішу втому та значне занепокоєння, мали нижчу якість життя, ніж учасники без фіброзу або з легким фіброзом (p<0,05 в усіх випадках). Подібну залежність відзначили в осіб з помірним фіброзом: вони потерпали від значної втоми порівняно з пацієнтами без фіброзу / з легким фіброзом (p<0,001) [12].
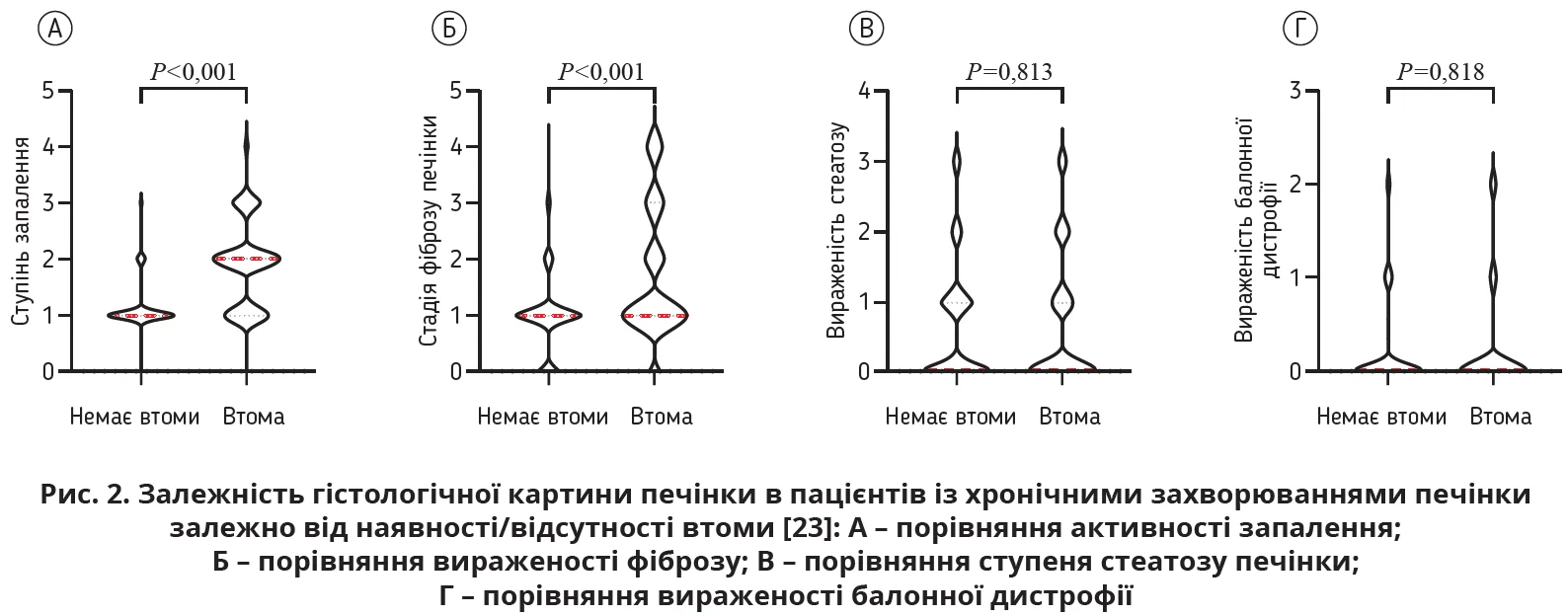
В іншій масштабній роботі (n=1374) відзначено вірогідне (p<0,05) прогресивне зростання втоми зі збільшенням активності запалення печінки та прогресуванням фіброзу в пацієнтів з патологією печінки молодого й середнього віку (рис. 2) [23].
- Патофізіологія втоми
Патофізіологія розвитку втоми у хворих на СХП/МАСХП недостатньо вивчена, проте вважають, що вона подібна до патогенезу розвитку депресії та когнітивних порушень у цієї групи пацієнтів [33].
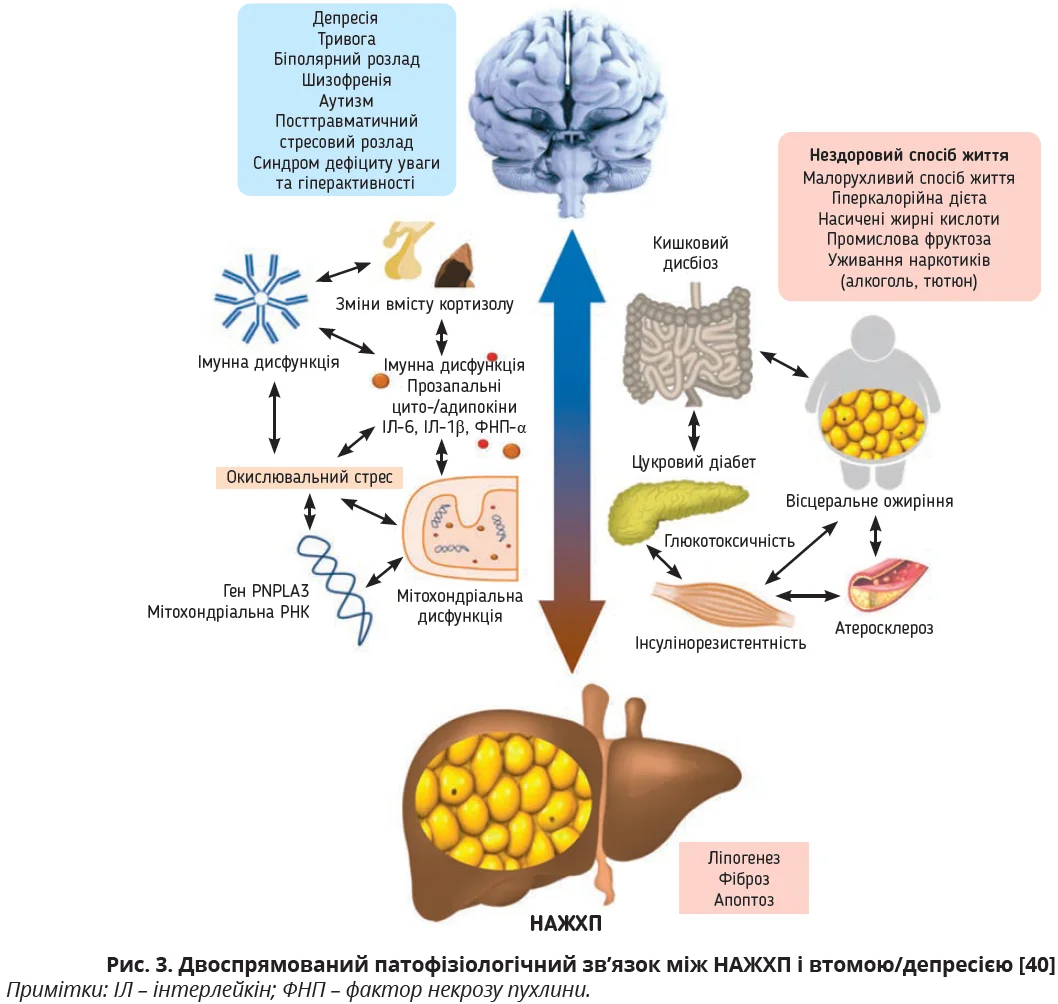
В основі появи та прогресування як втоми, так і депресії у хворих на СХП – хронічний запальний процес і порушення функціонування декількох гормональних сигнальних шляхів, які пов’язують печінку та головний мозок [47] і формують вісь «кишківник – печінка – головний мозок» [28]. Хронічне запалення з активацією імунних клітин, вивільненням цитокінів спричиняє виникнення автономної дисфункції, пошкодження м’язів, порушення метаболізму, дисрегуляцію окислювально-відновних шляхів і мітохондріального біогенезу, що врешті-решт призводить до змін метаболізму нервових клітин головного мозку [29]. Подібні зміни відбуваються в мозку при посттравматичному стресовому розладі. Наявні докази того, що втома асоціюється з нейрозапаленням і зміною декількох нейрофізіологічних механізмів: уміст цитокератину-18, одного з інформативних маркерів запалення та фіброзу при МАСХП, який за своєю природою є фрагментом проміжних філаментів цитоскелета клітини, що нарізуються ефекторною каспазою-3 при апоптозі гепатоцитів, також значно підвищується за гепатогенної втоми [12]. Згідно з даними останніх досліджень у пацієнтів з СХП/МАСХП та депресією змінюються деякі регіональні МРТ-характеристики головного мозку: як збільшення, так і зменшення товщини сірого шару, збільшення площі кори головного мозку. Ці зміни здатні пояснити підвищений ризик депресії у хворих на СХП/МАСХП [1], а при тривалому існуванні – створити умови для розвитку біполярних розладів, шизофренії (рис. 3) [40].
Всього лише втома: які можуть бути наслідки?
Наслідки такого простого симптому, як втома, можуть бути надзвичайно серйозними. Вважають, що втома спричиняє розвиток саркопенії, тобто зниження м’язової сили та маси тіла, яка, своєю чергою, асоційована зі зростанням ризику розвитку неалкогольного стеатогепатиту та прогресивного фіброзу печінки. Саркопенія в осіб з НАЖХП пов’язана з виникненням депресії (відносний ризик (ВР) 1,25; 95% довірчий інтервал (ДІ) 1,02-1,53; р=0,035), клінічно значущою втомою (ВР 1,14; 95% ДІ 1,04-1,26; р=0,008) і здатна негативно впливати на якість життя [39]. Низьку якість життя хворих на НАЖХП також пояснюють вираженою втомою та депресією [16].
Аналіз даних пацієнтів, які взяли участь у досліджені National Health and Nutrition Examination Survey (NHANES) протягом 2005-2010 та 2017-2018 рр., виявив неочікувані результати [47]. У когорті NHANES 2005-2010 рр. (n=5429) 37,6% мали НАЖХП, причому втомлюваність була поширенішою серед хворих на НАЖХП порівняно з особами без НАЖХП (8,35 проти 6,0% відповідно; р=0,002). У когорті NHANES 2017-2018 рр. (n=3830) НАЖХП діагностували в 36,9% учасників; втомлюваність знову частіше турбувала хворих на НАЖХП на відміну від осіб контрольної групи без цієї патології (8,7 проти 6,2% відповідно). Автори підтвердили раніше описаний факт щодо зв’язку втоми з розвитком депресії (ВР 11,52; 95% ДІ 4,45-29,80; р<0,0001), але також констатували неочікуваний і дуже важливий факт: рівень смертності дорослих з НАЖХП зі втомою був у 2,3 раза вище, ніж у хворих на НАЖХП без втоми (відношення шансів 2,31; 95% ДІ 1,37-3,89; р=0,002) [47].
Гепатогенна втома та депресія: рука в руку
Як стверджує метааналіз 31 дослідження, в яких узяли участь дорослі хворі на НАЖХП (n=2 126 593), у цій когорті пацієнтів надзвичайно поширені депресія (26,3%; 95% ДІ 19,2-34), тривога (37,2%; 95% ДІ 21,6-54,3) та стрес (51,4%; 95% ДІ 5,5-95,8) [38]. Ризик розвитку депресії в осіб з неалкогольним стеатогепатитом вище, ніж у хворих на НАЖХП (ВР 2,83;
95% ДІ 2,41-3,32; р<0,001) [43]. Виявляється, що спричиняє розвиток депресії в осіб з МАСХП зростання рівня печінкових ферментів, у тому числі γ-глутамілтрансферази (0,19%; 95% ДІ 0,15-0,22%; р<0,000000002), АЛТ (10%; 95% ДІ 7-13%; р<0,0002), АСТ (4,14%; 95% ДІ 2,34-5,94%; р<0,05) [22].
Крім того, формування депресії в осіб з НАЖХП з функціональними порушеннями печінки супроводжується зростанням рівня смертності від усіх причин на 62% порівняно з хворими на НАЖХП без змін функціональних показників печінки (ВР 1,62; 95% ДІ 1,10-2,39). Депресія при НАЖХП асоціюється зі збільшенням ризику серцево-судинної смертності майже на 50%, причому серцево-судинна смертність була вдвічі вищою в пацієнтів з порушенням функціонального стану печінки порівняно з пацієнтами без них (ВР 2,07; 95% ДІ 1,30-3,30) [20].
Лікування МАСХП і корекція гепатогенної втоми: особливості
Провідними підходами до лікування СХП/МАСХП згідно з чинними міжнародними рекомендаціями залишаються модифікація способу життя й оптимізація звичайного раціону харчування, нормалізація маси тіла та збільшення фізичної активності [11]. На ранніх стадіях СХП для досягнення терапевтичного ефекту може бути достатньо зниження ваги на 5-10%; за прогресивного перебігу захворювання застосовуються фармакологічне лікування, а за його неефективності – баріатрична хірургія [11].
Фізичні вправи, здорове харчування та зниження ваги суттєво покращують стан пацієнтів з СХП/МАСХП, сприяють покращенню їхніх когнітивних здібностей, зменшують втому [29], депресію та тривогу [40]. Проте деякі клініцисти зауважують, що зниження маси тіла може супроводжуватися явищами саркопенії, яка здатна перешкоджати підвищенню фізичної активності та веденню активнішого способу життя: «Розвиток саркопенії може зумовити посилення втоми та навіть відбити бажання займатися фізичними вправами» [10]. Тому першочерговими напрямами стабілізації стану пацієнтів із саркопенією та втомою на тлі СХП/МАСХП вважають нівелювання втоми й відновлення м’язової сили.
Слід мати на увазі, що велика кількість хворих зі втомою отримують антидепресанти першої лінії терапії, зазвичай селективний інгібітор зворотного захоплення серотоніну (СІЗЗС) або селективний інгібітор зворотного захоплення серотоніну-норепінефрину (СІЗЗСН), тому що цю провідну ознаку часто трактують як прояв синдрому хронічної втоми. Антидепресанти й інші антипсихотики обов’язково призначають пацієнтам з депресією. Деякі науковці стверджують, що майже у 2/3 випадків приймання СІЗЗС/СІЗЗСН не сприяє досягненню ремісії у хворих на депресію [41]. Крім того,
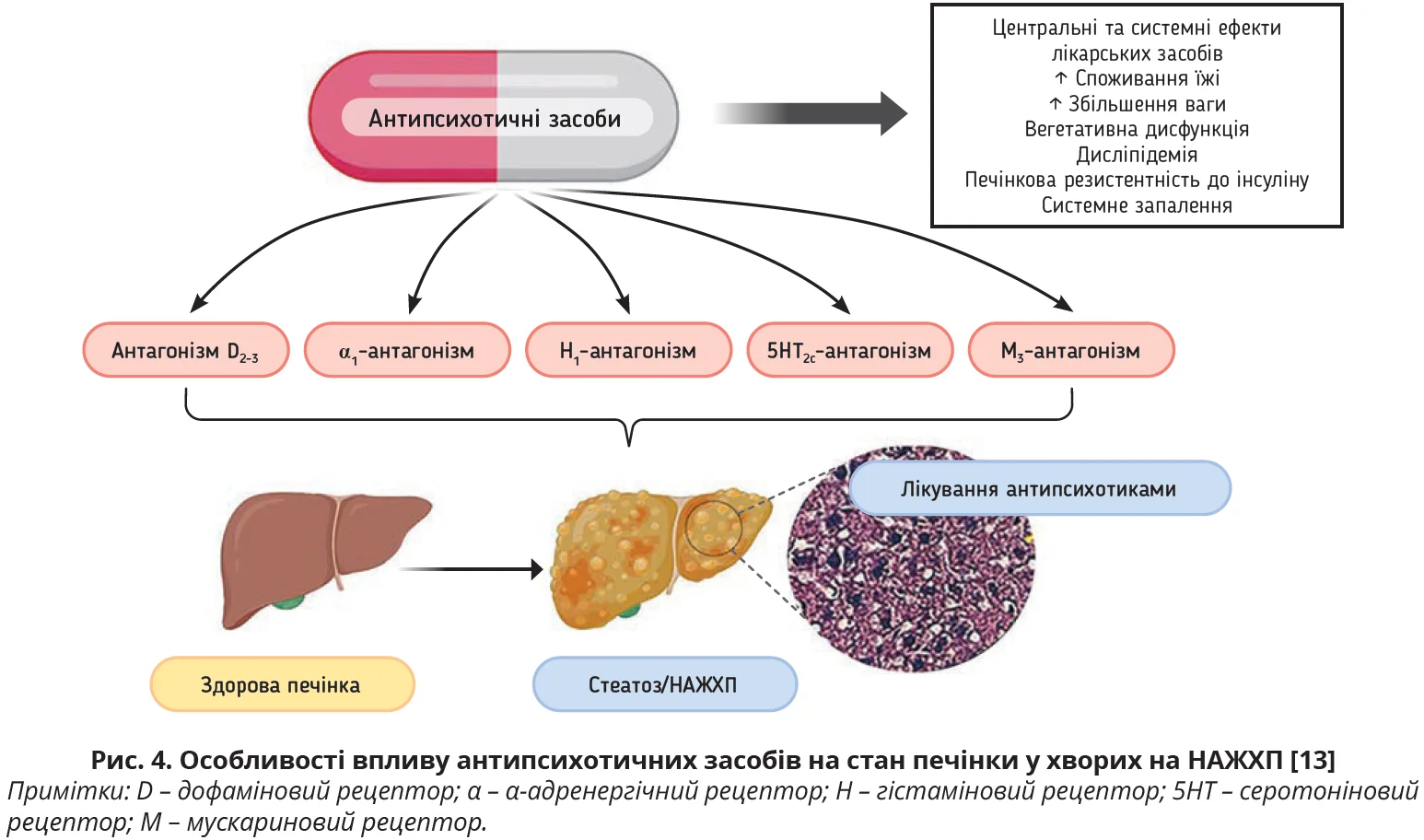
СІЗЗС/СІЗЗСН мають побічні ефекти (зниження сексуальної функції, головний біль, безсоння, запаморочення, пітливість, тремор, тривожність) і здатні спричинити погіршення функціонального стану печінки. Незважаючи на те, що наявність СХП/МАСХП необов’язково асоціюється з погіршенням печінкових проб і появою синдрому цитолізу/холестазу, прийом антидепресантів/антипсихотиків здатний призвести до підвищення рівня печінкових ферментів через їхній печінковий шлях метаболізму (рис. 4) [13]. Отже, перед призначенням і під час приймання антидепресантів хворими на СХП/МАСХП доцільно враховувати їхні можливі побічні дії та контролювати вміст печінкових проб у цієї когорти хворих [40].
Недостатня ефективність СІЗЗС/СІЗЗСН у хворих на СХП/МАСХП може бути частково пояснена складним механізмом виникнення саме гепатогенної втоми та депресії [41]; тому ефективна терапія цього стану потребує багатокомпонентного підходу, який сприятиме як нівелюванню втоми, так і підтримці функціонального стану печінки.
Оптимальне рішення: S-аденозилметіонін
Одним з оптимальних підходів до корекції гепатогенної втоми на тлі СХП/МАСХП вважають призначення засобу комплементарної терапії з доведеною ефективністю – S-аденозилметіоніну (SAMe). SAMe являє собою амінокислоту, яка міститься в організмі та діє як ко-субстрат для перенесення метилу [41]. Утворюється SAMe з L-метіоніну за умов адекватного рівня фолатів і вітаміну В12 [21]. SAMe, віддаючи свою метильну групу, сприяє метилюванню – важливому біологічному процесу, необхідному для синтезу генетичного матеріалу, росту та репарації клітин, утворення різних нейромедіаторів, у тому числі дофаміну та серотоніну – гормонів задоволення/насолоди й емоційної рівноваги відповідно (рис. 5) [21, 42]. Доведено, що незалежно від способу введення (перорально, парентерально) SAMe сприяє відновленню рівня цієї амінокислоти як у плазмі крові, так і в спинномозковій рідині [6].

- Гепатопротекторна властивість SAMe
У колі гастроентерологів SAMе добре відомий як препарат зі значними антиоксидантними та протизапальними властивостями [7], застосування котрого дає змогу зменшити активність запального процесу в печінці, нівелювати ознаки ВПХ та швидко поліпшити самопочуття хворих [30]. Доведено, що введення SAMe супроводжується зменшенням активності цитолітичного синдрому, зниженням умісту в печінці загального холестерину, тригліцеридів, зменшенням експресії цитохрому p450-2E1е, гідроксипроліну, трансформувального фактора росту-β1 і покращенням антиоксидантного балансу [5]. У низці робіт демонструються нормалізувальний вплив SAMe на метаболізм ліпопротеїнів дуже низької щільності, його здатність стимулювати FXR, покращувати метаболізм глюкози, тобто впливати на основні патологічні процеси, які займають провідне місце в патогенезі МАСХП [25-27]. Сучасні систематичні огляди підтверджують нівелювання ВПХ на тлі призначення SAMе, що проявляється нормалізацією рівнів лужної фосфатази, γ-глутамілтранспептидази, АСТ й АЛТ [30].
- SAMe для нівелювання гепатогенної втоми при ВПХ
Ефективність SAMe у нівелюванні гепатогенної втоми при ВПХ доведено в доклінічних (механічних) випробуваннях і рандомізованих клінічних дослідженнях (РКД), а також систематичних оглядах. Систематичний огляд 3 РКД та 6 неРКД констатував зниження вираженості гепатогенної втоми у хворих з ВПХ на тлі прийому SAMе; для нівелювання втоми знадобилося від 2 до 6-8 тижнів залежно від застосованого дозування препарату [30].
Ще в одному метааналізі (n=3238) досліджували вплив SAMе на вираженість втоми в пацієнтів з різною гепатологічною патологією з ВПХ (алкогольна хвороба печінки, СХП, первинний біліарний холангіт, первинний склерозивний холангіт, цироз печінки різного генезу, вірусний гепатит, медикаментозне ураження печінки) [34]. У 16 дослідженнях використовували різні дози, шляхи введення та тривалість прийому SAMе. Автори метааналізу констатували, що незалежно від шляху введення SAMе ефективно нівелював гепатогенну втому при ВПХ як у короткостроковій, так і в довгостроковій перспективі [34]. Вони відзначили дозозалежну дію препарату та можливість збереження постефекту після закінчення курсу лікування [34]. Слід додати, що SAMe визнаний у світі альтернативним варіантом лікування підліткової депресії [45], а також доцільним ефективним утручанням за неможливості призначення / непереносимості СІЗЗС/СІЗЗСН [21].
Висновки
Хвороби печінки є одними з надзвичайно поширених у світі, захворюваність на СХП/МАСХП продовжує зростати. Наявність втоми, провідної скарги хворих на гепатологічну патологію, зокрема МАСХП, не тільки асоційована зі зниженням якості життя, високою активністю запального процесу та фіброгенезу в печінці, але й спричиняє стигматизацію, соціальну відстороненість, розвиток депресії та саркопенії, зростання тривожності й рівня смертності дорослих з НАЖХП*. Основні шляхи корекції гепатогенної втоми полягають у покращенні перебігу основного захворювання, збільшенні, якщо змога, фізичної активності та призначенні препаратів з тонізувальною дією для покращення загального самопочуття. Оптимальним способом нівелювання гепатогенної втоми у хворих на СХП/МАСХП, що супроводжується ВПХ, є призначення SAMe – препарату з двоспрямованою дією: позитивним впливом на печінку (протизапальні, гіполіпідемічні, антихолестатичні, антиоксидантні властивості) та головний мозок (поліпшення синтезу нейромедіаторів). Завдяки таким властивостям SAMe не тільки сприяє нормалізації рівня печінкових ферментів, розрішенню холестазу, а також знижує прояви гепатогенної втоми як одного із симптомів ВПХ, СХП та поліпшує настрій.
* Після публікації настанови EASL (2024) та запровадження нової термінології (СХП, МАСХП) автори деяких сучасних публікацій продовжують використовувати термін «НАЖХП», якщо на момент планування/проведення дослідження застосовували чинні на той час діагностичні критерії НАЖХП. У цій статті ми зберегли авторську термінологію й використовували, відповідно, дефініції «СХП», «МАСХП» та «НАЖХП».
Література
- Arold D., Bornstein S.R., Perakakis N., et al. Regional gray matter changes in steatotic liver disease provide a neurobiological link to depression: a cross-sectional UK Biobank cohort study. Metabolism. 2024; 159: 155983. doi: 10.1016/j.metabol.2024.155983.
- Austin P.W., Gerber L., Karrar A.K. Fatigue in chronic liver disease: exploring the role of the autonomic nervous system. Liver Int. 2015; 35: 1489-1491.
- Baden K.E.R., McClain H., Craig E., et al. S-adenosylmethionine (SAMe) for central nervous system health: a systematic review. Nutrients. 2024; 16 (18): 3148. doi: 10.3390/nu16183148.
- Barberá A., White T.M., Arora A.K., et al. Patient-reported outcomes in metabolic dysfunction-associated steatotic liver disease. Semin. Liver Dis. 2024. doi: 10.1055/a-2435-2091.
- Bingül İ., Küçükgergin C., Fatih Aydın A., et al. Protective role of S-adenosylmethionine on high fat/high cholesterol diet-induced hepatic and aortic lesions and oxidative stress in guinea pigs. Gen. Physiol. Biophys. 2024; 43 (5): 411-421. doi: 10.4149/gpb_2024021.
- Bottiglieri T., Godfrey P., Flynn T., et al. Cerebrospinal fluid S-adenosylmethionine in depression and dementia: effects of treatment with parenteral and oral S-adenosylmethionine. J. Neurol. Neurosurg. Psychiatry. 1990; 53 (12): 1096-1098. doi: 10.1136/jnnp.53.12.1096.
- Capelo-Diz A., Lachiondo-Ortega S., Fernández-Ramos D. Hepatic levels of S-adenosylmethionine regulate the adaptive response to fasting. Cell Metab. 2023; 35 (8): 1373-1389.e8. doi: 10.1016/j.cmet.2023.07.002.
- Cené C.W., Beckie T.M., Sims M., et al. Effects of objective and perceived social isolation on cardiovascular and brain health: a scientific statement from the American Heart Association. J. Am. Heart Assoc. 2022; 11 (16): e026493. doi: 10.1161/JAHA.122.026493.
- Cuomo A., Beccarini Crescenzi B., Bolognesi S., et al. S-adenosylmethionine (SAMe) in major depressive disorder (MDD): a clinician-oriented systematic review. Ann. Gen. Psychiatry. 2020; 19: 50. doi: 10.1186/s12991-020-00298-z.
- Du X., Hu J., Xue J., et al. Rate and associated factors of fatigue in Chinese patients with non-alcoholic fatty liver disease: a cross-sectional survey. Int. J. Gen. Med. 2024; 17: 2945-2953. doi: 10.2147/IJGM.S466980.
- European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO clinical practice guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD). Obes. Facts. 2024; 17 (4): 374-444. doi: 10.1159/000539371.
- Funuyet-Salas J., Martín-Rodríguez A., Pérez-San-Gregorio M., et al. Health-related quality of life in non-alcoholic fatty liver disease: a cross-cultural study between Spain and the United Kingdom. PLoS One. 2024; 19 (5): e0300362. doi: 10.1371/journal.pone.0300362.
- Gangopadhyay A., Ibrahim R., Theberge K., et al. Non-alcoholic fatty liver disease (NAFLD) and mental illness: mechanisms linking mood, metabolism and medicines. Front. Neurosci. 2022; 16: 1042442. doi: 10.3389/fnins.2022.1042442.
- Gerber L.H., Weinstein A.A., Mehta R., et al. Importance of fatigue and its measurement in chronic liver disease. World J. Gastroenterol. 2019; 25 (28): 3669-3683. doi: 10.3748/wjg.v25.i28.3669.
- Godoy-Matos A., Silva Júnior W., Valerio C. NAFLD as a continuum: from obesity to metabolic syndrome and diabetes. Diabetol. Metab. Syndr. 2020; 12: 60. doi: 10.1186/s13098-020-00570-y.
- Golubeva J., Sheptulina A., Yafarova A., et al. Reduced quality of life in patients with non-alcoholic fatty liver disease may be associated with depression and fatigue. Healthcare (Basel). 2022; 10 (9): 1699. doi: 10.3390/healthcare10091699.
- Hashida R., Kawaguchi T., Nakano D., et al. Fast score is associated with patient-reported outcomes in patients with metabolic dysfunction-associated steatotic liver disease. Eur. J. Gastroenterol. Hepatol. 2024. doi: 10.1097/MEG.0000000000002895.
- Jung F.U., Luck-Sikorski C. Overweight and lonely? A representative study on loneliness in obese people and its determinants. Obes. Facts. 2019; 12 (4): 440-447. doi: 10.1159/000500095.
- Karlsen T.H., Sheron N., Zelber-Sagi S., et al. The EASL-Lancet Liver Commission: protecting the next generation of Europeans against liver disease complications and premature mortality. Lancet. 2022; 399 (10319): 61-116. doi: 10.1016/S0140-6736(21)01701-3.
- Kim D., Manikat R., Shaikh A., et al. Depression in nonalcoholic fatty liver disease and all-cause/cause-specific mortality. Eur. J. Clin. Invest. 2024; 54 (1): e14087. doi: 10.1111/eci.14087.
- Lande R.G. Nutraceutical augmentation strategies for depression: a narrative review. J. Am. Osteopath. Assoc. 2020; 120 (2): 100-106. doi: 10.7556/jaoa.2020.019.
- Liang W., Zhong K., Lai T., et al. Causal relationship between depression and metabolic dysfunction-associated steatotic liver disease: a bidirectional Mendelian randomized study. Front. Psychiatry. 2024; 15: 1384003. doi: 10.3389/fpsyt.2024.1384003.
- Liu J., Gong X., Lv H., et al. Is fatigue related to the severity of liver inflammation in patients with chronic liver disease? A cross-sectional study. BMJ Open. 2023; 13 (4): e069028. doi: 10.1136/bmjopen-2022-069028.
- Mahashabde M.L., Bhavsar H.M., Kumar L., et al. A study of non-alcoholic fatty liver disease in patients with hypothyroidism: a cross-sectional study in a tertiary care hospital. Cureus. 2024; 16 (9): e68956. doi: 10.7759/cureus.68956.
- Mao H. Hepatoprotective effect of S-ademetionine in the treatment of intrahepatic cholestasis through farnesoid X receptor mechanism in rats. J. Biomol. Res. Ther. 2019; 8: 176. doi: 10.35248/2167-7956.19.8.176.
- Marigorta U.M., Millet O., Lu S., et al. Dysfunctional VLDL metabolism in MASLD. NPJ Metab. Health Dis. 2024; 2 (1): 16. doi: 10.1038/s44324-024-00018-1.
- Matsui Y., Yamagami I., Iwata N. S-adenosyl-L-methionine improves the changes of calcium content and glucose metabolism after transient ischemia in the rat. Jpn. J. Pharmacol. 1989; 49 (1): 119-124. doi: 10.1254/jjp.49.119.
- Nguyen H.H., Swain M.G. Avenues within the gut-liver-brain axis linking chronic liver disease and symptoms. Front. Neurosci. 2023; 17: 1171253. doi: 10.3389/fnins.2023.1171253.
- Niezen S., Noll A., Bamporiki J., Rogal S.S. Management of fatigue and sleep disorders in patients with chronic liver disease. Clin. Liver Dis. (Hoboken). 2024; 23 (1): e0122. doi: 10.1097/CLD.0000000000000122.
- Noureddin M., Sander-Struckmeier S., Mato J. Early treatment efficacy of S-adenosylmethionine in patients with intrahepatic cholestasis: a systematic review. World J. Hepatol. 2020; 12 (2): 46-63. doi: 10.4254/wjh.v12.i2.46.
- Peng J.K., Hepgul N., Higginson I. Symptom prevalence and quality of life of patients with end-stage liver disease: a systematic review and meta-analysis. Palliat. Med. 2019; 33: 24-36.
- Peng T.R., Cheng H., Wu T. S-adenosylmethionine (SAMe) as an adjuvant therapy for patients with depression: an updated systematic review and meta-analysis. Gen. Hosp. Psychiatry. 2024; 86: 118-126. doi: 10.1016/j.genhosppsych.2024.01.001.
- Phaw N.A., Leighton J., Dyson J., et al. Managing cognitive symptoms and fatigue in cholestatic liver disease. Expert Rev. Gastroenterol. Hepatol. 2021; 15 (3): 235-241. doi: 10.1080/17474124.2021.1844565.
- Raikhelson K.L., Kondrashina E. Аdеmethionine in the treatment of fatigue in liver diseases: a systematic review. Ter. Arkh. 2019; 91 (2): 134-142. doi: 10.26442/00403660.2019.02.000130.
- Sarris J., Papakostas G.I., Vitolo O., et al. S-adenosyl methionine (SAMe) versus escitalopram and placebo in major depression RCT: efficacy and effects of histamine and carnitine as moderators of response. J. Affect. Disord. 2014; 164: 76-81. doi: 10.1016/j.jad.2014.03.041.
- Sarris J., Ravindran A., Yatham L., et al. Clinician guidelines for the treatment of psychiatric disorders with nutraceuticals and phytoceuticals: the World Federation of Societies of Biological Psychiatry (WFSBP) and Canadian Network for Mood and Anxiety Treatments (CANMAT) taskforce. World J. Biol. Psychiatry. 2022; 23 (6): 424-455. doi: 10.1080/15622975.2021.2013041.
- Shea S., Lionis C., Atkinson L., et al. Support needs and coping strategies in non-alcoholic fatty liver disease (NAFLD): a multidisciplinary approach to potential unmet challenges beyond pharmacological treatment. Livers. 2023; 3 (1):1-20. doi: 10.3390/livers3010001.
- Shea S., Lionis C., Kite C., et al. Non-alcoholic fatty liver disease and coexisting depression, anxiety and/or stress in adults: a systematic review and meta-analysis. Front. Endocrinol. (Lausanne). 2024; 15: 1357664. doi: 10.3389/fendo.2024.1357664.
- Sheptulina A.F., Yafarova A.A., Golubeva J., et al. Clinically meaningful fatigue and depression are associated with sarcopenia in patients with non-alcoholic fatty liver disease. J. Pers. Med. 2023; 13 (6): 932. doi: 10.3390/jpm13060932.
- Soto-Angona Ó., Anmella G., Valdés-Florido M., et al. Non-alcoholic fatty liver disease (NAFLD) as a neglected metabolic companion of psychiatric disorders: common pathways and future approaches. BMC Med. 2020; 18 (1): 261. doi: 10.1186/s12916-020-01713-8.
- Tobin D., Vuckovic A., Sarris J. Targeting divergent pathways in the nutritional management of depression. Nutrients. 2024; 16 (16): 2806. doi: 10.3390/nu16162806.
- Ullah H., Khan A., Rengasamy K., et al. The efficacy of S-adenosyl methionine and probiotic supplementation on depression: a synergistic approach. Nutrients. 2022; 14 (13): 2751. doi: 10.3390/nu14132751.
- Xiao J., Lim L., Ng C., et al. Is fatty liver associated with depression? A meta-analysis and systematic review on the prevalence, risk factors, and outcomes of depression and non-alcoholic fatty liver disease. Front. Med. (Lausanne). 2021; 8: 691696. doi: 10.3389/fmed.2021.691696.
- Xu J., Wang X., Xu W., et al. The protective effect of S-adenosylmethionine on chronic adolescent stress-induced depression-like behaviors by regulating gut microbiota. Eur. J. Pharmacol. 2024; 982: 176939. doi: 10.1016/j.ejphar.2024.176939.
- Younossi Z.M., AlQahtani S.A., Funuyet-Salas J., et al. The impact of stigma on quality of life and liver disease burden among patients with nonalcoholic fatty liver disease. JHEP Rep. 2024; 6 (7): 101066. doi: 10.1016/j.jhepr.2024.101066.
- Younossi Z.M., Kalligeros M., Henry L. Epidemiology of metabolic dysfunction-associated steatotic liver disease. Clin. Mol. Hepatol. 2024. doi: 10.3350/cmh.2024.0431.
- Younossi Z.M., Paik J.M., Golabi P., et al. The impact of fatigue on mortality of patients with non-alcoholic fatty liver disease: data from National Health and nutrition examination survey 2005-2010 and 2017-2018. Liver Int. 2022; 42 (12): 2646-2661. doi: 10.1111/liv.15437.
