Внутрішньопухлинна мікробіота: значення у виникненні та лікуванні раку
Переклала й адаптувала канд. мед. наук Ольга Королюк
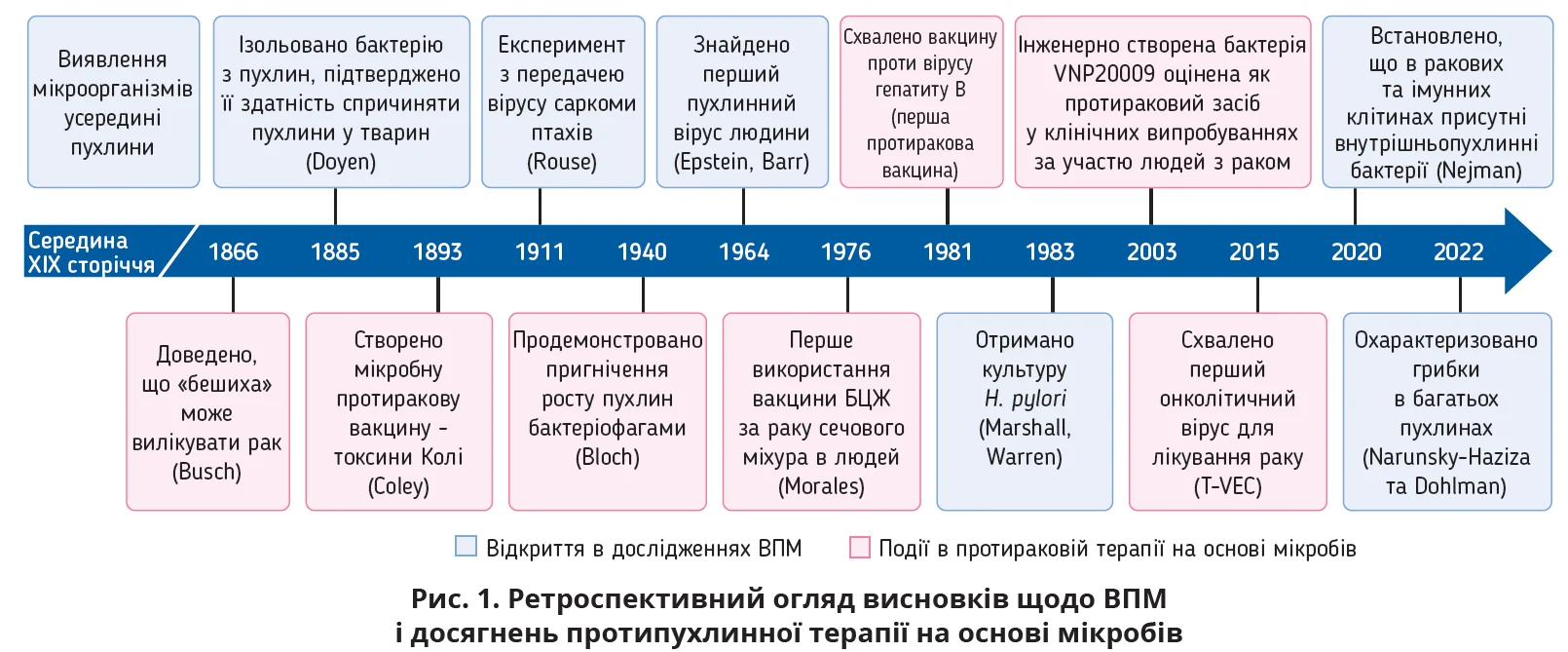
Мікробіота людини містить близько 38 трильйонів мікроорганізмів, що приблизно дорівнює кількості людських клітин. Завдяки інноваційним технологіям було встановлено, що тканини й органи, які колись вважалися стерильними (легені, молочна залоза, печінка, підшлункова залоза, простата, нирки), насправді містять мікробні спільноти. У зв’язку з виявленням мікроорганізмів у 33 основних типах злоякісних пухлин запропоновано концепцію внутрішньопухлинної мікробіоти (ВПМ), що є невід’ємною частиною мікрооточення пухлини. Мікроорганізми всередині пухлини здатні істотно змінювати біологію різних клітин, впливаючи на виникнення, розвиток і метастазування пухлин і протипухлинний імунітет. Основні повідомлення про важливі відкриття, пов’язані з ВПМ, ілюструє рисунок 1. Переклад огляду підсумовує характеристики й нові функції ВПМ у різних пухлинах травного тракту, вплив ВПМ на розвиток раку та протипухлинний імунітет і перспективи застосування ВПМ у прогнозуванні й терапії раку.
Характеристика ВПМ
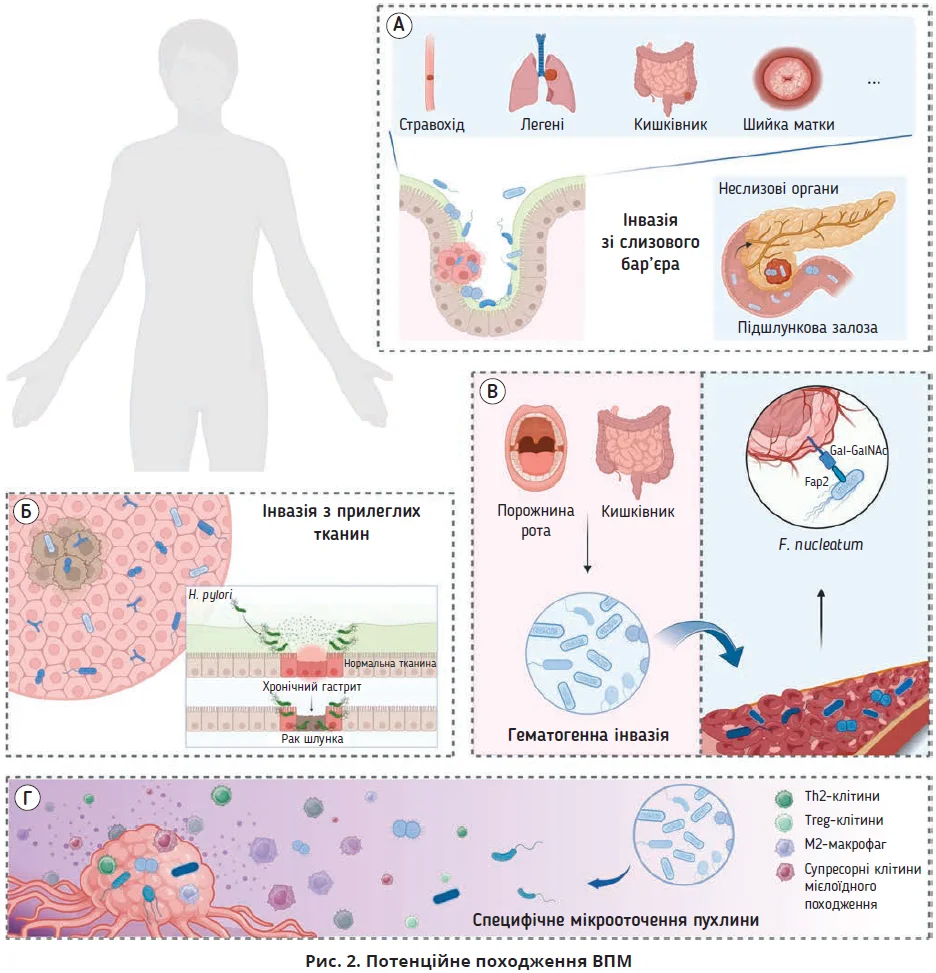
Колонізація пухлини мікроорганізмами
Основним джерелом є інвазія крізь слизовий бар’єр із проникненням мікробів у пухлину через пошкоджену слизову оболонку. Запропоновано бактерійну модель «водій – пасажир», у якій «водіями» є бактерії роду Bacteroides родини Enterobacteriaceae, які колонізують кишківник і стимулюють утворення пухлини. Зі зміною мікросередовища бактерії-«водії» поступово замінюються бактеріями-«пасажирами» – умовно-патогенними коменсалами або пробіотичними мікроорганізмами, які впливають на прогресування пухлини. Багато мікробів колонізують слизові оболонки стравоходу, легень, товстої кишки та шийки матки. Встановлено наявність ВПМ у неслизових органах, зокрема в підшлунковій залозі, внаслідок транслокації з кишкового тракту через панкреатичну протоку (рис. 2А).
Іншим джерелом ВПМ є інвазія з прилеглих тканин, адже мікробіоми пухлини та прилеглих нормальних тканин подібні. Специфічне хронічне запалення, опосередковане вірусами або бактеріями, зокрема гастрит, зумовлений Helicobacter pylori, може з часом перетворитися на пухлину. Походження мікроорганізмів у нормальних тканинах більшості органів не зрозуміле; мікроби можуть також поширюватися з місця пухлини; тому підтвердження цієї гіпотези потребує подальших досліджень (рис. 2Б).
Третім джерелом ВПМ є гематогенна інвазія, коли мікроорганізми з ротової порожнини або кишківника переносяться до пухлини та колонізують її через пошкоджені кровоносні судини. В експерименті встановлено, що внутрішньовенно введена бактерія Fusobacterium nucleatum взаємодіяла з полісахаридом D-галактозою-β(1-3)-N-ацетил-D- галактозаміном (Gal-GalNAc) у тканині аденокарциноми товстої кишки лектин-Fap2-залежним способом, що вказує на гематогенний шлях досягнення пухлини (рис. 2В).
Специфічні мікросередовища в пухлинах (імуносупресивні, гіпоксичні та метаболічні, збагачені поживними речовинами) можуть посилювати мікробну колонізацію (рис. 2Г). Проте ці припущення мають бути підтверджені шляхом цілісного метагеномного секвенування та генетичної ідентифікації.
Різноманітність ВПМ
Структура та чисельність популяції ВПМ за різних типів, підтипів і стадій раку істотно відрізняються.
Рак печінки
Більшість випадків первинного раку печінки становлять злоякісні гепатоцелюлярні пухлини, зокрема гепатоцелюлярна карцинома (ГЦК), яка зазвичай виникає внаслідок хронічного гепатиту. Понад 50% випадків раку печінки пов’язані з вірусом гепатиту B, понад 20% – з вірусом гепатиту C. У дослідженнях in vitro виявлено потенційний зв’язок між виникненням раку печінки та H. pylori; проте безпосередній вплив H. pylori на онкогенез дотепер не доведено. Деякі дослідники виявили мікроби в гепатоцитах і значно вищу кількість гамма-протеобактерій у ракових тканинах. Зокрема, при циротичних ГЦК спостерігалася більша кількість Streptococcaceae та Lactococcus, аніж у разі нециротичних ГЦК. За даними інших досліджень, у групі ГЦК була значно вища кількість Enterobacteriaceae; в групі ГЦК та внутрішньопечінкової холангіокарциноми – істотно менше Caulobacteraceae та Rickettsiaceae; в групі внутрішньопечінкової холангіокарциноми відзначено більший уміст Paraburkholderia fungorum у прилеглих тканинах і виявлено обернену кореляцію між Paraburkholderia fungorum і рівнями вуглеводного антигена-199 (CA199).
Колоректальний рак
Установлено, що Fusobacterium та ентеротоксигенні штами Bacteroides fragilis (ETBF) є канцерогенними факторами прогресування колоректального раку. Крім того, в пухлинах часто виявляли Lactococcus, Bacteroides, Fusobacterium, Prevotella та Streptococcus; натомість нормальні прилеглі тканини містили значно більше Pseudomonas та Escherichia-Shigella. В одному дослідженні виявлено різну кількість F. nucleatum на різних стадіях колоректального раку, з максимумом на III-IV стадіях. Однак інше дослідження не виявило F. nucleatum у більшості зразків колоректального раку та повідомляло про відсутність істотних відмінностей у мікробіомах пухлин і прилеглих тканин. Це може пояснюватися відмінностями у відборі пацієнтів і методах оцінювання. Виявлено також відмінності між раком лівої та правої половин товстої кишки: Bifidobacterium і Romboutsia переважали при пухлинах лівих відділів, Haemophilus і Veillonella – при раку правих відділів.
Що стосується грибів, то між аденомами та прилеглими тканинами переважали гриби родів Ascomycota, Glomeromycota та Basidiomycota; в пацієнтів з колоректальним раком відзначено вищий уміст Ascomycota, Malasseziomycetes, але меншу кількість Saccharomycetes і Pneumocystidomycetes.
У дослідженнях ВПМ зазвичай використовувалися зразки фекалій завдяки простій і неінвазивній процедурі збору. Проте для оцінювання фізіопатології більше підходять зразки тканини слизової оболонки кишківника, що потребує подальших досліджень.
Рак шлунка
У пацієнтів з раком шлунка та низкою передракових станів переважає H. pylori. У 9% випадків раку шлунка в злоякісних епітеліальних клітинах виявлено вірус Епштейна – Барр (EBV), який сильно корелює з гіперметилюванням промотора інгібітора циклінозалежної кінази 2A.
Мікробна різноманітність у ракових клітинах значно вища, ніж у клітинах доброякісних уражень: зокрема, більша поширеність родів Prevotella, Streptococcus, Veillonella, Haemophilus і Neisseria, проте менша поширеність Helicobacter. У тканинах раку шлунка відзначено високе навантаження потенційно карциномними бактеріями: Lactobacillus, Escherichia-Shigella, Lachnospiraceae, Nitrospirae, Burkholderia fungorum. В іншому дослідженні виявлено високий уміст Oceanobacter, Methylobacterium, Syntrophomonas у тканинах пухлини; вміст Methylobacterium значною мірою корелював з поганим прогнозом. Із прогресуванням раку шлунка може поступово зменшуватися кількість H. pylori та змінюватися різноманітність ВПМ. Спостерігалися також відмінності мікробіому в пацієнтів з гастритом, передраковими станами та раком шлунка: з погіршенням хвороби зменшувалася чисельність TM7, Porphyromonas, Neisseria та Streptococcus sinensis, а кількість Lactobacillus coleohominis і Lachnospiraceae – навпаки, зростала. Лонгітюдне проспективне дослідження виявило загалом шість мікробних таксономічних ознак (роди Moryella, Vibrio, Paludibacter, Agrobacterium, родина Comamonadaceae та порядок Clostridium), які можна використовувати для визначення ризику майбутнього раку шлунка.
Рак підшлункової залози
Рак підшлункової залози характеризується несприятливим прогнозом; більша частина випадків є аденокарциномою протоків підшлункової залози (АППЗ). Останні дослідження показали існування бактерій у підшлунковій залозі, причому ракові тканини містять більше бактерій, аніж звичайні тканини. У разі АППЗ переважають Proteobacteria, які домінують у складі мікробіому дванадцятипалої кишки. Встановлено, що H. pylori колонізує ракові клітини й асоціюється з активацією молекулярних шляхів ініціації та розвитку раку підшлункової залози. Проте види Helicobacter, виявлені в тканинах підшлункової залози та гастродуоденальної ділянки, відрізнялися; можливо, наявність Helicobacter у підшлунковій залозі не обов’язково вказує на міграцію з гастродуоденальної зони. Крім того, мікробна популяція АППЗ істотно відрізнялася від складу мікробів нормальних тканин підшлункової залози: в пухлинах переважали Pseudomonas та Elizabethkingia. Характерний ВПМ мають базальноподібні пухлини, особливо агресивний підтип АППЗ: значний уміст пов’язаних з канцерогенезом Acinetobacter, Pseudomonas і Sphingopyxis. Грибкова популяція АППЗ значно збагачена Malassezia.
Рак ротової порожнини
Мікробіом ротової порожнини містить понад 750 видів. У нормі переважають аероби; відсоток анаеробів зростає в разі раку. Плоскоклітинна карцинома порожнини рота (ПКПР) становить 90% епітеліальних злоякісних новоутворень ротової порожнини. Потенційним чинником виникнення ПКПР визнано вірус папіломи людини (HPV), з яким пов’язано близько 35% пухлин; найбільш значущим є HPV-16. Із ПКПР також асоційовані інші онкогенні віруси: EBV, вірус простого герпесу 1-го типу (HSV-1).
У слизовій оболонці порожнини рота присутня бактерія F. nucleatum, пов’язана з канцерогенезом. Іншим незалежним і вагомим чинником ризику раку є Porphyromonas gingivalis, які переважали в разі плоскоклітинного раку ясен і в тканинах ПКПР.
У пацієнтів з ПКПР установлено позитивну кореляцію між інфекцією P. gingivalis і пізньою стадією, поганою диференціацією пухлини й метастазами в лімфатичні вузли. У тканинах ПКПР виявлено також значну кількість Prevotella intermedia.
Із ПКПР і плоскоклітинною карциномою ротоглотки тісно корелює Treponema denticola. З раком ротової порожнини може асоціюватися Streptococcus anginosus, хоча результати досліджень суперечливі. В осіб з ПКПР виявлено також значну кількість Fusobacterium, Campylobacter і Pseudomonas aeruginosa. Із прогресуванням раку склад ВПМ змінюється: поширеність Fusobacterium збільшується, кількість Streptococcus, Haemophilus, Porphyromonas і Actinomyces зменшується.
Серед грибків у пацієнтів з ПКПР виявлено Candida albicans, Candida etchellsii та види, подібні до Hannaella luteola.
Роль ВПМ у розвитку раку
Прогресування раку зумовлене тим, що пухлинні клітини здатні підтримувати проліферацію, уникати пригнічення росту, протистояти апоптозу, забезпечуючи реплікативне безсмертя, індукувати ангіогенез, інвазію й метастазування. Хоча потенційна роль ВПМ в ініціюванні та прогресуванні раку залишається незрозумілою, вона може полягати в модуляції основних канцерогенних функцій між злоякісними та незлоякісними клітинами. Для пояснення ролі ВПМ в ініціюванні та прогресуванні раку запропоновано шість механізмів: 1) нестабільність геному та мутації; 2) епігенетична модифікація; 3) хронічне запалення; 4) уникнення впливу імунної системи; 6) регуляція метаболізму; 7) активація інвазії та метастазування (рис. 3). Розуміння механізмів є вирішальним для прогнозу й лікування раку.
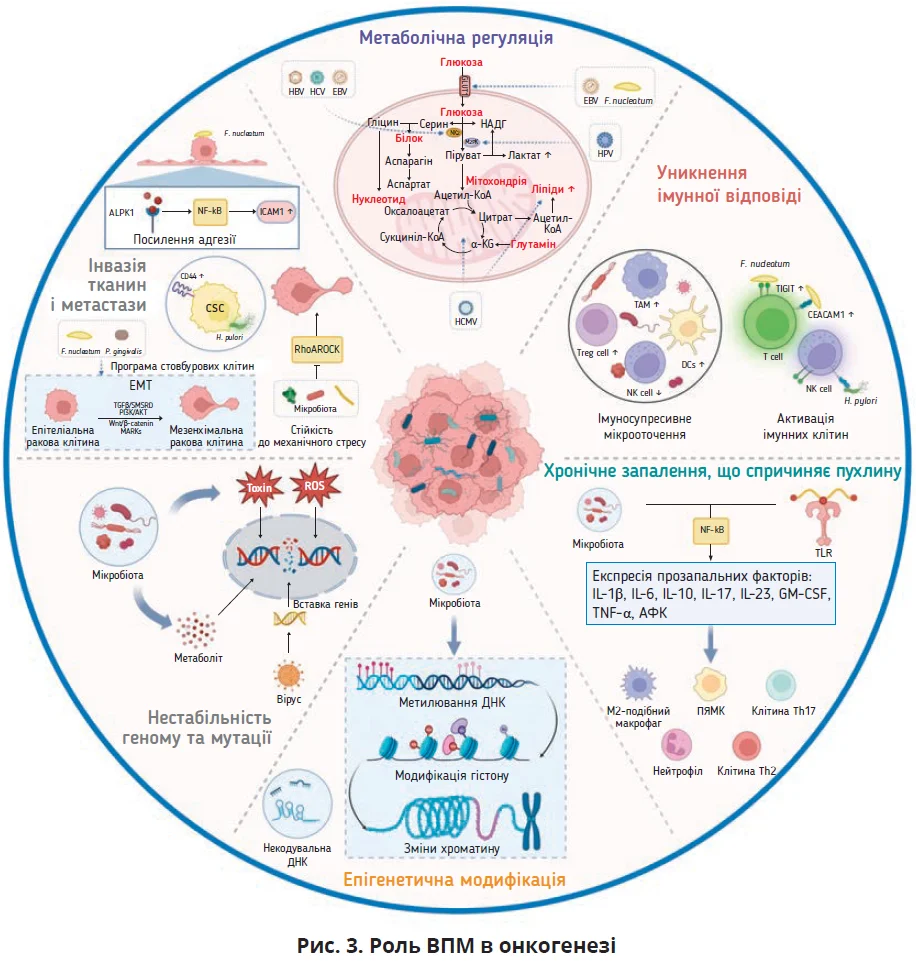
Нестабільність геному та мутації
Понад 10% злоякісних пухлин людини спричинені онковірусами, які інтегрують власний геном у хромосоми господаря, зумовлюючи генетичні мутації. Інтегрована дезоксирибонуклеїнова кислота (ДНК) призводить до продукції вірусного онкопротеїну, який модулює сигнальні шляхи господаря, змінює експресію генів і рибонуклеїнової кислоти (РНК).
У тваринних моделях онкопротеїн E7 HPV безпосередньо пригнічував шлях циклічного стимулятора генів інтерферону (STING) і знижував експресію генів, що кодують інтерферон 1-го типу (IFN-I) та прозапальні фактори, внаслідок чого пухлинні клітини уникали впливу імунної системи. Онкопротеїни EBV та герпесвірусів, асоційованих із саркомою Капоші, посилюють регуляцію онкогенних клітинних білків і мікроРНК у мишей, знижують регуляцію пухлинних супресорів і запускають сигнальні шляхи, зокрема ядерний фактор каппа – легкий ланцюг-підсилювач шляху активованих В-клітин (NF-κB), стимулюючи проліферацію та трансформацію В-клітин і ендотеліальних клітин. Т-лімфотропний вірус людини 1-го типу, ретровірус – тригер T-клітинної лейкемії дорослих, пригнічує шлях відновлення ДНК через власний білок Tax, що призводить до нестабільності геному та накопичення канцерогенних мутацій.
Певні канцерогенні бактерії, як-от pks+ Escherichia coli й ETBF, кодують і виділяють канцерогенні токсини, котрі пошкоджують ДНК, що пришвидшує онкогенез і підвищує смертність. Ключовий адгезин F. nucleatum зумовлює активацію Е-кадгерину/β-катеніну, що регулює кіназу CHK2, спричиняючи пошкодження ДНК у клітинах колоректального раку. Інфекція F. nucleatum призводить до ПКПР, зумовлюючи залежні від шляху Ku70/p53 дволанцюгові розриви ДНК. Ентеропатогенні E. coli та H. pylori, що експресують EspF, можуть заважати механізмам відновлення невідповідності ДНК, що посилює нестабільність геному та спричиняє онкогенез.
Щоб визначити безпосередню участь факторів вірулентності бактерій в індукуванні раку, потрібні подальші дослідження. Фундаментальна роль факторів вірулентності може полягати в реакції на пошкодження ДНК, що згодом активує імунну систему та зумовлює прозапальні зміни з формуванням сприятливого для раку мікросередовища. Діяльність мікроорганізмів здатна призводити до генерації активних форм кисню (АФК), сірководню та супероксиддисмутази. Зокрема, токсин ETBF збільшує експресію сперміноксидази в епітеліальних клітинах товстої кишки, запускаючи утворення АФК, що спричиняє пошкодження ДНК.
На онкогенез також впливає багато мікробних метаболітів, які зумовлюють пошкодження ДНК. Зокрема, S. anginosus і P. gingivalis здатні перетворювати етанол на ацетальдегід, що призводить до утворення адуктів ДНК або пригнічення ферментів відновлення ДНК, спричиняючи пошкодження ДНК й оральний канцерогенез.
Епігенетична модифікація
Важливу роль в онкогенезі відіграють епігенетичні шляхи через аномальне приглушення генів-супресорів пухлин і активацію онкогенів. Відомо, що бактерії виживають, розмножуються й уникають руйнування імунною системою господаря шляхом регулювання епігеному господаря. Індукція аномального метилювання ДНК є основним шляхом, яким H. pylori спричиняє аденокарциному шлунка. Вказаний механізм притаманний іншим шлунковим мікробам – Kytococcus sedentarius і Actinomyces oris, які призводять до аденокарциноми шлунка та метастазування. Дослідження, котре порівнювало ВПМ і профілі метилювання ДНК тканини ГЦК та нормальної тканини печінки, виявило 10 груп мікробіомів, які мали тісний зв’язок із 25 диференційно експресованими генами, пов’язаними з метилюванням.
У пацієнтів з колоректальним раком значна кількість F. nucleatum у пухлині асоціювалася з посиленням інфільтрації макрофагів і гіперметилюванням промоторного острівця циклінозалежної кінази 2A.
Молекулярні механізми епігенетичних змін, спричинених ВПМ, недостатньо вивчені. Ймовірно, мікроорганізми безпосередньо регулюють епігенетичні модифікації господаря. За даними досліджень, інфекція H. pylori зумовлює деметилювання субодиниць білка, що зв’язує гуаніннуклеотид β-44, шляхом активації NF-κB. F. nucleatum посилює транскрипцію довгих некодувальних РНК енолаза-1-інтронних транскриптів-1 через фактор транскрипції SP1, що змінює структуру декоратора гістонів на генах-мішенях, посилюючи гліколіз і канцерогенез. Hungatella hathewayi та F. nucleatum можуть бути посередниками гіперметилювання промотора генів-супресорів пухлин шляхом активації ДНК-метилтрансфераз у разі колоректального раку.
З іншого боку, мікроби синтезують і метаболізують велику кількість сполук, які служать епігенетичними субстратами та кофакторами або регулюють епігенетичні ферменти, тобто опосередковано впливають на епігенетичні модифікації господаря. Наприклад, фолієва кислота й вітаміни В2 та В12 є основними субстратами для метилювання ДНК і гістонів. Отримані з мікроорганізмів коротколанцюгові жирні кислоти зумовлюють геномні епігенетичні зміни, впливаючи на активність гістонацетилази та гістондеацетилази. Інші опосередковані механізми впливу включають продукцію АФК внаслідок хронічної інфекції F. nucleatum, що призводить до гіперметилювання ДНК. Описано індуковані бактерійною інфекцією зміни в різних некодувальних РНК та модифікацію структури хроматину.
Між вірусом і господарем також виникає перехресна взаємодія епігенетичної регуляції. Принаймні сім вірусів здатні спричиняти рак через епігенетичні зміни в клітинах-господарях. Описано декілька механізмів індукування раку печінки вірусом гепатиту В через модифікацію m6A РНК: реплікація вірусу, уникнення імунної відповіді та канцерогенез.
Отже, ВПМ прямо або опосередковано зумовлює епігенетичні зміни в клітинах господаря, модифікуючи ДНК, гістони, РНК та некодувальну РНК. Молекулярні механізми вказаних змін потребують подальшого вивчення.
Хронічне запалення
Більшість типів раку супроводжується стійким хронічним запаленням. Активація запальних сигнальних шляхів і каскадів може відбуватися через взаємодію ВПМ з рецепторами розпізнавання образів, зокрема Toll-подібними рецепторами (TLR). Експресія TLR можлива на різних імунних клітинах (макрофагах, дендритних клітинах, B-клітинах, певних типах T-клітин), а також на епітеліальних клітинах і фібробластах. Мікробіота АППЗ пригнічує поляризацію T-хелперів 1-го типу (Th1) CD4+ T-клітин і диференціацію M1-подібних макрофагів шляхом активації TLR, створюючи толерантну імунну програму. Fusobacterium, що розпізнається TLR4, посилює інтерлейкін-6 (IL-6) / перетворювач фосфосигналу й активатор сигнального шляху транскрипції-3, що призводить до M2-подібної поляризації макрофагів і прогресування колоректального раку в мишей. Дослідження асоційованої з колітом пухлиногенної моделі в мишей виявило, що мікробний ліпополісахарид / TLR4 опосередковує хемокінозалежне залучення моноцитоподібних макрофагів, спричиняючи утворення IL-1β й експансію клітин Th17. Як наслідок, підвищувалася кишкова проникність, спостерігалося надмірне вивільнення мікробних продуктів, що зумовлювало М2-подібну диференціацію макрофагів і створювало позитивну петлю зворотного зв’язку для залучення імуносупресивних клітин і формування толерогенного мікрооточення пухлини. Інша тваринна модель показала, що мікробні продукти активують запальні дендритні клітини в пухлині, індукуючи поляризацію клітин γδT17, які вивільняють IL-17, IL-8, фактор некрозу пухлин-альфа (TNF-α) й інші прозапальні цитокіни. Цитокіни спричиняють накопичення поліморфноядерних мієлоїдних супресорних клітин, перетворюючи запальне мікрооточення на імуносупресорне мікрооточення, що призводить до прогресування колоректального раку. Токсин ETBF запускає STAT3-NF-κB-залежний прозапальний сигнальний каскад з вивільненням IL-17 та IL-23, які приваблюють пропухлинні мієлоїдні клітини та зумовлюють дистальне пухлиноутворення товстої кишки. У дослідженнях на мишах показано, що F. nucleatum і Aggregatibacter actinomycetemcomitans активують TLR2 та TLR4, що призводить до активації NF-κB у макрофагах кісткового мозку з утворенням IL-6. Інфекція макрофагів Campylobacter conisus посилює регуляцію рецепторів розпізнавання образів і агрегацію індукованої IFN інфламасоми білка-16, що спричиняє рак стравоходу. Опосередковане F. nucleatum пригнічення автофагії в епітеліальних клітинах раку товстої кишки зумовлює накопичення АФК, запускаючи продукцію прозапальних цитокінів (IL-8, IL-1β, TNF-α).
Крім того, мікроби здатні індукувати макропіноцитоз, ендоцитну активність, яку клітини використовують для захоплення й доставлення антигена, щоб активувати запалення. Дослідження на мишах виявило, що шлях Wnt активує проліферацію макрофагів і стимулює поглинання макрофагами бактерій та їхніх продуктів у товсту кишку. Проте транскрипційні мішені для активації макропіноцитозу шляхом Wnt недостатньо вивчені. Перехресні взаємодії між ВПМ і поліморфноядерними нейтрофілами також призводять до розвитку раку. Зокрема, втрата нейтрофілів зумовлює збагачення Akkermansia в мишачій моделі колоректального раку. ВПМ здатні підвищувати утворення IL-17 та інфільтрацію пухлини В-клітинами, що спричиняє ріст пухлини та прогресування раку.
Запальна реакція супроводжується імунною відповіддю. Стрес і пошкодження тканин унаслідок мікробної інфекції залучають імунні клітини для сприяння запаленню та подальшої активації різних пропухлинних запальних факторів. Хронічне запальне мікрооточення зрештою перетворюється на імуносупресивне мікрооточення, зумовлюючи прогресування пухлини та пригнічення протипухлинного імунітету. Запальні клітини в ділянках інфікування здатні виробляти АФК, що пошкоджують ДНК та посилюють запальні реакції, поглиблюючи пошкодження ДНК. Між різними патогенними механізмами онкогенезу існують перехрести.
Уникнення імунної відповіді
Взаємодія між мікроорганізмами та господарем відіграє важливу роль у підтримці імунного гомеостазу. ВПМ здатні уникати імунної відповіді та впливати на онкогенез, спричиняючи імуносупресивне мікросередовище й інактивацію імунних клітин. Зокрема, F. nucleatum регулює імунне мікрооточення пухлини шляхом вибіркової агрегації мієлоїдних клітин, які інфільтрують пухлину, що посилює пухлиногенез. Віруси гепатитів B та C потенційно зумовлюють прогресування раку печінки внаслідок імуносупресії, опосередкованої Т-регуляторними клітинами (Tregs). Відомо, що Tregs можуть перешкоджати імунній відповіді проти HPV. У дослідженнях in vivo й in vitro грибкова популяція тканини АППЗ стимулювала експресію специфічного для ракових клітин IL-33, що призводило до рекрутування й активації клітин Th2 та вроджених лімфоїдних клітин-2, що посилювало прогресування пухлини.
Уникнення ВПМ імунної відповіді може пояснюватися інактивацією імунних клітин. У мишей ВПМ раку підшлункової залози спричиняв супресивну диференціацію макрофагів M1 через диференційну активацію селективного TLR для індукування анергії Т-клітин. Білок F. nucleatum може зв’язувати й активувати імунорецептор Т-клітин з імуноглобуліном та імунорецепторними доменами інгібіторного мотиву на основі тирозину та рецепторами молекули-1 клітинної адгезії карциноембріонального антигена (CEACAM1), які експресують NK-клітини людини й інші лімфоцити, пригнічуючи функцію протипухлинних імунних клітин у разі колоректального раку. Адгезин зовнішньої мембрани H. pylori взаємодіє з CEACAM1, що призводить до інактивації імунних клітин і міграції асоційованого з цитотоксином гена A (CagA) в клітини господаря з утворенням IL-8, що зумовлює рак шлунка. Крім того, CagA відповідальний за передракові ураження шлунка; ймовірно, цей процес опосередкований сигнальним шляхом Sonic Hedgehog.
Багато досліджень показали, що ВПМ має опосередкований вплив на імунну активацію та протипухлинний імунітет. Зокрема, HPV асоціювався з масивною інфільтрацією IFN-γ+ CD8+ T-клітин та IL-17+ CD8+ T-клітин у разі плоскоклітинного раку голови й шиї, що може пояснювати значно кращу відповідь HPV-позитивних пацієнтів на імунотерапію. У мишей кишкові мікроби Bifidobacterium переважно колонізують пухлини та посилюють передачу сигналів STING/IFN-I у дендритних клітинах усередині пухлини, сприяючи Т-клітинозалежним протипухлинним відповідям. Мишача модель колоректального раку показала, що колонізація Helicobacter hepaticus корелює з високою інфільтрацією мієлоїдних клітин CD11c+, Т- і В-клітин, що сприяє зменшенню пухлини. Індол-3-молочна кислота, отримана з Lactobacillus plantarum, збільшувала продукцію IL-12a дендритними клітинами, ініціюючи протипухлинних захист CD8+ T-клітин. Інший експеримент на мишах виявив, що внутрішньопухлинна Lactobacillus reuteri вивільняє харчовий катаболіт триптофану індол-3-альдегід, що стимулювало IFN-γ-продукувальні CD8+ T-клітини та посилювало терапевтичний ефект інгібіторів імунних контрольних точок. Метаболіт інозин, що продукували Bifidobacterium pseudolongum у мишачій моделі колоректального раку, індукував експресію Th1-регулювальних генів у CD4+ T-клітинах, сприяючи протипухлинній імунотерапії.
Загалом мікробіота та її метаболіти є потенційними терапевтичними мішенями імунотерапії; їхні ефекти потребують подальшого вивчення.
Далі буде.
Література
Cao Y., Xia H., Tan X., Shi C., Ma Y., Meng D., Zhou M., Lv Z., Wang S., Jin Y. Intratumoural microbiota: a new frontier in cancer development and therapy. Signal Transduct. Target. Ther. 2024 Jan 10; 9 (1): 15. doi: 10.1038/s41392-023-01693-0.
