Вміст аргініну та його метаболітів у хворих на хронічну лімфоцитарну лейкемію на тлі хіміотерапії й S-адеметіоніну
Автори: Ігор Миколайович СКРИПНИК, доктор медичних наук, професор, президент ГО «Українська гастроентерологічна асоціація», проректор із науково-педагогічної роботи та післядипломної освіти, професор кафедри внутрішньої медицини № 1 Полтавського державного медичного університету. Ганна Сергіївна МАСЛОВА, доктор медичних наук, завідувачка кафедри внутрішньої медицини № 1 Полтавського державного медичного університету.
Одним із найпоширеніших видів лейкемій у західних країнах є В-клітинна хронічна лімфоцитарна лейкемія (В-ХЛЛ) із частотою нових випадків 4,2 на 100 000 на рік. Захворюваність на В-ХЛЛ зростає з віком, перевищуючи 30:100 000 на рік у осіб віком понад 80 років.
Медіана віку пацієнтів із первинним діагнозом В-ХЛЛ становить 72 роки. Близько 10% від загальної кількості хворих на ХЛЛ становлять особи віком менш як 55 років [8]. В-ХЛЛ характеризується накопиченням зрілих, зазвичай неопластичних В-лімфоцитів CD5+, CD23+ у периферичній крові, кістковому мозку, лімфатичних вузлах, селезінці [2, 8]. Незважаючи на величезний прогрес у лікуванні В-ХЛЛ інгібіторами трансдукції сигналу рецепторів В-клітин (ібрутиніб) та інгібіторами bcl2 (венетоклакс), проблема ефективного лікування пацієнтів потребує подальшого вивчення [8, 20].
Тактика ведення хворих на В-ХЛЛ залежить від сукупності чинників, а саме від біологічних характеристик пухлини, наявності симптомів активності й розповсюдженості пухлинного процесу; віку пацієнта, супутньої патології та її тяжкості [2]. Протягом останніх десятиліть вивчається роль аргініну та його метаболітів у розвитку й прогресуванні солідних і гематологічних пухлин. Однією з ключових ознак пухлинної клітини є перебудова її метаболічного програмування [10, 12-15]. Спостерігається підвищене поглинання глюкози пухлиною в поєднанні з її надмірним використанням у процесах аеробного гліколізу, що називають ефектом Варбурга [10]. Особливого значення в підтримці життєдіяльності та постійного росту клітин пухлини мають амінокислоти [10, 12, 13]. Це створює можливість за допомогою медикаментозних препаратів утручатися в метаболізм пухлинних клітин [12, 15].
Аргінін являє собою частково незамінну амінокислоту. В умовах пухлинного процесу спостерігається зростання потреби в аргініні, що пов’язано з надмірним поглинанням останнього клітинами пухлини. Доведено, що клітини пухлини є аргінінауксотрофними, тобто такими, що втратили можливість підтримувати власний рівень аргініну шляхом його ресинтезу [6, 14, 15]. Це зумовлено відсутністю на пухлинних клітинах експресії аргінінсукцинатсинтази й аргінінсукцинатліази, які метаболізують цитрулін до аргініну. Підтримка належного рівня аргініну в такому випадку можлива лише завдяки його транспорту з позаклітинного середовища [20]. У мікрооточенні пухлин конкурентами за аргінін виступають імунні клітини. Аргінін-ауксотрофія підтверджена для меланоми, саркоми, гепатоцелюлярної карциноми, а також гострої мієлобластної та гострої лімфобластної лейкемії [15, 20].
З іншого боку, на процеси канцерогенезу може впливати активність орнітиндекарбоксилази (ОДК) – ферменту аргінін/цитрулінового циклу, що забезпечує метаболізм орнітину з утворенням путресцину, спермідину та сперміну. Саме підвищення утворення поліамінів вважають чинником ризику виникнення та прогресування пухлин [11, 16, 17, 19].
Важливою проблемою проведення хіміотерапії (ХТ) у хворих на В-ХЛЛ є ймовірність розвитку гепатотоксичних реакцій, що можуть бути зумовленими як впливом онкогематологічного захворювання, так і дією препаратів цитостатичного ряду. Із цього погляду важливим є розроблення супровідної терапії, яка має включати засоби профілактики виникнення гепатотоксичних реакцій. Під час вибору препарату гепатопротекторної дії потрібно враховувати його вплив на аргінін/цитруліновий цикл.
Мета – дослідити характер змін аргініну та його метаболітів у динаміці призначення S-адеметіоніну на тлі програмної ХТ у хворих на В-ХЛЛ.
Матеріали та методи
Обстежено 26 хворих на В-ХЛЛ, яким проводили ХТ на базі гематологічного відділення КП «Полтавська обласна клінічна лікарня ім. М.В. Скліфосовського ПОР» за період із 2012 по 2019 рік. Співвідношення чоловіків і жінок – 14 (53,8%) та 12 (46,2%) осіб. Діапазон віку обстежених хворих становив 54-78 років. До дослідження були включені хворі на В-ХЛЛ з ознаками прогресії онкогематологічного захворювання. Встановлення діагнозу В-ХЛЛ, визначення показань до призначення цитостатичної терапії, вибір схеми ХТ, критерії відповіді на ХТ було встановлено відповідно до наказу МОЗ України від 12.05.2016 № 439, протоколу ЕSМО. Загальний стан обстежених пацієнтів за ECOG відповідав І-ІІ, а за індексом Карновського – 60-80%. Критерієм включення в дослідження була наявність надмірної ваги або ожиріння. Визначали антропометричні показники пацієнтів: зріст і вагу. Підраховували індекс маси тіла (ІМТ) за формулою: ІМТ = вага (кг) / зріст (м2). У дослідження були включені хворі на ГМЛ з ІМТ >25 кг/м2.
Пацієнтам призначали специфічну цитостатичну терапію згідно зі схемами FC±R (флударабін 25 мг/м2 – 1-3-й дні, циклофосфан 300 мг/м2 – 1-3-й дні, ритуксимаб 375 мг/м2 у 1-й день), BR (бендамустин 90 мг/м2 у 1-й і 2-й дні, ритуксимаб 375 мг/м2 у 1-й день 1 цикл, потім із 2-го циклу 500 мг/м2 на добу в 1-й день), CVP±R (циклофосфамід 300 мг/м2 1-5-й дні, вінкристин 1,4 мг/м2 (до 2 мг) у 1-й день, преднізолон 40 мг/м2 1-5-й дні, ритуксимаб 375 мг/м2 на добу в 1-й день). Цикл ХТ повторювали що 28 днів. Залежно від включення в терапію супроводу S-адеметіоніну пацієнти були розподілені на дві групи:
І (n=12) – хворі на В-ХЛЛ, що отримували ХТ;
II (n=14) – хворі на В-ХЛЛ, яким на тлі ХТ призначали S-адеметіонін (Гептрал®) 1000 мг на добу внутрішньовенно крапельно на 250 мл 0,9% розчину натрію хлориду 10 днів, потім 1000 мг на добу перорально протягом 18 днів (цикл повторювали що 28 днів).
Стан хворих оцінювали двічі: перед початком ХТ і після двох курсів ХТ. У сироватці крові досліджували вміст аргініну [3], цитруліну [7], активність аргінази [4], ОДК [5]. Контрольну групу становили 20 практично здорових осіб, із них 9 (45%) жінок, 11 (55%) чоловіків віком 22-26 років.
Статистичну обробку отриманих результатів дослідження проводили з використанням статистичної програми GraphPad Prism версії 5.00 (GraphPad Software, Inc., США, ліцензійний номер: U1048-12MC), що дає змогу проводити параметричний і непараметричний статистичний аналіз. За нормального розподілу даних результати представляли у вигляді середніх арифметичних величин (М) та їхньої похибки (m). Достовірність відмінностей розраховували за допомогою критерію Стьюдента (t). При розподілі, що відрізняється від нормального, використовували парні непараметричні методи рангових критеріїв Вілкоксона (W). Взаємозв’язок досліджуваних показників оцінювали з використанням кореляційного аналізу за Пірсоном (r). Статистично достовірними вважали відмінності при p<0,05 [1].
Результати та їх обговорення
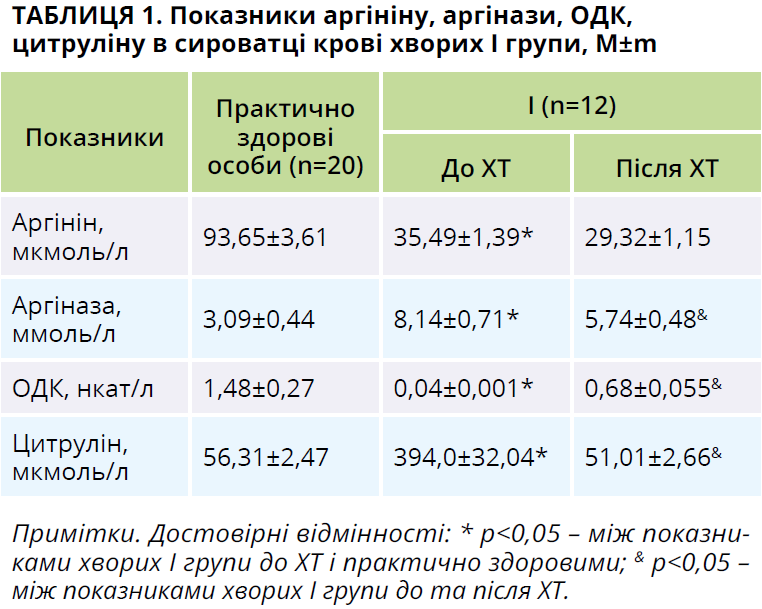
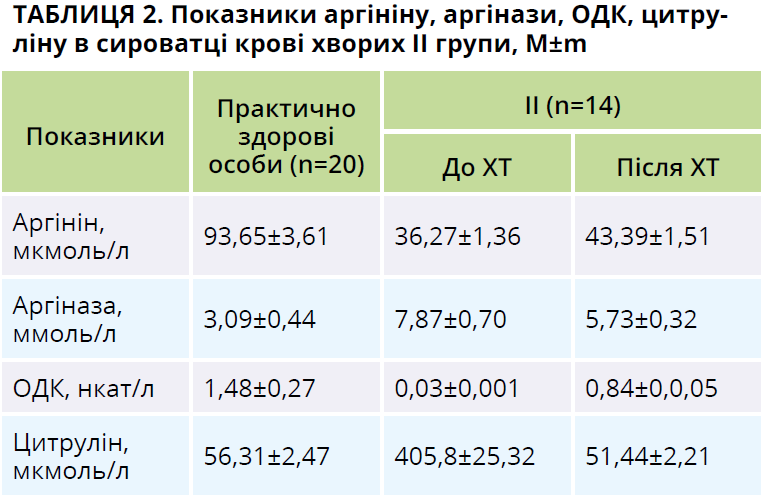
Під час первинного обстеження хворих на В-ХЛЛ І та ІІ груп установлено порушення аргінін/цитрулінового циклу, які зумовлені прогресією онкогематологічного захворювання. Вміст аргініну в сироватці крові хворих І та ІІ груп зростав у 2,6 раза порівняно з практично здоровими особами (р=0,0005 за критеріями t і W для пацієнтів І групи; р=0,0001 за критеріями t і W для пацієнтів ІІ групи; табл. 1, 2). Це може бути зумовлено підвищенням захоплення аргініну клітинами пухлини [12-15]. Одночасно в пацієнтів І групи виявлено зростання активності аргінази сироватки крові у 2,6 раза (р=0,001 за критеріями t і W; табл. 1), у хворих ІІ групи – у 2,5 раза (р=0,0004 за критеріями t і W; табл. 2). Висока активність аргінази характерна для активної фази онкологічних і онкогематологічних пухлин [12-15, 20].
В осіб І групи з прогресією В-ХЛЛ активність ОДК значно зменшувалася – у 37 разів (р=0,0005 за критеріями t і W; табл. 1), а у хворих ІІ групи – у 49 разів (р=0,0001 за критеріями t і W; табл. 2). Отримані нами результати можна пояснити гіпометиляцією гена ОДК на тлі В-ХЛЛ. Важливо, що за умови прогресії гострої лімфобластної, гострої мієлобластної лейкемій і множинної мієломи не спостерігається гіпометиляції гена ОДК, який може бути причиною пригнічення синтезу ОДК [18].
У пацієнтів до початку ХТ виявлено зростання вмісту цитруліну в сироватці крові: у хворих І групи – в 7 разів (р=0,0005 за критеріями t і W; табл. 1), у хворих ІІ групи – в 7,2 раза (р=0,0001 за критеріями t і W; табл. 2). Підвищення концентрації цитруліну в сироватці крові пацієнтів може бути зумовлене зростанням активності синтази оксиду азоту переважно через індуцибельну її форму [14].
У хворих на В-ХЛЛ до початку ХТ виявлено наявність високого прямого кореляційного зв’язку між умістом аргініну та цитруліну в сироватці крові (r=+0,6; р=0,03 за Пірсоном для пацієнтів І групи; r=+0,7; р=0,002 за Пірсоном для пацієнтів ІІ групи).
Після двох курсів ХТ у пацієнтів І групи, які отримували виключно цитостатичну терапію, в сироватці крові спостерігалося зниження активності аргінази в 1,4 раза (р=0,0005 за критеріями t і W; табл. 1) за одночасного зростання активності ОДК у 17 разів (р=0,0005 за критеріями t і W; табл. 1). У сироватці крові хворих І групи спостерігалося зниження вмісту цитруліну в 7,7 раза (р=0,0005 за критеріями t і W; табл. 1). Отримані нами результати можна пояснити ефективністю ХТ і зменшенням об’єму пухлини [12]. У хворих І групи після проведення специфічної ХТ виявлено наявність високого прямого кореляційного зв’язку між активністю аргінази й ОДК у сироватці крові (r=+0,7; р=0,002 за Пірсоном) і високого зворотного кореляційного зв’язку між активністю аргінази та вмістом цитруліну в сироватці крові (r=-0,8; р=0,002 за Пірсоном).
У хворих ІІ групи, які на тлі ХТ отримували S-адеметіонін, під час другого обстеження в сироватці крові спостерігалося зростання вмісту аргініну в 1,2 раза (р=0,01 за критеріями t і W; табл. 2), пригнічення активності аргінази в 1,4 раза (р=0,01 за критеріями t і W; табл. 2), підвищення активності ОДК у 28 разів (р=0,001 за критеріями t і W; табл. 2), зменшення концентрації цитруліну в 7,9 раза (р=0,0001 за критеріями t і W; табл. 2) порівняно з первинним обстеженням.
Динаміку показників аргінін/цитрулінового циклу в пацієнтів ІІ групи також можна пояснити ефективним проведенням ХТ. У хворих ІІ групи після проведення двох курсів ХТ виявлено наявність високого прямого кореляційного зв’язку між активністю аргінази й ОДК у сироватці крові (r=+0,8; р=0,001 за Пірсоном) і помірного зворотного кореляційного зв’язку між активністю ОДК і вмістом цитруліну в сироватці крові (r=-0,4; р=0,04 за Пірсоном).
Після двох курсів ХТ зі включенням до складу супровідної терапії S-адеметіоніну (Гептрал®) вміст аргініну в сироватці крові хворих ІІ групи зростав у 1,5 раза (р=0,0005 за критеріями t і W; табл. 1, 2), а активність ОДК – в 1,2 раза (р=0,0005 за критеріями t і W; табл. 1, 2) порівняно з пацієнтами І групи. За результатами нашого дослідження, показники аргінін/цитрулінового циклу на тлі терапії S-адеметіоніном не досягли рівня практично здорових осіб. Отже, призначення S-адеметіоніну (Гептрал®) на тлі ХТ дає змогу підтримувати рівень показників аргініну та продуктів його метаболізму на рівні, що потрібний для підтримки функціонування клітин організму й запобігання розвитку ускладнень цитостатичної терапії [9].
Висновки
- На тлі прогресії В-ХЛЛ спостерігається порушення аргінін/цитрулінового циклу, що характеризуються зменшенням умісту аргініну й активності ОДК і зростанням активності аргінази та концентрації цитруліну в сироватці крові (р<0,05).
- Проведення ХТ хворим на В-ХЛЛ зі включенням до складу супровідної терапії S-адеметіоніну (Гептрал®) дає змогу підвищити рівень аргініну в 1,2 раза (р=0,01), знизити активність аргінази в 1,4 раза (р=0,01), збільшити активність ОДК у 28 разів (р=0,001) і зменшити вміст цитруліну
в 7,9 раза (р=0,0001) у сироватці крові.
UKR2296836
Література
- Антомонов М.Ю. Математическая обработка и анализ медико-биологических данных. – Киев: Мединформ, 2018. – 579 с.
- Крячок И.А. Хронический лимфолейкоз: новое в лечении. Подходы к терапии первой линии и их эволюция. Клиническая онкология. 2013; 3 (11): 121-9.
- Стюарт Дж., Янг Дж. Твердофазный синтез пептидов / Ред.: Швачкина Ю.П. Перевод с англ.: Мишина Г.П. – Москва: Мир, 1971. – С. 129-130.
- Храмов В.А., Листопад Г.Г. Модификация метода определения орнитина по Chinard и ее использование для количественного определения сывороточной аргиназы. Лабораторное дело. 1973; 10: 591-2.
- Храмов В.А. Простой метод определения активности орнитиндекарбоксилазы в смешанной слюне человека. Клиническая лабораторная диагностика. 1997; 4: 14-5.
- Al–Koussa H., Mais N.E., Maalouf H., Abi–Habib R., El–Sibai Mirvat. Arginine deprivation: a potential therapeutic for cancer cell metastasis? A review. Cancer Cell Int. 2020; 20: 150. doi: 10.1186/s12935-020-01232-9.
- Boyde T.R., Rahmatullah M. Optimization of conditions for the colorimetric determination of citrulline, using diacetyl monoxime. Analytical Biochemistry. 1980; 107: 424-31.
- Eichhorst B., Robak T., Montserrat E., Ghia P., Hillmen P., Hallek M., et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2015; 26 (Supplement 5): v78-84. doi: 10.1093/annonc/mdv303.
- Frau M., Feo F., Pascale R.M. Pleiotropic effects of methionine adenosyltransferases deregulation as determinants of liver cancer progression and prognosis. J. Hepatol. 2013; 59 (4): 830-41. doi: 10.1016/j.jhep.2013.04.031.
- Hosios A.M., Hecht V.C., Danai L.V., Johnson M.O., Rathmell J.C., Steinhauser M.L., et al. Amino acids rather than glucose account for the majority of cell mass in proliferating mammalian cells. Dev. Cell. 2016; 36 (5): 540-49. doi: 10.1016/j.devcel.2016.02.012.
- Lam S.K., U K.P., Li Y.Y., Xu S., Cheng P.N., Ho J.C. Inhibition of ornithine decarboxylase 1 facilitates pegylated arginase treatment in lung adenocarcinoma xenograft models. Oncol. Rep. 2018; 40 (4): 1994-2004. doi: 10.3892/or.2018.6598.
- Martinez-Outschoorn U.E., Peiris-Pages M., Pestell R.G., Sotgia F., Lisanti M.P. Cancer metabolism: a therapeutic perspective. Nat. Rev. Clin. Oncol. 2017; 14 (2): 113. doi: 10.1038/nrclinonc.2016.60В.
- McCracken A.N., Edinger A.L. Nutrient transporters: the Achilles’ heel of anabolism. Trends Endocrinol. Metab. 2013; 24 (4): 200-8. doi: 10.1016/j.tem.2013.01.002.
- Morris S.M. Recent advances in arginine metabolism: roles and regulation of the arginase. British Journal of Pharmacology. 2009; 157 (6): 922-30. doi: 10.1111/j.1476-5381.2009.00278.x.
- Pavlova N.N., Thompson C.B. The emerging hallmarks of cancer metabolism. Cell Metab. 2016; 23 (1): 27-47. doi: 10.1016/j.cmet.2015.12.006.
- Saltykova L.B., Blinov M.N. Polyamine levels and biosynthesis in leukocytes during leukemic transformation. Eksp Onkol. 1987; 9 (2): 18-21.
- Stabellini G., Calastrini C., Gagliano N., Dellavia C., Moscheni C., Vizzotto L., et al. Polyamine levels and ornithine decarboxylase activity in blood and erythrocytes in human disease. Int. J. Clin. Pharmacol. Res. 2003; 23 (1): 17-22.
- Wahlfors J., Hiltunen H., Heinonen K., Hämäläinen E., Alhonen L., Jänne J. Genomic hypomethylation in human chronic lymphocytic leukemia. Blood. 1992; 80 (8): 2074-80.
- Wang M.F., Liao Y.F., Hung Y.C., Lin C.L., Hour T.C., Lue K.H., et al. Hydroxydibenzoylmethane induces apoptosis through repressing ornithine decarboxylase in human promyelocytic leukemia HL-60 cells. Experimental and Molecular Medicine. 2011; 43 (4): 189-96. doi: 10.3858/emm.2011.43.4.023.
- Werner A., Pieh D., Echchannaoui H., Rupp J., Rajalingam K., Theobald M., et al. Cationic amino acid transporter-1-mediated arginine uptake is essential for chronic lymphocytic leukemia cell proliferation and viability. Front. Oncol. 2019. doi: 10.3389/fonc.2019.01268.
Освітньо-практичний журнал Gastro Practice №1 2023р.