Синдром холестазу: сучасні можливості у веденні пацієнтів
 Автор: Галина Анатоліївна СОЛОВЙОВА, докторка медичних наук, професорка, завідувачка кафедри внутрішніх хвороб стоматологічного факультету Національного медичного університету ім. О.О. Богомольця, керівниця Гастроцентру клініки «Оберіг» (м. Київ)
Автор: Галина Анатоліївна СОЛОВЙОВА, докторка медичних наук, професорка, завідувачка кафедри внутрішніх хвороб стоматологічного факультету Національного медичного університету ім. О.О. Богомольця, керівниця Гастроцентру клініки «Оберіг» (м. Київ)
Визначення та класифікація холестазу
Холестаз визначають як патологічний стан, за якого різноманітні внутрішньопечінкові та позапечінкові чинники порушують утворення, секрецію або екскрецію жовчі, що призводить до збільшення надходження жовчі в кров [1].
У здорової дорослої людини щодоби утворюється 600 мл жовчі, з яких 450 мл продукують гепатоцити та 150 мл – холангіоцити [1]. Отже, за місцем виникнення холестаз класифікують на внутрішньопечінковий і позапечінковий. Внутрішньопечінковий холестаз (ВПХ) характеризується дисфункцією гепатоцитів, жовчних канальців, каналів Герінґа, жовчних дуктул (<15 мкм) або холангіоцитів міжчасточкових жовчних проток (15-100 мкм) без ознак явної обструкції при виконанні методів візуалізації. Своєю чергою, ВПХ класифікується на печінковоклітинний і каналікулярний; пошкодження гепатоцитів і холангіоцитів зумовлює змішаний холестаз [1]. У пацієнтів з лабораторними ознаками холестазу слід зібрати ретельний анамнез щодо вживання ліків, які можуть спричиняти холестатичні розлади.
Позапечінковий холестаз характеризується обструкцією або ураженням септальних (>100 мкм), регіональних (300-400 мкм) або сегментарних (400-800 мкм) жовчних проток, правої чи лівої печінкових проток або загальної жовчної протоки до ампули сосочка дванадцятипалої кишки. Основними причинами позапечінкового холестазу є конкременти в жовчних протоках, злоякісні пухлини підшлункової залози або жовчної протоки й ампули чи доброякісні стриктури жовчних шляхів, а також рак жовчних шляхів, що проростає у внутрішньопечінкову або загальну жовчну протоку у воротах печінки. Окремі хвороби, як-от первинний склерозивний холангіт (ПСХ), здатні уражати як внутрішньо-, так і позапечінкові жовчні протоки [1].
За тривалістю холестаз класифікують на гострий (<6 місяців) і хронічний (>6 місяців) [1].
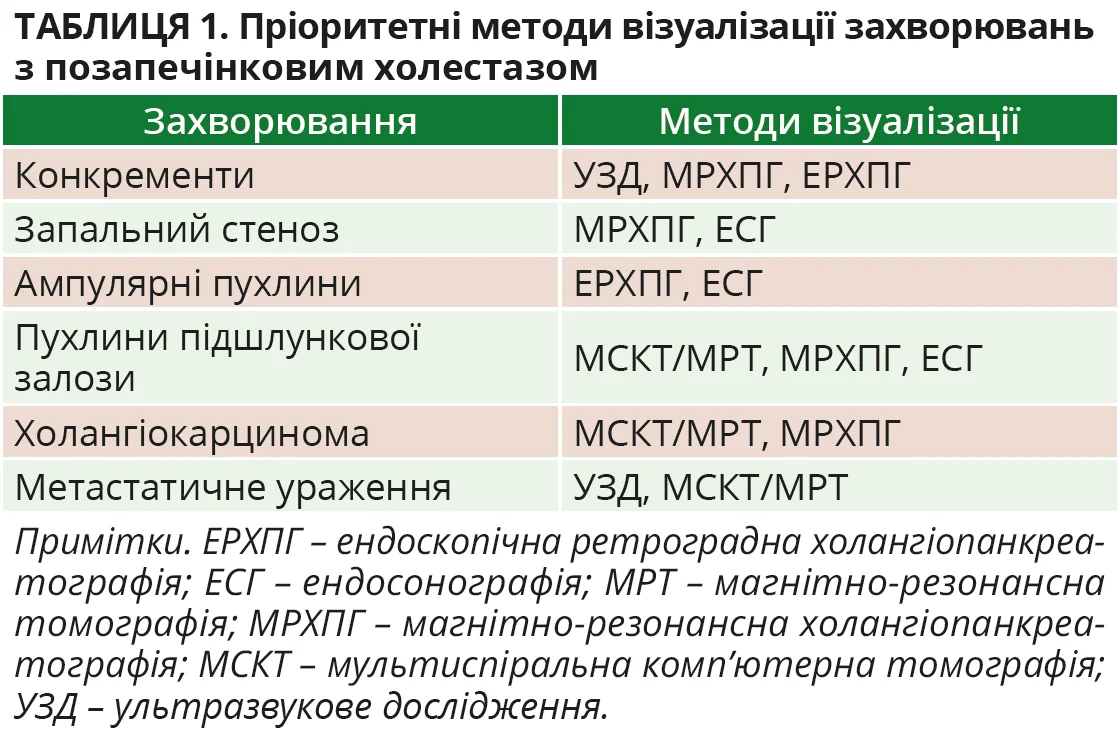
Для клініцистів важливо розрізняти позапечінковий і внутрішньопечінковий холестаз, що доволі складно на підставі виключно клінічних проявів і біохімічних маркерів. Зазвичай потрібна детальна діагностика, яка передбачає ретельний збір анамнезу, фізикальне обстеження, застосування лабораторних методів і візуалізації. Більшість станів позапечінкового холестазу є гострими, у їх діагностиці ключове значення мають методи візуалізації, підсумовані в таблиці 1.
Лабораторні маркери синдрому холестазу
Найпоширенішими маркерами холестазу є лужна фосфатаза (ЛФ), γ-глутамілтранспептидаза (ГГТП), жовчні кислоти та прямий білірубін. Часто в пацієнтів з холестазом спостерігається гіперліпідемія.
Вважається, що затримка жовчних солей за холестазу призводить до проліферації малих жовчних проток, унаслідок чого посилюється вироблення ЛФ і ГГТП, але досі не встановлені точні механізми їх підвищення в сироватці крові. Завдяки поверхневій активності жовчні кислоти розчиняють ЛФ з ліпідних мембран, що, принаймні частково, пояснює підвищення активності ЛФ у сироватці крові [1]. Підвищення ЛФ можливе також під час вагітності, в дітей у періоди активного росту, а також у пацієнтів із захворюваннями кісток і певними пухлинами.
У таких випадках ГГТП підвищується раніше й утримується довше. Серед печінкових ферментів ГГТП має найвищу діагностичну чутливість щодо холестазу, але низьку специфічність. Підвищення активності ЛФ і ГГТП вказує на пошкодження гепатоцитів і холангіоцитів за умови, що виключені інші причини ураження печінки (алкоголізм, інфекції тощо). Підвищення активності ГГТП за нормальної активності ЛФ указує на пошкодження жовчних канальців і холангіоцитів. Підвищення активності ЛФ за нормальної активності ГГТП вказує на те, що пошкодження печінки малоймовірне, за винятком окремих холестатичних захворювань, як-от прогресивний сімейний ВПХ 1-го, 2-го та 4-6-го типів, доброякісний рецидивний ВПХ, дефіцит USP53; в таких випадках рівні білірубіну або жовчних кислот підвищені, а рівні ГГТП нормальні або навіть знижені [1, 3].
Діагностичні критерії холестазу
Європейська асоціація з вивчення печінки (EASL), яка опублікувала настанови щодо лікування холестатичних захворювань печінки, запропонувала діагностичні критерії з використанням верхньої межі норми (ВМН) активності ферментів у сироватці крові: ЛФ >1,5×ВМН; ГГТП >3×ВМН [4].
Клінічні прояви та перебіг хронічних холестатичних захворювань печінки (ХХЗП)
На ранніх стадіях ХХЗП симптоми часто відсутні або неспецифічні, як-от утома, анорексія, нудота та дискомфорт в епігастрії. Основними клінічними проявами просунутого холестазу є жовтяниця, свербіж, утома, стеаторея, ксантоми, ксантелазми та печінкова остеодистрофія.
До ХХЗП відносять первинний біліарний холангіт (ПБХ) та ПСХ. Обом хворобам притаманні автоімунні тригери пошкодження жовчних проток, повільно прогресивний перебіг з можливістю виникнення цирозу печінки.
Первинний біліарний холангіт
Основними характеристиками ПБХ є гранульоматозна деструкція дрібних внутрішньопечінкових жовчних проток. Здебільшого хворіють жінки (гендерне співвідношення – 9:1). Вік установлення діагнозу – 40-60 років. Клінічні прояви та природний перебіг дуже індивідуальні: від безсимптомного перебігу з повільним прогресуванням до тяжкої хвороби, що швидко прогресує. Більшість пацієнтів скаржаться на слабкість, швидку втому (65-85%) і свербіння шкіри (80%). У пацієнтів з ПБХ втома не пов’язана з тяжкістю хвороби, але цей симптом слід диференціювати від печінкової енцефалопатії в разі тяжкого захворювання печінки. Свербіж може виникати на будь-якій стадії хвороби та значно погіршує якість життя, але важливо зазначити, що в разі прогресування хвороби печінки свербіння зменшується. Можливі також сухість слизових оболонок ротової порожнини або кон’юнктив, гепатомегалія, спленомегалія, жовтяниця, гіперпігментація, а також ксантоми та ксантелазми різної форми й розмірів. У певної частки пацієнтів з ПБХ виявляються інші автоімунні хвороби. Близько третини пацієнтів схильні до остеопенії, в 11% випадків діагностують остеопороз. Типовою ознакою ПБХ є гіперхолестеринемія, котра зазвичай не асоціюється з вищим ризиком атеросклерозу. Іншою відмітною рисою хвороби є наявність антимітохондріальних антитіл (АМА). За відсутності лікування хвороба призводить до глибокої дуктопенії та біліарного цирозу печінки. Виживаність без лікування становить 7,5-16 років [2, 5].
Первинний склерозивний холангіт
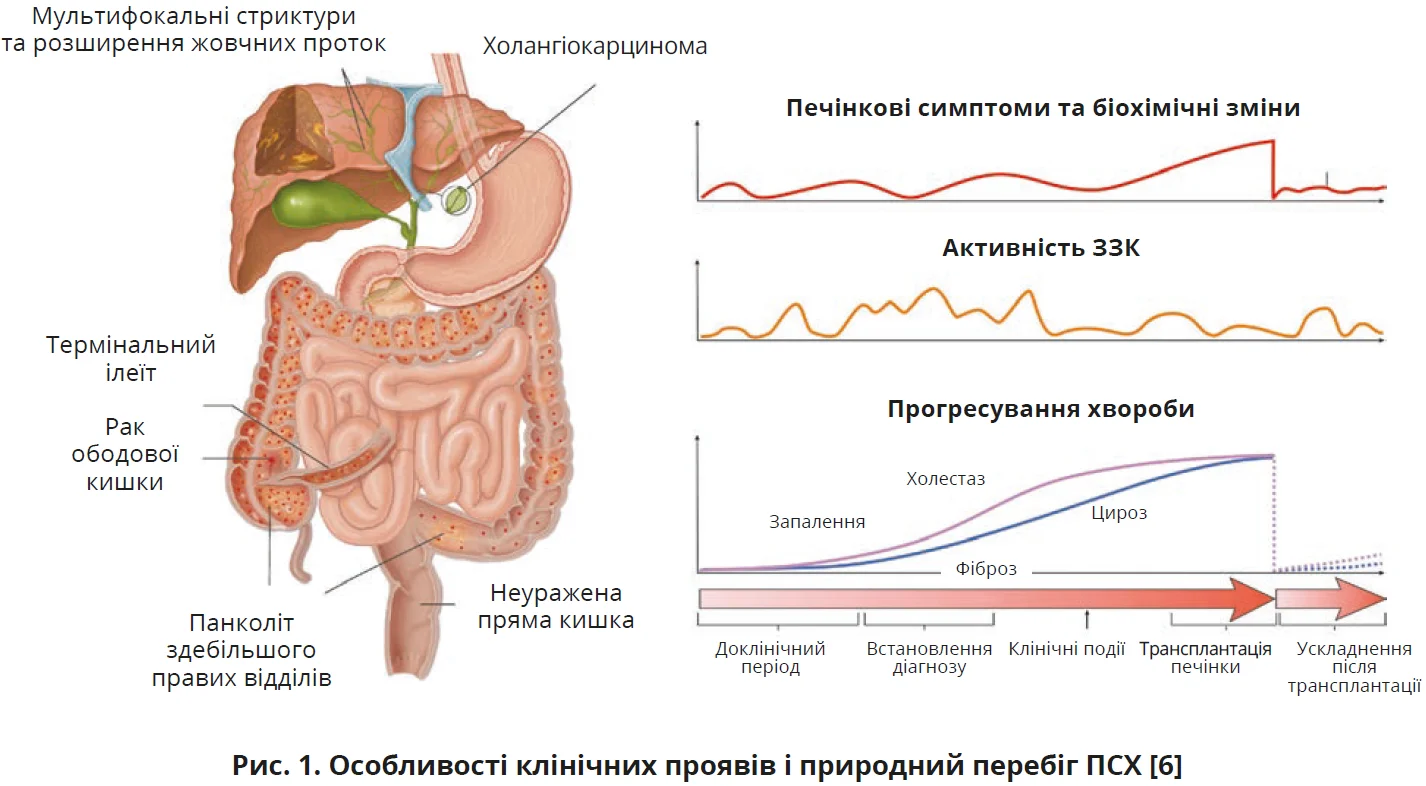
Хвороба характеризується запаленням і фіброзом внутрішньо- та позапечінкових жовчних проток, тобто мультифокальним ураженням усього жовчного дерева, що призводить до множинних стенозів (стриктур). Поширеність ПСХ становить 6-16 на 100 тисяч населення; чоловіки хворіють удвічі частіше, ніж жінки. Після тривалого доклінічного періоду та часу, потрібного для встановлення діагнозу, в більшості випадків спостерігається прогресування хвороби. На якість життя пацієнтів з ПСХ найбільше впливають свербіж, лихоманка, слабкість, абдомінальний біль, ментальні й емоційні розлади (тривога, депресія, порушення когнітивних функцій). Відмітною рисою ПСХ є тісна спорідненість змін із запальними захворюваннями кишківника (ЗЗК). На ЗЗК хворіють 70-80% пацієнтів з ПСХ, що погіршує прогноз. Часто активність ЗЗК не корелює з активністю захворювання печінки (рис. 1). У 9-11% пацієнтів виникає ПСХ з ізольованим ураженням малих проток, що за відсутності ЗЗК генетично відрізняється від ПСХ з ураженням великих проток [6, 7]. Окрім того, ПСХ асоціюється зі значним ризиком розвитку онкологічних захворювань травного тракту, насамперед холангіокарциноми (2,5%), гепатоцелюлярної карциноми, поліпів жовчного міхура (6-16%), раку жовчного міхура та колоректального раку (вищі ризики в 9-78 і 5-12 разів відповідно, ніж у загальній популяції) [6, 7].
За даними популяційного дослідження, проведеного на півночі Нідерландів за участю 590 пацієнтів з ПСХ, поширеність хвороби становила 6,0 на 100 тисяч населення; середній вік маніфестації ПСХ – 38,9 року; ЗЗК виявлено в 68% пацієнтів. Розрахункова медіана виживання від установлення діагнозу до смерті внаслідок лапароскопічного тромбозу або ПСХ у всій когорті становила 21,3 року, а в когорті пацієнтів після трансплантації печінки (n=422) – 13,2 року (P<0,0001). Ризик розвитку колоректальної карциноми в пацієнтів з ПСХ був удесятеро вищим, аніж у групі контролю, причому рак виникав значно раніше, ніж у групі контролю (39 проти 59 років відповідно; P=0,019). Колоноскопічне спостереження асоціювалося зі значно кращими результатами. Холангіокарциному діагностовано в 7% пацієнтів [8].
Принципи діагностики ХХЗП
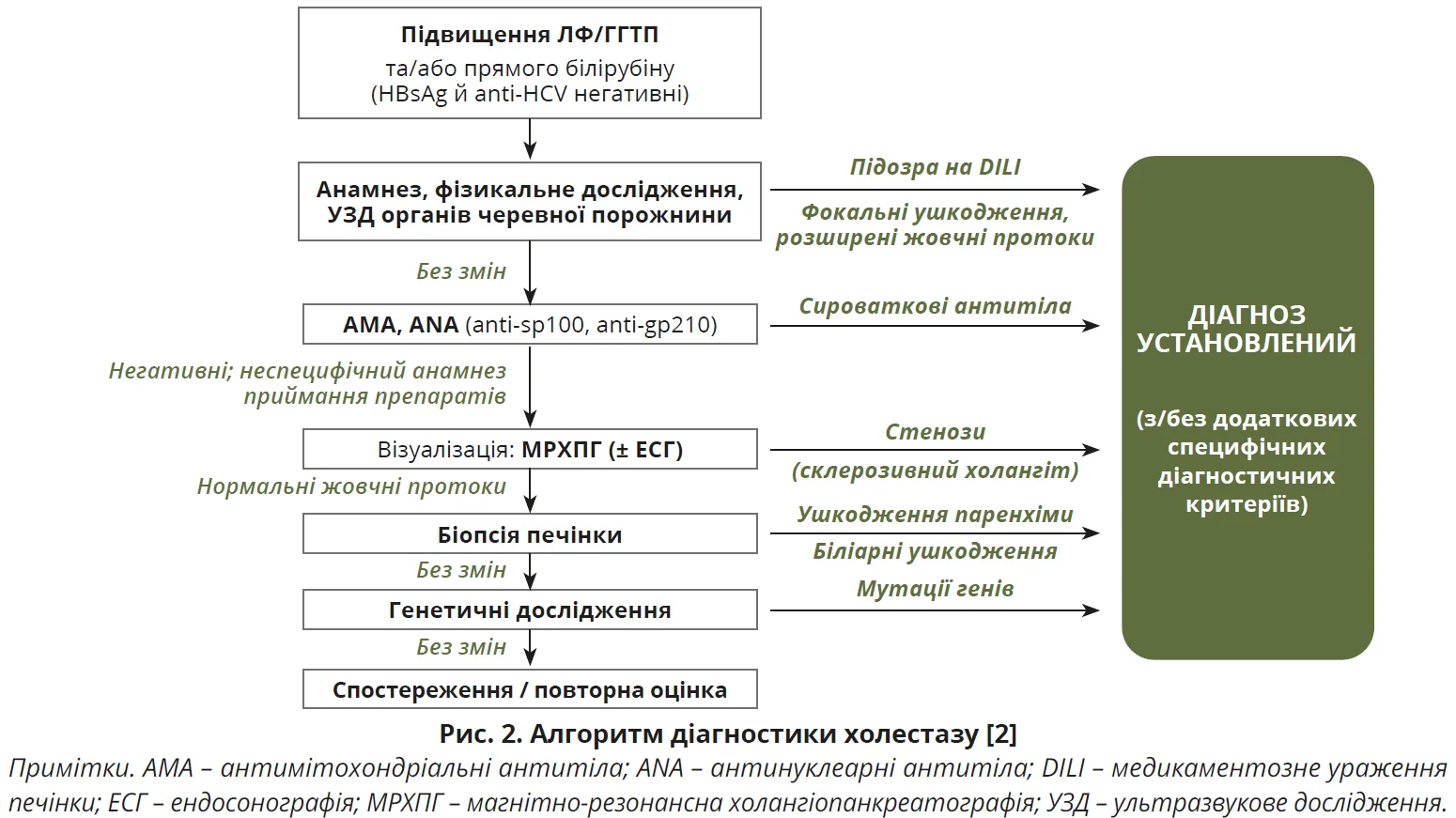
Настанови щодо ведення ХХЗП 2021 р. пропонують покрокову діагностику. Насамперед слід установити наявність холестазу шляхом визначення рівнів відповідних маркерів у сироватці крові. Наступним кроком є диференціація внутрішньопечінкового та позапечінкового холестазу, коли виконується візуалізація. Остаточний діагноз установлюється шляхом комплексного аналізу анамнезу, симптомів та ознак, біохімічних даних крові, сироваткових маркерів, результатів візуалізації, біопсії печінки та генетичного дослідження покроково (рис. 2) [2].
Діагноз ПБХ ґрунтується на таких критеріях:
1) стійке підвищення ЛФ і ГГTП за відсутності позапечінкової обструкції жовчних шляхів;
2) позитивні АМА >1:40 або АNА, здебільшого специфічні – anti-sp100, anti-gp210;
3) гістологічне підтвердження деструктивного холангіту.
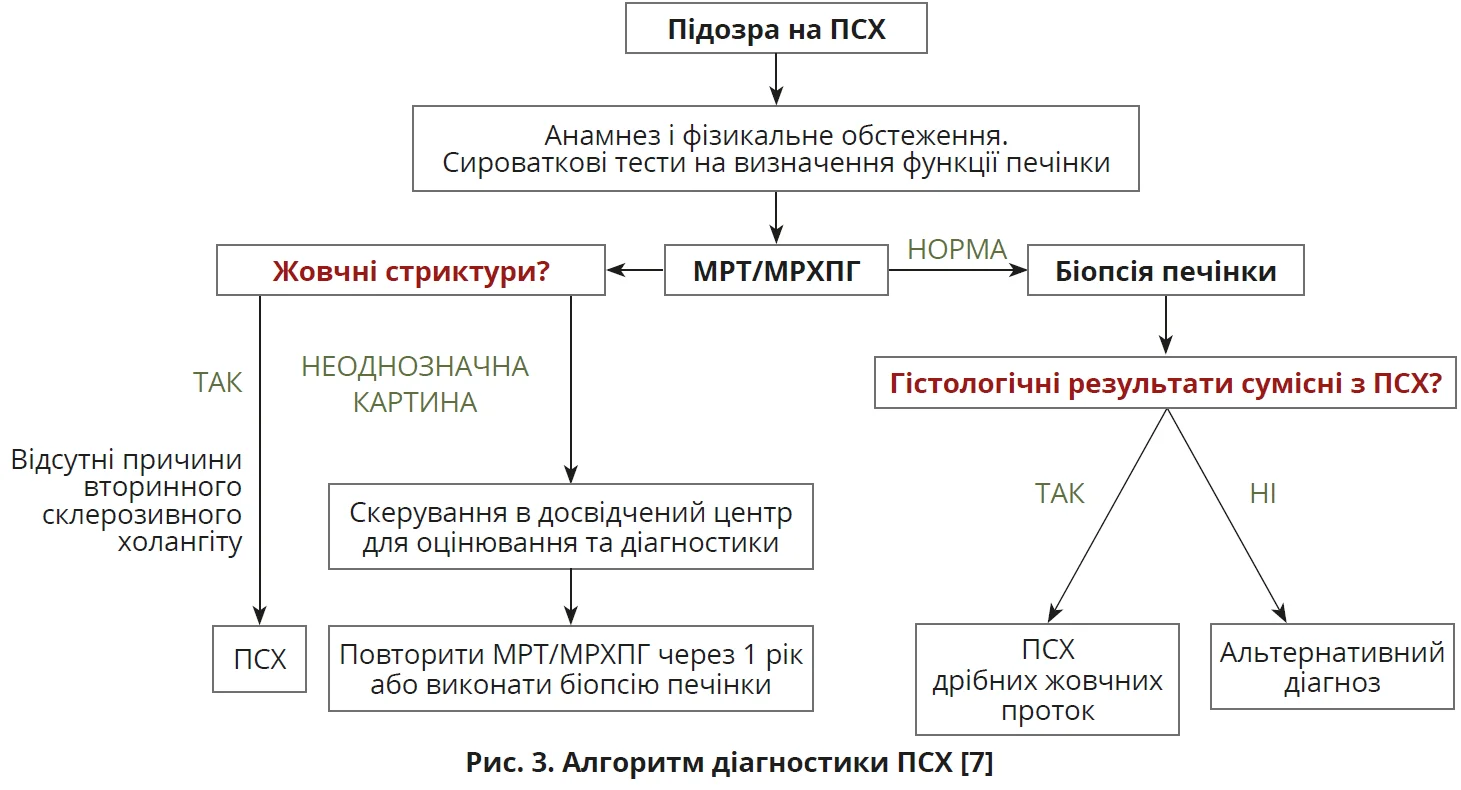
Для діагностики ПСХ вирішальне значення має візуалізація – МРХПГ, що виявляє стриктури біліарного дерева з післястенотичним розширенням.
Для діагностики хвороби малих проток вирішальне значення має біопсія печінки (рис. 3). Певне діагностичне значення в пацієнтів з ПСХ має визначення IgG4 та співвідношення IgG4/IgG1 <0,24 [7].
Принципи лікування ХХЗП
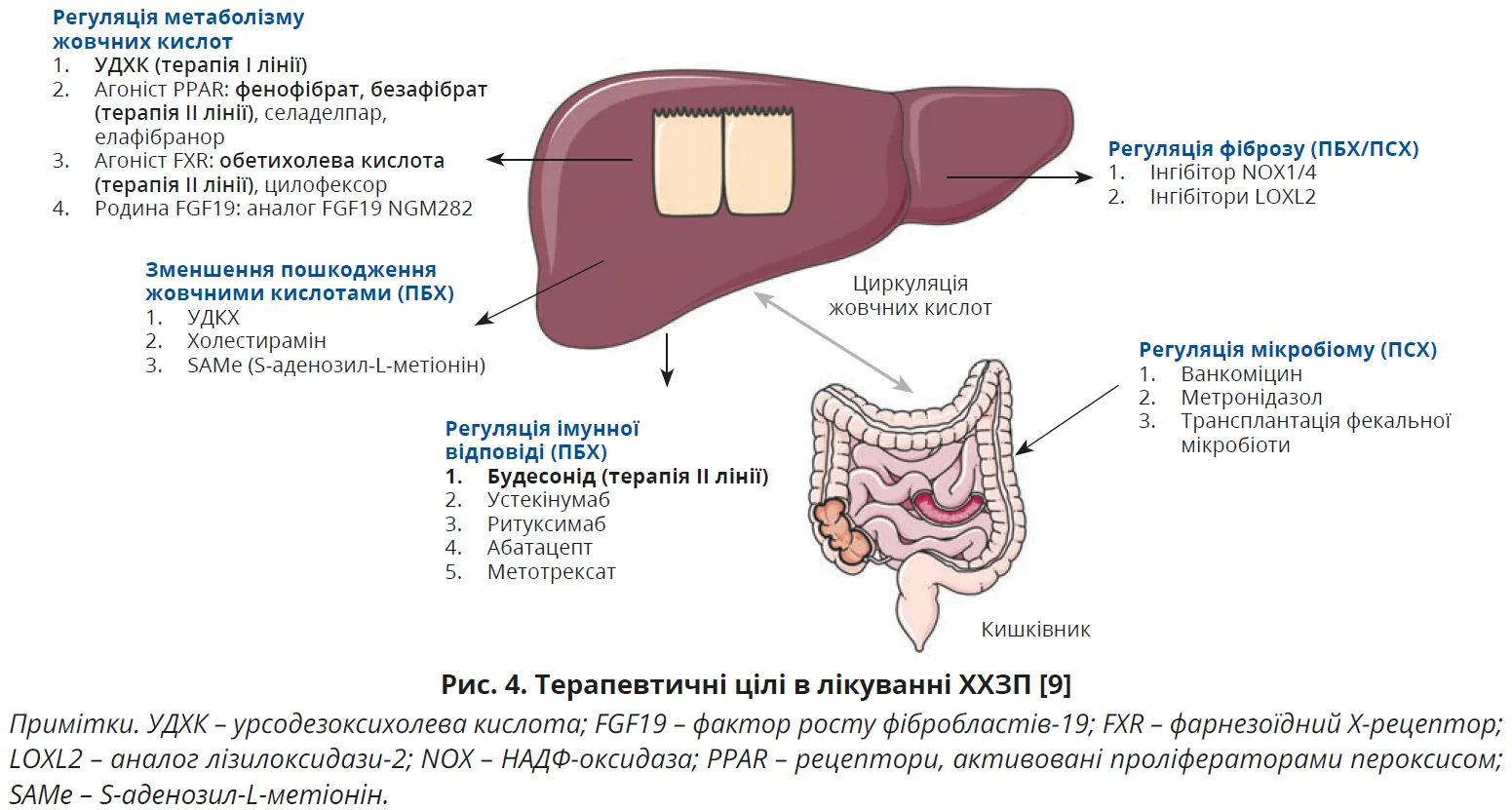
Сучасне лікування ХХЗП охоплює такі цілі: модуляцію метаболізму жовчних кислот, зменшення пошкодження жовчними кислотами, регуляцію імунної відповіді, фіброзу та мікробіому (рис. 4) [9].
Лікування ПБХ
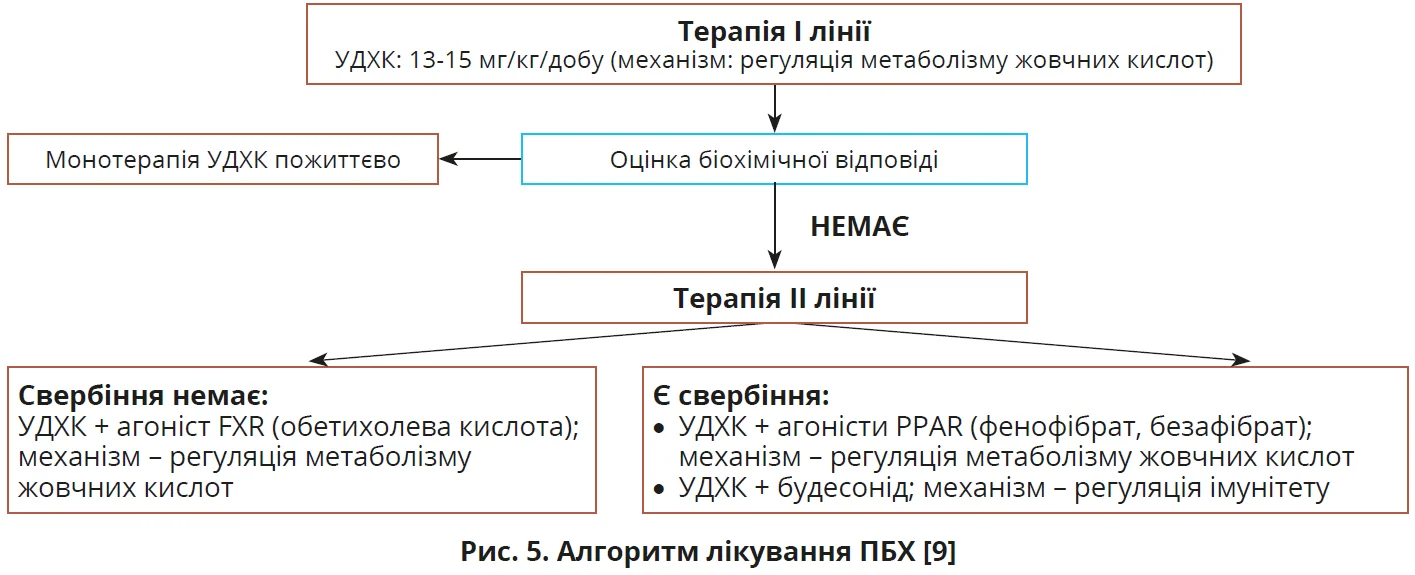
Як терапію І лінії всім пацієнтам з ПБХ настанови EASL (2017), Американської асоціації з вивчення хвороб печінки (AASLD, 2018) і Азійсько-Тихоокеанської асоціації з вивчення печінки (APASL, 2022) рекомендують пероральне застосування урсодезоксихолевої кислоти (УДХК) у дозі 13-15 мг/кг щодня [2, 10, 11]. Терапія УДХК проводиться довічно, але не всі пацієнти добре реагують на лікування; ефективного біохімічного покращення не спостерігається приблизно в 40% пацієнтів з ПБХ. Загальноприйнятим критерієм поганої відповіді на УДХК є рівень ЛФ >1,67×ВМН [9]. Більшість досліджень оцінювали відповідь на лікування через 1 рік.
Навіть коли пацієнти отримують лікування УДХК, ПБХ є прогресивним захворюванням з ризиком печінкових ускладнень і смерті. Отже, всім пацієнтам показано стратифікацію ризику ускладнень термінальної стадії та визначення потреби в додатковому лікуванні. Маркери стратифікації ризику при ПБХ поділяються на динамічні та статичні залежно від того, чи враховується відповідь на лікування, чи ні. Статичні маркери можна використовувати під час звернення або будь-коли під час лікування. Вони можуть охоплювати демографічні дані, симптоми, стандартні біохімічні аналізи, серологічні профілі, сироваткові маркери фіброзу, вимірювання жорсткості печінки, гістологічні особливості та пряме вимірювання портального тиску [2].
Для пацієнтів з ПБХ та поганою відповіддю на УДХК настанови EASL (2017), AASLD (2018) і APASL (2022) пропонують як терапію ІІ лінії обетихолеву кислоту, будесонід і фібрати, причому лише обетихолеву кислоту офіційно схвалено EASL і AASLD для терапії ІІ лінії, тоді як будесонід і фібрати запропоновано як незареєстровану терапію [2, 10, 11]. Обетихолева кислота – напівсинтетичний аналог жовчної кислоти й агоніст фарнезоїдного X-рецептора, пригнічує синтез жовчних кислот і полегшує симптоми холестазу. Численні клінічні випробування показали, що додавання або перехід на обетихолеву кислоту в дозі 5-10 мг/кг/день значно покращує біохімічну відповідь і сповільнює гістологічне прогресування ПБХ у пацієнтів зі слабкою відповіддю на УДХК [9]. Фібрати (фенофібрат і безафібрат) часто використовують як допоміжну терапію ПБХ у поєднанні з УДХК. Фібрати є агоністами PPAR; активація PPAR пригнічує синтез жовчних кислот, знижуючи експресію ключового ферменту синтази жовчних кислот CYP7A1. Декілька досліджень продемонстрували, що додавання фібратів до УДХК сприяло значнішому зниженню ЛФ і супроводжувалося тенденцією до покращення загальної виживаності пацієнтів з ПБХ. Настанови APASL (2022) рекомендують додавати безафібрат у дозі 400 мг/добу або фенофібрат у дозі 200 мг/добу до УДХК для лікування пацієнтів з ПБХ з неповною відповіддю на УДХК. Слід ретельно контролювати побічні ефекти комбінованої терапії, особливо в осіб із цирозом печінки [10]. Окремі невеликі дослідження показали значуще зниження ЛФ і зміни гістології печінки в пацієнтів з ПБХ, які отримували будесонід. Настанови APASL (2022) рекомендують будесонід у дозі 6-9 мг/добу для лікування пацієнтів з ПБХ без цирозу, які погано реагують на УДХК [10]. Алгоритм лікування ПБХ ілюструє рисунок 5.
Іншим препаратом, здатним зменшити пошкодження, спричинене жовчними кислотами, є S-аденозил-L-метіонін (SAMe, адеметіонін) – природне похідне амінокислоти метіоніну, присутнє в усіх клітинах людини [12-14]. Адеметіонін синтезується й метаболізується переважно в печінці та відіграє ключову роль у трьох шляхах метаболізму: 1) амінопропілювання, необхідне для синтезу поліамінів, які забезпечують стабільність ДНК та РНК, ріст і диференціювання клітин і зниження кількості прозапальних цитокінів; 2) трансметилювання, важливе для синтезу фосфатидилхоліну, що входить до складу клітинних мембран і бере участь у метаболізмі ліпідів, а також в утворенні нейротрансмітерів, брак яких зумовлює гепатогенну втому як один із симптомів ВПХ та пригнічення настрою; 3) транссульфурація, необхідна для вироблення глутатіону, що відіграє важливу роль у реалізації детоксикаційної функції печінки [15-17]. Крім того, адеметіонін регулює запалення, проліферацію та загибель гепатоцитів [15]. Будучи природним донором метильних груп, адеметіонін допомагає підтримувати цілісність клітинних мембран. Установлено, що адеметіонін пригнічує апоптоз, індукований солями жовчних кислот, in vitro. Крім того, в пацієнтів з ПБХ адеметіонін зупиняє автоімунну відповідь через антиоксидантну дію та процеси S-глутатіонілювання в холангіоцитах [18].
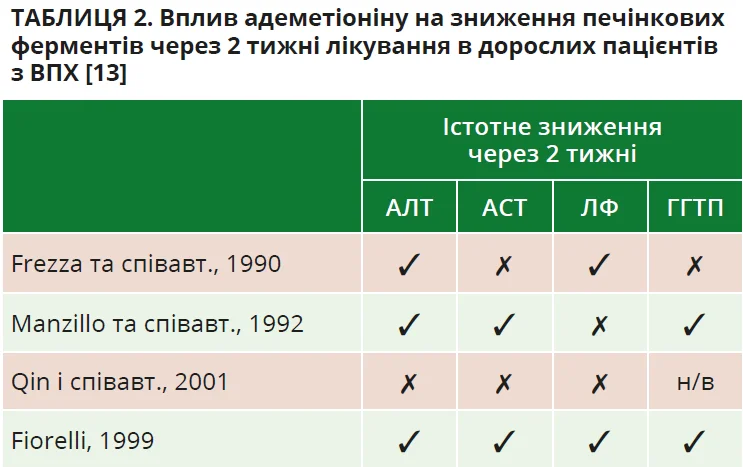
Нещодавно опубліковано результати систематичного огляду ефективності своєчасного лікування адеметіоніном у дорослих пацієнтів з ВПХ. Первинною метою була оцінка ефективності цієї молекули в покращенні біохімічних параметрів печінки (АЛТ, АСТ, ЛФ і ГГТП) протягом 8 тижнів після початку лікування. Вторинною метою був аналіз ефективності адеметіоніну в покращенні клінічних симптомів холестазу (втомлюваність, пригнічений настрій і свербіж). Для реалізації поставлених цілей проведено пошук опублікованих клінічних досліджень, у яких повідомлялося про ефективність адеметіоніну протягом 8 тижнів після початку лікування. Критеріями виключення були: наявність повних текстів статей, опублікованих у період з 1 січня 1990 р. по 10 червня 2019 р., у яких повідомлялися результати проспективних рандомізованих відкритих і обсерваційних досліджень; дослідження за участю дорослих чоловіків і жінок з ВПХ; дослідження, в яких повідомлялися результати ефективності внутрішньовенних (в/в), внутрішньом’язових (в/м) і пероральних форм адеметіоніну щодо змін біохімічних показників печінки; дослідження, в яких повідомлялося про ефективність адеметіоніну протягом перших 8 тижнів лікування порівняно з контрольною групою (препарат порівняння чи плацебо) або вихідним рівнем. Декілька досліджень продемонстрували зниження досліджуваних біохімічних показників печінки вже через 2 тижні (табл. 2) [13].
Встановлено численні механізми дії адеметіоніну на печінку. Впливаючи на синтез фосфоліпідів, він відновлює структуру мембран гепатоцитів, що сприяє зниженню цитолізу та холестазу. Через вплив на синтез таурину забезпечує виведення токсичних жовчних кислот, що знижує холестаз. Участь у синтезі глутатіону пояснює антиоксидантну та дезінтоксикаційну дії адеметіоніну. Крім того, адеметіонін бере участь у синтезі аденозинтрифосфату, має протизапальну й антифібротичну дії (рис. 6). Позитивні впливи не обмежуються лише печінкою. Сприяючи синтезу нейромедіаторів, адеметіонін знижує прояви гепатогенної втоми при ВПХ [16].
На ринку України доступний оригінальний лікарський засіб Гептрал® (фармацевтична компанія «Абботт»), що містить 500 мг адеметіоніну. Препарат випускається у двох формах: кишковорозчинні таблетки для перорального застосування та ліофілізований порошок у флаконах для в/в або в/м ін’єкцій. Показаннями до призначення препарату Гептрал® є ВПХ у дорослих, зокрема в пацієнтів із хронічним гепатитом різної етіології та цирозом печінки, а також ВПХ у вагітних. У ході клінічних досліджень у жінок, яких лікували адеметіоніном у ІІІ триместрі вагітності, не спостерігалося будь-яких побічних реакцій. Лікування можна розпочинати з парентерального введення з подальшим пероральним застосуванням або одразу із застосування таблеток. Рекомендована доза для парентерального застосування – 5-12 мг/кг маси тіла на добу (1-2 флакони) впродовж 2 тижнів з подальшим переходом на пероральну форму – 2 таблетки на добу протягом 1-2 місяців [1, 22].
Лікування ПСХ
Поки що немає затверджених ефективних методів лікування ПСХ, оскільки початку клінічних випробувань для вивчення препаратів, які покращують прогноз, перешкоджає відносно низька частота подій клінічно значущих кінцевих точок. Єдиним варіантом лікування є трансплантація печінки. Після трансплантації можливі ускладнення, як-от відторгнення, рецидив хвороби, загострення ЗЗК.
Для зменшення пошкодження жовчними кислотами запропоновано лікування УДХК у високих дозах 15-20 мг/кг/день, але це слабка рекомендація.
Настанови EASL (2022) категорично не рекомендують застосовувати УДКХ у дозах 28-30 мг/кг/добу (рівень оцінки 1, наполеглива рекомендація, 100% консенсус) [19, 20].
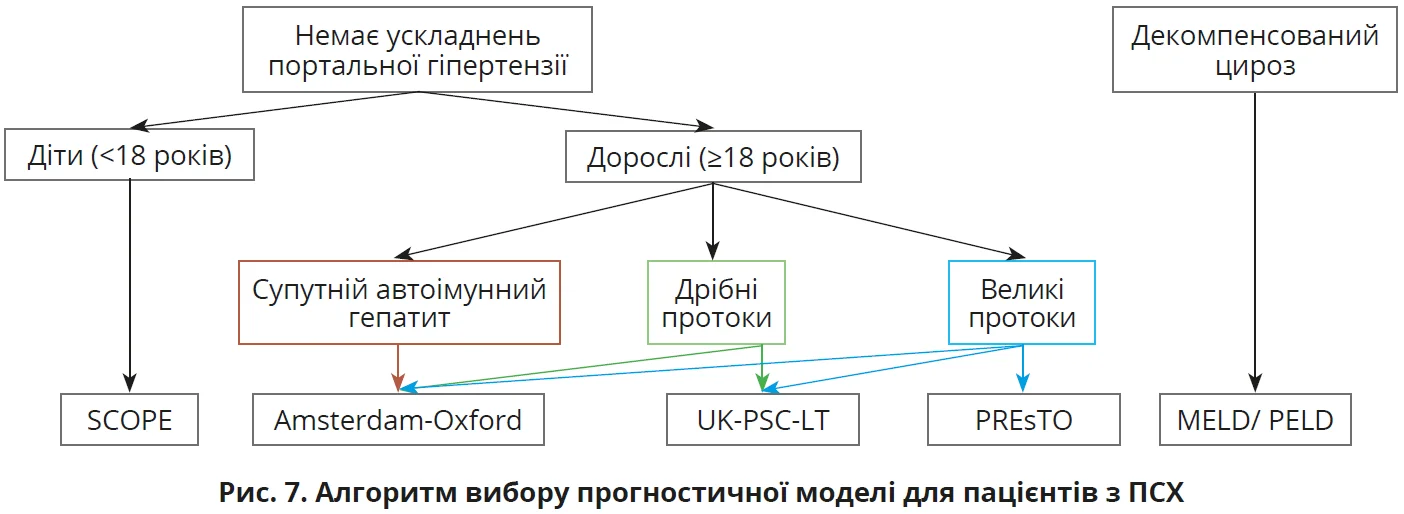
Як і в разі ПБХ, пацієнтам з ПСХ показана стратифікація ризику за допомогою валідованих прогностичних моделей. Принципи вибору моделі для оцінювання прогнозу ілюструє рисунок 7.
Лікування ускладнень
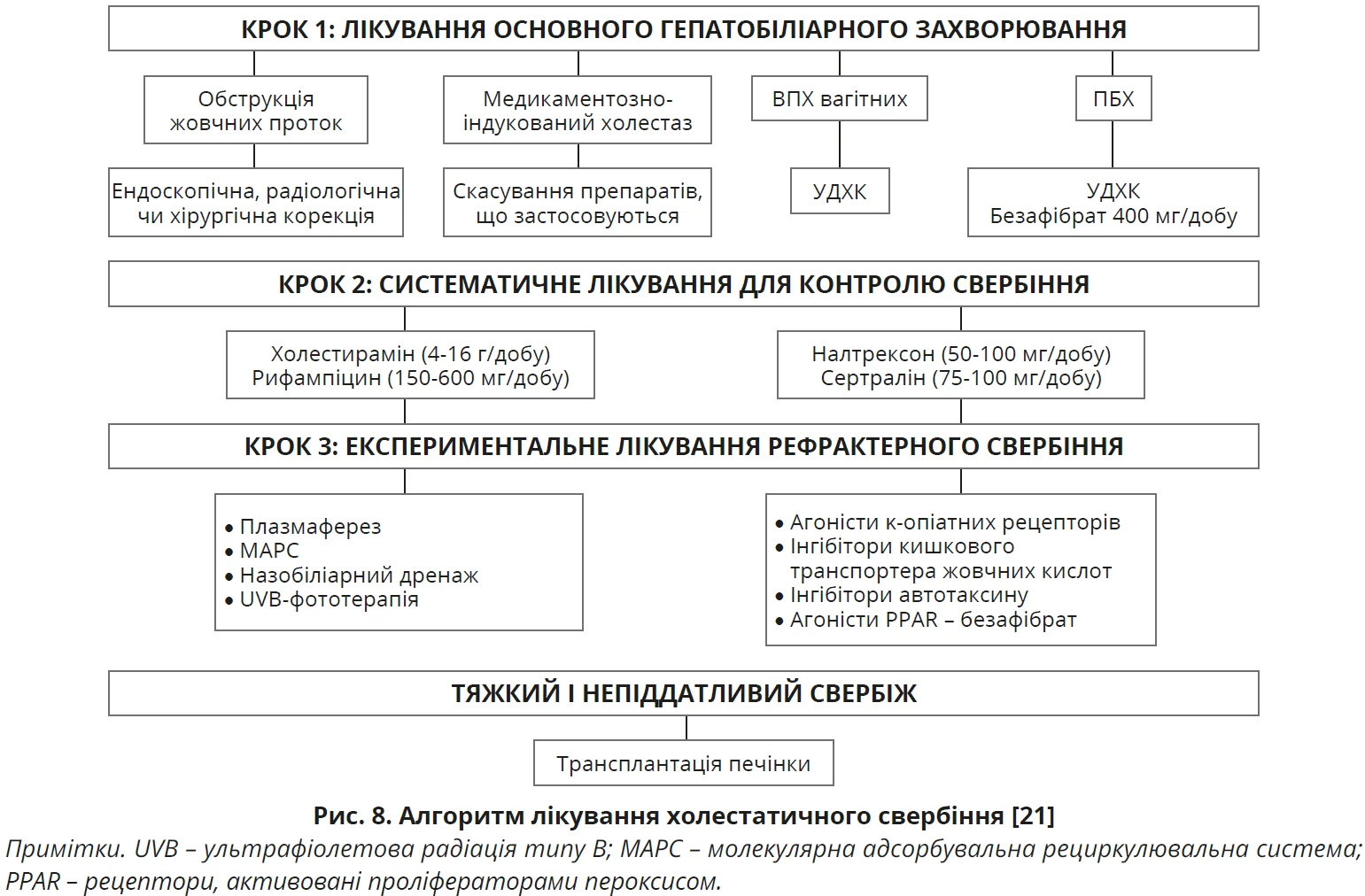
Поширеним ускладненням ХХЗП є свербіж. Загальні заходи для таких пацієнтів передбачають використання емолентів, місцевих зволожувальних засобів і препаратів з охолоджувальним ефектом; підстригання / зменшення довжини нігтів; носіння легкого одягу з натуральної бавовни, уникнення вовняного або дуже тісного одягу; ванни
з холодною водою; психологічні втручання. Важливе значення має лікування основного захворювання. За відсутності ефекту запропоновано алгоритм покрокової терапії лікування цього ускладнення (рис. 8).
Холестирамін – це неабсорбувальна смола, секвестрант жовчних кислот, запропонований як препарат І лінії для контролю свербіння. Проте холестирамін впливає на всмоктування УДХК, тому його зазвичай використовують за 4-6 годин до приймання УДХК. Як терапію ІІ лінії запропоновано агоніст прегнанового X-рецептора рифампіцин, який може полегшити свербіж у пацієнтів з непереносимістю холестираміну або за відсутності відповіді на терапію І лінії. Утім, рифампіцин негативно впливає на функцію зсідання крові та всмоктування вітаміну К. Як препарат ІІІ лінії використовується антагоніст опіоїдних рецепторів налтрексон, але в деяких пацієнтів можуть виникати побічні ефекти (нудота, блювання, легкий біль). Окрім того, в пацієнтів з декомпенсованою хворобою печінки можливе накопичення метаболітів налтрексону, що вимагає обережного застосовування [9].
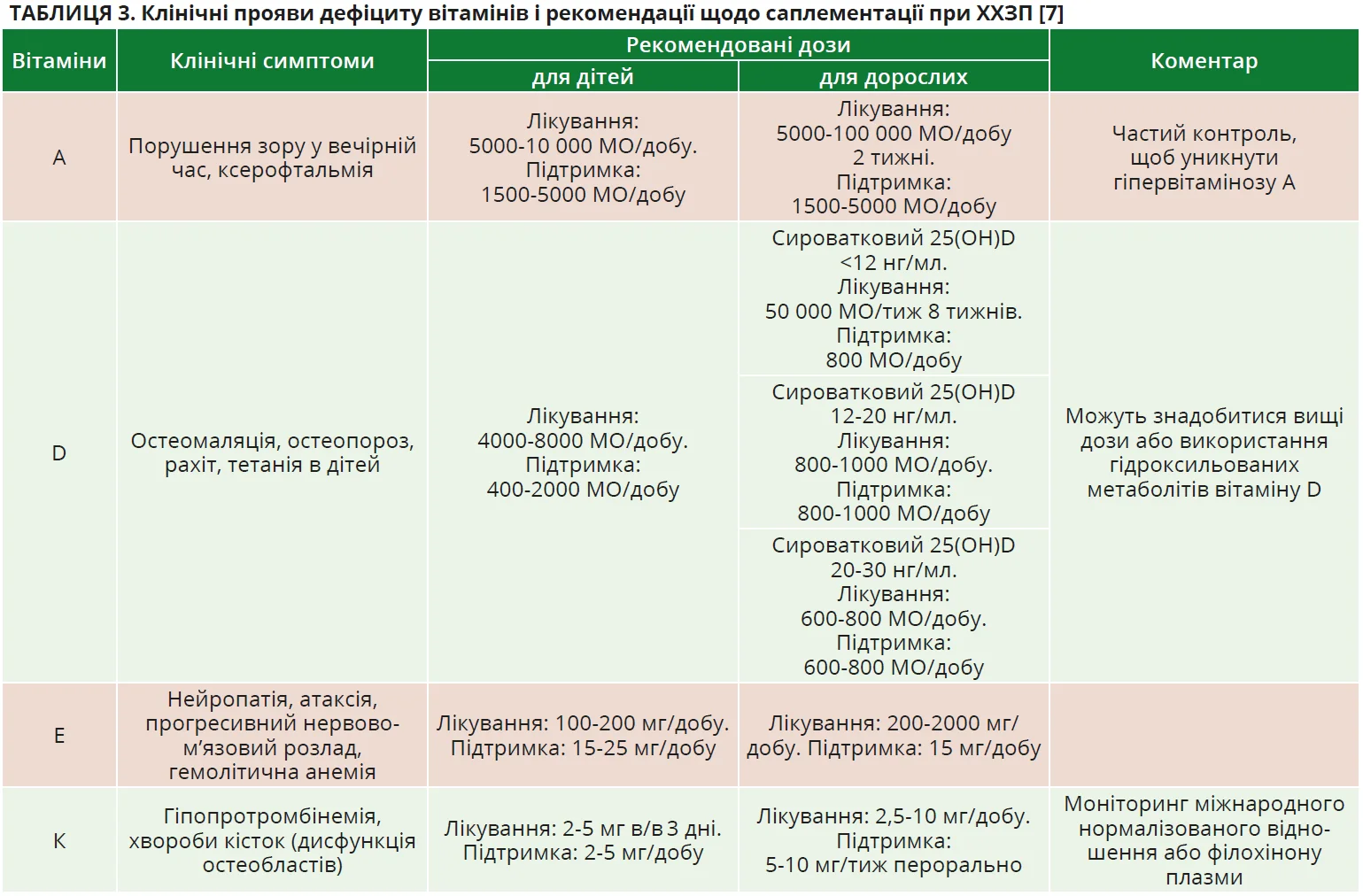
Іншим ускладненням ХХЗП є порушення всмоктування жиророзчинних вітамінів. Клінічна маніфестація дефіциту вітамінів і рекомендації щодо саплементації підсумовані в таблиці 3.
Висновки
- Синдром холестазу діагностується на підставі підвищення рівня ЛФ і супутнього підвищення ГГТП.
- Холестаз класифікується на позапечінковий і внутрішньопечінковий. ВПХ може бути печінковоклітинним і каналікулярним. Для діагностики позапечінкового холестазу застосовуються візуалізаційні методики: УЗД, МРХПГ, ЕРХПГ, МСКТ, ЕСГ.
- Ведення пацієнтів з ПБХ і ПСХ передбачає стратифікацію ризику за допомогою шкал на початку терапії та під час лікування.
- Сучасними цілями лікування ПБХ є нормалізація рівня ЛФ і зникнення клінічних симптомів. За відсутності відповіді на терапію І лінії УДХК при ХХЗП застосовуються інші фармакологічні опції.
- Нові терапевтичні підходи в лікуванні холестазу охоплюють такі напрями: модуляція метаболізму жовчних кислот, збереження функції ендотеліальних клітин (адеметіонін, УДХК, холестирамін), імунна регуляція та зменшення фіброзу.
- Гептрал® – оригінальний препарат адеметіоніну, який швидко (із 7-го дня терапії) та надовго (до 2-3 місяців) знижує рівень печінкових проб у разі ВПХ [22-24].
Список літератури – в редакції.