Сучасні погляди на проблему поєднання неалкогольної жирової хвороби печінки та саркопенії
Підготувала канд. мед. наук Ольга Королюк
Світова пандемія ожиріння призвела до збільшення поширеності неалкогольної жирової хвороби печінки (НАЖХП). Щоб підкреслити вагому патогенетичну роль інсулінорезистентності та метаболічних розладів, віднедавна для цього стану запропоновано інший термін – метаболічно-асоційована жирова хвороба печінки. За різними оцінками, це захворювання вражає від чверті до третини дорослого населення планети, а серед осіб з ожирінням її поширеність сягає 70% [1-3]. НАЖХП діагностують, коли жирові зміни в печінці відбуваються за відсутності значного вживання алкоголю [3]. Найчастішими причинами смерті в цій когорті є серцево-судинні захворювання та стани, пов’язані з печінкою, – стеатогепатит, цироз, гепатоцелюлярна карцинома [1].
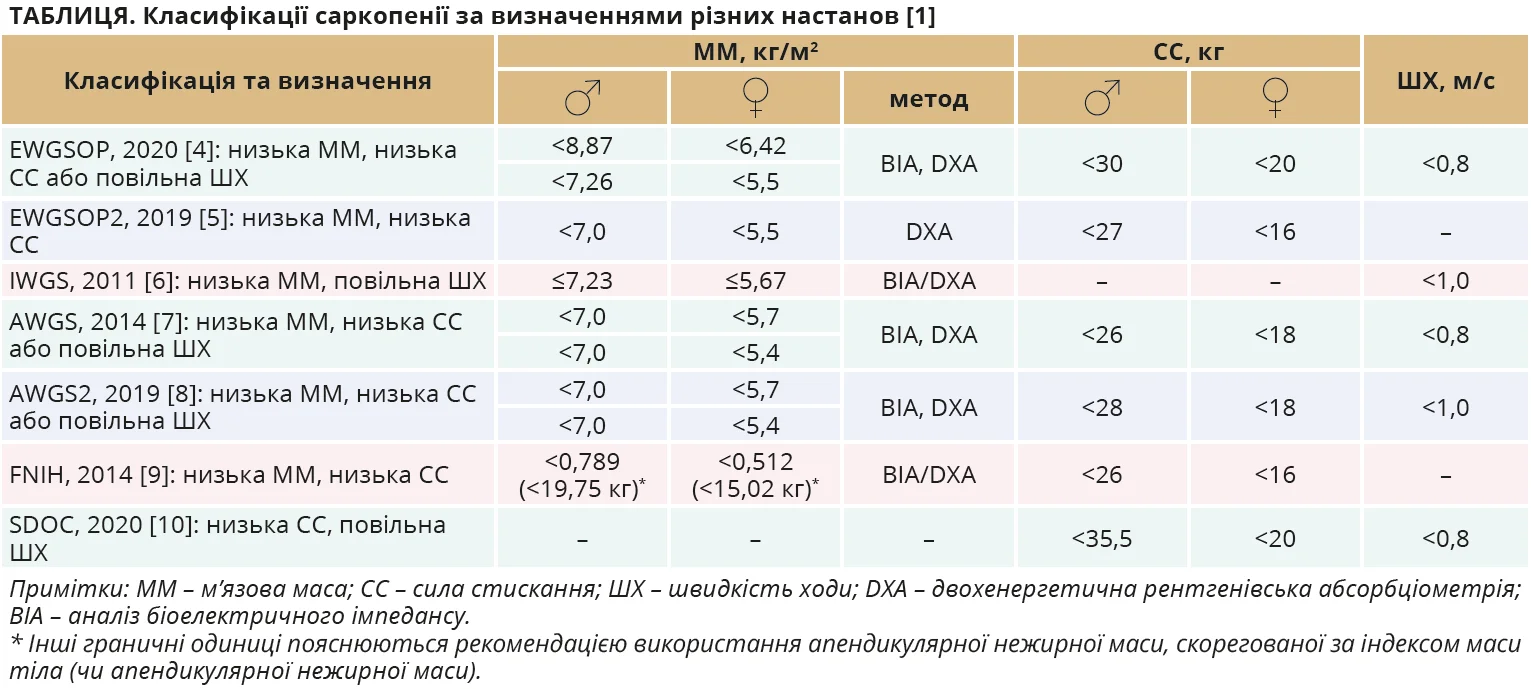
Саркопенія характеризується прогресивною втратою м’язової маси, сили або функції скелетних м’язів. Існують різні визначення саркопенії, зокрема запропоновані Європейською робочою групою з питань саркопенії в людей похилого віку (EWGSOP) 2010 р. з переглядом 2019 р., Азійською робочою групою з питань саркопенії (AWGS), Міжнародною робочою групою із саркопенії (IWGS) та Фондом національних інститутів здоров’я (FNIH) (табл.).
Хоча саркопенія частіше вражає людей похилого віку, її початок можливий у молодших вікових групах за наявності інших розладів, як-от резистентність до інсуліну, ожиріння, цукровий діабет 2-го типу, остеопороз. Існує багато чинників ризику саркопенії, зокрема вік, стать, недоїдання, недостатня фізична активність, хронічні хвороби та використання певних ліків [11, 12]. Через неоднорідність діагностичних критеріїв, різноманітність методів вимірювання м’язової маси та різні порогові значення (табл.) оцінки поширеності саркопенії суттєво коливаються: 5-13% у віці 60-70 років, 11-50% у віці понад 80 років [13]. Початок і прогресування саркопенії зазвичай непомітні, але цей стан погіршує якість і тривалість життя, а також підвищує ризик низки захворювань, зокрема опорно-рухового апарату, збільшуючи потребу в госпіталізації. Крім того, діагностика саркопенії передбачає комплексне оцінювання м’язової маси та сили із застосуванням сучасних методів візуалізації, використання котрих обмежене в рутинній клінічній практиці [1]. Отже, поширеність саркопенії часто недооцінюється.
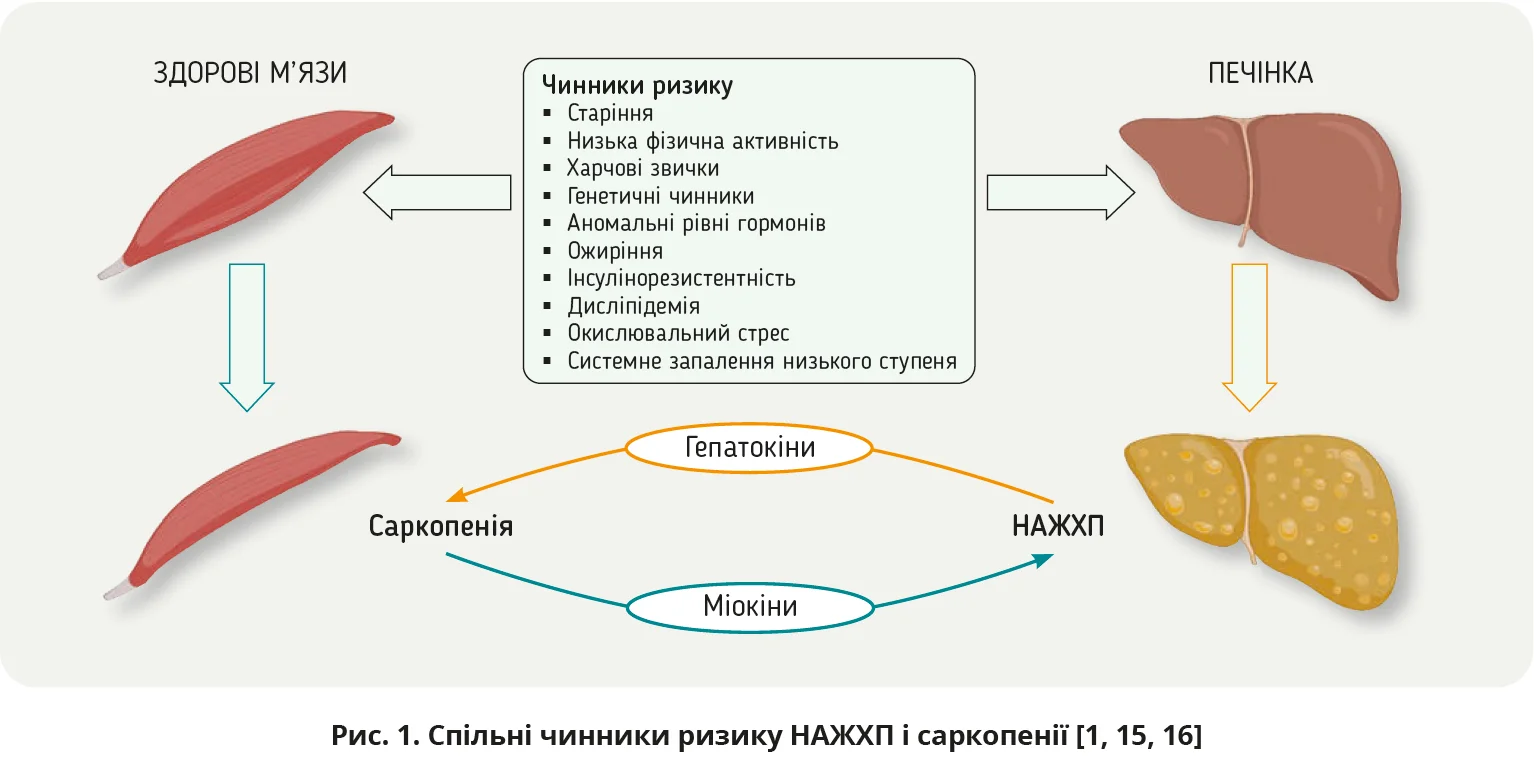
Пацієнтам з НАЖХП притаманний високий рівень втрати м’язової маси та сили [14]. Дедалі більше досліджень підтверджують наявність зв’язку між саркопенією та НАЖХП, які поділяють низку чинників ризику (рис. 1) [15, 16].
Дефекти та погіршення функції печінки впливають на кровообіг і метаболізм у скелетних м’язах, а атрофія скелетних м’язів унаслідок саркопенії посилює НАЖХП [17]. Проте в сучасній літературі є певний конфлікт між результатами різних досліджень щодо зв’язку між саркопенією та НАЖХП і впливом НАЖХП на скелетну масу пацієнтів із саркопенією [2, 18]. До того ж не завжди зрозуміло, який саме стан передує іншому. Існують також проблеми діагностики саркопенії в пацієнтів з НАЖХП. Зокрема, такі симптоми саркопенії, як м’язова слабкість, утомлюваність, зниження працездатності, можуть бути зумовлені прогресуванням НАЖХП, а клінічні ознаки саркопенії часто приховані через патологічне ожиріння.
Крім того, немає єдиного консенсусу щодо вибору інструментів для діагностики саркопенії.
Наприклад, такі методи вимірювання м’язової маси, як двохенергетична рентгенівська абсорбціометрія (DXA), аналіз біоелектричного імпедансу (BIA), комп’ютерна томографія (КТ) і магнітно-резонансна томографія (МРТ), можуть давати різні результати й мають певні обмеження [1]. Золотим стандартом неінвазивного оцінювання кількості та якості м’язів є МРТ і КТ, але через високу вартість, дороге йне завжди доступне обладнання, відсутність портативності та потребу спеціалізованого персоналу ці методи зазвичай не використовуються для початкового оцінювання. Настанови здебільшого рекомендують DXA чи BIA (табл.). Принцип методу DXA полягає в аналізі диференційного поглинання двох енергій рентгенівського випромінювання, коли вони проходять крізь тканини тіла. Висока точність і відтворюваність методу роблять його придатним для точних вимірювань складу тіла. Проте через високу вартість обладнання, використання малих доз рентгенівського випромінювання та потребу кваліфікованих фахівців DXA не підходить для частого використання. Натомість BIA оцінює склад тіла шляхом вимірювання імпедансу під час проходження струму крізь рідини та тканини організму, що дає змогу аналізувати склад як усього тіла, так і певної ділянки. Перевагами BIA є економічна ефективність, широка доступність, неінвазивність і портативність. Проте точність BIA поступається DXA, оскільки м’язова маса оцінюється не безпосередньо, а на підставі провідності всього тіла за допомогою рівнянь перетворення [1].
Розуміння механізмів і клінічних особливостей поєднання саркопенії та НАЖХП украй важливе для ранньої діагностики та своєчасного проведення відповідних профілактичних і лікувальних утручань. Із цією метою проаналізовано результати трьох систематичних оглядів, проведених у 2024 р., які включали метааналізи досліджень за період останніх 10-15 років.
Систематичний огляд і метааналіз, проведені C. Deng і колегами, включали 24 дослідження. Усі включені дослідження відповідали таким критеріям: 1) діагноз НАЖХП і саркопенії ґрунтувався на добре встановлених критеріях або встановлювався клініцистом; 2) учасники групи контролю не мали в анамнезі НАЖХП або саркопенії, без обмежень щодо статі та віку; 3) тип дослідження був обсерваційним, включаючи перехресні, когортні та дослідження «випадок – контроль»; 4) основним результатом була кореляція між саркопенією та НАЖХП, надано відношення шансів (ВШ) і 95% довірчий інтервал (ДІ) або була змога їх розрахунку за вихідними даними. Загальна кількість учасників становила 88 609 осіб (середній вік – від 39,32±15,6 до 71,28±7,67 року); 16 досліджень залучали осіб загальної популяції, 3 дослідження – пацієнтів із цукровим діабетом 2-го типу, 2 дослідження – пацієнтів із хронічною хворобою печінки та трансплантацією печінки, решта 3 дослідження – пацієнтів із хронічним обструктивним захворюванням легень, запальним захворюванням кишківника та стаціонарних пацієнтів з відділення геріатрії й ендокринології відповідно. Позитивну кореляцію між НАЖХП і ризиком саркопенії продемонструвало 21 з 24 досліджень: шанси виникнення саркопенії в пацієнтів з НАЖХП були значно вищими, ніж у групі контролю (ВШ 1,74; 95% ДІ 1,39-2,17; p<0,001). Аналіз підгруп за регіонами охоплював Азію (18 досліджень), Америку (4 дослідження) та Європу (2 дослідження). Результати виявили різні ризики саркопенії в пацієнтів з НАЖХП у різних регіонах: в азійській групі виявлено кореляцію між НАЖХП і ризиком саркопенії (ВШ 1,97; 95% ДІ 1,54-2,51; p<0,001), тоді як у пацієнтів з НАЖХП в американській і європейській підгрупах не було статистично значущих кореляцій з ризиком саркопенії (ВШ 1,31; 95% ДІ 0,71-2,40 та ВШ 0,99; 95% ДІ 0,21-4,69 відповідно). Автори дійшли висновку, що НАЖХП значною мірою та незалежно пов’язана з підвищеним ризиком саркопенії – на 74% вищий ризик, аніж у групі контролю. Регіональні чинники можуть вплинути на результати, ймовірно, через різницю в діагностичних критеріях саркопенії та НАЖХП. Результати багатофакторного аналізу підтвердили гіпотезу про те, що НАЖХП є незалежним чинником ризику саркопенії. Проте, оскільки узагальнювалися дані лише перехресних досліджень, причинно-наслідковий зв’язок між НАЖХП і саркопенією встановити не вдалося [3].
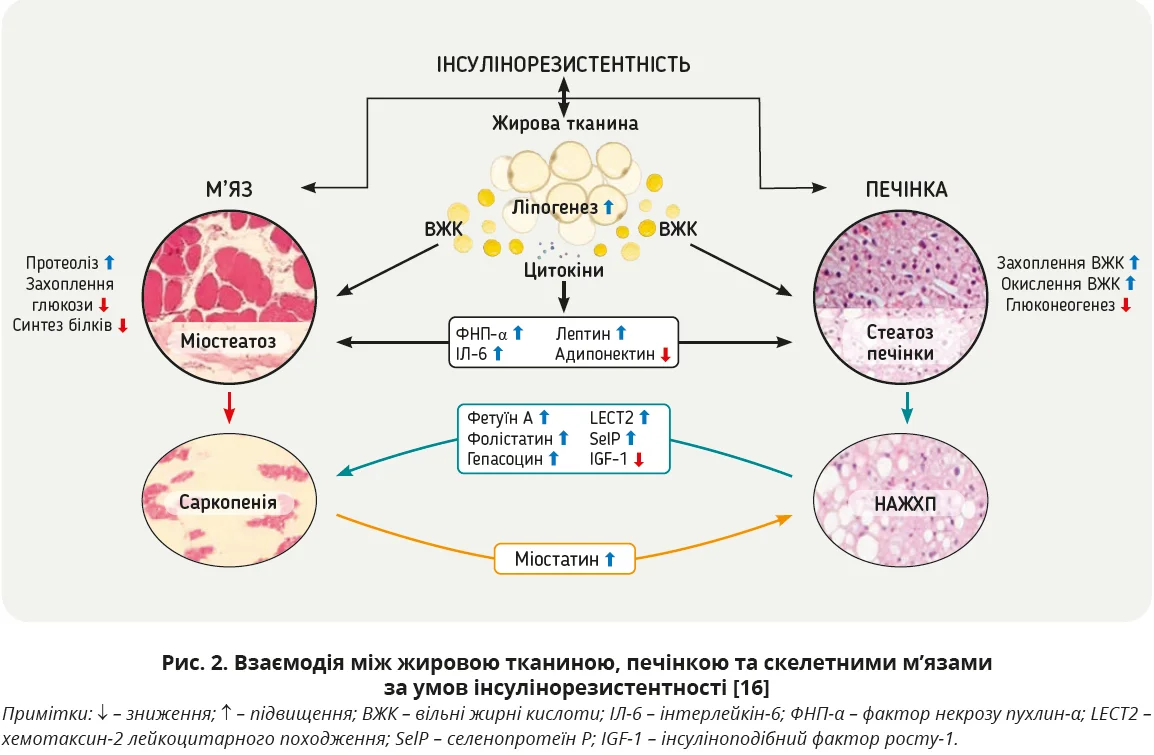
З одного боку, НАЖХП може відігравати роль у виникненні та прогресуванні саркопенії, адже в патогенезі НАЖХП важливу роль відіграють інсулінорезистентність, метаболічні розлади й запалення, котрі не лише спричиняють накопичення жиру в печінці, а й мають несприятливий вплив на інші органи, зокрема м’язи (рис. 2) [16, 19].
Порушення передачі сигналів інсуліну внаслідок впливу запальних цитокінів за ожиріння підвищує рівень вільних жирних кислот у плазмі крові, що призводить до накопичення ліпідів у печінці та м’язах. Інсулінорезистентність опосередковано впливає на метаболізм глюкози й ліпідів у печінці шляхом збільшення субстратів (глюкоза, жирні кислоти, гліцерин), які спричиняють ліпогенез і глюконеогенез [16]. Як відомо, інсулін підтримує м’язову масу через активацію мішені рапаміцину ссавців (mTOR) і відіграє важливу роль в анаболізмі скелетних м’язів. Отже, інсулінорезистентність у скелетних м’язах призводить до посиленої деградації м’язів, зниження вмісту мітохондрій і порушення окислювальної здатності в міоцитах [20]. Певну роль у прогресуванні саркопенії можуть відігравати цитокіни, що посилено вивільняються за НАЖХП. Окрім того, клітини печінки виділяють гепатокіни – білки, що виділяються автокринними, паракринними й ендокринними шляхами, зокрема фетуїн А, фолістатин, гепасоцин, хемотаксин-2 лейкоцитарного походження (LECT2), селенопротеїн P (рис. 2). Підвищення фетуїну А зумовлює печінковий глюконеогенез і синтез ліпідів, посилюючи інсулінорезистентність і запалення та спричиняючи саркопенію. Підвищення рівня LECT2 опосередковує ожиріння й інсулінорезистентність у скелетних м’язах. Експансія та ремоделювання білої жирової тканини в умовах ожиріння призводить до утворення депо вісцерального жиру, що спричиняє або посилює ліпотоксичність, запалення й порушує нейроендокринну функцію. Ліпотоксичність зумовлює проникнення макрофагів та інших імунних клітин у жирову тканину, що призводить до вивільнення фактора некрозу пухлин-α, інтерлейкіну-6 й інших запальних цитокінів; це спричиняє хронічне системне запалення низького ступеня. Запальні медіатори знижують реакцію м’язів на інсулін та інсуліноподібний фактор росту-1 (IGF-1), що призводить до стресу ендоплазматичного ретикулуму, мітохондріальної дисфункції та деградації м’язів [16, 21].
З іншого боку, саркопенія здатна прискорити прогресування НАЖХП. Скелетні м’язи є основним органом для підтримання гомеостазу глюкози в усьому тілі через експресію інсулінозалежного транспортера глюкози GLUT-4. Втрата м’язової маси може посилити резистентність до інсуліну та НАЖХП [22]. Скелетні м’язи не просто споживають енергію; це активний ендокринний орган, що виділяє міокіни, які мають регуляторний ефект. Зокрема, міостатин є негативним регулятором маси скелетних м’язів, що порушує сигнальні шляхи mTOR у скелетних м’язах через автофагію й убіквітин-протеасомні шляхи; зрештою це призводить до протеолізу скелетних м’язів [23]. Дослідження показали, що міостатин також може прискорити запалення та фіброз печінки через активні IIbr-рецептори на зірчастих клітинах печінки [24].
Деякі дослідники вважають, що саркопенія є ускладненням дисфункції печінки; порушення метаболізму глюкози, окислення ліпідів, синтезу кетонів і катаболізму білків призводить до втрати компонентів м’язової тканини. Також пацієнтам із хронічними хворобами печінки притаманна шлунково-кишкова дисфункція; внаслідок недостатнього споживання поживних речовин виникає слабкість м’язів, що обмежує фізичну активність і ще більше посилює втрату м’язової маси [23]. У пацієнтів з термінальною стадією хронічної хвороби печінки поширеність саркопенії сягає 60% і є ознакою поганого прогнозу [25]. Натомість інші дослідники вказують на відсутність причинно-наслідкового зв’язку між НАЖХП і саркопенією [26].
Інші систематичний огляд і метааналіз, проведені T. Ye та колегами, загалом включали дані 9 досліджень за участю 12 601 пацієнта з НАЖХП, серед яких дві третини учасників були з азійського регіону. Для діагностики НАЖХП у більшості досліджень використовували специфічні ознаки під час візуалізації печінки та різні неінвазивні методи, лише в 1 випробуванні проводили біопсію печінки. Наявність саркопенії здебільшого встановлювали за критеріями FNIH (2014), але методи оцінювання та граничні точки суттєво відрізнялися. Саркопенію виявлено у 21% пацієнтів. Результати метааналізу вказують, що пацієнти з НАЖХП і саркопенією були старшими за віком. У 5 включених дослідженнях у групі НАЖХП із саркопенією було менше чоловіків, аніж у групі НАЖХП, а в 4 дослідженнях у вказаній групі переважали жінки. До того ж у групі НАЖХП із саркопенією середні показники індексу маси тіла (ІМТ) й окружності талії значно перевищували відповідні середні значення в групі НАЖХП, зазвичай становлячи >27 кг/м2 і >90 см відповідно. Сім досліджень указують на вищу частку осіб з ожирінням у групі НАЖХП із саркопенією. Найчастішими супутніми хворобами були артеріальна гіпертензія, метаболічний синдром і діабет; більшість досліджень указували на вищу поширеність цих станів у групі з НАЖХП із саркопенією порівняно з групою НАЖХП. Рівні глюкози, індекс HOMA-IR, ліпідні профілі, показники функції печінки та нирок були несприятливішими в осіб із саркопенією, але узагальнити результати було складно через неоднакові розміри вибірки та гетерогенність досліджуваних популяцій. Вісім досліджень продемонстрували вищу поширеність дефіциту вітаміну D у пацієнтів із саркопенією [1].
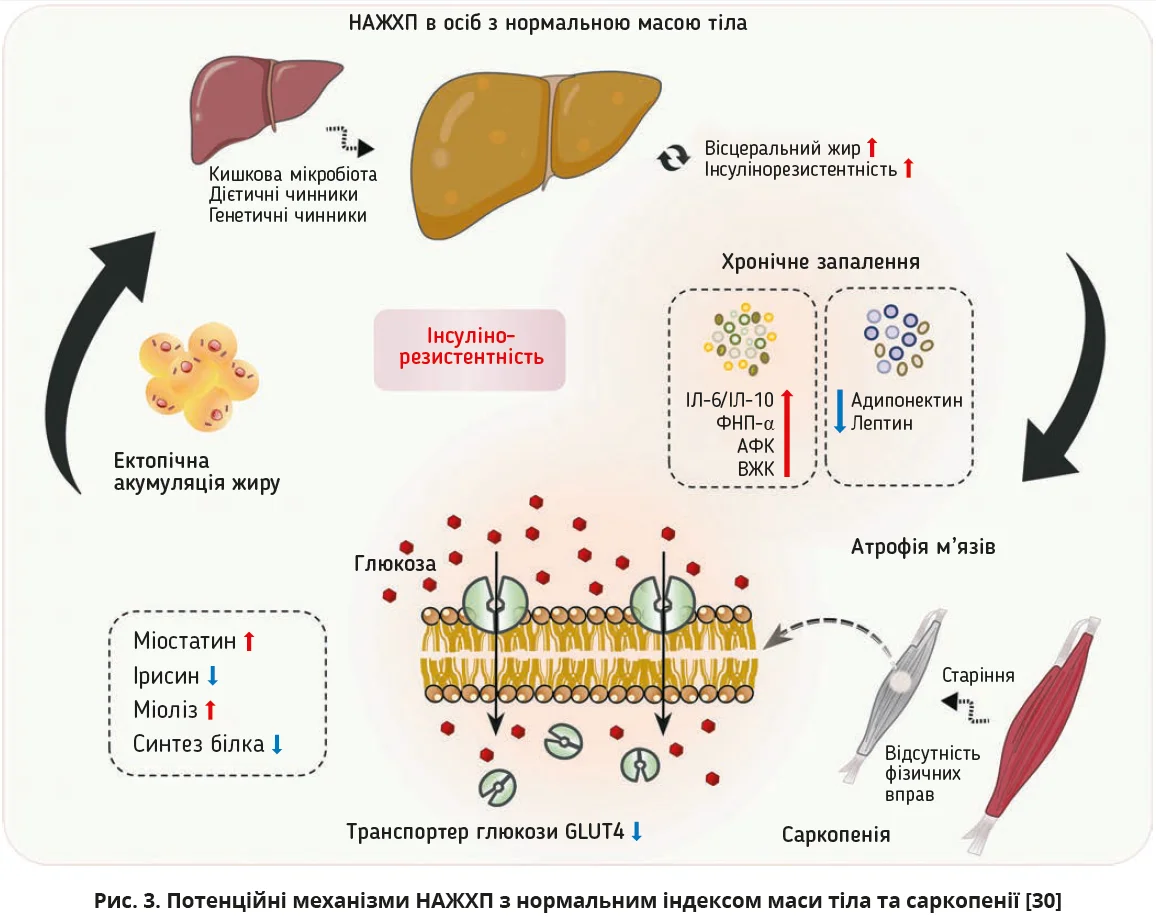
Виявлені дані вказують на складну патофізіологічну взаємодію між двома станами та складні зв’язки цих станів зі старінням, статтю, ожирінням і метаболічним синдромом. Попередні дослідження вказують на гендерні особливості поширеності НАЖХП: у жінок до менопаузи захворюваність є нижчою, ніж у чоловіків відповідного віку; після менопаузи частка жінок істотно збільшується, що пов’язують з гормональними змінами [27]. Крім того, жіноча стать є чинником ризику саркопенії [23]. Існує теорія, що м’язова маса досягає свого фізіологічного зеніту у віці 30 років. Після 40 років починається зниження м’язової маси, часто із супутнім збільшенням жирової тканини. Похилий вік зазвичай корелює зі збільшенням жирової тканини та маси тіла, що посилює схильність до НАЖХП і саркопенії, особливо серед осіб з підвищеним ІМТ [23, 28]. Однак іноді збільшення жирової тканини може відбуватися без відповідного збільшення маси тіла чи навіть з її зменшенням, тобто з переважною втратою м’язової маси. Із цього погляду варто вказати ще на одну цікаву знахідку в огляді T. Ye та колег: в 1 дослідженні виявлено підгрупу пацієнтів з НАЖХП, нормальним ІМТ і саркопенією, яким був притаманний підвищений ризик серцево-судинних захворювань [29].
Потенційні механізми взаємозв’язку між НАЖХП з нормальним ІМТ та саркопенією насамперед зумовлені інсулінорезистентністю й ектопічним відкладанням жиру. Надмірне споживання їжі та знижене споживання енергії, а також генетична схильність й інші чинники призводять до накопичення вісцерального жиру, інсулінорезистентності та виникнення НАЖХП за відсутності надмірної маси тіла. Одночасно інсулінорезистентність і метаболічні запальні процеси погіршують життєве середовище м’язових клітин, посилюють атрофію м’язів і призводять до виникнення саркопенії. Втрата маси скелетних м’язів пригнічує вісь «гормон росту – IGF-1», що призводить до зниження синтезу м’язового білка та посилення ліполізу. Зменшення експресії інсулінозалежного транспортера глюкози GLUT4 при саркопенії ще більше пригнічує утилізацію глюкози та посилює інсулінорезистентність, замикаючи згубне коло (рис. 3) [30].
Систематичний огляд і метааналіз, проведені A. Malik і колегами, включали 25 проспективних, ретроспективних і перехресних досліджень, які відрізнялися за дизайном, віком пацієнтів (10-70 років), розподілом за статтю (від <1% до 94% чоловіків), ІМТ (21-34 кг/м2), ліпідним профілем (загальний холестерин – 175-225 мг/дл, тригліцериди – 95-224 мг/дл) і рівнями ферментів печінки (аспартатамінотрансфераза – 20-72 МО/л, аланінамінотрансфераза – 13-63 МО/л, γ-глутамілтрансфераза – 21,2-98 МО/л). У більшості досліджень для діагностики НАЖХП використовували ультрасонографію. Загальна оцінка показала значущу асоціацію НАЖХП і саркопенії (ВШ 1,25; 95% ДІ 1,08-1,44; p=0,003); об’єднані дослідження були гетерогенними (p<0,00001; I2=63%), гетерогенність найкраще вирішувалася шляхом проведення аналізу підгруп відповідно до визначення саркопенії в кожному дослідженні залежно від маси тіла, зросту, ІМТ або інших змінних. У підгрупі, де саркопенія визначалася залежно від маси тіла, НАЖХП значуще асоціювалася із саркопенією (ВШ 1,29; 95% ДІ 1,07-1,56; p=0,007). У підгрупі, де саркопенія визначалася залежно від зросту, НАЖХП не асоціювалася із саркопенією (ВШ 0,92; 95% ДІ 0,81-1,03; p=0,15). У підгрупі, де саркопенія визначалася залежно від ІМТ, НАЖХП не асоціювалася із саркопенією (ВШ 1,31; 95% ДІ 0,99-1,73; p=0,06). Об’єднана оцінка 9 досліджень не показала суттєвого зв’язку між низьким індексом маси скелетних м’язів і НАЖХП (ВШ 1,02; 95% ДІ 0,91-1,15; p=0,7). Загальна оцінка показала вищі шанси фіброзу печінки в пацієнтів з НАЖХП і саркопенією порівняно з пацієнтами з НАЖХП (ВШ 1,49; 95% ДІ 1,03-2,14; p=0,03) [2].
Отже, в останньому метааналізі не було значного зв’язку між НАЖХП і низькими значеннями індексу маси скелетних м’язів, який розраховують шляхом ділення маси скелетних м’язів кінцівок (кг) на квадрат зросту пацієнта (м2). За визначенням, низька м’язова маса відповідає індексу маси скелетних м’язів <7,0 кг/м2 у чоловіків і <5,7 кг/м2 у жінок [2]. Ці результати суперечать метааналізу, проведеному Cai та колегами у 2020 р., який виявив, що пацієнти з НАЖХП мають нижчий індекс маси скелетних м’язів, аніж здорові люди [33]. Проте є дані, що зв’язок може змінюватися залежно від вікової групи або менопаузального стану [34]. Втім, у підгрупі, де саркопенія визначалася залежно від маси тіла, асоціація між НАЖХП була значущою. Крім того, в групі НАЖХП із саркопенією ризик фіброзу печінки був вищим, аніж у групі НАЖХП [2]. Декілька перехресних обсерваційних досліджень показали, що саркопенія пов’язана з підвищеним ризиком НАЖХП і прогресивного фіброзу печінки незалежно від ожиріння, метаболічного синдрому й інсулінорезистентності [31]. Фіброгенез у разі НАЖХП є критичним процесом, який погіршує прогноз. Пошкодження печінки виникає внаслідок прямого пошкодження клітин, клітинної дегенерації та смерті шляхом апоптозу або інших форм клітинної смерті, експресії прозапальних цитокінів, активації зірчастих клітин печінки та порушення регенерації, що призводить до фіброзу [32]. Важливу роль у цих процесах відіграє окислювальний стрес, а надмірне утворення токсичних метаболітів ліпідів посилює окисне пошкодження клітин печінки [23, 30].
Висновки
НАЖХП і саркопенія мають багато спільних патогенетичних механізмів, є взаємно причинно-наслідковими станами, що пов’язані між собою складними зв’язками. До чинників ризику відносять порушення харчування, низьке споживання білка, малорухливий спосіб життя, знижений рівень вітаміну D та метаболічні розлади. Клінічні особливості в пацієнтів з НАЖХП і саркопенією включають старший вік, вищі показники ІМТ й окружності талії, більшу частку жінок та осіб з метаболічним синдромом або окремими його компонентами (абдомінальним ожирінням, артеріальною гіпертензією, діабетом, дисліпідемією). Проте НАЖХП і саркопенія можуть виникати в певної частки пацієнтів з нормальними показниками ІМТ. Виявлено незалежний і позитивний зв’язок між НАЖХП і ризиком саркопенії. Саркопенія асоціюється з вищим ризиком фіброзу печінки в пацієнтів з НАЖХП. Патогенез НАЖХП і саркопенії до кінця не з’ясований і потребує подальших досліджень з використанням уніфікованих діагностичних критеріїв і точних діагностичних інструментів.