Складні кістозні ураження печінки: класифікація, діагностика та лікування
Переклала й адаптувала канд. мед. наук Ольга Королюк
Кістозні ураження печінки поділяються на прості та складні; їх поширеність коливається від 2,5 до 18%. Більшість випадків припадає на прості кісти печінки (ПКП) – зазвичай безсимптомні доброякісні утворення стабільних розмірів, що рідко потребують лікування. Складні кістозні ураження печінки включають уроджені, передракові, неопластичні, інфекційні та посттравматичні ураження. У поєднанні з клінічними й лабораторними даними ультразвукове дослідження (УЗД), комп’ютерна томографія (КТ), магнітно-резонансна томографія (МРТ) й УЗД з контрастуванням надають діагностичну інформацію та класифікують складні кістозні ураження печінки. Більшість складних кіст потребують хірургічного втручання, тому проблема точної діагностики в цих випадках особливо актуальна, адже за відсутності ефективного лікування потенційно збільшуються захворюваність і смертність. Отож оновлена інформація щодо діагностики, класифікації й ефективного лікування найпоширеніших складних кістозних уражень печінки є актуальною.
Пухлинні кістозні ураження печінки
Муцинозно-кістозні новоутворення (МКН) печінки, раніше відомі як біліарні цистаденоми (БЦА) чи біліарні цистаденокарциноми (БЦАК), становлять близько 3-5% усіх кістозних уражень печінки. Разом із внутрішньопротоковими папілярними новоутвореннями жовчних шляхів (ВПНЖШ) БЦА та БЦАК належать до муциносекретувальних кістозних новоутворень печінки й жовчних шляхів. Всесвітня організація охорони здоров’я (ВООЗ) у класифікації пухлин печінки та внутрішньопечінкових жовчних шляхів 2019 року виділила «важливі та бажані критерії» для патологічної діагностики біліарних МКН: 1) наявність кістозного новоутворення печінки без сполучення із жовчними шляхами; 2) стовпчастий і кубоподібний епітеліальний покрив із варіабельною продукцією муцину; 3) строма яєчникового типу. Вказані ознаки не стосуються ВПНЖШ, які сполучаються із жовчними шляхами та не мають строми яєчникового типу. Класифікація ВООЗ не передбачає використання попередніх термінів – БЦА та БЦАК. За неопластичним прогресуванням МКН класифікують на: 1) МКН з інтраепітеліальною неоплазією (дисплазією) низького ступеня; 2) МКН з інтраепітеліальною неоплазією високого ступеня; 3) МКН з асоційованою інвазивною карциномою.
Неінвазивні МКН печінки
Неінвазивні МКН – утворення розмірами 1,5-35 см із повільним ростром, зазвичай у лівій частці печінки. Захворюваність становить 1-5 на 100 000 осіб; часто трапляються в жінок віком 45 років. У 10-20% випадків можлива позапечінкова та жовчноміхурова локалізація. Злоякісна трансформація МКН з асоційованою інвазивною карциномою (раніше БЦАК) можлива у 12-30% випадків. Гістологічно неінвазивні МКН складаються з трьох шарів: зовнішнього колагенового шару; мезенхімального стромального шару, що нагадує строму яєчника; муциносекретувального стовпчастого епітеліального шару. Подібно до нормального біліарного епітелію, внутрішній епітеліальний шар кісти позитивно забарвлюється на CK-7 і CK-19 при застосуванні спеціальних барвників для ідентифікації клітин, що секретують муцин (наприклад, MUC5AC). Імуногістохімія виявляє естрогенові рецептори у стромальних клітинах.
У разі складних кістозних уражень печінки діагностичним тестом першого вибору є УЗД, яке краще за інші методи візуалізації визначає наявність внутрішніх перегородок. УЗД-ознаки пухлини: овоїдні багатокістозні внутрішньопечінкові утворення з потовщеними нерівними стінками та численними тонкими перегородками. Характерними ознаками МКН на УЗД з контрастом є артеріальне посилення стінки кісти, внутрішньої перегородки, стінкових і септальних вузликів та інтракістозних солідних компонентів із подальшим прогресивним вимиванням під час портальної та пізньої фаз.
На КТ неінвазивні МКН мають вигляд поодиноких внутрішньопечінкових багатокістозних утворень із чіткою товстою або неправильною фіброзною стінкою, внутрішніми перегородками, стінковими вузликами, зрідка з кальцифікацією капсули. Щільність пухлини на КТ-зображеннях без підсилення відповідає щільності води (≤30 HU) та може відрізнятися в різних вогнищах усередині кісти через наявність серозної, муцинозної рідини з домішками жовчі, кристалів холестерину та некротичного або гнійного матеріалу. Підсилення контрастом спостерігається вздовж стінки кісти, в ділянках внутрішніх перегородок і стінкових або перегородкових вузликів.
МРТ або магнітно-резонансна холангіопанкреатографія (МРХПГ) має найвищу чутливість для анатомічного окреслення гепатобіліарних кістозних уражень порівняно з КТ. Типові результати МРТ включають наявність великого багатолокулярного рідинного об’ємного утворення з низьким сигналом T1, високим сигналом T2, товстими стінками неправильної
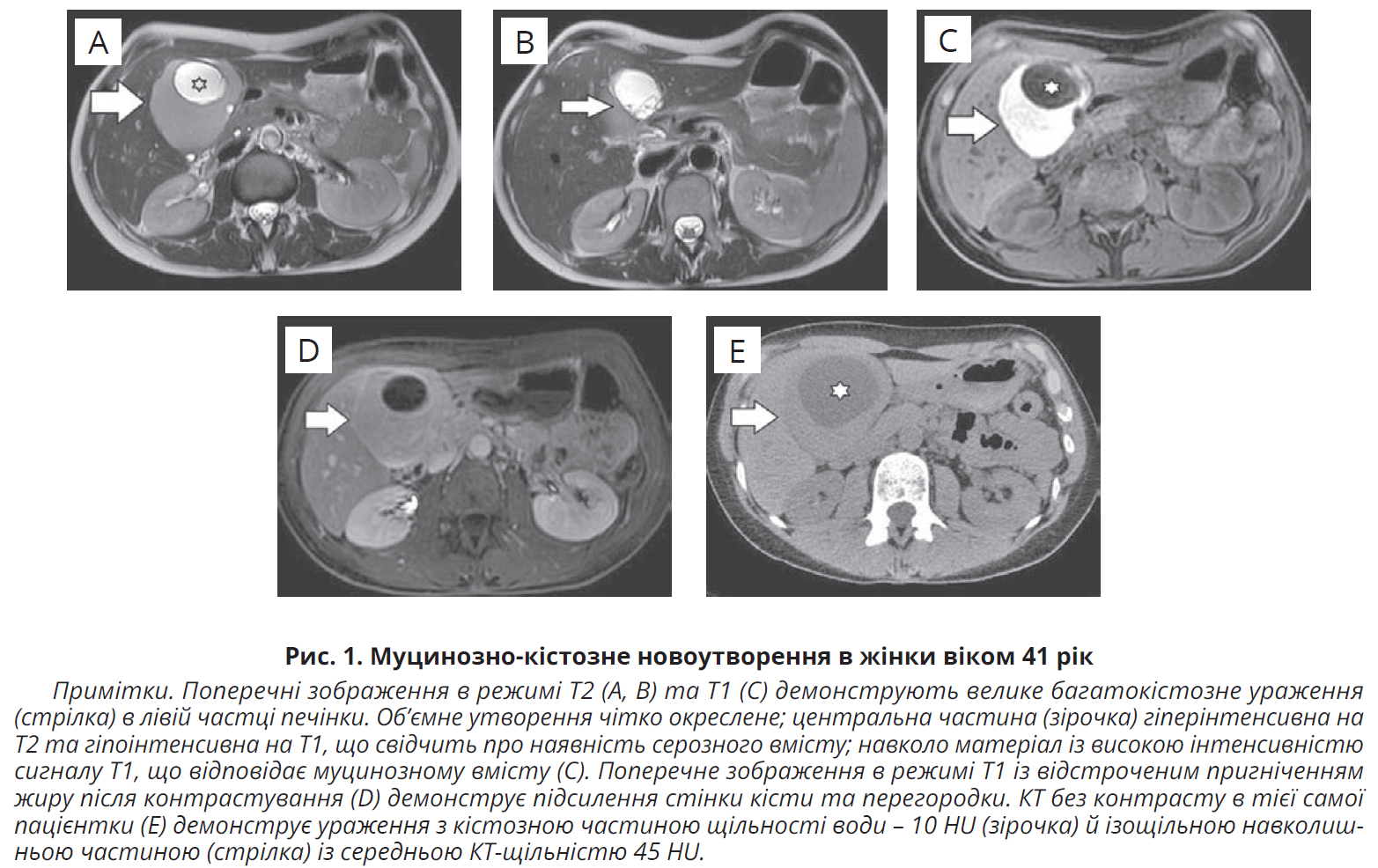
форми та підсиленням стінки кісти й перегородок після введення гадолінію. Такі ознаки, як тонкі перегородки, внутрішній крововилив, білково-казеозний детрит, рівні рідина-рідина, зв’язок із жовчними шляхами та проксимальним розширенням жовчних шляхів, краще видно на МРТ (рис. 1).
Специфічною ознакою, що диференціює МКН від простих кіст із перегородками, є зв’язок перегородок із зовнішнім контуром стінки кісти. Зокрема, для ПКП характерні перегородки, які відходять від зовнішніх макролобуляцій або ділянок увігнутості стінки кісти (специфічність – 91-100%); у разі МКН перегородки зазвичай відходять від інших ділянок стінки кісти (специфічність – 56-93%). Аспірація тонкою голкою при МКН не рекомендована, зважаючи на ризик дисемінації пухлини. Підвищені рівні СА 19-9 і СЕА варіюють у широких межах, а отже, клінічна користь цих маркерів обмежена. Найкращу діагностичну здатність для диференціації злоякісних кіст від ПКП продемонстрував рівень TAG-72 (також відомий як CA72-4) в рідині кісти >25 Од/мл. Труднощі в диференціації неінвазивних та інвазивних МКН, а також значний відсоток злоякісної трансформації зумовлюють потребу в їх повному хірургічному видаленні.
МКН з асоційованою інвазивною карциномою
Поширеність інвазивних МКН становить ≈6% усіх випадків МКН, частіше вони трапляються в чоловіків похилого віку. Характерними ознаками є великі розміри з трубчастою або тубулопапілярною структурою. Проте на підставі візуалізації інвазивні та неінвазивні МКН зазвичай важко диференціювати. Корисними для диференціації можуть бути клінічні прояви, демографічні ознаки (вік, стать) і показники функції печінки. Підвищення показників функції печінки при інвазивних МКН відбувається внаслідок інвазії біліарних шляхів, натомість сироваткові рівні CEA та CA 19-9 мають помірну прогностичну цінність.
При візуалізації обидва новоутворення мають вигляд солітарних внутрішньопечінкових багатолокулярних кістозних пухлин. Внутрішні перегородки без вузликів більше вказують на неінвазивні МКН. Пристінкові або перегородкові вузли, а також нерівномірне потовщення стінки кісти підвищують імовірність злоякісності, хоча можливі й за доброякісних МКН. Діаметр вузликів >10 мм та/або значний солідний компонент, наявність внутрішньокістозного детриту, грубих кальцифікатів підвищують імовірність інвазивного МКН.
Молекулярні дослідження показали, що мутації KRAS, підвищення регуляції шляхів Hedgehog і Wnt, а також зниження регуляції шляхів Т-хелперів 1-го та 2-го типів є потенційними молекулярними механізмами, які спричиняють поступове переродження доброякісних МКН в інвазивні ураження.
Внутрішньопротокові папілярні новоутворення жовчних шляхів
Термін «ВПНЖШ» (Chen et al., 2001) визначає епітеліальну пухлину жовчних шляхів, що характеризується наявністю виразного, часто багатофокального (до 50% випадків), папілярного або ворсинчастого епітеліального ураження всередині просвіту жовчної протоки з або без (2/3 випадків) продукції муцину з розширенням жовчної протоки. Ці утворення складаються з біліарних папілом, що можуть виникати в будь-якій частині жовчних шляхів – внутрішньопечінкових (69%), позапечінкових (22%) або ворітних (9%). ВПНЖШ характеризуються зв’язком із жовчними протоками та дистальною дилатацією жовчних шляхів унаслідок утворення муцину в просвіті (на відміну від проксимальної дилатації, яка частіше спостерігається при МКН унаслідок зовнішньої компресії). З незрозумілих причин найчастіше уражаються жовчні протоки в лівій частці.
ВПНЖШ становлять ≈10-15% пухлин жовчних шляхів. Частими симптомами є біль у правому підребер’ї (35-88%), рецидивний холангіт (5-59%) і механічна жовтяниця (20-36%). Лабораторне дослідження може виявити зміни показників функції печінки та білірубіну. Підвищення СА 19-9 у сироватці крові має обмежену специфічність, оскільки часто асоціюється із запальними або неопластичними станами, які супроводжуються холестазом або холангітом.
ВПНЖШ та біліарні внутрішньоепітеліальні новоутворення є двома основними ранніми доінвазивними ураженнями, що призводять до інвазивних холангіокарцином. Зважаючи на злоякісний потенціал, вони надалі поділяються на диспластичні ураження низького та високого ступенів, а також ВПНЖШ, асоційовані з інвазивною карциномою. Інактивація P53 і p16, а також мутації KRAS відбуваються на ранніх стадіях ВПНЖШ, тоді як втрата SMAD4/DPC4 спостерігається на пізніх стадіях хвороби. Іноді можливі ядерна експресія β-катеніну та мутації GNAS.
Трансабдомінальне УЗД дає змогу визначити дилатацію жовчних шляхів і гепатолітіаз, але чутливість у діагностиці ВПНЖШ обмежена (41%).
Для точнішого діагнозу та встановлення стадії необхідна КТ з контрастним підсиленням (чутливість – 50%) або МРТ/МРХПГ (чутливість – 65,5%). Ендоскопічна ретроградна холангіопанкреатографія демонструє внутрішньопросвітні ураження як неправильні дефекти наповнення в жовчних протоках. Додатковими ендоскопічними ознаками муцинопродукувальних ВПНЖШ є розширена ампула Фатера у формі «риб’ячого рота» з видимим дренажем муцину. Ендоскопічне УЗД дає змогу оцінити глибину інфільтрації стінки жовчної протоки, а також виявляє нерівномірно збільшені гепатодуоденальні лімфатичні вузли. Холангіоскопія дає можливість безпосередньої візуалізації солідної частини ВПНЖШ, виявляючи ураження, які не видно на початковій візуалізації, приблизно в третині випадків; окрім того, цей метод дає змогу провести біопсію. Позитронно-емісійна томографія (ПЕТ-КТ) всього тіла може бути корисною в сумнівних випадках ВПНЖШ, коли підвищене поглинання фтордезоксиглюкози (ФДГ) допомагає визначити основну локалізацію злоякісної пухлини.
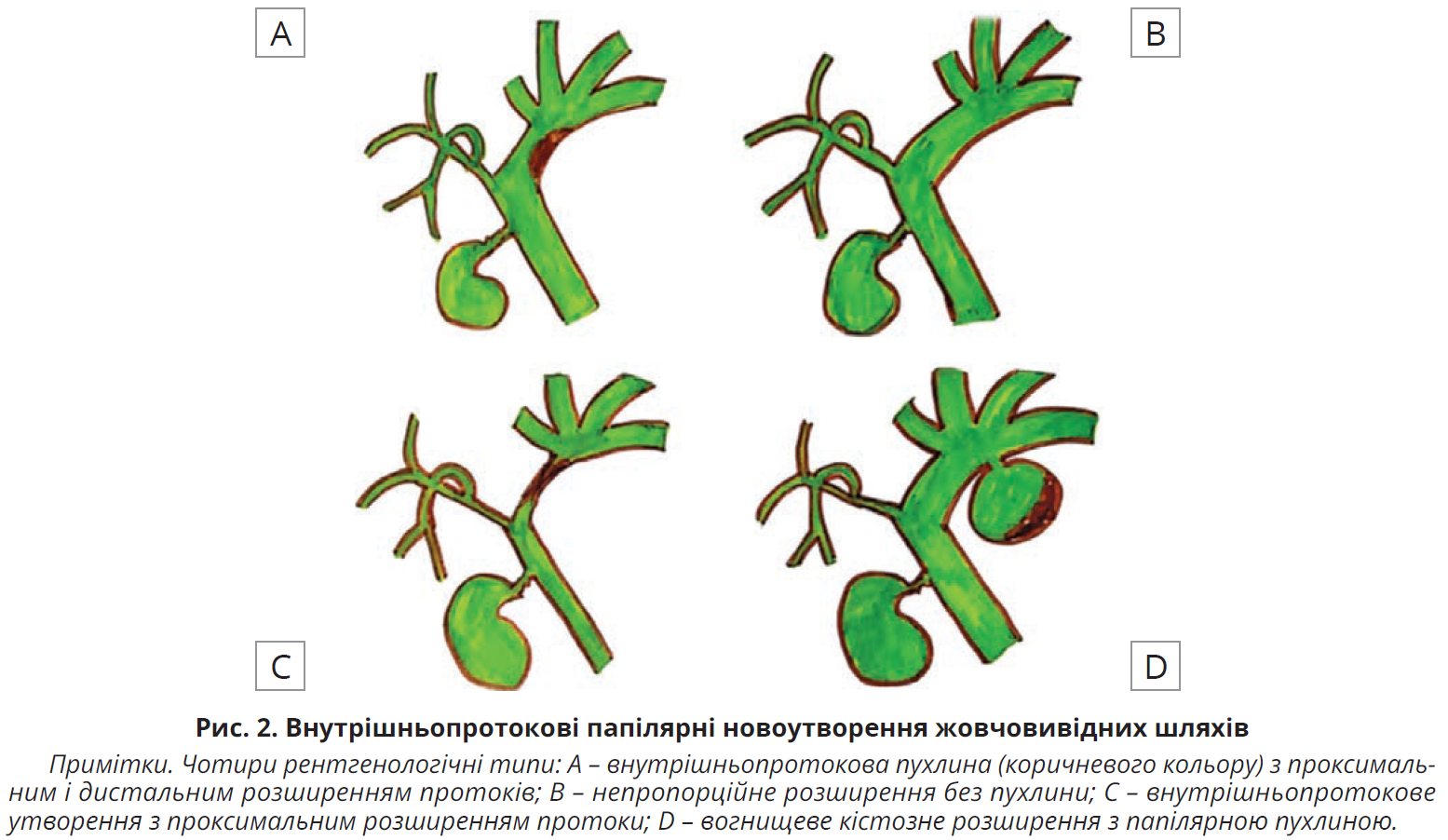
Існує чотири чіткі рентгенологічні моделі ВПНЖШ залежно від розміру та морфології внутрішньопротокової пухлини, ступеня секреції муцину й розташування пухлини (рис. 2).
Внутрішньопротокові пухлини з проксимальним розширенням протоки (ВПНЖШ 1-го типу)
У разі ВПНЖШ, що не секретує муцин, внутрішньопротокова пухлина може спричинити обструкцію з проксимальним розширенням жовчних шляхів. На КТ-зображеннях в артеріальній фазі такі пухлини демонструють тенденцію до ізопідсилення порівняно з прилеглою паренхімою печінки. Зображення в пізній фазі допомагають диференціювати ВПНЖШ від холангіокарцином: ВПНЖШ мають тенденцію «вимиватися» через незначну кількість фіброзної тканини в клітинній фіброваскулярній ніжці, натомість холангіокарциномам притаманне уповільнене поступове підсилення через високий уміст сполучної тканини. На МРТ-зображеннях у Т2-режимі ВПНЖШ 1-го типу зазвичай демонструють папілярний візерунок із середнім і низьким сигналом, який легко ідентифікується на тлі жовчі з високою інтенсивністю Т2-сигналу. Наявність значно знижених коефіцієнтів дифузії в дифузійно-зважених зображеннях підвищує ймовірність ВПНЖШ, асоційованої з інвазивною карциномою.
Непропорційне розширення без видимої пухлини (ВПНЖШ 2-го типу)
Ідентифікувати муциносекретувальні ВПНЖШ без видимої внутрішньопротокової пухлини дуже складно, оскільки єдиною рентгенологічною знахідкою може бути сегментарне або лобарне розширення жовчної протоки на МРХПГ. Щоб локалізувати пухлину, спочатку слід оцінити сегмент печінки з найпомітнішою дилатацією жовчних шляхів і асоційованою атрофією. Внутрішньопротокові лінійні або криволінійні гіпоінтенсивні смуги в розширеній жовчній протоці (ознака «павутинки») є високоспецифічною ознакою ВПНЖШ (99-100%), однак її чутливість не перевищує 53%.
Внутрішньопротокова пухлина з проксимальним і дистальним розширенням протоків (ВПНЖШ 3-го типу)
Найпоширеніший підтип ВПНЖШ, класичними проявами якого є внутрішньопротокова папілярна пухлина, схожа на цвітну капусту, пов’язана з дилатацією жовчних шляхів проксимальніше та дистальніше внаслідок секреції муцину.
Вогнищеве кістозне розширення з папілярною пухлиною (ВПНЖШ 4-го типу)
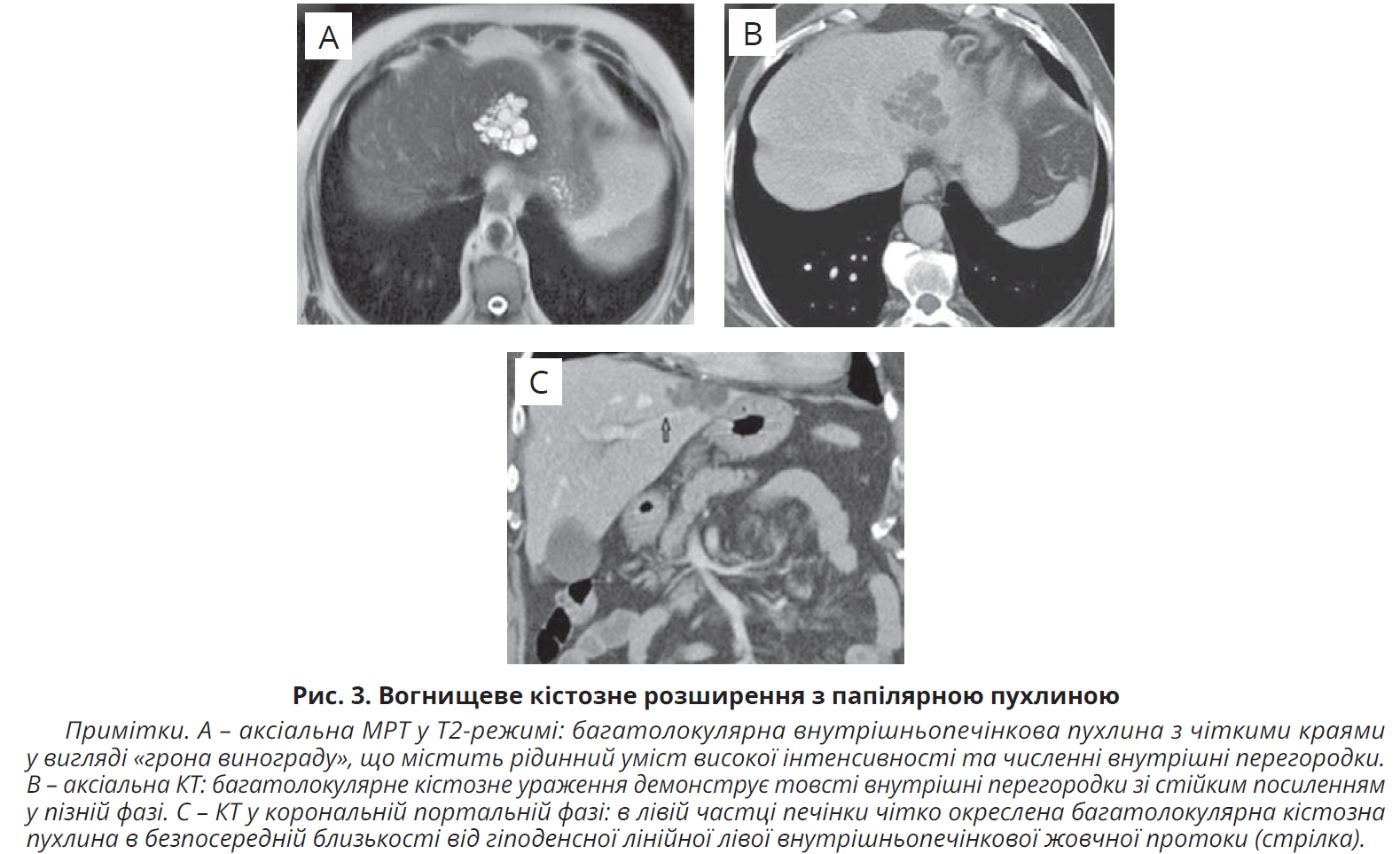
У разі ВПНЖШ 4-го типу надмірне утворення муцину призводить до підвищення внутрішньопротокового тиску й аневризматичного розширення жовчних шляхів або кістозного розширення перибіліарних залоз. ВПНЖШ кістозного типу мають вигляд багатолокулярних кістозних утворень («гроно винограду») з посиленими стінковими вузликами (рис. 3). ВПНЖШ 4-го типу дуже схожі на МКН; їх можна диференціювати за зв’язком між кістозним ураженням і жовчними протоками, що найкраще демонструє МРХПГ. На відміну від ВПНЖШ кістозного типу, для МКН не є характерним розширення жовчних шляхів. Досить корисними для диференціації є препарати на основі гадолінію, що виділяються в осередок ураження в гепатобіліарній фазі. Крім того, диференційна діагностика має включати ускладнені кісти печінки, локалізовану хворобу Каролі та рідкісніші кістозні гемангіоми, лімфангіоми, кісти печінки з ембріологічної передньої кишки, мезенхімальні гематоми або тератоми.
Слід зазначити, що підозра на ВПНЖШ 1-го, 3-го й 4-го типів потребує диференціації з інвазією протоків гепатоцелюлярною карциномою та внутрішньопротоковими метастазами. Характерні ознаки гепатоцелюлярної карциноми: гіперваскулярна паренхіматозна пухлина з уповільненим вимиванням у пацієнтів із відповідними чинниками ризику. Метастази асоціюються із суміжною паренхіматозною пухлиною й анамнезом первинної злоякісної пухлини, зазвичай колоректального походження.
ВПНЖШ демонструють мікроскопічні фіброваскулярні ядра чи тубулопапілярні утворення в жовчних протоках. Епітелій може бути панкреатобіліарного, кишкового, шлункового або онкоцитарного типу з різним ступенем атипії. Залежно від гістопатологічного підтипу ВПНЖШ експресують специфічні білки муцинового ядра (MUC5AC та MUC6) у панкреатобіліарних і шлункових клітинах, MUC1 у панкреатобіліарних клітинах і MUC2 у клітинах кишкового типу. Строма пухлини є фіброзною, а не схожою на яєчники, як у разі МКН. Більшість карцином, що виникають унаслідок ВПНЖШ, є холангіокарциномами панкреатобіліарного типу, тоді як муцинозні карциноми зазвичай асоціюються з пухлинами кишкового типу. ВПНЖШ з інвазивними характеристиками відповідають стадії внутрішньопечінкової холангіокарциноми, але мають кращий прогноз, що визначається глибиною інвазії та часткою (%) інвазивного компонента.
Варіанти лікування
Лікування може бути показано для симптоматичних або сумнівних ПКП. Відкрита чи лапароскопічна фенестрація є лікуванням першої лінії для дренування ПКП у черевній порожнині, що в 92% випадків сприяє зменшенню симптомів. Лапароскопічна фенестрація в поєднанні з марсупіалізацією виявилася безпечною й ефективною в пацієнтів із ПКП >15 см у діаметрі, з єдиним рецидивом, зареєстрованим упродовж спостереження тривалістю 41 місяць. Ендоскопічне трансгастральне дренування кісти є привабливим варіантом лікування, що усуває потребу в розрізах. Проте такий варіант можливий лише в разі поверхнево розташованих лівобічних кіст печінки, якщо процедура не проводиться лапароскопічно.
Склеротерапія – простий, безпечний та ефективний метод лікування, показаний ослабленим пацієнтам. Склерозувальний агент (дегідратований спирт або тетрациклін) уводять у ПКП після повної аспірації вмісту. У багатоцентровому дослідженні за участю пацієнтів із ПКП >5 см у діаметрі повна клінічна відповідь через 6 місяців становила 55%, тоді як у разі складних кіст, що мали геморагічний уміст або значну кількість інтракістозного детриту, спостерігався менший клінічний ефект. За підозри на злоякісну пухлину необхідна резекція печінки з чіткими краями.
Через обмеження передопераційних діагностичних інструментів будь-яка підозра на МКН в ідеалі потребує хірургічного видалення з негативними межами. Золотим стандартом лікування є радикальна резекція з широким (>2 см) хірургічним краєм, особливо в разі МКН з асоційованою інвазивною карциномою. Патологічна стадія інвазивних МКН відповідає стадії внутрішньопечінкових холангіокарцином, але прогноз сприятливіший через меншу клінічну агресивність, повільний ріст і рідкісні метастази. У ретроспективному дослідженні в пацієнтів із МКН після повної хірургічної резекції (R0) не спостерігалося рецидивів. Частка пацієнтів, які вижилили через 1, 3 та 5 років після операції, становила 100, 100 та 75% відповідно. В іншому дослідженні частота рецидивів МКН становила 5% після резекції або енуклеації та до 100% після фенестрації. Аналіз 25 досліджень, які включали 103 пацієнтів із МКН, демонструє, що основним показанням до вибору енуклеації замість резекції печінки була велика кіста, розташована в центральній частині печінки. Огляд даних засвідчив нульову частоту рецидивів, відсутність післяопераційних смертей і віддалених злоякісних пухлин. Отже, енуклеація МКН є безпечним та ефективним варіантом для пацієнтів, яким не можна виконати велику гепатектомію.
Хірургічна резекція – основний метод лікування ВПНЖШ. Обсяг хірургічної резекції залежить від локалізації пухлини, ступеня ураження жовчних шляхів та індивідуальних характеристик пацієнта. Здебільшого достатньо провести радикальну хірургічну резекцію, яка включає гепатектомію з резекцією жовчної протоки або без неї. У разі агресивніших ВПНЖШ з позитивними краями резекції можна виконати велику гепатектомію або ортотопічну трансплантацію печінки, за потреби з панкреатодуоденектомією. Після радикальної хірургічної резекції пацієнти з ВПНЖШ мають значно кращий прогноз порівняно з холангіокарциномами, з 5-річним виживанням без захворювання до 81%. Позитивні краї резекції, позитивні лімфатичні вузли, інвазія пухлини ≥5 мм та інвазивний компонент ≥10% асоціюються з гіршим прогнозом. Зважаючи на частоту інвазивності та метастазів у пацієнтів із ВПНЖШ, а отже, й високу ймовірність рецидиву, рекомендується регулярне післяопераційне спостереження з короткими інтервалами візуалізації.
Інфекційні кісти
Основними видами складних кіст печінки інфекційної етіології є: бактерійні, грибкові й амебні абсцеси печінки та гідатидні кісти печінки.
Абсцес печінки
Піогенні абсцеси печінки виникають унаслідок висхідного холангіту, гематогенної дисемінації чи пілефлебіту після інтраабдомінальних інфекцій, як-от гострий апендицит або дивертикуліт. Захворюваність вища в пацієнтів середнього чи похилого віку. Клінічні прояви включають вечірню субфебрильну лихоманку, втому, біль у правому верхньому квадранті, чутливу гепатомегалію та лейкоцитоз. На КТ з контрастним підсиленням інфекційні абсцеси демонструють периферичний інтенсивний ободок, що оточує центральну зону низької інтенсивності та зовнішню зону низької інтенсивності, зумовлену периферичним набряком паренхіми, що створює характерну ознаку «подвійної мішені». Наявність газу в абсцесі переконливо вказує на газоутворювальні штами. Варіанти лікування гнійних абсцесів печінки включають антибіотикотерапію та черезшкірне або відкрите дренування. У пацієнтів із поодинокими невеликими абсцесами печінки (<3 см) можна застосовувати лише тривалу антибіотикотерапію >3 тижні. Черезшкірне катетерне дренування в поєднанні з антибіотиками забезпечує успіх у понад 97% пацієнтів зі швидким клінічним покращенням. У дослідженні за участю 40 пацієнтів із гнійними абсцесами печінки діаметром >10 см черезшкірне дренування було успішним у 98% випадків; 1 пацієнт потребував подальшого відкритого дренування, 3 пацієнти – вторинного черезшкірного дренування. Незначні ускладнення спостерігалися у 25% учасників, 1 випадок був летальним. За відсутності ефекту від указаних методів лікування або в разі складних багатолокулярних абсцесів, абсцесів із перегородками чи перитонітом показане відкрите хірургічне дренування.
Амебний абсцес – найпоширеніший позакишковий прояв амебіазу. Клінічно визначаються гепатомегалія, біль у правому підребер’ї, діарея; в анамнезі – поїздки в ендемічні регіони; результати серологічного дослідження позитивні. На відміну від піогенних абсцесів, амебні абсцеси досить ефективно лікуються пероральним метронідазолом протягом 7-10 днів. Черезшкірне або хірургічне дренування може знадобитися в 15% випадків для лікування поверхневих абсцесів, що збільшуються (високий ризик розриву), бактерійних суперінфекцій або за відсутності ефекту від метронідазолу.
Кандидозні абсцеси зазвичай трапляються в пацієнтів з ослабленим імунітетом. КТ демонструє множинні ураження низької інтенсивності з типовим інтенсивним краєм і частим ураженням селезінки. За відсутності ефекту від дренування та прийому антибіотиків широкого спектра слід розглянути антимікотичну терапію на ранніх стадіях, до початку фунгемії.
Ехінококові кісти
Гідатидна хвороба печінки – це ендемічна паразитарна інфекція, спричинена метацестодами (личинкова стадія) Echinococcus granulosus унаслідок перорального споживання зараженої їжі.
У тонкій кишці личинки проникають у кровотік і мігрують у тканини. Основними органами-мішенями є печінка й легені, де виникають гідатидні кісти. Кіста складається із зовнішнього шару (адвентиція), середньої ламінованої мембрани (ектоциста) та внутрішнього зародкового шару. Ектоциста та внутрішній зародковий листок формують ендоцисту. На периферії материнської кісти з часом виникають дочірні кісти, формуючи складну кісту. Тривалий час (місяці – роки) ехінококові кісти (ЕК) залишаються безсимптомними. Клінічні прояви включають біль у правому верхньому квадранті, анорексію, механічну жовтяницю та свербіж. Розрив кісти з витіканням умісту асоціюється із серйозною імунологічною реакцією, опосередкованою імуноглобуліном Е, яка проявляється лихоманкою, свербінням, еозинофілією та загрозливою для життя анафілактичною реакцією. Іншими можливими ускладненнями розриву ЕК є вторинний гідатидоз, сепсис і гострий холангіт. ЕК, які сполучаються із жовчними протоками, зазвичай неактивні; в рідкісних випадках можливе позапечінкове розширення з ураженням прилеглих внутрішніх органів верхньої частини живота.
Смертність від ЕК становить 2-5%, що підкреслює важливість точної діагностики. Діагноз установлюється за допомогою серологічного дослідження та відповідних методів візуалізації. Чутливість тестів на антиехінококові антитіла сягає 97%, але цей метод не диференціює активну та раніше перенесену інфекцію; крім того, в 30-40% пацієнтів антитіла не виявляються. Визначення ехінококового антигена має варіабельний діапазон чутливості (33-85%), що перешкоджає його використанню в клінічній практиці. Тож основним методом діагностики ЕК є візуалізація.
Початковим методом візуалізації є УЗД, що дає змогу оцінити кількість, локалізацію, внутрішню структуру та наявність ускладнень, керувати терапевтичними рішеннями, класифікуючи ЕК на активні, перехідні й неактивні, а також застосовується для подальшого спостереження за пацієнтом.
Неофіційна робоча група ВООЗ із класифікації ехінококів (WHO-IWGE) стандартизувала систему класифікації ЕК 2001 року, поділивши їх на три групи: активні (CE1 і CE2), перехідні (CE3), неактивні (CE4 та CE5). Клас CE1 – однолокулярні кісти з однорідним анехогенним умістом, видимою стінкою й ознакою «сніжинки»; CE2 – багатолокулярні кісти з множинними перегородками, дочірніми кістами й ознакою «бджолиного стільника». Клас CE3 включає кісти, які вважаються дегенеративними та надалі поділяються на CE3a – однолокулярні накопичення рідини з мембраною відокремленої ендоцисти, що плаває (ознака «водяної лілії»); CE3b – переважно тверді кісти з дочірніми кістами. До класу CE4 належать кісти з гетерогенним гіпо- або гіперехогенним дегенеративним умістом і дочірніми кістами; до класу CE5 – кісти з товстою кальцифікованою стінкою.
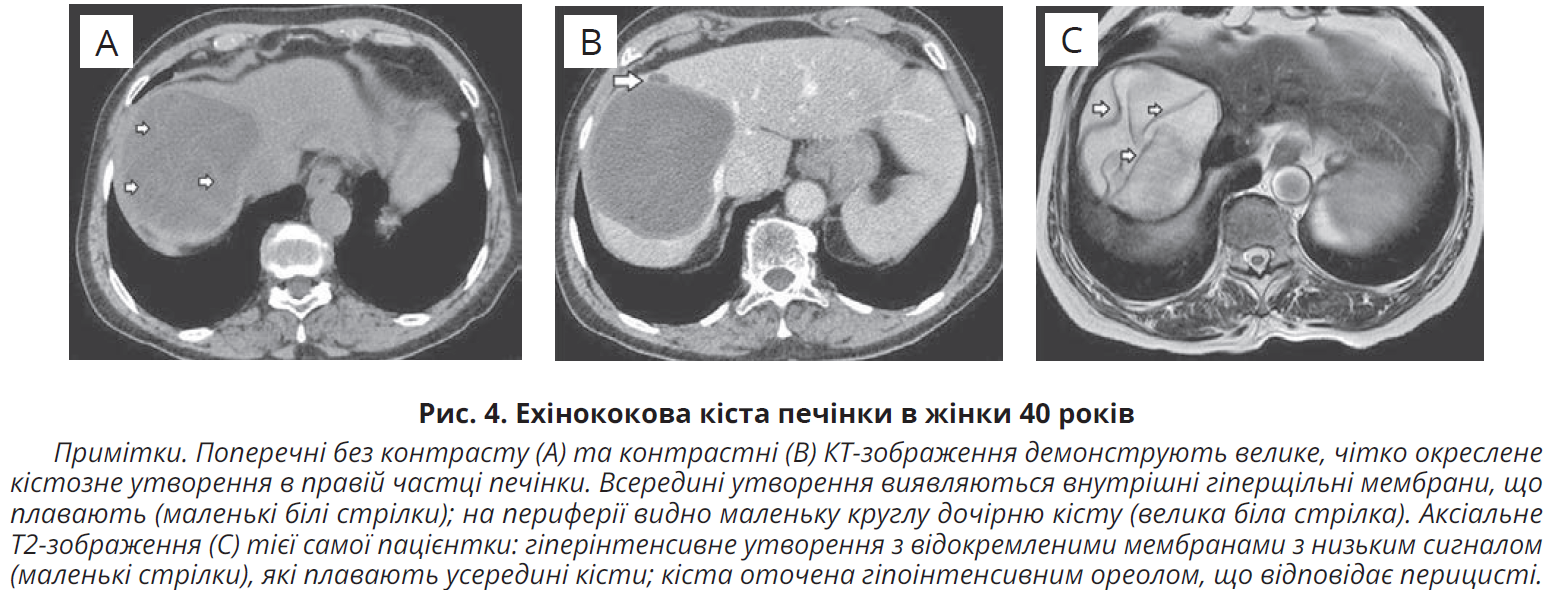
Методи КТ і МРТ допомагають у діагностиці піддіафрагмальних і позаабдомінальних кіст. КТ дає змогу виявити розташування та глибину кісти в паренхімі печінки, наявність кальцинованих стінок (у 50% випадків) і дочірніх кіст (у 75% пацієнтів), що полегшує рішення щодо хірургічного втручання. КТ-ознаки EК 1-го типу: чітко окреслені однолокулярні кістозні ураження без посилення (щільність води), що імітують ПКП. EК 2-го типу поділяються на підтип ІІА – кістозні ураження з круглими дочірніми кістами, розташованими на периферії, зазвичай меншої інтенсивності, ніж материнська кіста; підтип IIB – більші дочірні кісти неправильної форми, які займають майже всю материнську кісту, залишаючи між собою гіперщільну рідину, що створює вигляд «розетки»; підтип IIIC – гіперщільне, кругле або овальне внутрішньопечінкове утворення з розсіяними кальцифікатами й окремими дочірніми кістами (рис. 4A, B). Кальцифікація кісти видається гіперщільною на КТ, зазвичай криволінійна чи кільцеподібна, спочатку в перицисті, на пізніх стадіях хвороби – цілковита.
Типові МРТ-ознаки EК: 1) обідок із низькою інтенсивністю сигналу (ознака «обідка») на T2WI, утворений шарами перицисти й ендоцисти інтактної кісти; 2) помітно гіперінтенсивний гідатидний матрикс на T2WI («гідатидний пісок»); 3) дочірні кісти видаються ізоінтенсивними до материнської кісти на T2WI та гіпоінтенсивними або ізоінтенсивними до гідатидного матриксу на T1WI та T2WI відповідно, якщо є життєздатними; 4) відокремлені мембрани EК, що плавають, – темні утворення на T1WI та T2WI (ознака «змії» – рис. 4C); 5) кальцифікати, що мають вигляд зон виключення сигналу.
Методом вибору для виявлення ураження жовчних шляхів та/або судин, розриву стінки кісти й суперінфекції є КТ. До неспецифічних ознак інтрабіліарного розриву відносять зміни в архітектурі EК, розширення жовчних шляхів, наявність повітря, рівнів повітря-рідина чи жирової рідини всередині кісти. МРТ і МРХПГ у режимі Т2 також корисні для діагностики розриву інтрабіліарної EК. Погано окреслене кістозне ураження, надмірно розширений обідок і плямисті, гетерогенно посилені ділянки поблизу ураження, наявність газу або рівнів повітря-рідина всередині кісти на КТ у поєднанні з відповідним клінічним сценарієм указують на суперінфекцію EК.
EК 1-го типу та біліарні МКН мають багато спільних радіологічних характеристик із ПКП.
У разі однолокулярних кістозних уражень печінки слід пам’ятати, що симптоматичні кісти, які швидко збільшуються, треба диференціювати з МКН та EК; відповідно, діагностичні тести мають включати антиехінококові антитіла, особливо якщо в анамнезі було перебування в ендемічних регіонах.
Вибір оптимального лікування EК печінки залежить від ступеня ураження органів, кількості та розміру кіст, їхнього зв’язку із жовчними шляхами, наявністю супутньої бактерійної інфекції та/або внутрішньокістозного крововиливу. Можливі опції включають три методи лікування: 1) системна хіміотерапія мебендазолом/альбендазолом; 2) хірургічні методи (від видалення кісти до великої гепатектомії); 3) черезшкірна пункція, аспірація, ін’єкція та повторна аспірація (метод PAIR) під контролем УЗД. Пацієнтів із невеликими EК (<5 см) зазвичай лікують протигельмінтними засобами з клінічним спостереженням. У дослідженні, яке оцінювало таку спостережну стратегію, 97,4% EК залишалися неактивними впродовж 2 років.
Хірургічні втручання можуть бути відкритими та лапароскопічними, консервативними та радикальними. Консервативні методи включають дренаж і розкриття кісти з оментопластикою або без неї. При фенестрації кісту розкривають, після ін’єкції гіпертонічного розчину вміст кісти аспірують. Радикальні процедури включають тотальну перицистектомію та малу або велику гепатектомію. Бензимідазол завжди вводять перед будь-яким типом операції для стерилізації кісти та зниження ризику анафілактичної реакції. Метод PAIR передбачає черезшкірну пункцію, аспірацію кісти, ін’єкцію гіпертонічного розчину та/або 100% спирту й повторну аспірацію. Метод показаний, коли діаметр кісти становить 5-10 см, за неможливості проведення або невдачі попереднього хірургічного втручання. PAIR найкраще проводити під постійним УЗ- або КТ-контролем із застосуванням бензимідазолу. Частка одужання після лапароскопічного втручання становила 98,7%, після PAIR і хіміотерапії – 97,5%. Спостереження рекомендовано що 6 місяців упродовж перших 2 років, надалі раз на рік залежно від клінічної ситуації.
Запальні (перибіліарні) кісти
Перибіліарні кісти – це множинні двобічні кістозні ураження (0,2-2,5 см), які виникають унаслідок порушення перипортального кровотоку та перипортального запалення в циротичній печінці або внаслідок генетичних змін за спадкових фіброзно-кістозних захворювань. Ці ураження розташовані переважно навколо злиття печінкових протоків, без сполучення із жовчним деревом. Вони не потребують лікування, проте важливо встановити правильний діагноз, оскільки хибна діагностика злоякісного ураження може спричинити відмову або затримку з трансплантацією в пацієнтів із термінальною стадією хвороби печінки.
Ускладнені ПКП (геморагічні або інфіковані)
Внутрішньокістозний крововилив (найчастіше ускладнення ПКП) або інфекція ПКП зрештою призводять до складних кістозних уражень, які зазвичай неможливо відрізнити від пухлин. Клінічні прояви включають біль і гарячку. На УЗД ускладнення видаються гіпоехогенними з товстою стінкою, детритом і дистальним акустичним посиленням без внутрішньої васкуляризації. КТ-зображення геморагічних кіст варіює від ПКП із внутрішнім геморагічним компонентом у вигляді «язиків полум’я» до складніших кістозних утворень із товстою фіброзною капсулою, внутрішніми перегородками та стінковими вузлами. Інфіковані ПКП демонструють посилене потовщення стінки, рівень рідини-рідина чи внутрішньокістозні бульбашки газу на КТ. Геморагічний або білково-казеозний уміст не посилюється на МРТ.
Однак у гострому стані геморагічні кісти є гіперінтенсивними в режимах Т1 і Т2. Через декілька місяців вони можуть видаватися гіперінтенсивними в режимі T1; окрім того, можна побачити перегородки, вузлики на стінці та внутрішній детрит.
Для діагностики внутрішньокістозного крововиливу точнішими вважаються УЗД та МРТ. Для виявлення активної екстравазації геморагічного вмісту в черевну порожнину внаслідок розриву стінки кісти краще застосовувати КТ.
Геморагічні кісти зазвичай лікуються консервативно. Антикоагулянти й антиагреганти тимчасово припиняють і відновлюють через 7-15 днів або 3 дні відповідно після припинення активної кровотечі. Емболізація або хірургічне втручання показані в разі неконтрольованого розриву ПКП або гемодинамічної нестабільності.
18ФДГ-ПЕТ-КТ демонструє підвищене поглинання ФДГ оболонкою кісти порівняно з нормальною паренхімою печінки та може використовуватися для підтвердження діагнозу інфікованих кіст у складних випадках. Стандартом лікування інфікованих кіст печінки є фторхінолони та цефалоспорини ІІІ покоління спочатку парентерально, надалі тривало перорально (загалом 4-6 тижнів). Проте для цілковитого вилікування більшість інфікованих кіст потребують додаткового черезшкірного дренування. Основні показання до черезшкірного дренування: діаметр кісти >5 см; відсутність відповіді на антибіотики через 48 годин; наявність газу всередині кісти на КТ/МРТ; пацієнти з ослабленим імунітетом.
Рідкісні та вроджені кісти печінки
Фіброзно-полікістозні хвороби печінки – це унікальний спектр патологічних аномалій, спричинених порушенням розвитку ембріональної протокової пластинки. Зазвичай уроджені кістозні ураження виникають у внутрішньо- або позапечінкових жовчних протоках, спричиняючи розвиток панкреатиту, холангіту, літіазу та злоякісних пухлин. Залежно від часу ураження протокової пластинки вроджені кістозні ураження доволі різноманітні: жовчні гамартоми; автосомно-домінантний полікістоз печінки (>20 печінкових кіст), хвороба Каролі (ураження 4-го типу за класифікацією Тодані) та кісти холедоха. Ці ураження варто враховувати при диференціації складних кістозних уражень печінки; в разі ускладнення крововиливом, бактерійною суперінфекцією або інтракістозним розвитком неопластичних уражень їх слід лікувати, як обговорювалося раніше. Полікістоз печінки зі стисненням жовчних протоків, печінкових вен, нижньої порожнистої вени, ворітної вени (спричиняє портальну гіпертензію) або прилеглих внутрішніх органів може потребувати відкритої чи лапароскопічної фенестрації множинних кіст печінки або гепатектомії. При тяжкій печінковій декомпенсації, асциті, недостатньому харчуванні, закупорці судин або в разі, коли резекція не вдається чи вважається недоцільною, показано ортотопічну трансплантацію печінки.
Висновки
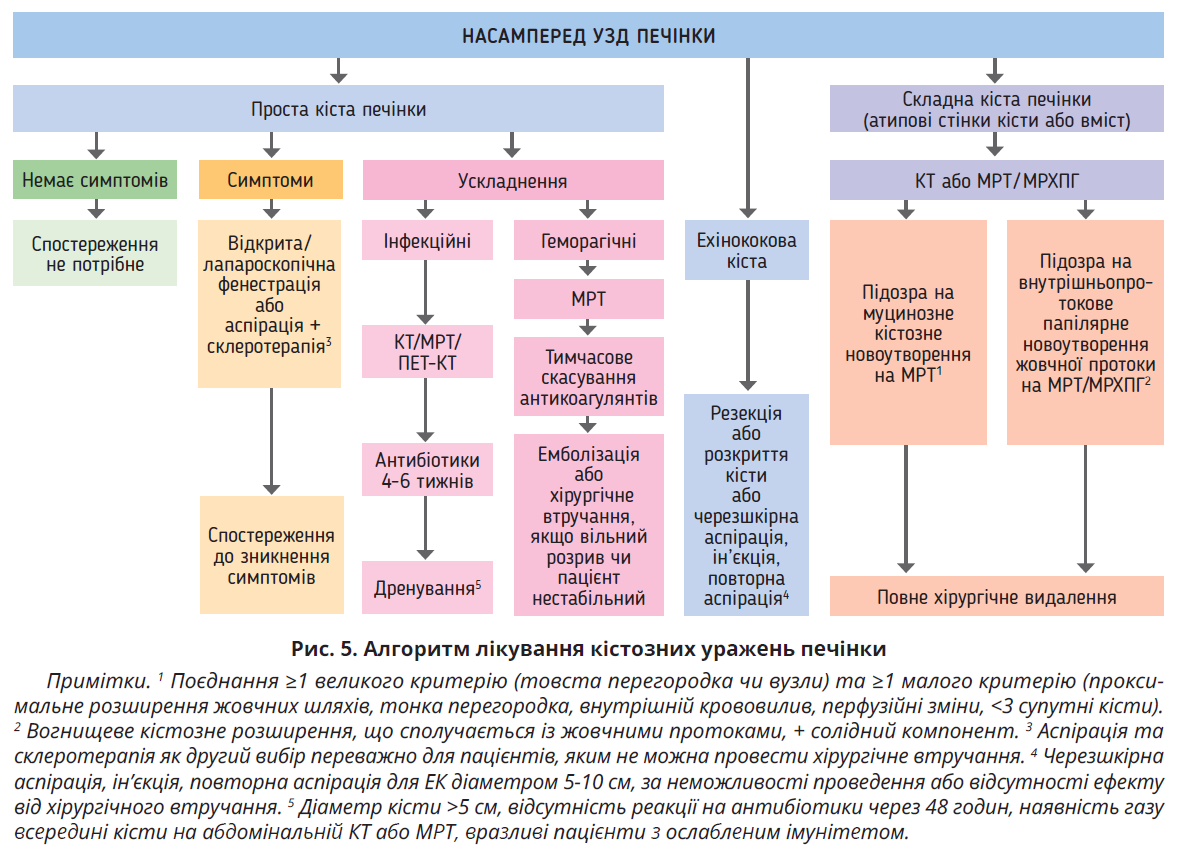
Комплексні кістозні ураження печінки дедалі частіше виявляються в безсимптомних осіб або під час обстеження з приводу неспецифічних абдомінальних симптомів, що спонукають пацієнтів звертатися по хірургічну допомогу. Вони охоплюють спектр станів, який включає непухлинні утворення, доброякісні та злоякісні пухлини. Складні кістозні ураження печінки є причиною численних діагностичних і терапевтичних дилем для гепатобіліарних спеціалістів – радіологів, патологів, гастроентерологів, гепатологів і хірургів. Характеристики кіст печінки, які допомагають їх класифікувати, включають наявність перегородок, посилені потовщені стінки, ущільнення/вузлики в стінці, кальцинати та якість кістозної рідини з детритом або без нього. За підозри на основну злоякісну пухлину випадок слід обговорити на засіданні онкологічної міждисциплінарної команди. У разі злоякісного новоутворення або дисплазії високого ступеня хірургічні варіанти включають радикальну резекцію й енуклеацію відповідно до локалізації кісти та стану пацієнта. Коли характеристики візуалізації нетипові або непереконливі, варто проводити регулярний короткочасний моніторинг, використовуючи методи візуалізації з високою роздільною здатністю (рис. 5). На сьогодні тривають дослідження патогенезу та прогресування складних кістозних уражень печінки, які допоможуть знайти клінічно значущі молекулярні маркери для покращення діагностики та класифікації.
Література
Baltagiannis E.G., Tsili A., Goussia A., Glantzouni A., Frigkas K., Charchanti A., Glantzounis G.K., Gomatos I.P. Complex cystic liver lesions: classification, diagnosis, and management. Ann. Gastroenterol. 2024; 37 (3): 255-265. doi: 10.20524/aog.2024.0876.