Синдром подразненого кишківника: менше подразнень чи краще лікування?
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Синдром подразненого кишківника (СПК) – це поширений хронічний стан, зумовлений дисфункцією осі кишківник – мозок, який значно погіршує якість життя пацієнтів. Для діагностики СПК застосовуються Римські критерії IV (табл.).
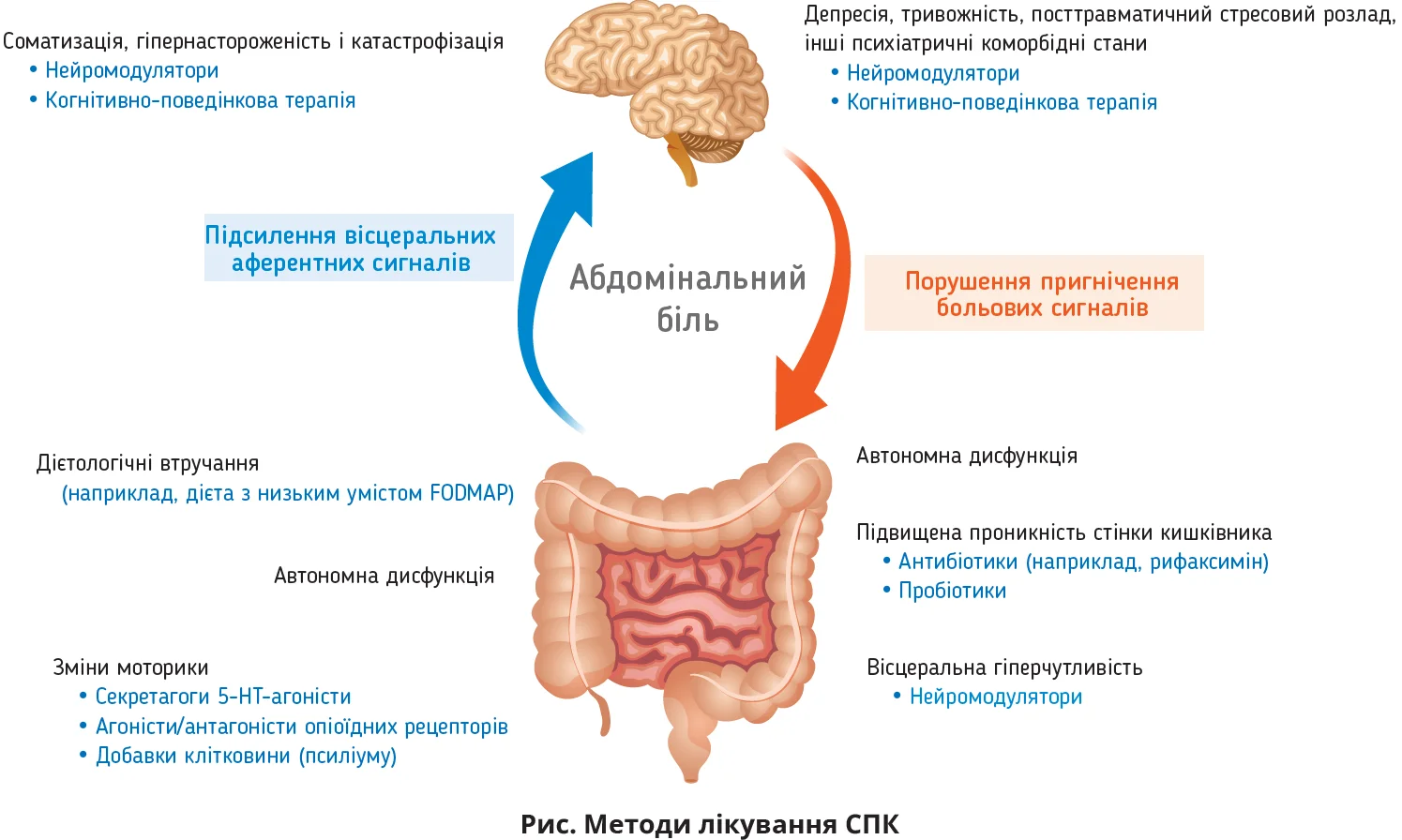
Поняття СПК зазнало тривалої повільної еволюції. Уперше цей стан було описано в 1818 р. під назвою «слизистий коліт»; популярності цьому терміну надали фахові описи Вільяма Ослера в 1890-х рр. Термін «подразнений кишківник» уперше з’явився в науковій літературі в 1929 р., а термін «СПК» – у 1944 р.Для лікування СПК застосовуються різні нефармакологічні та фармакологічні методи (рис.).
Харчування
Патофізіологія СПК повністю не вивчена, хоча відзначено, що споживання певних продуктів у схильних осіб може спричиняти локалізоване запалення та посилення гастроінтестинальних симптомів. Найпотужнішу доказову базу має дієта з низьким умістом FODMAP (ферментованих оліго-, ди-, моносахаридів і поліолів). Систематичний огляд і метааналіз 13 рандомізованих контрольованих досліджень виявив, що ця дієта була ефективнішою за інші дієтологічні втручання в усуненні абдомінального болю, здуття та відчуття розтягнення живота (відносний ризик відсутності покращення становив 0,67). Показано також, що дієта з низьким умістом FODMAP асоціюється з кращими показниками якості життя порівняно з контрольними дієтами, однак існує потреба в тривалих дослідженнях цієї дієти з метою з’ясування її впливу на мікробіом.
Пробіотики
Із медичною метою застосовуються понад 500 штамів пробіотиків, найпоширенішими з яких є лактобацили, біфідобактерії та сахароміцети. Точний механізм дії пробіотиків у разі СПК нез’ясований. Відповідно до гіпотез він включає утворення молочної кислоти й ацетату при ферментації вуглеводів, закислення просвіту кишківника, утворення бутирату, зміни складу мікробіому кишківника, зниження проникності кишкової стінки та покращення імунної функції кишківника.
Оцінювання переваг пробіотиків у лікуванні СПК є складним, оскільки дослідження значно відрізняються за типом і дозою пробіотика, тривалістю лікування, кількістю пацієнтів, кінцевими точками.
У зв’язку з цим результати нерідко є суперечливими. Зокрема, метааналіз 37 досліджень (n=4403) з’ясував, що комбінації пробіотиків ефективніше усувають симптоми СПК, ніж монопрепарати, натомість інший систематичний огляд не виявив відмінностей ефекту пробіотиків від плацебо.
Антибіотики
Мікробіота кишківника залучена до низки процесів, що лежать в основі розвитку СПК (зміни моторики та вісцеральної чутливості, локальна імунна активація, бар’єрна функція кишківника). Крім того, чинники, які зумовлюють розвиток СПК – стрес, певні особливості харчування, генетика, також впливають на стан мікробіоти. У зв’язку з цим антибіотики, які змінюють її бактерійний склад, можуть бути цінною стратегією лікування СПК.
У систематичному огляді та метааналізі (n=2845) було виявлено, що семиденний курс лікування неоміцином достовірно зменшував симптоми СПК порівняно з плацебо. Однак інші дослідження повідомили про швидке наростання резистентності до неоміцину, що унеможливлює його застосування для повторних курсів терапії.
Описано також сприятливий ефект норфлоксацину та рифаксиміну. Для останнього доказова база є найпотужнішою, що дало можливість Управлінню США з контролю продовольства та медикаментів (FDA) схвалити його для лікування діарейного варіанта СПК.
Препарати, що діють у кишківнику
Рекомендації Американського коледжу гастроентерології (ACG, 2021) не радять застосовувати спазмолітики на кшталт дицикломіну чи гіосціаміну для усунення загальних симптомів СПК. Таке рішення пояснюється тим, що хоча спазмолітини і є широко застосовуваними при СПК препаратами, дослідження на підтримку їх використання переважно являють собою старі невеликі випробування, часто короткотривалі та низькоякісні.
Аналогічно вищезгадані рекомендації не радять застосовувати препарати поліетиленгліколю для лікування СПК із закрепом, оскільки дані про вплив цих засобів на абдомінальний біль відсутні. Утім, деякі автори продовжують визнавати поліетиленгліколь засобом першої лінії для усунення закрепів у разі СПК, оскільки цьому препарату властиві доведена проносна ефективність, доступність, сприятливий профіль безпеки та невисока вартість.
Секретагоги, включаючи агоністи гуанілатциклази С (лінаклотид, плеканатид) і активатор хлоридних каналів лубіпростон, є схваленими FDA препаратами для лікування СПК із закрепом.
Тегасерод, агоніст серотоніну, схвалений для лікування СПК із закрепом у жінок віком менш як 65 років з одним або менше чинником серцево- судинного ризику. Рекомендації ACG (2021) радять розглянути тегасерод у цій популяції, якщо відповідь на секретагоги є недостатньою.
Для терапії СПК із закрепом схвалено також тенапанор – інгібітор ізоформи-3 гастроінтестинального натрій-водневого обмінника.
Усі ці препарати достовірно зменшують здуття живота; найвища ефективність притаманна лінаклотиду.
Для лікування діарейного варіанта СПК FDA схвалило три препарати: рифаксимін, алосетрон та елуксадолін. Ці самі препарати радять застосовувати чинні рекомендації ACG та рекомендації з клінічної практики Американської гастроентерологічної асоціації (AGA).
Алосетрон – селективний агоніст 5-HT3-рецепторів – свого часу відкликали з фармацевтичного ринку у зв’язку з ризиком обструкції та перфорації товстого кишківника, ішемічного коліту, але у 2002 р. цей препарат повернули в доступ, обмеживши його застосування колом жінок із хронічним тяжким діарейним варіантом СПК, які не відповідають на традиційні методи лікування.
Елуксадолін – периферичний агоніст мю- та каппа- опіоїдних рецепторів і антагоніст дельта-опіоїдних рецепторів – достовірно зменшує абдомінальний біль і нормалізує консистенцію калу, однак він протипоказаний пацієнтам з анамнезом панкреатиту, зловживанням алкоголем і видаленим жовчним міхуром у зв’язку з певним ризиком розвитку панкреатиту та спазму сфінктера Одді.
Нейромодулятори
Провідним симптомом СПК є біль у животі. Схвалені FDA препарати здатні зменшувати абдомінальний біль у деяких, але не в усіх пацієнтів з СПК. Із цією метою застосовуються нейромодулятори – препарати, покликані знизити й вісцеральний біль, і центральну гіперчутливість. До нейромодуляторів належать трициклічні антидепресанти (ТЦА), інгібітори зворотного захоплення серотоніну та норадреналіну й інші препарати (габапентин, прегабалін).
Впливаючи на норадреналінергічні та допамінергічні рецептори, ТЦА здатні змінювати сприйняття болю завдяки центральній модуляції вісцеральних аферентних сигналів, зниженню активації первинних сенсорних аферентних нервових волокон і лікуванню коморбідних психологічних розладів. ТЦА є найчастіше застосовуваними нейромодуляторами. Ці препарати включають амітриптилін, нортриптилін, іміпрамін і дезипрамін. ТЦА також притаманні антихолінергічні ефекти та здатність сповільнювати шлунково-кишковий транзит (у разі застосування високих доз), таким чином усуваючи діарею в деяких пацієнтів із діарейним варіантом СПК. За даними систематичного огляду та метааналізу, ТЦА мають перевагу над плацебо в усуненні загальних симптомів СПК. Застосування цих препаратів підтримують і чинні рекомендації ACG. Найпоширенішими побічними ефектами ТЦА виступають сухість у роті, закрепи та сонливість.
Інгібітори зворотного захоплення серотоніну та норадреналіну (наприклад, дулоксетин) теж можуть зменшувати вираженість болю в животі, проте дані щодо пацієнтів з СПК є обмеженими.
Лікування, спрямоване на вісь кишківник – мозок
Для лікування хвороб на кшталт СПК дедалі частіше застосовуються методи лікування, спрямовані на покращення функціонування осі кишківник – мозок, а саме когнітивно-поведінкова терапія та певні види гіпнотерапії. Це пояснюється тим, що симптоми СПК виникають або загострюються на тлі психологічних розладів (тривожність, депресія), а також поведінкових розладів (соматизація, гіпернастороженість і катастрофізація).
Поведінкова терапія може застосовуватися окремо або в поєднанні з традиційними методами лікування, вона є безпечною та включена в сучасні рекомендації ACG.
Серед інноваційних методів лікування СПК – застосування віртуальної реальності, точніше лікувальної розширеної реальності. Хоча точний механізм дії цього методу дотепер остаточно не встановлений, вважається, що тривимірне імерсивне середовище, яке створюється віртуальною реальністю, ніби відволікає користувача та його мозок від обробки патологічних периферичних сигналів, даючи змогу зосередитися та відпрацювати саморегуляцію симптомів. Хоча досліджень віртуальної реальності при СПК досі не проводилося, нещодавнє рандомізоване контрольоване дослідження продемонструвало, що цей метод достовірно зменшував симптоми, зокрема абдомінальний біль, і покращував якість життя пацієнтів з іншим подібним станом – функціональною диспепсією.
Висновки
Хоча для полегшення симптомів СПК запропоновано низку дієт і фармакопрепаратів, універсальний алгоритм лікування дотепер відсутній. Популярною стратегією є дієтотерапія, а саме застосування дієти з низьким умістом FODMAP. Однак слід зауважити, що ця дієта не є однаково ефективною для всіх пацієнтів з СПК. Доказова база на підтримку пробіотиків є досить слабкою, хоча деякі препарати та штами визнано ефективнішими за інші. Нещодавні рекомендації радять застосовувати для лікування СПК із закрепом секретагоги, тегасерод, тенапанор і не радять призначати спазмолітики та поліетиленгліколь для усунення загальних симптомів СПК. За діарейного варіанта СПК рекомендованими рецептурними препаратами є рифаксимін, алосетрон та елуксадолін. Зростає також застосування методів лікування, що модулюють функціонування осі кишківник – мозок, зокрема нейромодуляторів і когнітивно-поведінкової терапії. Потенційно можливим засобом терапії СПК є також віртуальна реальність, яка, однак, потребує подальших досліджень. Активне вивчення вже наявних та експериментальних методів дає надію на створення ефективного персоналізованого лікування СПК у майбутньому.
Література
Travers P., Lacy B.E., Cangemi D.J. Irritable bowel syndrome – less irritable, or better treatments? Curr. Opin. Gastroenterol. 2024; 40 (1): 27-33.