Роль порушень моторики в ґенезі функціональних захворювань шлунково-кишкового та біліарного трактів. Актуальна терапевтична корекція на прикладі тривалого клінічного спостереження
Автор: Олександра Юріївна ФІЛІППОВА, доктор медичних наук, професор кафедри внутрішньої медицини 2, фтизіатрії, професійних хвороб і клінічної імунології Дніпровського державного медичного університету
 Розлади моторики шлунково-кишкового (ШКТ) і біліарного тракту (БТ) можуть бути провідним патогенетичним чинником, що зумовлює розвиток багатьох поширених гастроентерологічних захворювань. Моторні порушення можуть бути патогенетичним механізмом розвитку як органічної патології, так і функціональних захворювань ШКТ, пов’язаних із порушенням нервової, гуморальної, метаболічної та місцевої регуляції, які досить часто трапляються в клінічній практиці.
Розлади моторики шлунково-кишкового (ШКТ) і біліарного тракту (БТ) можуть бути провідним патогенетичним чинником, що зумовлює розвиток багатьох поширених гастроентерологічних захворювань. Моторні порушення можуть бути патогенетичним механізмом розвитку як органічної патології, так і функціональних захворювань ШКТ, пов’язаних із порушенням нервової, гуморальної, метаболічної та місцевої регуляції, які досить часто трапляються в клінічній практиці.
Корекція порушень моторики визначається розумінням механізмів її складної регуляції, що дає змогу знайти потрібні точки застосування лікарських препаратів і підібрати необхідну терапію. На моторику ШКТ впливають прокінетики, спазмолітики, антидепресанти. Однією з найперспективніших груп із доведеною ефективністю вважаються спазмолітики, що використовуються протягом багатьох років. Відомо, що застосування цієї групи препаратів може бути ускладнене розвитком гладком’язової атонії та системних ефектів, у зв’язку із чим вибір оптимального спазмолітичного препарату набуває великого значення в клінічній практиці. Важливою умовою призначення спазмолітиків є тривалість терапії з можливістю застосування лікарського препарату не менш як 1 місяць і далі тривало в режимі «на вимогу». Таким умовам відповідають селективні спазмолітики. Клінічну ефективність одного з представників селективних спазмолітиків, мебеверину гідрохлориду, було продемонстровано в низці наукових досліджень, при цьому усунення симптомів супроводжувалося покращенням якості життя пацієнтів. Оригінальний препарат мебеверину (Дуспаталін®) сприятливо діє як за гіперкінетичних, так і за гіпокінетичних форм порушень моторної діяльності ШКТ і БТ. Цей механізм дії препарату дає змогу ефективно застосовувати його в пацієнтів із функціональними захворюваннями травної системи, в тому числі при синдромі їх перехресту. Дуспаталін® може бути препаратом вибору при такій поєднаній патології, як синдром подразненого кишківника (СПК) та функціональні розлади жовчного міхура (ЖМ). Його застосування представлено в статті на клінічному прикладі цих двох захворювань.
Моторна функція ШКТ – один із головних компонентів травного процесу, що забезпечує захоплення, механічну обробку та просування їжі травним трактом. Відомо, що більшість скарг гастроентерологічних пацієнтів пов’язані з порушеннями моторної функції ШКТ і БТ. Саме тому нормалізація моторики залишається одним із першорядних завдань лікаря при лікуванні таких пацієнтів [1, 9, 43]. Функціональні розлади ШКТ виявляються приблизно в 50% пацієнтів і формуються внаслідок соціальної дезадаптації, постійної психологічної напруги, стресу, втоми, порушення режиму роботи, навчання та відпочинку [2, 4, 6, 39]. Дискінезії БТ трапляються в 10-15% дорослого населення в економічно розвинених країнах [12]. Порушення моторики ШКТ і БТ є одним із провідних патогенетичних чинників, що зумовлюють розвиток поширених функціональних та органічних гастроентерологічних захворювань [3, 11, 13, 15]. У клінічній практиці внутрішньої та сімейної медицини дуже часто спостерігаються функціональні захворювання ШКТ і БТ.
Функціональні захворювання ШКТ і БТ визначають як комплекс клінічних симптомів, що розвинулися внаслідок моторно-тонічної дисфункції стравоходу, шлунка, кишківника, ЖМ, жовчних проток і сфінктерів, без таких ознак органічного походження, як запалення та каменеутворення [5, 8]. Характер моторних порушень має складний багаторівневий ґенез і перебуває під контролем нервових і гуморальних механізмів регуляції, тому, з одного боку, моторні порушення визначають характер клінічних проявів, а з іншого – є вторинними та присутні в клініці захворювань майже завжди. Головною причиною розвитку функціональних шлунково-кишкових порушень є функціональна диссинергія осі «кишківник – мозок», в основі котрої закладена двобічна нейрогуморальна взаємодія між ШКТ і мозком. Інакше кажучи, органи ШКТ і мозок – це єдиний механізм, який має спільні медіатори та рецептори до них, тому лікування функціональних гастроінтестинальних порушень має бути комплексним і включати вплив як на периферичні (ШКТ), так і на центральні структури (центральна нервова система) [13, 16, 20].
Етіопатогенетичні аспекти моторних порушень ШКТ
Порушення моторики – збірне поняття різних патологічних станів, під час яких ШКТ втрачає свою здатність координувати м’язову активність з ендогенних або екзогенних причин. Причини порушення моторики ШКТ найменш зрозумілі та погано корегуються, оскільки мають багаторівневий характер [44, 47, 48, 53]. Під впливом несприятливих чинників різного походження та патологічних станів може відбуватися посилення (гіпермоторика) чи уповільнення (гіпомоторика) ШКТ (табл. 1).
Пікові прояви цих коливань виражаються діареєю чи закрепом відповідно. З огляду на причини порушення моторних функцій виокремлюють органічні моторні порушення, зумовлені різною патологією з боку ШКТ й інших органів та систем, і функціональні, пов’язані з порушенням нервової, гуморальної, метаболічної та місцевої регуляції [2, 5, 22].
Функціональні розлади ШКТ виявляються приблизно в 50% усіх пацієнтів і формуються внаслідок різних за силою стресових чинників, постійної перевтоми, соціальної дезадаптації, психологічної напруги, порушення режиму роботи, навчання та відпочинку. До цієї групи захворювань належать гастроезофагеальна рефлюксна хвороба, дискінезії стравоходу, кардіоспазм, функціональна диспепсія (ФД), дискінезії дванадцятипалої кишки (ДПК), БТ і сфінктера Одді (СО), СПК [3, 25, 32].
Моторні порушення супроводжують не лише функціональні, а й органічні захворювання ШКТ. У цьому випадку крім корекції основного захворювання потрібно корегувати ті моторні порушення, що супроводжують цю патологію. Органічні порушення моторики можуть бути зумовлені патологічним процесом у різних відділах ШКТ, наприклад у разі виразкової хвороби ДПК, за ентеритів і колітів [2, 3]. Моторика змінюватиметься при здавленні ззовні, за наявності перешкоди в просвіті кишківника, зі збільшенням обсягу вмісту кишківника що спостерігається при осмотичній діареї [8]. Також органічні порушення моторики можуть спостерігатися при ураженні інших органів і систем, що виникають унаслідок органічних уражень (наприклад, у разі цукрового діабету, системної склеродермії) [2, 9]. Органічні порушення моторики ШКТ продовжують становити серйозну клінічну проблему, особливо через обмеження діагностичних тестів і відсутність ефективних варіантів лікування.
Регуляція моторики ШКТ здійснюється за допомогою нервової, гуморальної та місцевої регуляції [2, 3, 54].
Нервова регуляція моторики є складним багаторівневим процесом взаємодії безлічі типів клітин. Психоемоційні реакції чинять еферентні впливи на стан симпатичної та парасимпатичної вегетативної нервової системи, яка через позакишкові та внутрішньокишкові ганглії, ентеральну нервову систему кишківника регулює роботу гладком’язових клітин (ГМК). Отже, кінцевим місцем дії ентеральної нервової системи та реалізації моторно-рухової активності є ГМК [2].
Гуморальна регуляція здійснюється на системному рівні, а також шляхом вироблення інтестинальних гормонів, які забезпечують узгоджену роботу різних відділів ШКТ. Через взаємозв’язок нервової регуляції на місцевому та сегментарному рівнях й інтестинальні пептиди страждання одного відділу або органа ШКТ призводить до залучення в патологічний процес інших [8, 9].
Місцева регуляція моторики ШКТ здійснюється завдяки наявності клітин – водіїв ритму в гладкій мускулатурі. Інтерстиційні клітини Кахаля відіграють найважливішу роль в управлінні спонтанною моторикою ШКТ, є водіями ритму (пейсмейкерами), що задають частоту повільних хвиль електричного потенціалу гладком’язової тканини ШКТ і визначають частоту перистальтики різних відділів ШКТ [2]. Інтерстиційні клітини Кахаля є в усіх відділах ШКТ від нижньої третини стравоходу до внутрішнього сфінктера ануса та широко представлені в пухкій сполучній тканині, позам’язових шарах і шарах гладких м’язів. Окрім цього, регуляцію моторики здійснюють різні медіатори (простагландини, кініни, оксид азоту, гістамін та ін.) [16, 54]. Велику роль у місцевій регуляції відіграють і барорецептори, активність яких регулюється тиском калових мас і жовчними кислотами. Мікробіота ШКТ також впливає на стан моторики. Бактерії виробляють величезну кількість різних речовин, що впливають на моторику (коротколанцюгові жирні кислоти, гістамін, серотонін, γ-аміномасляна кислота, токсини та пептиди, бактеріальні метаболіти жовчних кислот). Бактерії ШКТ зумовлюють збільшення обсягу калових мас, газоутворення, зниження порога чутливості міоцитів, стимуляцію вироблення холецистокініну тощо [18]. Зважаючи на всі чинники регуляції моторики ШКТ, практично формується парадигма двоспрямованої комунікаційної системи за участю осей «кишківник – нейроендокринна система» та «нейроендокринна система – кишківник».
Серед ключових патогенетичних чинників розвитку функціональних захворювань ШКТ поряд із моторними порушеннями важливе значення має вісцеральна гіперчутливість, яка в багатьох випадках також формується під впливом хронічного стресу та маркує дисфункцію фізіологічних антистресових систем [31, 58]. Також установлено, що при цій патології відзначається незвичайне запалення низького ступеня. Важливу роль у цих запальних процесах відіграють тучні клітини, що мають вплив на дисмоторні порушення, вісцеральну гіперчутливість та інші патогенетичні чинники в пацієнтів із функціональними дисфункціями кишківника [10].
Етіопатогенетичні аспекти моторних порушень БТ
Зміни моторної функції відбуваються й за функціональної патології БТ. Функціональні захворювання БТ – це комплекс клінічних симптомів, що розвинулися внаслідок моторно-тонічних дисфункцій БТ, сфінктерного апарату, жовчних проток за відсутності органічної патології [2, 5, 15].
В основі дисфункції ЖМ і сфінктерного апарату БТ лежать порушення нейрогуморальної регуляції моторики та тонусу жовчних шляхів, що розвинулися внаслідок психоневротичних, аліментарних, інтоксикаційних, алергічних впливів, конституційної схильності, інфекцій. Скорочення гладкої мускулатури ШКТ виникає при стимуляції ацетилхоліном мускаринових рецепторів на поверхні м’язової клітини, що супроводжується взаємодією систем Са2+-, Na+– та К+-каналів мембран клітини. Ці процеси визначають скорочення й розслаблення гладких клітин і зміни тонусу мускулатури. Моторна активність БТ регулюється за участю центральних рефлексів, локальних (гастродуоденальних) рефлексів, що спричиняються механічним розтягуванням і впливом компонентів їжі, та гуморальних впливів. Під впливом цих регуляторних ланок ЖМ скорочується, а СО розслаблюється [8, 27].
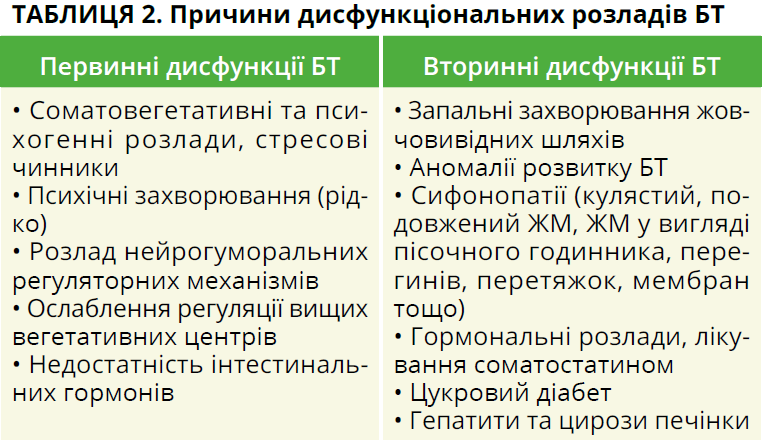
Виокремлюють первинні та вторинні дисфункції БТ. Первинні дисфункції ЖМ і СО становлять від 10 до 30%. Причини їх найчастіше пов’язані із соматовегетативними розладами, неврозами, депресіями, стресовими чинниками, що призводять до порушення рухливості нервових процесів у корі головного мозку, ослаблення регуляції вищих вегетативних центрів, розладу нейрогуморальних регуляторних механізмів, а потім і до порушення моторики [5, 33]. Провідна роль у розвитку дисфункції ЖМ і БТ належить недостатності інтестинальних гормонів, насамперед холецистокініну [2].
Вторинні дисфункції БТ діагностують у 85-90% випадків у разі патології жовчовивідних шляхів запального характеру та при аномаліях розвитку. Дискінетичні розлади часто поєднуються з аномаліями розвитку ЖМ, сифонопатіями, виникають у разі гормональних розладів, лікування соматостатином, цукрового діабету, гепатитів, цирозу печінки й інших патологічних станів [9] (табл. 2).
Запальні процеси та вроджені зміни в шийці ЖМ, міхуровій, загальній жовчній протоці та в ділянці фатерового соска, при вторинних дискінезіях рідко розпізнаються фахівцями й можуть розцінюватись як первинні дискінезії.
Біліарна дисфункція часто є одним із проявів рефлюксних порушень верхнього відділу ШКТ. У таких пацієнтів виявляють дуоденальну гіпертензію, яка є причиною дуодено-біліарних рефлюксів. До істотних порушень функції БТ призводять різноманітні оперативні втручання. У більшості пацієнтів, які перенесли холецистектомію, спостерігається недостатність СО, рідше його спазм. Дистальна резекція шлунка призводить до послаблення гормональної регуляції та гіпотонії ЖМ. Порушення режиму харчування, похибки в дієті, зловживання алкоголем, жирними та смаженими стравами, напоями (чай, кава) можуть бути чинниками ризику дисфункції БТ [5, 52].
Клінічні аспекти порушень моторики ШКТ
Клінічна картина порушень моторики ШКТ різноманітна й залежить від локалізації процесу, його характеру та першопричини. Серед скарг часто відзначають біль або дискомфорт у животі, послаблення випорожнень, або закрепи, або їх чергування, регургітацію тощо. На формування скарг впливають особливості нервової системи та психоемоційні реакції пацієнта [7, 24].
Порушення моторної функції ШКТ супроводжуються розвитком клінічної симптоматики, яка пов’язана зі змінами перистальтичної активності стінок органа та дисфункціями сфінктерного апарату [39, 42].
Найчастіше в клінічній практиці спостерігаються уповільнення моторної активності стінки органа, що проявляється гіпомоторною дискінезією та супроводжується відчуттям тяжкості в епігастрії, раннім насиченням, нудотою, втратою апетиту, здуттям живота, закрепами. Гіпермоторна дискінезія виникає при посиленні рухової активності та проявляється болями спастичного характеру, дисфагією, діареєю [2, 8, 9]. У разі дисфункцій сфінктерного апарату можна говорити про його недостатність і про несвоєчасне розкриття, коли розвивається стаз в ураженому органі, що клінічно проявляється відчуттям переповнення в епігастрії, дисфагією, закрепом. За недостатності сфінктера виникає рефлюкс і пацієнти мають скарги на печію та відрижку [25, 48, 52].
Больовий синдром і розвиток спазму є основними симптомами при функціональних розладах ШКТ. У ґенезі болів у животі, що мають нападоподібний або колючий характер, важлива роль належить гіпертонусу травного тракту. Болі, пов’язані із затримкою проходження їжі стравоходом і шлунком, хімусу – кишківником, частіше мають тупий або розпиральний характер. Під час проведення диференційної діагностики больового синдрому важливо виключити інші чинники, пов’язані із запаленням або «симптомами тривоги», як-от кровотеча, травма, порушення кровообігу, злоякісні новоутворення тощо. Розвиток больового синдрому при функціональних захворюваннях ШКТ, окрім порушення моторики, спричиняє вісцеральна гіперчутливість. Підвищення порога чутливості вісцеральних рецепторів визначає сприйняття болю та рухову функцію ШКТ, у його регуляції особливу роль відіграє внутрішня іннервація з боку ентеральної нервової системи [2, 3, 6, 7].
Клінічні аспекти порушень моторики БТ
Згідно з Римськими критеріями ІV функціональні розлади ЖМ і СО можуть спричиняти больові синдроми, що ховаються під різноманітними назвами, включаючи некалькульозний біліарний біль, біліарну дискінезію, порушення моторики ЖМ і стеноз СО [15, 28, 34]. Функціональні порушення біліарної системи є основними у формуванні клінічної симптоматики, як у разі первинних функціональних порушень, що існують у вигляді самостійної патології, так і за вторинних дисфункцій, які є наслідками захворювань органічного характеру. Основною скаргою хворих із патологією БТ є біль у животі. Біліарний біль і функціональні порушення БТ відображено в Римських критеріях IV: у рубрику «Функціональні розлади ЖМ і СО» включені розділи: «Біліарний біль», «Функціональні розлади ЖМ», «Функціональні розлади біліарного СО», «Функціональні розлади панкреатичного СО» [5, 28, 52].
Потрібно зауважити, що клінічні прояви й характер болю залежать від форми дискінезії. Дисфункцію ЖМ розрізняють за гіпо- та гіперкінетичним типом [2, 8].
Основним проявом гіпокінетичної дисфункції ЖМ є характерний больовий синдром. Пацієнта турбує відчуття розпирання, що триває ≥20 хвилин, іноді постійні, тривалі, тупі, ниючі, що періодично посилюються, неінтенсивні, помірні, рідше виразні болісні відчуття в правому підребер’ї. Для больового синдрому при гіпокінетичній дисфункції ЖМ характерна відсутність іррадіації болісних відчуттів, рідше відзначається проєктування болю в ділянку спини або правої лопатки. Біль посилюється відразу після їди. Пацієнти скаржаться на виникнення болю у вечірній час. Це пов’язано з переповненням жовчю ЖМ, розтягуванням його стінки у зв’язку зі слабким тонусом гладкої мускулатури, зниженням скорочувальної здатності, що проявляється як у міжтравний період, так і після прийому їжі [9].
При гіперкінетичному типі дисфункції ЖМ болісні напади частіше виникають на тлі нервово-емоційних або виразних вегетативних порушень, рідше при значному фізичному навантаженні, що супроводжується підвищенням внутрішньочеревного тиску. Біль має характер «жовчної кольки»: йому властива середня або мала інтенсивність, раптовість, переймоподібність, тривалість до декількох хвилин. Цей вид больових відчуттів добре усувається спазмолітиками або минає самостійно [2, 9, 36].
Дисфункції та спазм СО також є чинниками порушення моторики з характерними клінічними проявами, пов’язаними з порушенням фізіологічного руху жовчі та розвитком різних клінічних сценаріїв. За різкого надходження жовчі в ДПК спостерігаються епізоди підвищення моторної активності кишківника та клінічний розвиток діареї. При зниженні надходження жовчі в ДПК знижується відповідно й моторна активність кишківника з подальшим розвитком закрепу [15, 27].
Варто відзначити багатофакторний патогенез функціональних розладів, широкий спектр скарг і проявів захворювання, що може значно ускладнювати ведення таких пацієнтів. З огляду на клінічне різноманіття можуть формуватися функціональні порушення в різних відділах ШКТ, що спричиняє розвиток «синдрому перехреста». За даними Всесвітньої гастроентерологічної організації (WGO), ФД відзначається в 42-87% пацієнтів із СПК, причому перехрест ФД – СПК асоціюється з тяжчими клінічними проявами [11, 25, 40]. У 49% пацієнтів виникає інший перехрест, пов’язаний з одночасним перебігом СПК та функціональних біліарних розладів [40].
Діагностика порушень моторної функції ШКТ і БТ
Для діагностики порушень моторно-евакуаторної функції ШКТ враховують дані клінічної симптоматики, застосовують різні інструментальні методи дослідження: рентгенологічне, ультразвукове дослідження (УЗД), манометрію стравоходу, антродуоденальну манометрію, рН-метрію, сцинтиграфію, комп’ютерну томографію, що дає змогу визначити механізм розвитку симптомів, призначити пацієнту патогенетичне лікування [2, 7, 9].
Діагностика дисфункції ЖМ і СО також ґрунтується на клінічній симптоматиці та даних інструментальних методів дослідження. Як скринінгові діагностичні методи використовують: лабораторні тести (загальний аналіз крові, визначення рівнів γ-глютамілтранспептидази (ГГТП), лужної фосфатази, білірубіну, аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ), амілази, ліпази); інструментальні методи діагностики, етапне хроматичне дуоденальне зондування (трансабдомінальна ультрасонографія, езогастродуоденоскопія (ЕГДС) із прицільним оглядом фатерового соска, УЗД) з оцінкою функціонального стану ЖМ і СО (харчова та фармакологічна проби), магнітну резонансну холангіографію й ендоскопічну ретроградну холангіопанкреатографію з манометрією СО [2, 28, 38].
Корекція порушеної моторики ШКТ
Корекція порушень моторики ШКТ і БТ визначається розумінням механізмів її складної регуляції, що дає змогу знайти потрібні точки застосування лікарських препаратів. Насамперед лікування пацієнтів із порушенням моторно-евакуаторної функції передбачає загальні заходи, в тому числі роз’яснення хворому механізмів розвитку його симптомів, що підвищує прихильність до терапії. Істотну роль у системі лікувальних заходів відіграє дієтотерапія [2, 6, 9, 19]. Основним її принципом є режим харчування з частими прийомами невеликої кількості їжі (5-6-разове харчування), що сприяє нормалізації тиску в ДПК та регулює спорожнення ЖМ і протокової системи, забезпечує нормалізацію моторно-евакуаторної функції кишківника. Психологічна та когнітивно-поведінкова терапія, специфічна для СПК, може бути ефективним методом лікування основних симптомів цього патологічного стану. Потрібно розглянути психологічну терапію, якщо симптоми СПК не покращилися після 12 місяців медикаментозного лікування [39, 46].
В основі медикаментозного лікування функціональних розладів ШКТ і БТ лежить комплексний підхід, метою якого є усунення больового синдрому, спазму, відновлення продукції жовчі, моторної функції ЖМ і тонусу сфінктерного апарату жовчних шляхів, відновлення тиску в ДПК, моторики кишківника [2, 5, 8].
Медикаментозна терапія захворювань, що супроводжуються ослабленням тонусу та перистальтики різних відділів ШКТ, передбачає застосування препаратів, які підсилюють моторику травного тракту. Обґрунтованим є призначення прокінетиків. Основними класами прокінетиків є блокатори допамінових рецепторів, інгібітори ацетилхолінестерази (або їх комбінація з блокаторами допамінових рецепторів), агоністи 5-НТ4-рецепторів. Нині вони знаходять широке застосування в лікуванні гастроезофагеальної рефлюксної хвороби, ФД, функціональних закрепів, обстипаційного варіанта СПК й інших захворювань із порушенням моторної функції ШКТ [2, 9, 50].
Захворювання ШКТ функціонального й органічного ґенезу, які перебігають із порушеннями моторики, потребують тривалого курсового лікування спазмолітиками [28]. Відомо, що застосування цієї групи препаратів може бути ускладнене розвитком гладком’язової атонії, у зв’язку із чим вибір оптимального спазмолітичного препарату набуває великого значення в клінічній практиці [29].
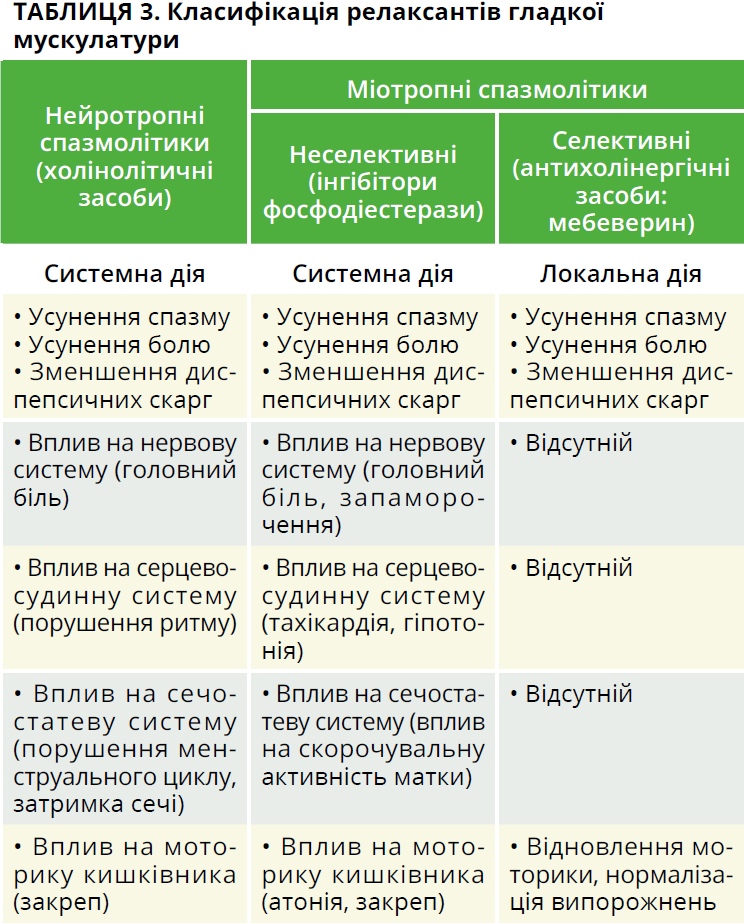
Для усунення абдомінального больового та диспепсичного синдромів у комплексному лікуванні функціональних захворювань ШКТ і БТ традиційно використовують релаксанти гладкої мускулатури (табл. 3), які включають кілька груп препаратів: препарати, що впливають на етапі проведення нервового імпульсу / гуморального сигналу (нейротропні спазмолітики); препарати, що впливають безпосередньо на ГМК, – міотропні спазмолітики: блокатори натрієвих каналів; блокатори кальцієвих каналів; донатори оксиду азоту (нітрати); інгібітори фосфодіестерази (похідні ізохіноліну) [2, 7, 9, 13, 17].
При лікуванні захворювань ШКТ, які супроводжуються порушенням моторних функцій, доцільним є застосування спазмолітичних препаратів, що підтвердили свою високу клінічну ефективність. Важливою умовою призначення спазмолітиків є тривалість терапії з можливістю застосування лікарського препарату не менш як 1 місяць і далі тривало в режимі «на вимогу». Таким умовам відповідають селективні спазмолітики [14, 21, 30].
Клінічну ефективність одного з представників селективних спазмолітиків, мебеверину гідрохлориду, було продемонстровано в низці наукових досліджень, при цьому усунення симптомів супроводжувалося поліпшенням якості життя пацієнтів [34, 37].
Мебеверин був зареєстрований у 1965 році та призначається приблизно 7 мільйонам пацієнтів у всьому світі щороку [26, 45]. Мебеверину гідрохлорид є похідним метоксибензаміну. Наразі він продається в більш ніж 70 країнах під різними торговими назвами. Оскільки відомо, що селективні спазмолітики не лише сприяють зниженню болю, а й здатні усувати спазм, зменшувати диспептичні скарги, варто звернути увагу на оригінальний препарат мебеверину гідрохлориду (Дуспаталін®).
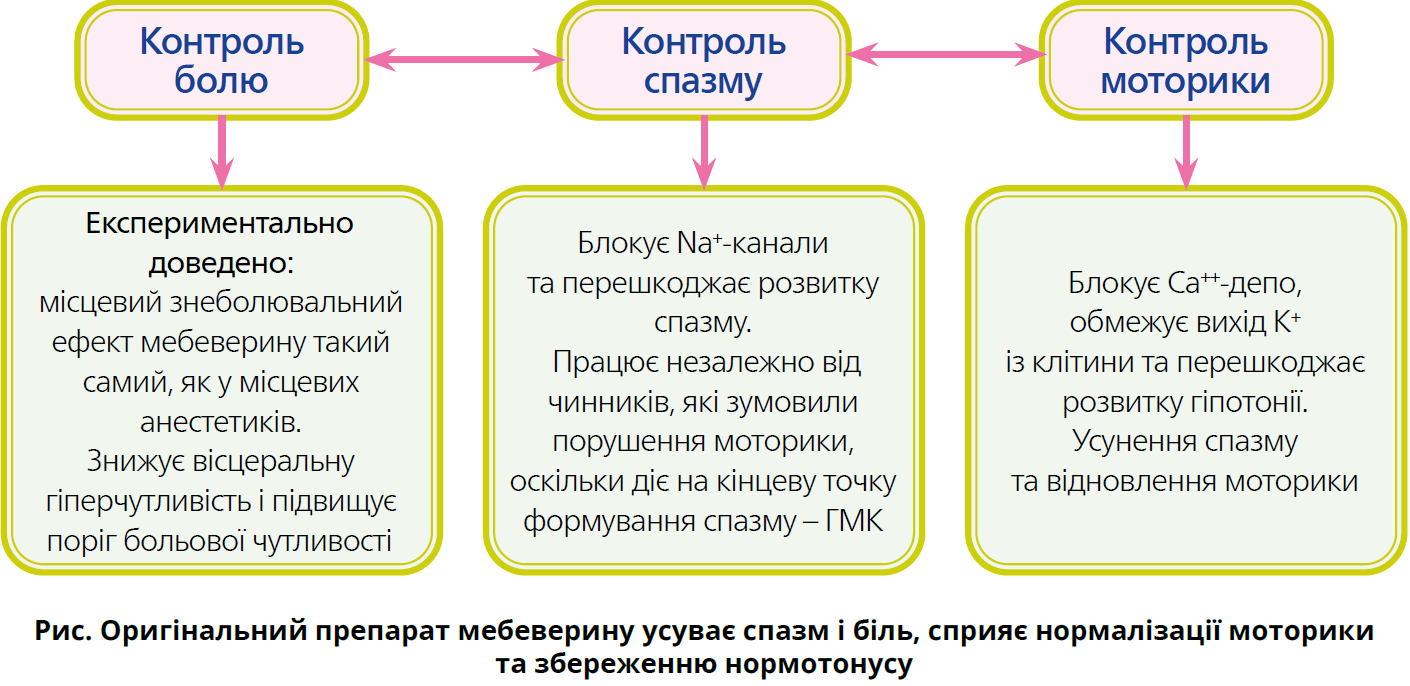
Клінічний ефект мебеверину (Дуспаталін®) поширюється як на гіперкінетичні, так і на гіпокінетичні, а також змішані форми порушень моторної функції ШКТ (рис.). Універсальний подвійний механізм дії мебеверину дає змогу ефективно застосовувати його в пацієнтів із функціональними розладами ШКТ, у тому числі при синдромі перехреста [23, 35]. Дуспаталін® – препарат із селективною дією на гладкі м’язи травної системи, позбавлений побічних ефектів холінолітиків і системної вазодилатувальної дії, властивої інгібіторам фосфодіестерази [45, 49].
Мебеверин може бути препаратом вибору при такій поєднаній патології, як СПК та ФД, функціональна біліарна дисфункція й СПК. Ефективність препарату Дуспаталін® щодо корекції порушень біліарної та дуоденальної моторики можна пояснити його високою спазмолітичною активністю, тропністю до СО, а також нормалізацією відтоку жовчі й покращенням її складу [2, 5, 21, 38]. Мебеверин (Дуспаталін®) широко застосовується в лікуванні шлунково-кишкових спазмів вторинного ґенезу, спричинених органічними захворюваннями [2, 8].
Мебеверин є міотропним спазмолітиком, тобто препаратом, що діє безпосередньо на ГМК. Блокуючи Na+-канали ГМК, мебеверин реалізує спазмолітичний ефект; блокуючи натрієві канали периферичних нейронів, препарат виявляє знеболювальний ефект, схожий на дію місцевих анестетиків. Мебеверин блокує кальцієве депо та вихід калію з клітини, тим самим запобігаючи повному розслабленню м’язових волокон [41, 55]. Сукупність цих механізмів дії дає мебеверину змогу нормалізувати моторику кишківника та СО, знизити вісцеральну гіперчутливість і усунути больові відчуття в короткі терміни. Завдяки зазначеним властивостям призначення мебеверину можна вважати найраціональнішим рішенням при виборі спазмолітичного препарату для лікування захворювань ШКТ і БТ. Тривалі курси терапії оригінальним препаратом мебеверину не призводять до зниження його ефективності [1, 5, 16, 21].
Отже, оригінальний препарат мебеверину – Дуспаталін® – є необхідним терапевтичним рішенням у лікуванні абдомінального, біліарного болю, спазму та для нормалізації моторної функції ШКТ. На фармацевтичному ринку України є дві дози препарату Дуспаталін® – у формі таблеток 135 мг і капсул 200 мг. Таблетки Дуспаталін® 135 мг призначають для лікування СПК 3 рази на добу за 20 хвилин до прийому їжі. Капсули Дуспаталін® 200 мг призначають 2 рази на добу дорослим і дітям віком від 10 років для симптоматичного лікування абдомінального болю та спазмів, розладів кишківника й відчуття дискомфорту в ділянці кишківника при СПК, а також для лікування шлунково-кишкових спазмів вторинного ґенезу, спричинених органічними захворюваннями. Дуспаталін® 200 мг має пролонговану дію, що також є його перевагою порівняно з іншими спазмолітиками [23, 29, 37]. Пролонгована дія забезпечується мікрогранульованою формою випуску, завдяки якій препарат рівномірно розподіляється та вивільняється в кишківнику протягом 16 годин. Тривалість лікування препаратом Дуспаталін® не обмежена [41, 57].
Досить часто в клінічній практиці серед функціональних захворювань ШКТ трапляється синдром перехресту СПК та функціонального розладу ЖМ. Далі представлено клінічний приклад ведення такого пацієнта.
Клінічний випадок
Пацієнтка Д., 34 роки, менеджерка в комерційній фірмі, звернулася зі скаргами на біль у нижніх відділах живота, здуття живота, виділення слизу з калом, чергування епізодів неоформленого випорожнення 3-4 рази на день з епізодами затримки дефекації понад 3 дні. Крім того, відзначає періодичний біль у правому підребер’ї без чіткого зв’язку з прийомами їжі, а також постійне відчуття тривоги, зниження настрою без явних причин, поганий сон із частими пробудженнями.
Анамнез: захворіла близько 2 років, появу симптоматики пов’язує з перенесеною стресовою ситуацією в сім’ї та подальшими проблемами на роботі. Сімейний лікар рекомендував спазмолітичні препарати (дротаверин), пробіотичні засоби, препарати панкреатину, прийом яких значного ефекту не справив. Пізніше пройшла сеанси психотерапії з позитивною динамікою. Епідеміологічний анамнез без особливостей. Алергічні реакції на ліки та харчові продукти заперечує.
Теперішнє погіршення стану – з початку березня 2022 року. На тлі стресових подій з’являлися часті ниючі болі в животі, здуття, чергування проносів і закрепів, відчуття тривоги, депресивний стан.
Під час огляду статура нормостенічна, індекс маси тіла – 23,4. Органи дихання: дихання везикулярне, хрипів немає, частота дихання – 16. Органи кровообігу: артеріальний тиск – 110/75 мм рт. ст., частота серцевих скорочень – 74/хв. Тони серця ясні, ритмічні, шуми не вислуховуються. Язик вологий, чистий. Живіт під час пальпації здутий, відзначається помірна болючість у ділянці низхідного відділу товстого кишківника. Міхурові симптоми негативні. Нижній край печінки не виступає з-під правої реберної дуги. Селезінка не пальпується. Випорожнення з чергуванням закрепів і проносів.
Загальний аналіз крові: еритроцити – 4,7×1012/л, гемоглобін – 139 г/л, лейкоцити – 6,2×109/л, тромбоцити – 278×109/л, паличкоядерні – 2%, сегментоядерні – 55%, базофіли – 1%, еозинофіли – 1%, лімфоцити – 32%, моноцити – 9%, ШОЕ – 9 мм/год.
Біохімічний аналіз крові: білірубін загальний – 8,7 ммоль/л, АСТ – 23,0 Од/л, АЛТ – 34,0 Од/л, глюкоза в крові – 4,2 ммоль/л, лужна фосфатаза – 69,8 ммоль/л, загальний білок – 78,0 г/дл, альбумін – 43,6 г/л, амілаза – 67,2 Од/л, ГГТП – 38,2 Од/л, C-реактивний протеїн – 3,76 мг/л.
Кров на скринінг целіакії: гліадинові антитіла (IgA – 0,76 Од/мл, IgG – 0,82 Од/мл) – негативні.
Кров на антитіла до гельмінтів і найпростіших: IgG до Opisthorchis felineus – 0,17 ум. од.;
IgG до Ascaris lumbricoides – 0,12 ум. од.; IgG до Toxocara canis – 0,09 ум. од.; антитіла до Lamblia intestinalis сумарні – 0,31 ум. од. – не виявлено.
Рівень фекального кальпротектину – 12,7 мкг/л. Тест на приховану кров у калі негативний.
Копрограма: неоформлений, коричневий;
слиз «+»; реакція слаболужна; м’язові волокна:
перетравлені – 2 у п/з, неперетравлені – 1 у п/з; нейтральний жир відсутній; жирні кислоти відсутні; неперетравлена клітковина – 1-2 у п/з;
перетравлена клітковина – 1 у п/з; мила відсутні; крохмаль відсутній; йодофільні бактерії – 6-8 у п/з; лейкоцити – 0 у п/з; еритроцити – 0 у п/з.
Дослідження калу на мікрофлору (пройшла самостійно): біфідобактерії <107, лактобактерії – 107, специфічних ентеропатогенних бактерій не виявлено.
УЗД органів черевної порожнини та динамічна ехохолецистографія ЖМ: структурної патології не виявлено, встановлено гіпокінетичний тип скорочення ЖМ. ЕГДС: еритематозна гастропатія, недостатність кардії. Антиген Helicobacter pylori в калі – негативний результат.
Фіброколоноскопія: патологічних змін не виявлено.
Клінічний діагноз: СПК, змішаний тип. Функціональний розлад ЖМ, гіпокінетичний тип.
Лікування: зміни способу життя (зниження стресу та збільшення фізичної активності), Дуспаталін® 200 мг 2 рази на добу, дулоксетин – 60 мг 1 раз на добу, пробіотичний комплекс СПК 1 капсула на день. Тривалість лікування – 3 місяці.
На тлі лікування пацієнтка відзначала зменшення больового синдрому на 3-й день, а його повне припинення – до кінця 2-го тижня після початку терапії. Наприкінці 1-го тижня лікування пацієнтка констатувала зменшення метеоризму. Через 2 тижні регулярної терапії встановився щоденний режим дефекацій із відновленням фізіологічного позову 1 раз на добу. Після відновлення в пацієнтки фізіологічного ритму дефекації було призначено препарати з холекінетичним впливом (артишок 3 рази на добу). Через 1 місяць після початку терапії пацієнтка мала скарги лише на періодичний метеоризм. Зважаючи на зменшення симптомів, хорошу переносимість лікування, відсутність побічних ефектів, було рекомендовано продовження терапії протягом 2 місяців. За період спостереження (2-й і 3-й місяці) пацієнтка скарг не висувала. Метеоризм зник на початку 2-го місяця терапії. Позитивний ефект комплексного лікування зберігається після припинення терапії ще протягом 6 місяців.
Обговорення
Як видно з цього клінічного прикладу, пацієнтка має перехрест двох функціональних захворювань – СПК та функціонального розладу ЖМ. У патогенезі СПК та функціонального розладу ЖМ ключова роль відводиться моторно-евакуаторним порушенням, спастичній дискінезії та вісцеральній гіперчутливості [28, 39, 40].
Основною групою препаратів для лікування больового синдрому, спазму при СПК та функціональному біліарному розладі є гладком’язові релаксанти, що відображено в Римських критеріях IV перегляду [28, 33]. Отже, в цьому клінічному випадку із синдромом перехреста двох функціональних захворювань раціональним є призначення препарату, здатного вплинути на моторні порушення та вісцеральну гіперчутливість. У багатьох дослідженнях було показано вплив мебеверину на моторику не тільки нижніх відділів ШКТ, але й БТ і його ефективність як селективного спазмолітика, анестетика при лікуванні СПК та функціонального розладу ЖМ [34, 37, 45]. Саме застосування оригінального препарату мебеверину має патогенетичну спрямованість і вирішальне значення для покращення якості життя пацієнтів. Препарат Дуспаталін® у капсулах пролонгованої дії 200 мг дозволений до застосування в дорослих і дітей віком від 10 років. Указана форма випуску дає змогу приймати препарат 2 рази на добу по 200 мг, що зручно для пацієнта й підвищує його прихильність до терапії. Крім того, згідно з Римськими критеріями IV перегляду вперше для лікування СПК рекомендовано селективні антибактеріальні препарати (рифаксимін) і пробіотики [51], що також було рекомендовано пацієнтці: в комплексе лікування додали пробіотичний комплекс СПК. Відповідно до низки досліджень пацієнти з функціональними розладами ШКТ мають депресивні та тривожні розлади [31, 58, 59], особливо при СПК у хворих відзначають підвищений ризик тривоги, депресії, біполярного розладу та розладів сну [56]. Тому в комплексне лікування нашої пацієнтки, зважаючи на постійні тривожні симптоми та депресивний стан, було включено комбіновані інгібітори зворотного захоплення серотоніну й норепінефрину (дулоксетин).
Висновки
Порушення моторики мають важливе значення в розвитку багатьох захворювань ШКТ і БТ як функціональної, так і органічної природи. Лікар-практик має зважати на той факт, що лікування, спрямоване на корекцію порушеної моторно-евакуаторної функції ШКТ і БТ, має проводитися з урахуванням усіх можливих патогенетичних ланок розвитку захворювання. Крім того, в корекції цих розладів потрібно приділяти увагу індивідуальним особливостям перебігу хвороби в конкретного пацієнта, особливо в рамках перехресту кількох захворювань. При цьому оригінальний препарат мебеверину можна розглядати як унікальний селективний спазмолітик із подвійним механізмом дії при моторних порушеннях ШКТ і БТ.
Література
- Біловол О.М., Князькова І.І. Лікарські засоби, що знижують моторику шлунково-кишкового тракту. Ліки України. 2021; 4 (250): 13-20.
- Гастроентерологія: підручник у 2-х томах / За ред. Харченко Н.В., Бабака О.Я. – 2-ге вид., переробл., доповн. – Кіровоград: Поліум, 2016. – Т. 1. – 488 с.
- Губергриц Н.Б. Хроническая абдоминальная боль. Боль при заболеваниях пищевода, желудка, двенадцатиперстной кишки. – Донецк: ООО «Лебедь», 2009. – 312 с.
- Губська О.Ю., Прикащикова Г.І. Психогастроентерологія розладів кишково-мозкової взаємодії. Огляд літератури з власними дослідженнями. Сучасна гастроентерологія. 2023; 3: 61-67. doi: 10.30978/MG-2023-3-61.
- Звягинцева Т.Д., Шаргород И.И. Билиарные дисфункции и методы современной терапии. Семейная медицина. 2017; 4 (72): 129-132.
- Звягинцева Т.Д., Скрипник І.М., Ткач С.М., Харченко Н.В. Функціональні розлади шлунково-кишкового тракту (Римські критерії IV – вибрані питання). Посібник для лікарів. – К., 2017. – 55 с.
- Ткач С.М., Дорофеев А.Э., Скрыпник И.Н. Клинические рекомендации Украинской гастроэнтерологической ассоциации по ведению больных синдромом раздраженной кишки. Здоров’я України. 2019; 20 (465): 14-15.
- Передерий В.Г., Ткач С.М., Каштелянов А.И. Практическая гастроэнтерология: руководство для врачей. – Винница, 2011. – 770 с.
- Свінціцький А.С. Діагностика та лікування поширених захворювань органів травлення. – К.: Медкнига, 2007. – 296 с.
- Степанов Ю.М., Будзак И.Я., Гайдар Ю.А. Морфологические проявления синдрома раздраженного кишечника. Gastroenterologìa. 2021; 55 (2): 108-114. doi: 10.22141/2308-2097.55.2.2021.233635.
- Ткач С.М., Дорофєєв А.Е., Харченко Н.В. Сучасні погляди на механізми патогенезу і тактику ведення хворих із перехрестом симптомів функціональної диспепсії та синдрому подразненого кишечника. Огляд літератури. Сучасна гастроентерологія. 2022; 1-2: 63-72. doi: 10.30978/MG-2022-1-63.
- Філіппова О.Ю. Хвороби гепатобіліарної системи: фокус на раціональну гепатотропну терапію. Gastroenterologìa. 2019; 53 (3): 188-195. doi: 10.22141/2308-2097.53.3.2019.182866.
- Чернявський В.В., Павловський Л.Л. Корекція моторики як наріжний камінь лікування функціональних розладів гастродуоденальної зони. Здоров’я України. 2020; 15 (484): 49-50.
- Annaházi A., Róka R., Rosztóczy A., Wittmann T. Role of antispasmodics in the treatment of irritable bowel syndrome. World J. Gastroenterol. 2014; 20 (20): 6031-43. doi: 10.3748/wjg.v20.i20.6031.
- Behar J., Corazziari E., Guelrud M., Hogan W., Sherman S., Toouli J. Functional gallbladder and sphincter of Oddi disorders. Gastroenterology. 2006; 130: 1498-509. doi: 10.1053/j.gastro.2005.11.063.
- Bellini M., Gambaccini D., Stasi C., et al. Irritable bowel syndrome: a disease still searching for pathogenesis, diagnosis and therapy. World J. Gastroenterol. 2014 Jul 21; 20 (27): 8807-8820.
- Berthelot J., Centonze M. Etude contrôlée en double aveugle Duspatalin (mébévérine) contre placebo, dans le traitement du côlon irritable. Gaz. Méd. Fr. 1981; 88: 2341-3.
- Bhattarai Y., Muniz Pedrogo D.A., Kashyap P.C. Irritable bowel syndrome: a gut microbiota-related disorder? Am. J. Physiol. Gastrointest. Liver Physiol. 2017; 312: G52-G62.
- Black C.J., Burr N.E., Camilleri M., et al. Efficacy of pharmacological therapies in patients with IBS with diarrhoea or mixed stool pattern: systematic review and network meta-analysis. Gut. 2020; 69: 74-82.
- Black C.J., Drossman D.A., Talley N.J., et al. Functional gastrointestinal disorders: advances in understanding and management. The Lancet. 2020; 396 (10263): 1664-1674. doi: 10.1016/s0140-6736(20)32115-2.
- Brenner Darren M., Lacy Brian E. Antispasmodics for chronic abdominal pain: analysis of North American treatment options. Am. J. Gastroenterol. 2021 Aug 1; 116 (8): 1587-1600. doi: 10.14309/ajg.0000000000001266.
- Cassar G.E., Youssef G.J., Knowles S., et al. Health-related quality of life in irritable bowel syndrome: a systematic review and meta-analysis. Gastroenterol. Nurs. 2020; 43 (3): E102-22. doi: 10.1097/SGA.0000000000000530.
- Chakraborty D.S., Hazra A., Sil A., Pain S. Will controlled release mebeverine be able to surpass placebo in treatment of diarrhoea predominant irritable bowel syndrome? J. Family Med. Prim. Care. 2019 Oct 31; 8 (10): 3173-3178. doi: 10.4103/jfmpc.jfmpc_522_19.
- Chen J., Barandouzi Z.A., Lee J., et al. Psychosocial and sensory factors contribute to self-reported pain and quality of life in young adults with irritable bowel syndrome. Pain Manag. Nurs. 2022; S1524-9042 (21): 00264-2. doi: 10.1016/j.pmn.2021.12.004.
- Choi Y.J., Kim N., Yoon H., et al. Overlap between irritable bowel syndrome and functional dyspepsia including subtype analyses. J. Gastroenterol. Hepatol. 2017; 32: 1553-1561.
- Connell A.M. Physiological and clinical assessment of the effect of the musculotropic agent mebeverine on the human colon. Br. Med. J. 1965; 2: 848-51.
- Corazziari E.S., Cotton P.B. Gallbladder and sphincter of Oddi disorders. Am. J. Gastroenterol. 2010; 105 (4): 764-769. doi: 10.1038/ajg.2010.67.
- Cotton P.B., Elta G.H., Carter C.R. Galbladder and sphincter of Oddi disorders. Rome IV Functional gastrointestinal disorders: disorders of gut-brain interaction. Gastroenterology. 2016; 150: 1420-9.
- Daniluk J., Malecka-Wojciesko E., Skrzydlo-Radomanska B., Rydzewska G. The efficacy of mebeverine in the treatment of irritable bowel syndrome – a systematic review. J. Clin. Med. 2022; 11 (4): 1044. doi: 10.3390/jcm11041044.
- Dumitrascu D.L., Chira A., Bataga S., et al. The use of mebeverine in irritable bowel syndrome. A position paper of the Romanian Society of Neurogastroenterology based on evidence. J. Gastrointestin. Liver Dis. 2014 Dec; 23 (4): 431-5. doi: 10.15403/jgld.2014.1121.234.mibs.
- Dantzer C., Gauchez A., Emotional overactivity in patients with irritable bowel syndrome. Neurogastroenterol. Motil. 2018 Oct; 30 (10): Epub 2018 Jun 1.
- Drossman D.A. Chronic functional abdominal pain. Fordtrans’s gastrointestinal and liver disease. Philadelphia – London – Toronto – Montreal – Sydney – Tokyo, 2003; 1: 90-97.
- Drossman D.A., Hasler W.L. Rome IV-functional GI disorders: disorders of Gut-brain interaction. Gastroenterology. 2016; 150 (6): 1257-1261. doi: 10.1053/j.gastro.2016.03.035.
- Dumitrascu D.L., Chira A., Bataga S., et al. Romanian Society of Neurogastroenterology. The use of mebeverine in irritable bowel syndrome. A position paper of the Romanian Society of Neurogastroenterology based on evidence. J. Gastrointestin. Liver Dis. 2014; 23 (4): 431-5. doi: 10.15403/jgld.2014.1121. ц234.mibs.
- Gilbody J.S., Fletcher C.P., Hughes I.W., Kidman S.P. Comparison of two different formulations of mebeverine hydrochloride in irritable bowel syndrome. Int. J. Clin. Pract. 2000; 54: 461-4.
- Goussous N., Kowdley G.C., Sardana N., Spiegler E., Cunningham S.C. Gallbladder dysfunction: how much longer will it be controversial? Digestion. 2014; 90 (3): 147-54.
- Guyot P. Efficacy of Duspatalin® 200 mg in patients with irritable bowel syndrome: results of a descriptive study onvarious symptom subgroups. In: Denis P. (ed.). Clinical implications of irritable bowel syndrome. Walter de Gruyter: Berlin, 1997, pp. 39-47.
- Hall T.C., Dennison A.R., Garcea G. The diagnosis and management of sphincter of Oddi dysfunction: a systematic review. Langenbecks Arch. Surg. 2012 Aug; 397 (6): 889-98. doi: 10.1007/s00423-012-0971-3. Epub 2012 Jun 13. PMID: 22688754.
- Hanning N., Edwinson A.L., Ceuleers H., et al. Intestinal barrier dysfunction in irritable bowel syndrome: a systematic review. Therap. Adv. Gastroenterol. 2021; 14: 1756284821993586. doi: 10.1177/1756284821993586.
- Hunt R., Quigley E., Abbas Z., Eliakim A., Emmanuel A., Goh K.-L., et al. WGO Global Guideline – Coping with common GI symptoms in the community. 2013. Available at: https://www.worldgastroenterology.org/guidelines/global-guidelines/common-gi-symptoms/common-gi-symptoms-english.
- Inauen W., Halter F. Clinical efficacy, safety and tolerance of mebeverine prolonged release (200 mg) vs. mebeverine tablets in patients with irritable bowel syndrome. Drug Invest. 1994; 8: 234-40.
- Khan E.H., Ahamed F., Karim M.R., et al. Psychiatric morbidity in irritable bowel syndrome. Mymensingh Med. J. 2022; 31 (2): 458-65.
- Lacy D.J., Mearin F., Chang L. Bowel disorders. Rome IV Functional gastrointestinal disorders: disorders of gut-brain interaction. Gastroenterology. 2016; 150: 1393-407.
- Lam C.Y., Palsson O.S., Whitehead W.E., et al. Rome IV functional gastrointestinal disorders and health impairment in subjects with hypermobility spectrum disorders or hypermobile Ehlers-Danlos syndrome. Clin. Gastroenterol. Hepatol. 2020. doi: 10.1016/j.cgh.2020.02.034.
- Darvish-Damavandi M., Nikfar S., Abdollahi M. A systematic review of efficacy and tolerability of mebeverine in irritable bowel syndrome. World J. Gastroenterol. 2010 Feb 7; 16 (5): 547-53. doi: 10.3748/wjg.v16.i5.547.
- Martínez-Vázquez M.A., Vázquez-Elizondo G., González-González J.A., et al. Effect of antispasmodic agents, alone or in combination, in the treatment of irritable bowel syndrome: systematic review and meta-analysis. Rev. Gastroenterol. Mex. 2012; 77 (2): 82-90. doi: 10.1016/j.rgmx.2012.04.002.
- McNally M.A., Locke G.R., Zinsmeister A.R., Schleck C.D., Peterson J., Talley N.J. Biliary events and an increased risk of new onset irritable bowel syndrome: a population-based cohort study. Aliment. Pharmacol. Ther. 2008; 28 (3): 334-343. doi: 10.1111/j.1365-2036.2008.03715.
- Melchior C., Colomier E., Trindade I.A., et al. Irritable bowel syndrome: factors of importance for disease-specific quality of life. United European Gastroenterol. J. 2022. doi: 10.1002/ueg2.12277.
- Prout B.J. The treatment of irritable bowel syndrome: two doses of mebeverine compared. Practitioner. 1983; 227: 1607-8.
- Quigley M. Prokinetics in the management of functional gastrointestinal disorders. Neurogastroenterol. Motil. 2015 Jul; 21 (3): 330336. doi: 10.5056/jnm15094.
- Rivkin A., Rybalov S. Update on the management of diarrhea-predominant irritable bowel syndrome: focus on rifaximin and eluxadoline. Pharmacotherapy. 2016; 36: 300-316.
- Schmulson M.J., Drossman D.A. What is new in Rome IV. J. Neurogastroenterol. Motil. 2017; 23 (2): 151-163. doi: 10.5056/jnm16214.
- Stanghellini V., Chan F.K.L., Hasler W.L. Malagelada J.R., Suzuki H., Tack J., Talley N.J. Gastroduodenal disorders. Gastroenterology. 2016; 150 (6): 1380-92. doi: 10.1053/j.gastro.2016.02.011.
- Stasi C., Bellini M., Bassotti G., Blandizzi C., Milani S. Serotonin receptors and their role in the pathophysiology and therapy of irritable bowel syndrome. Tech. Coloproctol. 2014; 18: 613-621.
- Van Outryve M., Mayeur S., Meeus M.A., et al. A double-blind crossover comparison study of the safety and efficacy of mebeverine with mebeverine sustained release in the treatment of irritable bowel syndrome. J. Clin. Pharm. Ther. 1995; 20: 277-82.
- Wang B., Duan R., Duan L. Prevalence of sleep disorder in irritable bowel syndrome: a systematic review with meta-analysis. Saudi J. Gastroenterol. 2018; 24 (3): 141-150.
- Winsemius A., Meuwsen I.M., Boon C., et al. A pharmacokinetic comparison of the modified release capsule and a plain tablet formulation of mebeverine. Int. J. Clin. Pract. 2002; 56: 659-62.
- Yeh H.W., Chien W.C., Chung C.H. Risk of psychiatric disorders in irritable bowel syndrome – a nationwide, population-based, cohort study. Int. Clin. Pract. 2018 Jul; 72 (7).
- Zhang Q.E., Wang F., Qin G., et al. Depressive symptoms in patients with irritable bowel syndrome: a meta-analysis of comparative studies. Int. J. Biol. Sci. 2018; 14 (11): 1504-12. doi: 10.7150/ijbs.25001.
Освітньо-практичний журнал Gastro Practice №1 2023р.