Рекомендації Європейської організації з хвороби Крона та неспецифічного виразкового коліту щодо позакишкових проявів запальних хвороб кишківника. Частина 1
Підготувала д-р мед. наук Лариса Стрільчук
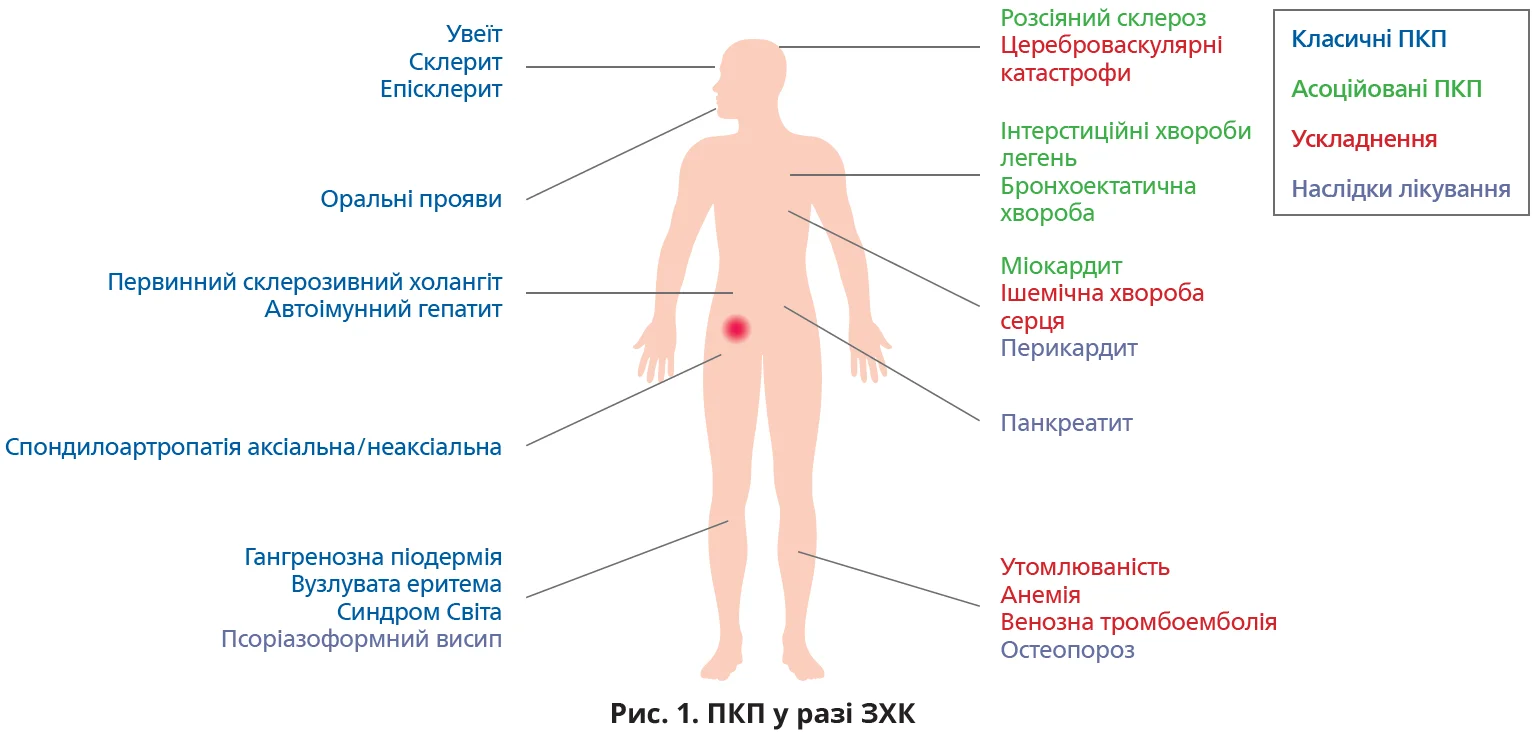
Майже в 50% пацієнтів із запальними хворобами кишківника (ЗХК) розвивається щонайменше один позакишковий прояв (ПКП). ПКП можуть виникати в будь-якій системі органів і асоціюються з підвищенням захворюваності та смертності (в разі первинного склерозивного холангіту чи венозної тромбоемболії – ВТЕ). Загалом ПКП поділяють на класичні, які виникають унаслідок активації запалення у віддалених від кишківника ділянках, наслідки системного запалення, наслідки лікування ЗХК та більш віддалено асоційовані патології (рис. 1).
Патофізіологія позакишкового запалення повністю не з’ясована. Потенційними його причинами є поширення імуноопосередкованої відповіді на інші органи, зміни мікробіому кишківника, генетична схильність.
Гематологічні та кардіоваскулярні ПКП
Консенсусне твердження 1. Тромботичні події більш ніж удвічі частіше виникають в осіб із ЗХК порівняно із загальною популяцією. Поширеність їх у разі неспецифічного виразкового коліту (НВК) та хвороби Крона (ХК) є однаковою. Найвагомішими чинниками ризику виступають активне захворювання, госпіталізація та проведення хірургічного втручання.
Коментар. Незважаючи на вдосконалення лікування ЗХК, ризик ВТЕ в цих хворих, за даними нещодавніх метааналізів, відповідає давнішим результатам. Тромботичний ризик є однаковим для осіб із НВК та ХК, а також для чоловіків і жінок. Чинниками ризику тромбозу є попередній анамнез тромботичних подій, вагітність, уживання контрацептивів тощо.
Консенсусне твердження 2.1. Пацієнтам із ЗХК, госпіталізованим із приводу гострого захворювання або великого хірургічного втручання, протягом стаціонарного лікування рекомендовано призначати профілактичні дози низькомолекулярного гепарину або фондапаринуксу. Пацієнтам із ЗХК, яким було проведено велике хірургічне втручання, треба призначати профілактичні дози низькомолекулярного гепарину щонайменше протягом 3 тижнів після виписки. У пацієнтів після стаціонарного лікування або амбулаторних пацієнтів із тяжким загостренням ЗХК можна розглянути тромбопрофілактику.
Коментар. Фармакологічна тромбопрофілактика в умовах стаціонару асоціюється зі зниженням ризику розвитку ВТЕ після виписки на 54%. У пацієнтів із гострими та тяжкими хворобами низькомолекулярний гепарин має перевагу над нефракціонованим. Профілактичні дози прямих оральних антикоагулянтів схвалено для застосування після ортопедичних хірургічних утручань, але не в хронічно хворих пацієнтів, оскільки мають несприятливий профіль користь/ризик.
У пацієнтів, яким було виконано велике хірургічне втручання, рекомендовано проводити розширену антитромботичну профілактику (3-6 тижнів). Переваги розширеної тромбопрофілактики після виписки в стаціонарних пацієнтів нехірургічного профілю невідомі, відповідно, в таких випадках вона рутинно не рекомендована. Однак у масштабному дослідженні (n=872 122) ризик розвитку ВТЕ після виписки таких пацієнтів становив 0,13%; більшість випадків траплялися в перші 60 днів після виписки. Чинниками ризику виступали клостридіальна інфекція та значна тривалість стаціонарного лікування.
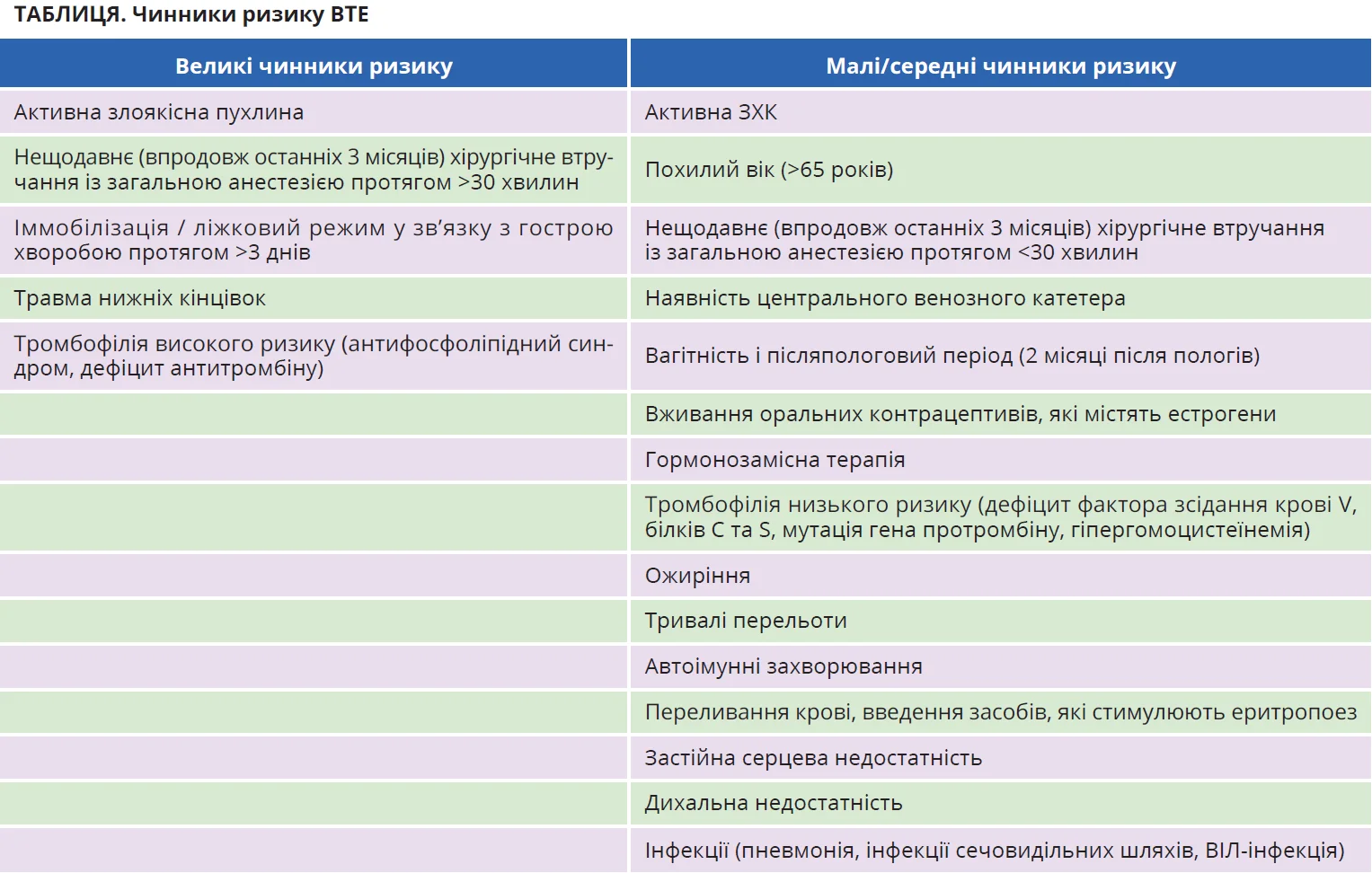
Тромбопрофілактика в амбулаторних пацієнтів із загостренням ЗХК теж вивчена недостатньо. Хоча ризик таких хворих є дещо вищим, аніж ризик відносно здорових осіб, абсолютний ризик є низьким, тому фармакологічна тромбопрофілактика не показана й не є фармакоекономічно доцільною. Утім, цей захід може застосовуватися в пацієнтів із помірно тяжкими або тяжкими загостреннями та чинниками ризику ВТЕ (табл.). Слід зауважити, що тромбопрофілактика низькомолекулярними гепаринами не асоціюється з підвищеним ризиком виникнення значних кровотеч.
Консенсусне твердження 2.2. Пацієнтам із ЗХК та гострою ВТЕ рекомендовані прямі оральні антикоагулянти в терапевтичних дозах. Для визначення тривалості антикоагулянтного лікування слід оцінити чинники ризику виникнення ВТЕ.
Коментар. Прямі оральні антикоагулянти є першою лінією лікування ВТЕ в загальній популяції та в осіб із ЗХК. У гострій фазі альтернативою можна вважати низькомолекулярні гепарини. Прямі оральні антикоагулянти є особливо необхідними пацієнтам із портальним або церебральним тромбозом; їх застосування асоціюється з учетверо вищою ймовірністю рентгенологічного розрішення тромбозу, кращими показниками реканалізації та сприятливим профілем безпеки порівняно з варфарином.
Стратифікація ризику при ВТЕ залежить від наявності модифікованих чинників ризику. Наприклад, у разі ВТЕ, спровокованої нещодавнім хірургічним утручанням, госпіталізацією або загостренням ЗХК, антикоагулянтну терапію можна припинити через 3 місяці.
Консенсусне твердження 3. Пацієнти із ЗХК незалежно від її лікування мають незначне підвищення ризику розвитку цереброваскулярних подій, ішемічної хвороби серця, мезентеріальної ішемії, фібриляції передсердь, серцевої недостатності. Відмінностей у кардіоваскулярній смертності виявлено не було.
Коментар. Кардіоваскулярний ризик є вищим у пацієнтів із ХК, жінок та осіб молодого віку.
Консенсусне твердження 4. У пацієнтів із ЗХК спостерігається невелике підвищення ризику міокардиту та перикардиту, хоча загальна захворюваність на ці патологічні стани при ЗХК є досить низькою.
Коментар. Підвищений ризик розвитку міо- та перикардиту супроводжує велику кількість імуноопосередкованих запальних хвороб, включаючи ЗХК. Однак абсолютний ризик міокардиту при ХК становить лише 8,3 випадку на 100 000 пацієнто-років, а при НВК – 2,6 випадку на 100 000 пацієнто-років. Із міокардитом асоційовані й деякі ліки, що застосовуються в лікуванні ЗХК (месалазин, антагоністи фактора некрозу пухлин-α). Причиною перикардиту в осіб із ЗХК переважно є фармакотерапія, тому скасування лікування сприяє повному видужанню.
Консенсусне твердження 5.1. Одним із найпоширеніших ПКП у разі ЗХК є анемія, переважно залізодефіцитна й анемія хронічних хвороб, які можуть траплятися окремо або в поєднанні з іншими дефіцитами мікронутрієнтів.
Коментар. Для пацієнтів із ЗХК застосовуються ті самі критерії анемії, що й для загальної популяції: вміст гемоглобіну <130 г/л для дорослих чоловіків, <120 г/л для дорослих невагітних жінок і <110 г/л для дітей віком 6-59 місяців. Дані щодо поширеності анемії при ЗХК є дуже гетерогенними, показники коливаються від 6 до 74%.
Консенсусне твердження 5.2. Пацієнтів із ЗХК слід регулярно обстежувати щодо анемії, оскільки цей ПКП є дуже поширеним і має потужний несприятливий вплив на якість життя та коморбідні стани.
У пацієнтів у стані ремісії або з незначною активністю хвороби такі обстеження потрібно проводити раз на 6-12 місяців, а в осіб із високою активністю хвороби – щонайменше раз на 3 місяці. За наявності біохімічних або клінічних доказів запалення діагностичними критеріями анемії хронічних хвороб є вміст сироваткового феритину >100 мкг/л і сатурація трансферину <16%. Якщо сироватковий уміст феритину становить 30-100 мкг/л, високою є ймовірність комбінації залізодефіцитної анемії та анемії хронічних хвороб.
Коментар. У ході обстеження пацієнтів із ЗХК й анемією важливо встановити етіологію останньої. Нормальний показник середнього об’єму еритроцита (MCV) не виключає залізодефіциту, оскільки близько 40% залізодефіцитних анемій є нормоцитарними. І навпаки, мікроцитоз не завжди є свідченням дефіциту заліза. Для оцінки статусу заліза в організмі визначають рівень феритину, який, однак, може виявитися нормальним або підвищеним за наявності запалення. У зв’язку з цим слід додатково визначати вміст С-реактивного білка, швидкість осідання еритроцитів і сатурацію трансферину. Сироватковий уміст заліза не є маркером залізодефіциту.
Анемія хронічних хвороб є ймовірною в разі сироваткового феритину >100 мкг/л і сатурації трансферину <20%.
Діагностичний алгоритм анемії при ЗХК представлено на рисунку 2.
Консенсусне твердження 5.3. Пацієнтам із ризиком дефіциту вітаміну B12 або фолієвої кислоти, особливо особам із ХК у ділянці тонкого кишківника чи резекцією кишківника та хворим із макроцитозом, треба проводити скринінгове визначення сироваткового вмісту вітаміну B12 і фолієвої кислоти щонайменше щорічно.
Коментар. Дефіцит вітаміну B12 виникає при ХК внаслідок шлунково-кишкових розладів чи обмеженого споживання нутрієнтів. Цей дефіцит здатен спричинити прогресивне та незворотне погіршення зору у зв’язку з нейропатією зорового нерва, а також неврологічні ускладнення та порушення пам’яті. Можливий і функціональний дефіцит вітаміну B12, за якого вміст вітаміну є нормальним, а співвідношення гомоцистеїну до метилмалонової кислоти – підвищеним, що зумовлює ураження органів-мішеней. Моніторинг рівнів вітаміну B12 і фолієвої кислоти показаний усім пацієнтам із макроцитарною анемією або анемією, яка не відповідає на добавки заліза та/або стимулятори еритропоезу.
Хоча золотого стандарту не існує, діагноз вітамінодефіциту B12 установлюється при рівні цього вітаміну <200 пг/мл (148 пмоль/л). Аналогічно порогове значення для фолієвої кислоти становить 7 нмоль/л. Слід бути особливо уважними до пацієнтів, у яких показники вітаміну B12 і фолієвої кислоти перебувають у проміжній зоні (200-400 пг/мл і 7-10 нмоль/л відповідно).
Консенсусне твердження 6.1. Пацієнти із ЗХК та залізодефіцитною анемією мають отримувати добавки заліза для нормалізації рівня гемоглобіну та поповнення депо заліза.
Коментар. Залізо є необхідним для всіх клітин організму, тому симптоми залізодефіциту можуть виникати ще до появи явної анемії. Такими симптомами виступають зниження толерантності до фізичних навантажень, погіршення когнітивної функції, втомлюваність, головний біль, розлади сну, зниження лібідо, синдром неспокійних ніг.
Консенсусне твердження 6.2. Внутрішньовенні препарати заліза рекомендовані як терапія першої лінії для осіб із клінічно активною ЗХК, попередньою непереносимістю препаратів заліза та пацієнтів, які потребують стимуляторів еритропоезу. Пероральні препарати заліза рекомендовані пацієнтам із нетяжкою залізодефіцитною анемією та клінічно неактивною ЗХК.
Коментар. Внутрішньовенним препаратам заліза слід також віддавати перевагу в періопераційних умовах, коли потрібна швидка відповідь.
Великі дослідження підтвердили ефективність у пацієнтів із ЗХК сахарози, карбоксимальтози та дерізомальтози заліза. Сучасні інфузійні препарати заліза рідко провокують побічні явища, проте при застосуванні декстрану заліза потрібно вводити тестову дозу, оскільки препарат здатен провокувати анафілаксію.
Ризик перевантаження залізом при інфузійній терапії є невеликим; як критерій припинення лікування слід використовувати насичення трансферину на рівні 50% і сироватковий феритин >800 мкг/л. Критерієм відповіді на терапію слугує підвищення гемоглобіну на 20 г/л упродовж 4 тижнів лікування.
Від внутрішньом’язового введення заліза наразі відмовилися, оскільки ін’єкції є болючими й асоціюються з неприйнятними побічними ефектами.
Якщо було вирішено застосовувати пероральні препарати, слід моніторувати рівень гемоглобіну впродовж перших 4 тижнів лікування та продовжувати терапію протягом близько 3 місяців після нормалізації цього показника з метою забезпечення насичення депо заліза. Для покращення переносимості перорального заліза запропоновано призначати добавки в дозі 60-120 мг зранку через день. Хоча більшість досліджень оцінювали вплив сульфату заліза, нові препарати (наприклад, мальтол заліза) демонструють достатню ефективність і кращу переносимість.
Консенсусне твердження 6.3. Після лікування залізодефіцитної анемії слід моніторувати гемоглобін і феритин раз на 3-6 місяців протягом щонайменше 1 року після поповнення дефіциту та раз на 6-12 місяців після того. Повторне лікування рекомендовано при зниженні феритину <100 мкг/л або гемоглобіну <120 чи 130 г/л залежно від статі. Метою профілактичного лікування є підтримка сироваткових рівнів гемоглобіну та феритину в межах норми.
Коментар. У 50% випадків залізодефіцитна анемія рецидивує впродовж найближчих 10 місяців, тому пацієнтам із ЗХК потрібно проводити регулярний моніторинг. Швидкість настання рецидиву залежить від наповненості депо заліза після проведеного лікування. Фармакоекономічний аналіз свідчить про доцільність проактивного підходу до лікування анемії та підтримки цільового рівня феритину >100 мкг/л.
Консенсусне твердження 6.4. У пацієнтів, які не досягли адекватної відповіді на оптимізацію терапії ЗХК та внутрішньовенні препарати заліза, слід розглянути стимулятори еритропоезу; цільовий рівень гемоглобіну має становити не більш як 120 г/л.
Коментар. Системне запалення при ЗХК пригнічує еритропоез, тому більшість пацієнтів із такими хворобами добре відповідають на його стимулятори підвищенням гемоглобіну та покращенням якості життя. За наявності ниркової недостатності або раку нирок застосування стимуляторів еритропоезу обмежене максимальним значенням гемоглобіну 120 г/л із метою мінімізації ризику розвитку ВТЕ та кардіоваскулярних подій. Така сама тактика стосується й ЗХК, оскільки дослідження довготривалої безпеки стимуляторів еритропоезу при цих хворобах відсутні.
Паралельно слід застосовувати внутрішньовенне залізо для профілактики функціонального залізодефіциту; цільовий рівень феритину становить >200 мкг/л. Відповідь на ці препарати оцінюється за ретикулоцитозом.
Література
Gordon H., Burisch J., Ellul P., et al. ECCO guidelines on extraintestinal manifestations in inflammatory bowel disease. Journal of Crohn’s and Colitis. 2024; 18 (1): 1-37. doi: 10.1093/ecco-jcc/jjad108.