Прогностичні шкали при цирозі печінки: від теорії до клінічної практики
Переклала й адаптувала канд. мед. наук Тетяна Можина
Традиційна зустріч, яка щорічно об’єднує фахівців внутрішньої медицини з усієї України, – П’яті наукові читання пам’яті професора А.С. Свінціцького «Внутрішня медицина: наука та практика» – відбулася 15-17 жовтня.
 Серед великої кількості доповідей, які пролунали під час конгресу, лікарів-практиків зацікавив виступ завідувачки кафедри внутрішніх хвороб стоматологічного факультету Національного медичного університету ім. О.О. Богомольця (м. Київ), докторки медичних наук, професорки Галини Анатоліївни Соловйової на тему «Прогностичні шкали при цирозі печінки».
Серед великої кількості доповідей, які пролунали під час конгресу, лікарів-практиків зацікавив виступ завідувачки кафедри внутрішніх хвороб стоматологічного факультету Національного медичного університету ім. О.О. Богомольця (м. Київ), докторки медичних наук, професорки Галини Анатоліївни Соловйової на тему «Прогностичні шкали при цирозі печінки».
Перші описи змін, подібних до цирозу печінки (ЦП), трапляються ще в працях античних лікарів. За сучасним визначенням Всесвітньої організації охорони здоров’я, цироз (від грец. kirros – жовтувато-бурий) є дифузним процесом, що характеризується фіброзом і супроводжується перебудовою нормальної структури печінки з утворенням вузлів регенерації. Макроскопічно печінка при ЦП зменшується в розмірах, стає щільною, з горбистою поверхнею; мікроскопічно спостерігають дифузний фіброз, порушення архітектоніки часточок, формування «хибних часточок», дистрофію та некроз гепатоцитів, проліферацію дрібних жовчних проток. Такі морфологічні зміни стають основою для розвитку різноманітних ускладнень: портальної гіпертензії, асциту, печінкової енцефалопатії, гепаторенального синдрому, коагулопатій, гепатопульмонального синдрому. Саме на стадії декомпенсації перебіг ЦП стає життєзагрозливим, а оцінка прогнозу – клінічно значущою.
На початкових етапах розвитку медицини тяжкість ЦП оцінювалася переважно за клінічними проявами, що обмежувало точність прогнозу. З розвитком лабораторної діагностики оцінка тяжкості хвороби стала точнішою, однак залишалася частково суб’єктивною, оскільки значною мірою ґрунтувалася на клінічному досвіді. Поступово виникла потреба у створенні стандартизованих підходів, які давали б можливість об’єктивно оцінювати функціональний стан печінки, прогнозувати перебіг хвороби та визначати тактику лікування. Так з’явилися перші прогностичні шкали, які згодом стали підґрунтям для створення нових систем оцінювання, що й сформували основу сучасної клінічної гепатології.
Шкали при ЦП: від Чайлда – П’ю до MELD
Протягом багатьох років основним інструментом для оцінювання тяжкості ЦП була шкала Чайлда – П’ю, запропонована ще в 1973 р. Вона ґрунтується на поєднанні клінічних і лабораторних показників (табл. 1). Утім, ця шкала має певну суб’єктивність, що обмежує її використання в порівнянні стану різних пацієнтів, особливо при відборі кандидатів на трансплантацію. Тому згодом було розроблено шкалу MELD, засновану виключно на лабораторних показниках: умісті креатиніну, білірубіну та міжнародному нормалізованому відношенні (МНВ). Її оновлена версія, відома під назвою MELD-Na, додатково враховує вміст натрію в сироватці крові, що дає змогу підвищити точність прогнозу (табл. 1). Перевагами цієї моделі є її об’єктивність і можливість кількісно оцінити ризик летального наслідку протягом 3 місяців. Для зручності створено численні онлайн-калькулятори MELD і MELD-Na, які дають змогу швидко розрахувати бал за введеними лабораторними показниками.
Сьогодні використання шкал Чайлда – П’ю та MELD/MELD-Na офіційно рекомендовано низкою провідних професійних спільнот: Європейською асоціацією з вивчення печінки (EASL), Американською асоціацією з вивчення хвороб печінки (AASLD) та консенсусом Baveno VII. Водночас експерти наголошують, що зазначені шкали слід використовувати для різних цілей: Чайлда – П’ю – для клінічного оцінювання тяжкості ЦП, а MELD/MELD-Na – з метою об’єктивного прогнозування перебігу хвороби й визначення показань до трансплантації печінки.
Оцінювання гострої декомпенсації ЦП: група шкал CLIF-С
Якщо шкали Чайлда – П’ю та MELD/MELD-Na застосовують переважно для оцінювання хронічного перебігу ЦП, то в разі гострої декомпенсації або розвитку синдрому гострої печінкової недостатності на тлі хронічної (ГПНХ) потрібні деталізованіші інструменти.
Синдром ГПНХ виникає у хворих із хронічними захворюваннями печінки та характеризується гострою декомпенсацією, що призводить до печінкової недостатності й поліорганної дисфункції. ГПНХ асоціюється з високим ризиком летальності протягом перших 28 днів – 3 місяців від початку загострення. На відміну від «традиційної» гострої декомпенсації, яка проявляється асцитом, енцефалопатією, жовтяницею та не має тяжких системних порушень, ГПНХ супроводжується поліорганною недостатністю, яка визначає прогноз хвороби.
Саме це стало підставою для створення спеціалізованих шкал, які дають змогу не лише оцінити тяжкість стану, а й стратифікувати ризики, визначити доцільність і ймовірну ефективність трансплантації печінки. Із цією метою консорціум EASL-CLIF (Chronic LIver Failure) розробив низку спеціалізованих шкал CLIF-С (Chronic Liver Failure Consortium): CLIF-C AD (Acute Decompensation – гостра декомпенсація), CLIF-С OF (Organ Failure – органна недостатність), CLIF-SOFA (Sequential Organ Failure Assessment; шкала динамічного оцінювання органної недостатності, адаптована для пацієнтів із ЦП) і CLIF-C ACLF (Acute-on-Chronic Liver Failure – ГПНХ). Ці шкали допомагають оцінити ступінь органної дисфункції, визначити прогноз виживаності й оптимізувати тактику лікування у хворих з тяжкими формами ЦП (табл. 2).
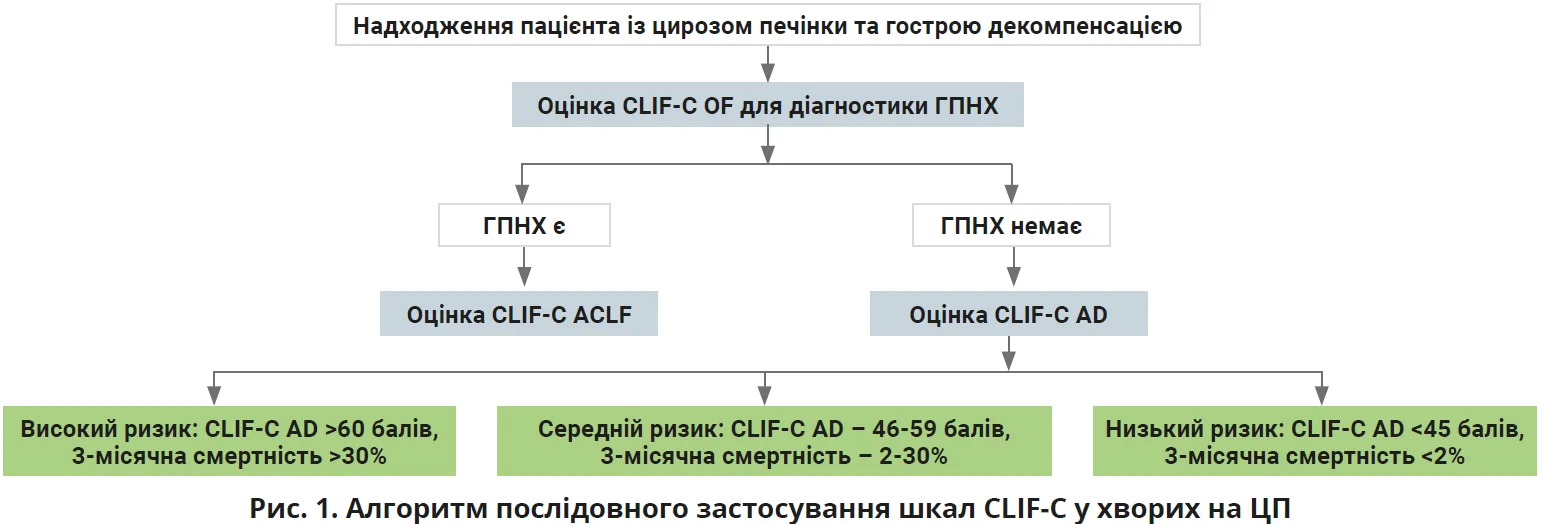
Першим етапом у сучасному алгоритмі ведення хворих на ЦП з гострою декомпенсацією є оцінювання за шкалою CLIF-C OF (рис. 1). Ця шкала визначає функціональний стан шести ключових органів і систем організму: печінки, нирок, мозку, системи коагуляції, кровообігу та легень. Для кожного органа визначають три рівні порушення функціонування: від помірної дисфункції до тяжкої недостатності; беруть до уваги також потребу в підтримувальній терапії (вазопресори, діаліз, вентиляція). Сумарна оцінка за шкалою CLIF-C OF дає змогу підтвердити наявність або відсутність ГПНХ.
За умови підтвердження ГПНХ оцінюють стан пацієнта за шкалою CLIF-C ACLF, яка допомагає визначити ступінь тяжкості та прогноз виживаності. Якщо ГПНХ немає, то стан оцінюють за іншою шкалою – CLIF-C AD, яка відображає ризик декомпенсації (низький, середній і високий) (рис. 1). Ці моделі дають змогу кількісно оцінити ступінь органної дисфункції, визначити прогноз виживаності й оптимізувати тактику лікування у хворих з тяжкими формами ЦП.
Так у гепатології розпочалася епоха широкого застосування прогностичних шкал. Нині шкали Чайлда – П’ю, MELD/MELD-Na та група шкал CLIF-С становлять основу сучасної стратифікації ризику у хворих на ЦП. Якщо шкали Чайлда – П’ю й MELD відображають ступінь хронічного ураження та прогноз довгострокової виживаності, то шкали CLIF-С дають змогу оцінити тяжкість гострої декомпенсації та прогнозувати короткострокові наслідки при ГПНХ.
Застосування сучасних прогностичних шкал: клінічний приклад
Для ілюстрації використання прогностичних шкал професорка Г.А. Соловйова навела клінічний приклад пацієнтки К. віком 44 роки, яка в липні 2021 р. звернулася до стаціонару зі скаргами на пожовтіння шкіри, періодичну нудоту та блювання. Пацієнтка вважала себе хворою з 2016 р., коли почали з’являтися епізоди нудоти після вживання алкоголю (щоденно вона вживала до 50 мл міцних напоїв, із 2019 р. споживання алкоголю зросло до 300 мл на добу). В анамнезі життя – без значущих особливостей.
При госпіталізації стан пацієнтки оцінювався як середньої тяжкості. Температура тіла становила 36,8 °С. Шкіра бліда, склери іктеричні. Живіт збільшений у розмірах через незначне скупчення рідини в черевній порожнині. Печінка виступала на 2,5 см з-під реберної дуги, при пальпації – м’якої консистенції, неболюча. Сечовипускання вільне, безболісне. Дихання ритмічне, SpO2 – 97%. Інших патологічних змін під час об’єктивного огляду не виявлено.
При лабораторному обстеженні встановлено численні зміни. Відзначили ознаки гіпохромної нормоцитарної анемії (гемоглобін – 80 г/л, гематокрит – 22,4%, еритроцити – 4,78×10¹²/л) зі зниженням умісту фолієвої кислоти (2,2 нг/мл; норма – 3-17 нг/мл) і незміненим рівнем вітаміну В12 (497 пг/мл). Гематолог діагностував вторинну анемію хронічного захворювання змішаного генезу (печінкова та фолієводефіцитна). Спостерігали явища цитолітичного синдрому (АСТ – 68,1 Од/л, АЛТ – 21,0 Од/л; співвідношення АСТ/АЛТ >3, що підтверджує алкогольне ураження печінки) та внутрішньопечінкового холестазу – ВПХ (γ-глутамілтранспептидаза (ГГТП) – 840 Од/л (норма – до 71 Од/л), загальний білірубін – 135,9 мкмоль/л, прямий – 93,7 мкмоль/л, лужна фосфатаза – в нормі). Одночасно простежувалися ознаки гепатоцелюлярної недостатності через гіпоальбумінемію (28,0 г/л), гіпопротеїнемію (61 г/л), гіпергаммаглобулінемію (23%; норма – 13-19%). Порушення білоксинтетичної функції поєднувалося з коагулопатією: протромбіновий час – 17,7 с (норма – 10,1-14,6 с), протромбіновий індекс – 67,4%, МНВ – 1,66. Рівень аміаку в крові становив 477 мкмоль/л (норма <60 мкмоль/л), що свідчило про порушення детоксикаційної функції печінки та розвиток печінкової енцефалопатії 1-го ступеня. Показники системного запалення також були змінені: підвищені С-реактивний білок – СРБ (19,9 мг/л; норма <5), прокальцитонін (1,33 нг/мл; норма <0,5) за відсутності ознак бактеріємії (отримано негативні результати посівів крові та сечі). Зростання феритину (1091 нг/мл) і заліза (24,9 мкмоль/л) відображало опосередковану цитокіном реакцію запалення або вторинне перевантаження залізом. Констатували порушення водно-електролітного балансу внаслідок гіпонатріємії (118,9 ммоль/л), гіпохлоремії (92,9 ммоль/л) за збереженого рівня калію (4,07 ммоль/л); гіпоосмолярний синдром виник на тлі збереженої функції нирок: креатинін – 64,9 мкмоль/л, швидкість клубочкової фільтрації – 99,5 мл/хв. Виявлено значущі атерогенні зміни ліпідного обміну: загальний холестерин – 4,44 ммоль/л, ліпопротеїни низької щільності – 3,16 ммоль/л, ліпопротеїни високої щільності – 0,3 ммоль/л, тригліцериди – 2,73 ммоль/л, коефіцієнт атерогенності – 7,0.
Імунологічне та вірусологічне обстеження дало змогу виключити вірусну й автоімунну етіологію ураження печінки: не виявлені HBsAg, сумарні антитіла до HCV, антимітохондріальні, антинуклеарні, антимікросомальні антитіла. Виключена ймовірна трансформація в гепатоцелюлярну карциному (α-фетопротеїн, раково-ембріональний антиген – у межах норми). Дослідження асцитичної рідини підтвердило неускладнений асцит портального генезу: отримано 30 мл прозорої серозної рідини з низьким умістом білка (14,8 г/л), нормальним співвідношенням альбуміну до глобуліну (0,96), відсутністю бактеріального росту; цитологічно визначено поодинокі лімфоїдні клітини з дистрофічними змінами.
Отримані клініко-лабораторні результати дали можливість оцінити стан пацієнтки за допомогою міжнародно визнаних прогностичних шкал.
За шкалою Чайлда – П’ю стан хворої відповідав класу C, що свідчило про тяжке ураження печінки. Показник MELD становив 28 балів і вказував на високий ризик 3-місячної летальності, а значення індексу Maddrey Discriminant Function – mDF (34 бали) підтверджувало тяжкий перебіг алкогольного гепатиту. Додаткове оцінювання за шкалою CLIF-C ACLF (39 балів) відображало ймовірність смерті на рівні близько 10% протягом 1 місяця та 32% протягом року, що підкреслювало потребу в інтенсивній терапії й динамічному моніторингу стану пацієнтки.
Сформульовано такий діагноз: гострий алкогольний гепатит; індекс mDF – 34; алкогольний ЦП, клас С за Чайлдом – П’ю, MELD – 28; портальна гіпертензія; асцит; спленомегалія; печінкова енцефалопатія, тип С, клас 1, рецидивна, спровокована (алкоголем), гіпонатріємія. CLIF-C ACLF – 39.
Тактика лікування формувалася відповідно до положень міжнародних настанов EASL (2018) і Baveno VII (2022). Окрім відмови від алкоголю та дотримання дієти призначили метилпреднізолон (32 мг на добу) з огляду на тяжкий перебіг алкогольного гепатиту для зниження запальної активності, обмеження цитокінового каскаду та покращення короткострокової виживаності. Базисну терапію доповнили цефтріаксон як антибактеріальна терапія, спіронолактон і фуросемід для контролю асциту, β-блокатор для профілактики варикозних кровотеч, лактулоза (Дуфалак®) і рифаксимін для запобігання прогресуванню енцефалопатії. Відновлення білоксинтетичної функції печінки та зменшення ендогенної інтоксикації проводили, відповідно, за допомогою інфузій альбуміну (20% розчин, по 200 мл внутрішньовенно курсом 5 днів) і S-адеметіоніну – SAMe (Гептрал®) у дозі 500 мг 2 рази на добу внутрішньовенно протягом 2 тижнів. Додатково проводилися корекція дефіциту фолієвої кислоти (5 мг на добу), вітаміну D, підтримка нутритивного статусу та регулярний моніторинг лабораторних показників, динаміки прогностичних шкал.
Застосування SAMe при ЦП
Важливою складовою лікування пацієнтки стала метаболічна підтримка функції печінки, спрямована на зменшення цитолітичного синдрому та ВПХ, корекцію оксидативного стресу й поліпшення енергетичного обміну в гепатоцитах. Із цією метою використовували препарат адеметіоніну (SAMe).
SAMe є природним коферментом, який необхідний для реакцій метилювання, синтезу фосфоліпідів, глутатіону, цистеїну й таурину. Його рівень у гепатоцитах знижується при хронічних ураженнях печінки будь-якої етіології, особливо при алкогольному та неалкогольному стеатогепатиті. Дефіцит адеметіоніну призводить до порушення синтезу фосфоліпідів клітинних мембран, накопичення токсичних жовчних кислот і зниження антиоксидантного потенціалу.
Механізм дії цієї активної речовини багатокомпонентний. Доведено, що на рівні гепатоцитів SAMe сприяє синтезу фосфатидилхоліну, відновленню мембран гепатоцитів, зниженню активності цитолітичних ферментів (АЛТ, АСТ), ВПХ. На метаболічному рівні SAMe посилює синтез глутатіону, який забезпечує нейтралізацію вільних радикалів і детоксикацію ксенобіотиків. На нейрогуморальному рівні SAMe стимулює утворення серотоніну, дофаміну й інших нейромедіаторів, що сприяє зниженню проявів гепатогенної втоми (як одного із симптомів ВПХ) та енцефалопатії.
Клінічні ефекти SAMe підтверджено низкою досліджень. У рандомізованому контрольованому дослідженні (РКД), виконаному під керівництвом Jose Mato, аналізували ефективність препарату при алкогольному ЦП. У випробуванні взяли участь 123 хворих (за шкалою Чайлда – П’ю клас А – 75 осіб, клас В – 40, клас С – 8), яких рандомізували для перорального приймання Гептрал® (1200 мг на добу) чи плацебо протягом 2 років. Первинною кінцевою точкою була летальність або потреба в трансплантації печінки. Зареєстровано тенденцію до зниження смертності та потреби в трансплантації в групі SAMe порівняно з плацебо (16 проти 30% відповідно; p=0,077). Після вилучення хворих з тяжким цирозом (клас С за Чайлдом – П’ю) міжгрупова різниця стала статистично достовірною: 12 проти 29% відповідно (р=0,025). Кумулятивна 2-річна виживаність також була вищою в групі Гептрал® (p<0,046), що свідчить про здатність препарату покращувати прогноз і відстрочувати необхідність трансплантації у хворих на алкогольний ЦП (рис. 2).
В іншому РКД, проведеному під началом G. Choudhuri, хворим на алкогольну хворобу печінки з ВПХ (n=250) призначали SAMe (800-1600 мг на добу). Терапія SAMe достовірно зменшувала інтенсивність цитолізу й холестазу (рис. 3), а також скорочувала тривалість госпіталізації в 4 рази та зменшувала тривалість тимчасової непрацездатності в 1,6 раза порівняно з контролем.
Важливим компонентом гепатопротекторної дії Гептрал® є підвищення рівня ендогенного глутатіону в печінці. У пацієнтів з алкогольним ураженням печінки середній рівень глутатіону за приймання плацебо становив 2,2±0,2 мкмоль/г, тоді як на тлі терапії SAMe він зріс до 3,2±0,1 мкмоль/г. Аналогічну тенденцію спостерігали при неалкогольній хворобі печінки: введення SAMe сприяло зростанню рівня глутатіону (з 2,5±0,2 до 3,3±0,2 мкмоль/г) і його наближенню до показників здорових осіб (4,0±0,8 мкмоль/г). Результати цього РКД підтверджують, що SAMe чинить комплексну дію: покращує структурну та функціональну цілісність гепатоцитів, нормалізує процеси метилювання, відновлює антиоксидантну систему організму, знижує вираженість цитолізу й холестазу, потенційно покращує виживаність хворих на ЦП.
Клінічна динаміка та результати лікування
Проведене лікування сприяло поетапній стабілізації стану пацієнтки. На момент виписки спостерігали позитивну клінічну динаміку: зменшилися жовтяниця й асцит, покращився апетит, нормалізувалося загальне самопочуття. Водночас зберігалися ознаки залишкової системної запальної реакції: рівень СРБ залишався високим (16,5 мг/л), як і ШОЕ (77 мм/год), прокальцитонін (0,49 нг/мл). Вираженість цитолізу та холестазу зменшилася, але деякі показники перевищували нормативні значення (АСТ – 130,1 Од/л, АЛТ – 106,2 Од/л, ГГТП – 690 Од/л, загальний білірубін – 129,9 мкмоль/л, прямий білірубін – 86,3 мкмоль/л).
Покращилися показники білкового (альбумін – 42,5 г/л) і електролітного (натрій – 142,1 ммоль/л, хлор – 105,8 ммоль/л) обмінів. Подальше 2-місячне амбулаторне комбіноване лікування із застосуванням SAMe (рис. 4) забезпечило стійке покращення лабораторних і клінічних показників. У вересні 2021 р. стан пацієнтки оцінювався вже як стабільний: значно покращилися рівні трансаміназ, ГГТП, білірубіну, СРБ, ШОЕ. Такий перебіг відображає ефективність поетапного ведення пацієнтки з гострою декомпенсацією алкогольного ЦП і підтверджує клінічну доцільність застосування SAMe (Гептрал®) у складі комплексної терапії.
Висновки
Сучасна гепатологія ґрунтується на використанні стандартизованих кількісних підходів до оцінювання стану хворих на ЦП. Шкали Чайлда – П’ю, MELD/MELD-Na та група шкал CLIF-C дають змогу комплексно оцінити як хронічний перебіг ЦП, так і гостру декомпенсацію, включно з ГПНХ. Їх застосування має важливе клінічне значення, оскільки допомагає об’єктивно визначати ступінь тяжкості ураження печінки, прогнозувати перебіг хвороби, своєчасно виявляти розвиток поліорганної недостатності й оптимізувати тактику лікування. Включення SAMе (Гептрал®) у схему тривалого комплексного лікування алкогольного ЦП сприяє покращенню загального стану, нормалізації біохімічних показників, зменшенню проявів холестазу та гепатогенної втоми при ВПХ.