Практичні рекомендації AASLD щодо первинного склерозивного холангіту та холангіокарциноми
Переклала й адаптувала канд. мед. наук Тетяна Можина
Що нового в рекомендаціях порівняно з 2010 роком?
- Включено рекомендації з діагностики та лікування холангіокарциноми (ХКА) в пацієнтів із/без первинного склерозивного холангіту (ПСХ).
- Запроваджено термін «значуща стриктура», котру визначають як будь-яку жовчну стриктуру загальної печінкової протоки або печінкових проток, асоційовану з появою ознак/симптомів обструктивного холестазу та/або бактеріального холангіту (табл. 1).
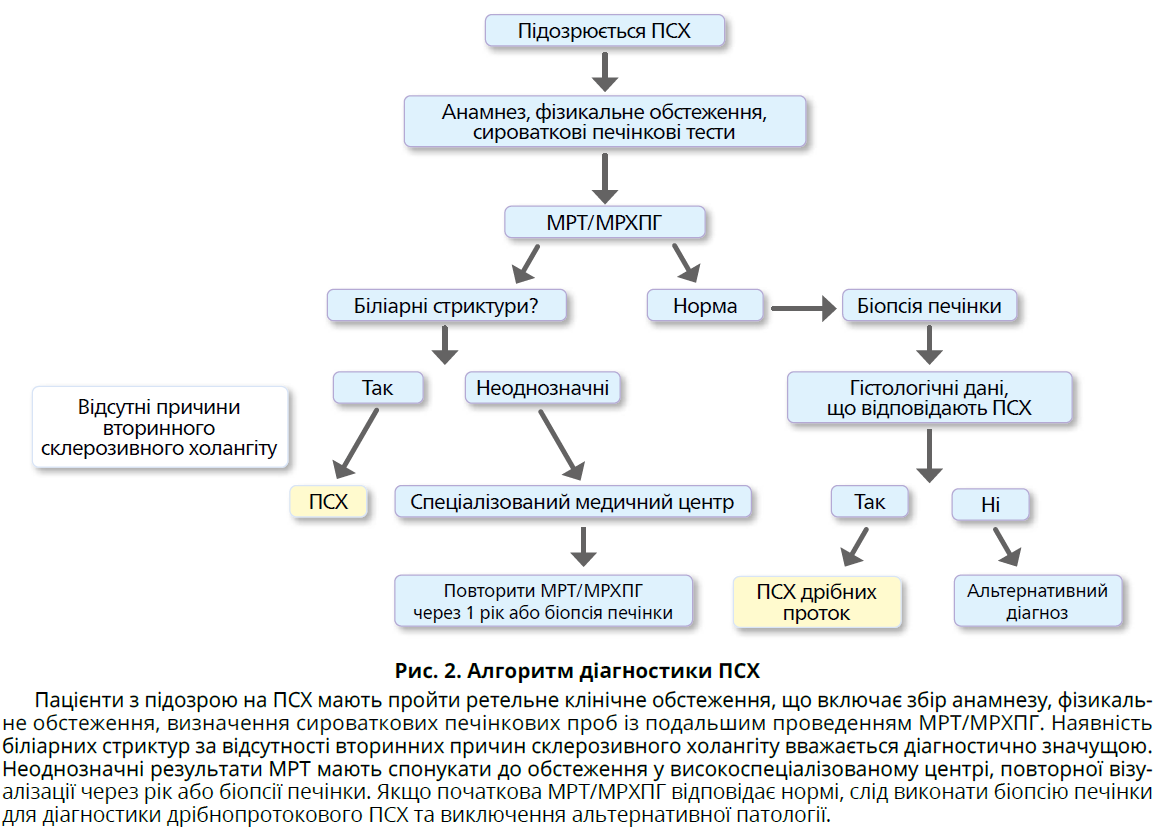
- У пацієнтів із сумнівними результатами магнітно-резонансної томографії з холангіопанкреатографією (МРТ/МРХПГ) варто виконати повторну високоякісну МРТ/МРХПГ із діагностичною метою. Слід уникати ендоскопічної ретроградної холангіопанкреатографії – ЕРХПГ (рис. 2).
- У пацієнтів із ПСХ без явного запального захворювання кишківника (ЗЗК) необхідно виконати діагностичну колоноскопію з отриманням гістологічних біоптатів; її варто проводити повторно що 5 років, якщо ЗЗК не діагностовано спочатку.
- Скринінг раку товстої кишки слід починати з 15-річного віку у хворих на ПСХ та ЗЗК.
- Доступні нові клінічні шкали оцінки ризику ПСХ, але ймовірність розвитку значних подій в окремих пацієнтів слід інтерпретувати з обережністю.
- Усіх хворих на ПСХ варто розглядати як потенційних учасників клінічних досліджень; але слід розглянути доцільність прийому урсодезоксихолевої кислоти – УДХК (13-23 мг/кг/добу) та продовжити за доброї переносимості, покращення вмісту лужної фосфатази – ЛФ (g-глутамілтрансферази (ГГТ) у дітей) та/або симптомів через 12 місяців лікування.
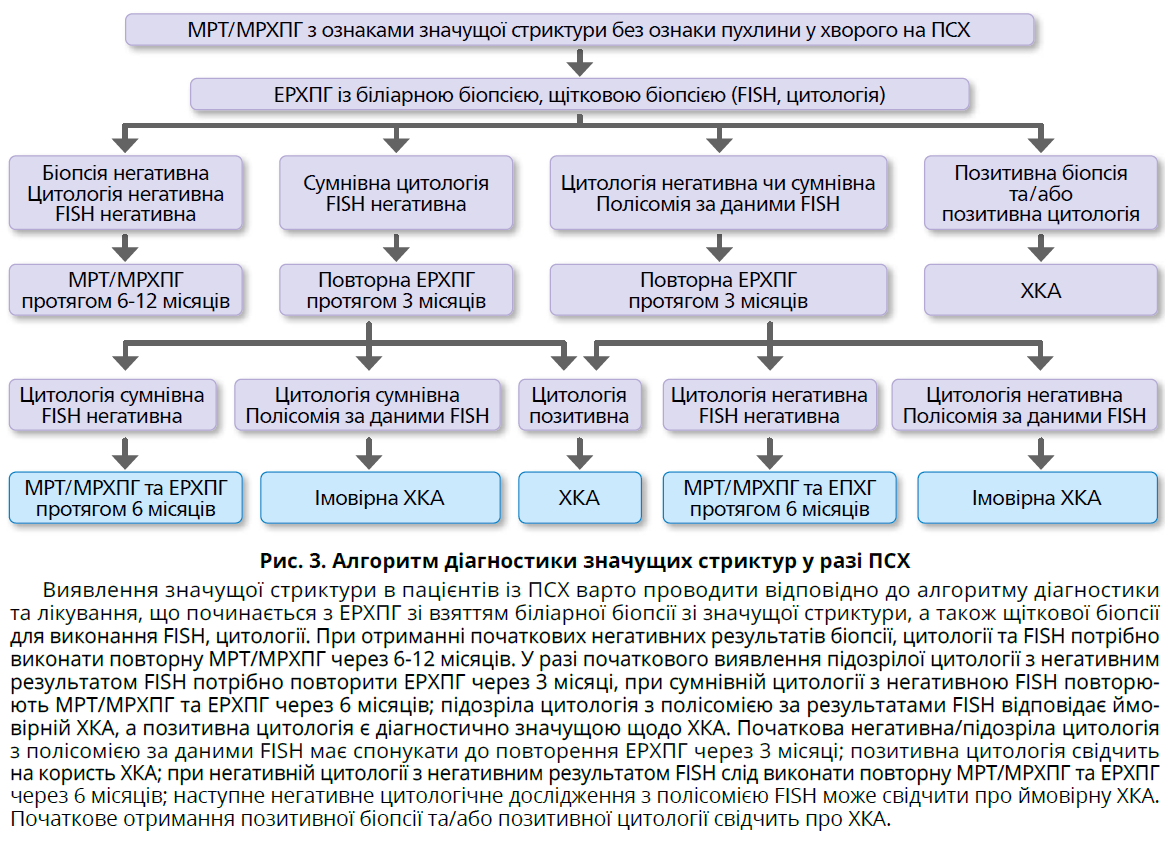
- ЕРХПГ із біопсією жовчовивідних шляхів для виконання цитології та флуоресцентного гібридизаційного аналізу in situ (FISH) варто проводити в усіх пацієнтів із підозрою на перипортальну або дистальну ХКА.
- Трансплантацію печінки після неоад’ювантної терапії рекомендовано хворим на перипортальну ХКА <3 см у діаметрі, яка є неоперабельною або виявлена під час діагностування ПСХ за відсутності внутрішньопечінкових або позапечінкових метастазів (рис. 3).
Вступ
ПСХ являє собою холангіопатію, яка характеризується хронічним фіброзним запаленням, пошкодженням біліарного дерева й часто поєднується із ЗЗК. Більшість пацієнтів із ПСХ мають фіброзні жовчні стриктури на холангіограмі, тоді як невелика кількість страждає від ПСХ дрібних проток на тлі незміненої холангіограми, але з типовими гістологічними ознаками ПСХ у біоптатах печінки. У невеликій кількості випадків спостерігають overlap-синдром ПСХ – автоімунний гепатит (АІГ). ПСХ уражає як чоловіків, так і жінок і може виникати в будь-якому віці. Він вважається автоімунним захворюванням, хоча патофізіологія залишається недостатньо вивченою. ПСХ часто призводить до холестатичного ураження печінки, цирозу, печінкової недостатності та може рецидивувати у 20-30% пацієнтів після трансплантації. ПСХ супроводжується високим ризиком розвитку ХКА та колоректального раку. Наразі немає ефективного лікування ПСХ; у таблиці 1 наведено нову термінологію, яка характеризує біліарні стриктури.
Етіологія ПСХ
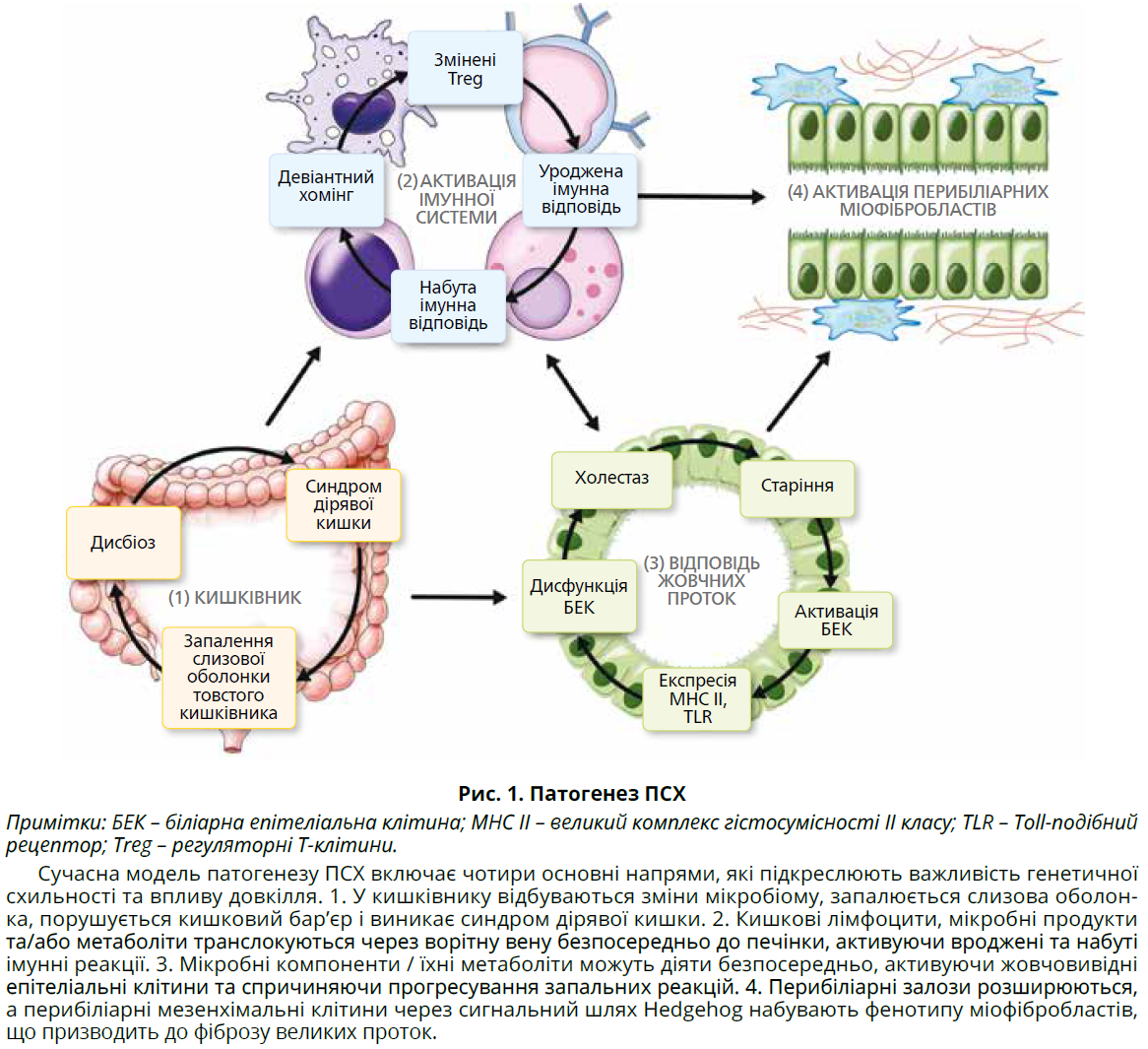
Кілька різноманітних механізмів призводять до розвитку та прогресування ПСХ (рис. 1).
Існує чітка генетична схильність, пов’язана з носійством лейкоцитарного антигену людини (HLA) [42-48] та інших додаткових не-HLA-локусів [46, 49]. Дані доказової медицини свідчать, що ЗЗК може стати причиною ПСХ, а не просто епіфеноменом [52, 53]. Кілька досліджень продемонстрували порушення кишкового бар’єра при ПСХ [54-56]; з’являється дедалі більше доказів впливу дисбактеріозу товстого кишківника на виникнення ПСХ [57-72]. Порушення міграції лімфоцитів кишківника [73, 74] та/або транслокація мікробних компонентів або метаболітів [67, 75, 76] здатні індукувати активацію біліарних епітеліальних клітин, перибіліарне запалення з участю макрофагів [77, 78], еозинофілів [79-81] і Т-клітин [82-84]. Однак специфічний антиген / імунна відповідь іще не визначені [85-87]. Фіброз великих жовчних проток у разі ПСХ асоційований із гіперплазією перибіліарних залоз і активацією перибіліарних мезенхімальних клітин, які набувають фенотипу міофібробластів [93, 94]. Стриктури великих жовчних проток, зменшення відтоку жовчі підвищують тиск жовчі; холестаз-асоційовані зміни жовчі здатні додатково спричиняти прогресування захворювання [95-97].
Діагностика ПСХ
ПСХ слід підозрювати в усіх пацієнтів із холестазом, особливо на тлі ЗЗК. Діагноз ґрунтується на виявленні характерних стриктур під час холангіографії (рис. 2). Обов’язково потрібно виключати вторинний склерозивний холангіт, особливо за відсутності ЗЗК (табл. 2).
Діагноз дрібнопротокового ПСХ встановлюють на підставі гістологічних даних, типових або сумісних із ПСХ за нормальної холангіограми.
За підозри на дрібнопротоковий ПСХ без ЗЗК потрібно виключити носійство алелів АТФ-зв’язувального касетного транспортера В, відомого також як ген білка множинної резистентності-3. За наявності клінічних, біохімічних, гістологічних ознак АІГ і холангіографічних ознак ПСХ слід розглянути ймовірність overlap-синдрому ПСХ-АІГ, також відомого як ПСХ із перехресними ознаками АІГ.
І навпаки, перехрещення ПСХ-АІГ слід розглянути у хворих на АІГ та ЗЗК із незрозумілими лабораторними ознаками холестазу або відсутністю відповіді на традиційну глюкокортикоїдну терапію.
Алгоритм діагностики значущих стриктур представлено на рисунку 3.
Біохімічні та серологічні дослідження
Біохімічні маркери чутливі, але неспецифічні для ПСХ. Холестатичний біохімічний профіль із підвищеними печінковими ферментами, як-от ЛФ і ГГТ, спостерігається в 75% пацієнтів [40]. Показово, що підвищення амінотрансфераз трапляється часто й не обов’язково свідчить на користь АІГ, якщо вони не перевищують більш ніж у 5 разів верхню межу норми (ВМН) [109]. Однак точні діагностичні критерії overlap-синдрому ПСХ-АІГ поки що не встановлені.
У пацієнтів із ПСХ часто виявляють підвищення рівня сироваткових автоантитіл, включаючи антинуклеарні, антигладком’язові та перинуклеарні антинейтрофільні антитіла, що, ймовірно, вказує на імунну дисрегуляцію [110, 111]. На відміну від первинного біліарного холангіту й АІГ автоантитіла мають мінімальну діагностичну значущість для ПСХ [112]. Підвищення сироваткового IgG4 відзначають у ≈15% пацієнтів із ПСХ, але клінічне значення залишається неясним [113, 114]. Високий титр IgG4 (>5,6 г/л) трапляється рідко та свідчить про IgG4-склерозивний холангіт, тоді як індекс IgG4/IgG1 <0,24 дає змогу виключити IgG4-склерозивний холангіт за сироваткової концентрації IgG4 1,4-2,8 г/л [114, 115].
Лікування ПСХ
Нині не існує рекомендованих ліків для терапії ПСХ, не доведено, що певний медикамент здатний зупинити прогресування захворювання. Тому наразі лікування ПСХ полягає у своєчасному розпізнаванні та терапії ускладнень за їх появи. Трансплантацію печінки рекомендовано пацієнтам із рефрактерним холангітом та/або декомпенсованим цирозом печінки.
Медикаментозне лікування
Велика кількість жовчогінних, імуносупресивних, протимікробних, антифіброзних засобів застосовувалася в лікуванні ПСХ; але не доведено, що будь-який із препаратів здатний змінити природний перебіг захворювання та надати вагомі клінічні переваги. Преднізолон [233], метотрексат [234], азатіоприн [235], пеніциламін [168], такролімус [236], колхіцин [237], нікотин [238], мікофенолату мофетил [167], пентоксифілін [239], будесонід [166], метронідазол [172], силімарин [240], пірфенідон [241] та етанерцепт [242] не змогли надати докази ефективності.
Урсодезоксихолева кислота
УДХК є найвивченішим препаратом у разі ПСХ. Потенційні переваги при ПСХ включають збільшення відтоку жовчі, прямий і опосередкований цитопротекторний вплив, стабілізацію клітинних мембран, імуномодуляцію, розведення гідрофобного пулу жовчних кислот і зниження регуляції апоптозу. Крім того, УДХК має протизапальні та протинабрякові властивості [244]. Докази її ефективності при ПСХ не є послідовними. Дослідження з використанням низьких доз УДХК (13-15 мг/кг/день) продемонстрували покращення показників ЛФ протягом 12 місяців, але без покращення гістологічного стану печінки або виживання без трансплантації [169]. Докази застосування проміжних доз УДХК (17-23 мг/кг/добу) визнані непереконливими [171, 245]. У найбільшому на сьогодні дослідженні УДХК у дозі 17-23 мг/кг не сприяла статистично вірогідному зниженню потреби в трансплантації печінки, ХКА чи загальної смертності [246]. Багатоцентрове контрольоване дослідження, проведене за участю 150 пацієнтів, які отримували високі дози УДХК (28-30 мг/кг/добу) або плацебо, було припинено достроково через безрезультатність [229]. За даними аналізу post hoc, використання УДХК пов’язано з підвищенням ризику виникнення серйозних небажаних явищ [247]. Окрім того, в пацієнтів із ПСХ та виразковим колітом високі дози УДХК асоційовані з підвищеним ризиком розвитку колоректальної неоплазії [248]. Тому застосування високих доз УДХК не рекомендовано.
У попередніх настановах Американської асоціації з вивчення захворювань печінки (AASLD, 2010) не рекомендовано використовувати УДХК як медикаментозну терапію ПСХ [249]. Однак нещодавні дані, отримані в дорослих, показали, що значуще зниження ЛФ асоціюється зі значно кращими результатами, включаючи:
Положення настанови
- Пацієнтам із підозрою на ПСХ потрібно провести 3D-МРТ/MРХПГ з аксіальними зображеннями T1w, T2w і контрастним підсиленням із метою виявлення холангіографічних ознак ПСХ, включаючи внутрішньопечінкові та/або позапечінкові стриктури, що чергуються з нормальними або незначно розширеними сегментами.
- У пацієнтів із підозрою на ПСХ та нормальними результатами МРТ/МРХПГ із високою роздільною здатністю слід розглянути доцільність біопсії печінки з метою виключення ПСХ дрібних проток.
Пацієнтів із сумнівними результатами МРТ/МРХПГ варто спрямувати до високоспеціалізованого центру для повторного проведення високоякісної МРТ/МРХПГ або біопсії печінки. Проведення повторної МРТ/МРХПГ можна розглянути через 1 рік, якщо діагноз залишається неясним. - У діагностиці ПСХ слід уникати ЕРХПГ.
- У всіх пацієнтів з імовірним ПСХ слід визначити сироватковий рівень IgG4 з метою виключення IgG4-склерозивного холангіту.
- Не варто проводити біопсію печінки в пацієнтів із типовими холангіографічними ознаками на МРТ/МРХПГ, за винятком випадків, коли існують побоювання щодо overlap-синдрому з AIГ.
- Ілеоколоноскопію з біопсією потрібно виконати пацієнтам з уперше встановленим діагнозом ПСХ і відсутністю попереднього діагнозу ЗЗК. У пацієнтів без ЗЗК слід розглядати повторну ілеоколоноскопію з 5-річним інтервалом або виконати негайно за наявності ознак, що вказують на ЗЗК.
- Стан пацієнтів із ПСХ дрібних проток слід моніторувати за допомогою МРТ/МРХПГ що 3-5 років із метою скринінгу патології великих проток.
- Потрібно виконати стратифікацію ризику, визначити стадію фіброзу при діагностиці ПСХ та проводити їх регулярно під час контрольних оглядів.
- Щільність печінки, вимірювана за допомогою транзиторної еластографії або магнітнорезонансної еластографії, нині вважається найкращим методом оцінки фіброзу печінки при ПСХ.
- Проведення біопсії печінки з метою визначення стадії фіброзу не рекомендоване.
- Варто враховувати можливість усіх пацієнтів із ПСХ брати участь у клінічних дослідженнях.
- Пацієнтам, які не підходять або не зацікавлені брати участь у клінічних дослідженнях, зі стійко підвищеним рівнем ЛФ або ГГТ, можна рекомендувати УДХК 13-23 мг/кг/добу та продовжити лікування за умови значного зниження/нормалізації ЛФ (ГГТ у дітей) та/або покращення симптомів через 12 місяців лікування.
- Нині недостатньо доказових даних, щоб рекомендувати використовувати пероральний ванкоміцин для лікування ПСХ.
- Хворих на ПСХ із супутнім АІГ слід лікувати згідно з рекомендаціями AASLD щодо терапії АІГ.
- Антибіотики слід застосовувати за бактеріального холангіту з урахуванням даних МРХПГ для виключення значущої стриктури.
- ЕРХПГ необхідно виконати при бактеріальному холангіті за недостатньої відповіді на антибіотики.
- Показано проведення верхньої ендоскопії з метою скринінгу варикозних змін стравоходу, якщо щільність печінки >20 кПа за даними транзиторної еластографії або кількість тромбоцитів ≤150 000/мм3.
- Скринінг ХКА, карциноми жовчного міхура слід виконувати щорічно та включати зображення черевної порожнини, бажано за допомогою МРТ/МРХПГ із/без сироваткового рівня CA 19-9. Спостереження за хворими ПСХ віком <18 років і ПСХ дрібних проток не рекомендоване.
- Внутрішньопротокові зразки тканини зі значущих стриктур для цитології та FISH слід отримувати регулярно під час ЕРХПГ.
- Варто розглянути можливість холецистектомії у хворих на ПСХ із поліпами жовчного міхура >8 мм, бажано у високоспеціалізованому центрі при прогресивному перебігу хвороби. Поліпи ≤8 мм можна контролювати за допомогою ультразвукового дослідження що 6 місяців.
- Хворі на ПСХ із цирозом печінки мають проходити обстеження на гепатоцелюлярну карциному відповідно до поточних рекомендацій AASLD.
- У хворих на ПСХ та ЗЗК слід розпочати проводити колоноскопію з високою роздільною здатністю та біопсією у віці 15 років і повторювати її що 1-2 роки з метою оцінки дисплазії товстої кишки.
Література
Bowlus C.L., Arrivé L., Bergquist A., et al. AASLD practice guidance on primary sclerosing cholangitis and cholangiocarcinoma. Hepatology. 2023; 77 (2): 659-702. doi: 10.1002/hep.32771.
Освітньо-практичний журнал Gastro Practice №1 2024р.