Персоналізований підхід до діагностики та лікування хворих на хронічний панкреатит
Підготувала канд. мед. наук Ірина Жакун
Процес тривалого запалення паренхіми підшлункової залози (ПЗ) може ускладнюватися розвитком фіброзу, структурними змінами її протоки, зниженням екзокринної й ендокринної функцій і виникненням інших ускладнень. Це погіршує якість життя та знижує працездатність пацієнтів із хронічним панкреатитом (ХП). Частота його становить від 5 до 10 на 100 тисяч населення країн Європи.
Дослідники з медичних університетів Німеччини проаналізували дані сучасної медичної літератури щодо стратегій діагностики та лікування пацієнтів з ХП. Метою роботи науковців було встановити обсяг діагностичних обстежень і визначити терапевтичні підходи до лікування ХП різної етіології, а також запропонувати стратегію клінічного спостереження ефективності лікування ускладнень цієї хвороби [14].
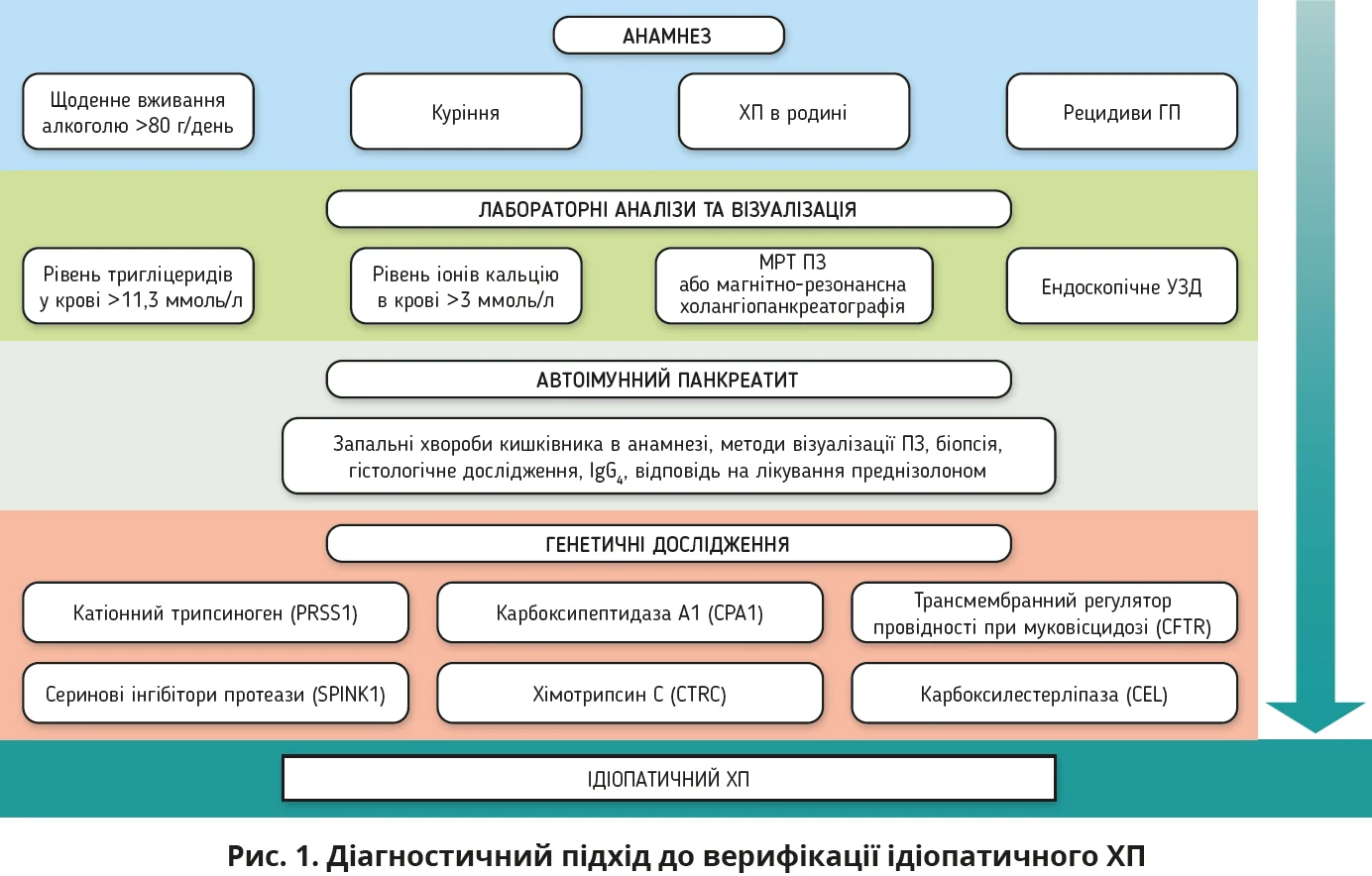
У міжнародних дослідженнях найчастіше використовується класифікація панкреатитів TIGAR-O (Toxic, Idiopathic, Genetic, Autoimmune, Recurrent acute, Obstructive pancreatitis), яка враховує основні етіологічні фактори ХП, дає змогу обрати відповідну стратегію лікування залежно від причини виникнення. Згідно з цією класифікацією виділяють токсичний (метаболічний), ідіопатичний, генетичний (спадковий), автоімунний, рецидивний гострий та обструктивний панкреатити. Наявність додаткових факторів ризику, як-от нераціональне харчування, обтяжена спадковість, обструкція загальної жовчної протоки, підвищений рівень тригліцеридів крові, куріння, спричиняють виникнення ХП та його ускладнень.
Основною причиною токсичного ХП є зловживання алкоголем. Відомо, що споживання близько 80 г алкоголю щодня впродовж 6-12 років призводить до розвитку ХП. За результатами обстеження, серед майже півтори тисячі чоловіків, які регулярно вживали алкоголь, діагноз ХП було встановлено щонайменше в 3% випадків [15].
ХП вважають ідіопатичним у тих клінічних ситуаціях, коли повний комплекс обстежень пацієнта не допоміг встановити причину виникнення хвороби (рис. 1).
Аналіз результатів дослідження особливостей ХП довів сприятливіший клінічний перебіг ідіопатичного ХП та меншу кількість ускладнень порівняно з панкреатитами, причини яких були відомі [3].
Генетичні фактори, що впливають на розвиток ХП, являють собою мутації в генах, які кодують ферменти та білки, котрі беруть участь у регуляції роботи ПЗ і в процесах травлення. Одними з найважливіших факторів розвитку спадкового ХП є генетичні зміни в катіонному трипсиногені (PRSS1). Мутація гена спричиняє передчасну активацію ферментів з пошкодженням тканин ПЗ та рецидивні напади гострого панкреатиту (ГП), який із часом переходить у ХП. Існують численні інші мутації генів, які порушують процес утворення протеїнів і змінюють функцію ферментів у хворих на ХП: інгібіторів серинової протеази Kazal-Type 1, карбоксипептидази A1, хімотрипсину C, карбоксилестерліпази, трансмембранного регулятора провідності при муковісцидозі (CFTR), панкреатичної ліпази та ін. Чинні рекомендації пропонують призначати генетичне тестування пацієнтам з діагнозом ХП молодше 20 років і пацієнтам, у сімейному анамнезі яких є або були родичі, хворі на ХП [7].
Європейські дослідження виявили, що 9% пацієнтів з ідіопатичним ХП мали автоімунний механізм розвитку цієї хвороби. Згідно з Міжнародними консенсусними діагностичними критеріями (ICDC) автоімунний панкреатит (АП) 1-го типу класифікується як захворювання, пов’язане з IgG4, тоді як АП 2-го типу пов’язаний із запальними хворобами кишківника. Типи АП розрізняють за допомогою гістологічного дослідження.
Виявлено, що ХП розвивається в кожного десятого пацієнта з першим епізодом ГП та в 36% хворих на рецидивний ГП. Основними причинами переходу ГП у хронічний вважають уживання алкоголю й куріння.
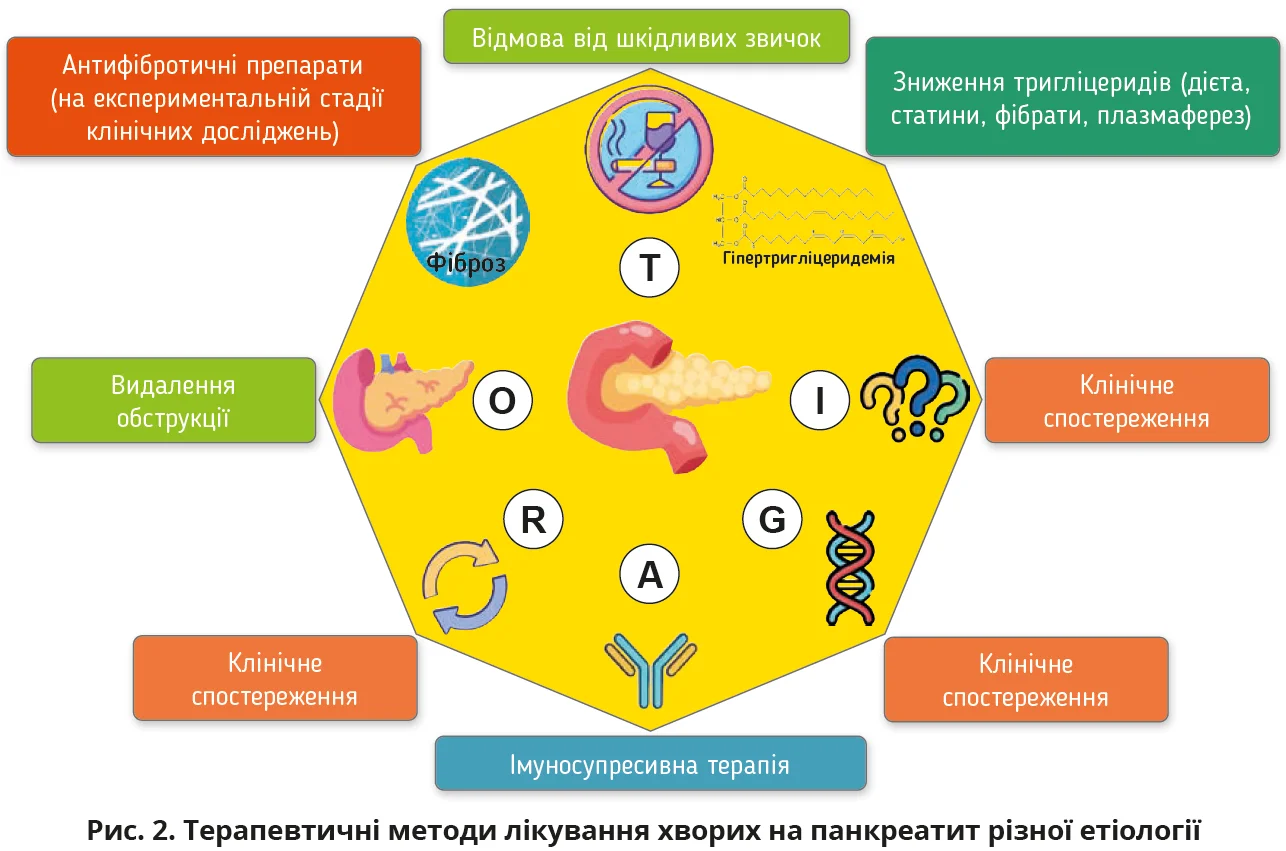
Оптимальним підходом до терапевтичного лікування ХП є раннє усунення його причини (рис. 2).
З наведених у класифікації TIGAR-O видів ХП терапевтичному лікуванню піддаються токсичний ХП, клінічні стани, пов’язані з дисфункцією CFTR, АП та ХП, асоційований з обструкцією протоки ПЗ.
Пацієнтам з ХП, спричиненим алкоголем, пояснюють необхідність повного припинення його вживання. Якщо пацієнт дотримується рекомендацій, це знижує частоту загострень та ускладнень ХП [5]. Структуровані програми припинення вживання алкоголю є перспективними, але навіть у спеціалізованих клініках немає затверджених стандартних процедур [12].
Поширеність куріння нікотинових виробів пацієнтами з ХП вища, ніж у загальній популяції. Хоча проспективні дослідження відсутні, всім пацієнтам незалежно від етіології ХП рекомендується припинити курити. Попри застосування антинікотинових програм, відмова від куріння пацієнтів з ХП залишається надзвичайно складним завданням. Аналіз бази даних Кокранівської бібліотеки показав, що 8,5% курців припинили паління цигарок завдяки психотерапевтичним методам лікування, 16,3% – за допомогою нікотинозамісної терапії та 18% – фармакологічної терапії [6].
Лікування панкреатиту в пацієнтів з гіпертригліцеридемією охоплює методи зниження рівня ліпідів у плазмі крові: дієтотерапію, призначення інсуліну та плазмаферез. Однак результати досліджень ефективності плазмаферезу неоднозначні. У проміжках між загостреннями панкреатиту призначають дієту з низьким умістом жирів і фармакологічне лікування гіпертригліцеридемії.
Пацієнти з генетичним типом ХП, які є носіями мутацій у гені CFTR, можуть мати клінічні прояви муковісцидозу або залишатися безсимптомними носіями [11]. У лікуванні пацієнтів з генетичним типом ХП та симптомами муковісцидозу застосування модуляторів CFTR покращує екзокринну функцію ПЗ та знижує частоту загострень панкреатиту. Водночас на сьогодні існує недостатня кількість досліджень ефективності лікування пацієнтів з ХП, пов’язаним із CFTR, тому оцінювання терапевтичного ефекту застосування модуляторів CFTR потребує детальнішого вивчення [8].
Одним з діагностичних критеріїв для АП є позитивна відповідь на стероїдну терапію. Однак АП 1-го типу часто супроводжується рецидивами та гормональною залежністю, що потребує тривалого підтримувального лікування стероїдами, азатіоприном або ритуксимабом [10].
У всіх випадках ХП внаслідок обструкції панкреатичної протоки пацієнт потребує консультації хірурга для визначення оптимального оперативного методу лікування.
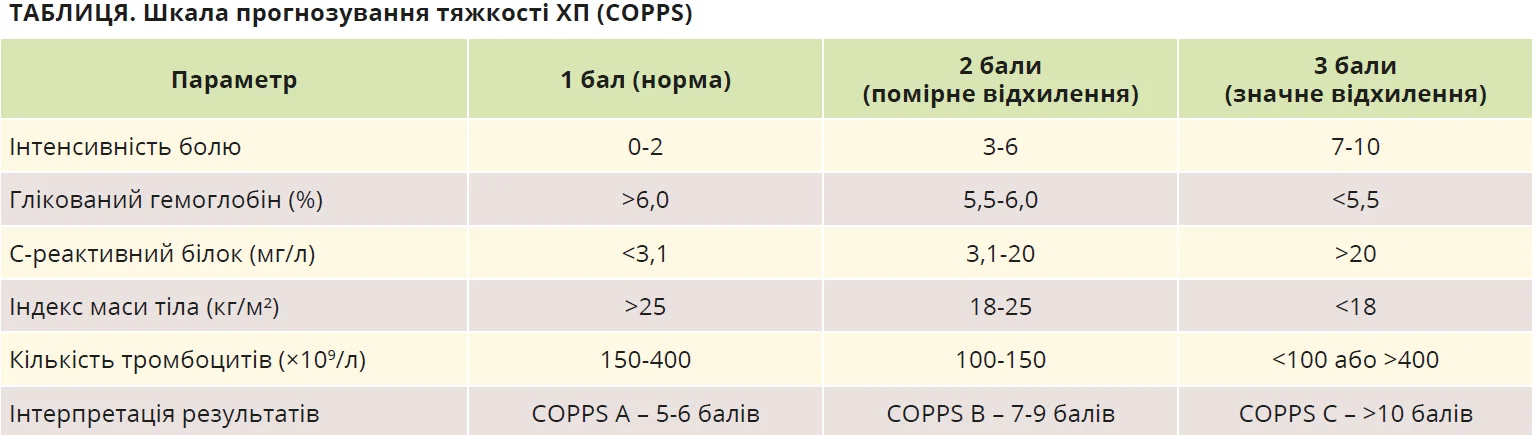
Міжнародних рекомендацій щодо спостереження хворих на ХП поки що не розроблено. Проте існує прогностична шкала COPPS (Chronic Pancreatitis Prognosis Score), створена для оцінювання ризику ускладнень і прогресування ХП, яка розроблена для прогнозування тяжкості перебігу ХП та ризику госпіталізацій упродовж року. Вона допомагає оцінити ефективність лікування, вчасно скеровувати пацієнтів до спеціалізованих медичних установ (табл.).
Пацієнти категорії A мають сприятливий прогноз, найменшу ймовірність госпіталізацій упродовж року, найменшу тривалість перебування в стаціонарі. У пацієнтів категорії B ризик несприятливого перебігу помірний: більша потреба в госпіталізаціях, довша тривалість порівняно з категорією А. У пацієнтів категорії C ризик високий: прогноз перебігу ХП несприятливий, найвища ймовірність частих і тривалих госпіталізацій [2].
Основною метою подальших обстежень пацієнтів з діагнозом ХП є раннє виявлення екзокринної недостатності ПЗ, цукрового діабету (ЦД) та раку ПЗ (рис. 3).
З метою верифікації наведених раніше ускладнень пацієнтам з ХП призначають трансабдомінальне ультразвукове дослідження (УЗД) [7].
Екзокринна недостатність ПЗ вважається пізнім ускладненням ХП і являє собою зменшення її секреторної функції або активності панкреатичних ферментів нижче рівня, що забезпечує нормальне травлення. Для підтвердження діагнозу використовується визначення фекальної еластази-1, але цей тест не завжди достатньо чутливий. Ефективнішим є дихальний тест з 13C-тригліцеридами. Крім точної діагностики зовнішньосекреторної недостатності, його використовують для моніторингу успішності замісної терапії панкреатичними ферментами. Однак цей тест доступний лише в спеціалізованих лабораторіях.
Динамічне спостереження за хворими на ХП має включати щорічне визначення екзокринної недостатності ПЗ [7]. Якщо в таких пацієнтів з’являються симптоми або лабораторні ознаки порушення травлення, варто призначити замісну терапію панкреатичними ферментами. У разі недостатньої ефективності ферментного лікування потрібно дослідити інші причини мальдигестії та мальабсорбції. Наприклад, важливо диференціювати екзокринну недостатність ПЗ від синдрому надмірного росту бактерій у тонкій кишці, який часто трапляється в пацієнтів з ХП та призводить до виникнення таких симптомів, як біль у животі, діарея, метеоризм, мальабсорбція та втрата ваги. Екзокринна недостатність супроводжується зниженням кількості протимікробних пептидів, що виробляються ПЗ та є важливими для підтримання кишкового мікробіому.
Одночасно з прогресуванням ХП виникають ускладнення: ЦД, екзокринна недостатність ПЗ, больовий синдром, скупчення рідини в ПЗ, підвищення ризику виникнення раку ПЗ.
ЦД може бути першим клінічним проявом ХП. У третини хворих на ХП діагностується вперше виявлений ЦД, ризик його виникнення зростає пропорційно тривалості хвороби. Останніми роками в медичній літературі дедалі частіше використовується термін «постпанкреатичний ЦД». Пацієнти з цим типом ЦД мають значно вищий ризик ускладнень порівняно з пацієнтами, які хворіють на ЦД 2-го типу. Це пов’язано з тим, що при постпанкреатичному ЦД контроль глікемії ускладнюється швидкими коливаннями між гіпер- і гіпоглікемією, оскільки порушується контррегуляторне вироблення глюкагону та соматостатину.
Основою фармакологічного лікування постпанкреатичного ЦД є метформін та інсулін. Оскільки діабет, який виникає внаслідок хвороб екзокринної частини ПЗ, зокрема ХП, характеризується абсолютним дефіцитом інсуліну, призначення лікування метформіном може здаватися нелогічним. Однак частота виживання пацієнтів з постпанкреатичним ЦД, які приймали метформін, була вищою [4]. На відміну від ЦД 2-го типу, обмеження калорій таким хворим не рекомендується. Замісна терапія ферментами та приймання жиророзчинних вітамінів відіграють вирішальну роль у досягненні глікемічного контролю й підтриманні адекватного харчування пацієнтів з постпанкреатичним ЦД.
Найчастішою скаргою хворих на ХП будь-якої етіології є біль, провідну роль у патогенезі якого відіграють місцеві запальні та нейромодулювальні механізми [4]. Поетапна схема знеболення від Всесвітньої організації охорони здоров’я є базисом лікування пацієнтів з ХП. У разі, коли біль спричинений мальабсорбцією, лікування має включати замісну терапію ферментами ПЗ [7]. Якщо пацієнт оцінює інтенсивність болю як помірну, рекомендується використовувати неопіоїдні аналгетики. Також можливе їх поєднання з допоміжними медикаментами, які посилюють ефективність основних знеболювальних засобів. Зокрема, застосування прегабаліну дає змогу краще контролювати біль [9]. Канабіс і канабіноїди є відносно новими засобами в галузі знеболення. Кількість доказів ефективності похідних канабіноїдів для медичного використання при неонкологічному болю обмежена [13]. Щодо ХП рекомендовано обережність у призначенні цієї групи препаратів, оскільки в деяких випадках уживання канабісу асоціювалося з розвитком ГП [1].
Значна частина пацієнтів не може досягти адекватного контролю симптомів за допомогою лише фармакологічного лікування. Тривалість медикаментозного лікування больового синдрому визначається індивідуально та часто потребує консультації хірурга для розгляду можливості інтервенційних або хірургічних процедур. Якщо панкреатична протока розширена до 5 мм і більше через обструкцію, рекомендують інтервенційні ендоскопічні або хірургічні заходи щонайбільше після 6 місяців неефективного лікування. Якщо ендоскопічні процедури не покращують стану пацієнтів з обструктивним ХП впродовж 3 місяців, рекомендують хірургічне втручання [7].
У третини пацієнтів з ХП розвивається ускладнення у вигляді скупчення рідини в ділянці ПЗ. У разі виникнення таких симптомів, як біль, холестаз, обструкція панкреатичної протоки, або наявності ускладнень, пов’язаних з кістою ПЗ, – кровотечі, інфекції чи розриву стінки кісти – потрібне негайне інтервенційне втручання.
Найтяжчим ускладненням ХП є розвиток аденокарциноми ПЗ. Спадкова форма ХП пов’язана з підвищеним ризиком малігнізації на ґрунті хронічного запалення. Ризик розвитку аденокарциноми ПЗ зростає з віком: на 10% до 50 років і на 53% до 75 років. На підставі епідеміологічних даних німецькі національні настанови рекомендують проводити скринінг аденокарциноми ПЗ хворим на спадковий ХП починаючи від 40 років або від 20 років, якщо пацієнту вже встановлено діагноз спадкового ХП. Як основний метод скринінгу рекомендується щорічне ендоскопічне УЗД [7]. Отже, питання діагностики та лікування ускладнень ХП і надалі залишаються актуальними й потребують подальших досліджень.
Література
- Adenusi A.O., Magacha H.M., Nwaneki C.M., Asifat O.A., Annor E.N. Cannabis use and associated gastrointestinal disorders: a literature review. Cureus. 2023; 15 (7): e41825. doi: 10.7759/cureus.41825.
- Capurso G., Beyer G., Boninsegna E., Signoretti M., Stigliano S., et al. Development and validation of a prognostic model to assess the individual risk of chronic pancreatitis. Gastroenterology. 2017; 153 (6): 1544-1556. doi: 10.1053/j.gastro.2017.08.073.
- Cartelle L.A., Bocchino R., Shah I., et al. Natural history, clinical characteristics, and outcomes in idiopathic chronic pancreatitis. Gastro Hepatol. Adv. 2023; 2 (4): 449-453. doi: 10.1016/j.gastha.2023.01.005.
- Demir I.E., Friess H., Ceyhan G.O. Neural plasticity in pancreatitis and pancreatic cancer. Nat. Rev. Gastroenterol. Hepatol. 2015; 12 (11): 649-659. doi: 10.1038/nrgastro.2015.166.
- Göltl P., Murillo K., Simsek O., et al. Impact of alcohol and smoking cessation on the course of chronic pancreatitis. Alcohol. 2023; 119: 29-35. doi: 10.1016/j.alcohol.2023.11.006.
- Hartmann-Boyce J., Livingstone-Banks J., Ordóñez-Mena J.M., et al. Behavioural interventions for smoking cessation: an overview and network meta-analysis. Cochrane Database Syst. Rev. 2021; (1): CD013229. doi: 10.1002/14651858.CD013229.pub2.
- Löhr J.M., Domínguez-Munoz E., Rosendahl J., et al. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United Eur. Gastroenterol. J. 2017; 5 (2): 153-199. doi: 10.1177/2050640616684695.
- McKay I.R., Ooi C.Y. The exocrine pancreas in cystic fibrosis in the era of CFTR modulation: a mini review. Front. Pediatr. 2022; 10: 914790. doi: 10.3389/fped.2022.914790.
- Olesen S.S., Bouwense S.A.W., Wilder-Smith O.H.G., van Goor H., Drewes A.M. Pregabalin reduces pain in patients with chronic pancreatitis in a randomized, controlled trial. Gastroenterology. 2011; 141 (2): 536-543. doi: 10.1053/j.gastro.2011.04.003.
- Pretis N.D., Carlin M., Calderini E., et al. Clinical features and long-term outcomes of patients with type 2 autoimmune pancreatitis. United Eur. Gastroenterol. J. 2024; 12: 319-325. doi: 10.1002/ueg2.12504.
- Simmonds N.J., Southern K.W., Wachter de J., et al. ECFS standards of care on CFTR-related disorders: identification and care of the disorders. J. Cyst. Fibros. 2024; 23 (4): 590-602. doi: 10.1016/j.jcf.2024.03.008.
- Sissingh N.J., Umans D.S., Goudriaan A.E., et al. Alcohol reduction to reduce relapse in acute alcoholic pancreatitis – missed opportunities. Alcohol Alcohol. 2021; 56 (6): 678-682. doi: 10.1093/alcalc/agab014.
- Stockings E., Campbell G., Hall W.D., et al. Cannabis and cannabinoids for the treatment of people with chronic non-cancer pain conditions: a systematic review and meta-analysis of controlled and observational studies. Pain. 2018; 159 (10): 1932-1954. doi: 10.1097/j.pain.0000000000001293.
- von Widdern J.C., Rosendahl J., Ammer-Herrmenau C. Chronic and idiopathic pancreatitis: a personalized treatment approach. United Eur. Gastroenterol. J. 2025; 13 (1): 116-124. doi: 10.1002/ueg2.12741.
- Yadav D., Eigenbrodt M.L., Briggs M.J., Williams D.K., Wiseman E.J. Pancreatitis: prevalence and risk factors among male veterans in a detoxification program. Pancreas. 2007; 34 (4): 390-398. doi: 10.1097/mpa.0b013e318040b332.