Оновлення щодо стратегії внутрішньовенної інфузійної терапії при гострому панкреатиті
Переклала й адаптувала д-р мед. наук Лариса Стрільчук
Гострий панкреатит (ГП) являє собою гострий запальний процес підшлункової залози (ПЗ) із варіабельним перебігом, який може варіювати від нетяжкого самообмежувального до прогресивного тяжкого з поліорганною недостатністю й високою часткою захворюваності та смертності. Серед пацієнтів, госпіталізованих із ГП, 80% мають нетяжкий клінічний перебіг, натомість у інших 20% розвивається тяжка хвороба з показником смертності на рівні 20%.
Станом на сьогодні фармакотерапія ГП з доведеною ефективністю відсутня; проте внутрішньовенна інфузійна терапія (ІТ) є фундаментальним складником стартового підтримувального лікування, покликаного зменшити захворюваність і смертність пацієнтів із цим патологічним станом. Деякі дослідження, результати яких було опубліковано протягом останньої декади, викликали занепокоєння щодо ефективності та безпеки ранньої агресивної ІТ у лікуванні ГП. Велика кількість клінічних рекомендацій із терапії цього стану радять застосовувати потужну ранню ІТ, але надмірно агресивні інфузії можуть призвести до незадовільних клінічних наслідків, зокрема респіраторних ускладнень і абдомінального компартмент-синдрому. Метою цього огляду є оновлене узагальнення наявної доказової бази щодо стратегії ІТ, а також формування цілей лікування та моніторингу в пацієнтів із ГП.
Патофізіологічне підґрунтя
Смертність у разі тяжкого ГП переважно зумовлена недостатністю органів унаслідок надмірної активації прозапальних медіаторів і синдрому системної запальної відповіді (ССЗВ). Надмірна експресія запальних медіаторів (фактора некрозу пухлин-α, інтерлейкіну-6 і -8) ушкоджує ендотелій мікросудинного русла та збільшує проникність судин, що призводить до транссудації рідини з внутрішньосудинного простору в так званий третій простір і спричиняє дисфункцію органів. Іншими наслідками ГП є нудота та блювання, котрі в поєднанні з недостатнім уживанням рідини додатково зменшують внутрішньосудинний об’єм рідини. Крім того, при ГП збільшується вміст вазоактивних медіаторів і прокоагулянтних факторів (імовірно, під впливом прозапальних чинників), що спричиняє вазоконстрикцію капілярів та утворення мікротромбів. Порушення мікроциркуляції в ПЗ, зумовлене підвищеною проникністю капілярів, вазоспазмом й утворенням мікротромбів, має значущий вплив на ранніх стадіях хвороби та вважається вагомим чинником патогенезу некрозу ПЗ. У зв’язку із цим метою ефективної ІТ є відновлення дефіциту об’єму крові та перешкоджання мікроциркуляторним розладам на ранніх стадіях хвороби, що дає змогу запобігти місцевим і системним ускладненням.
Ступені тяжкості ГП і стратифікація ризику
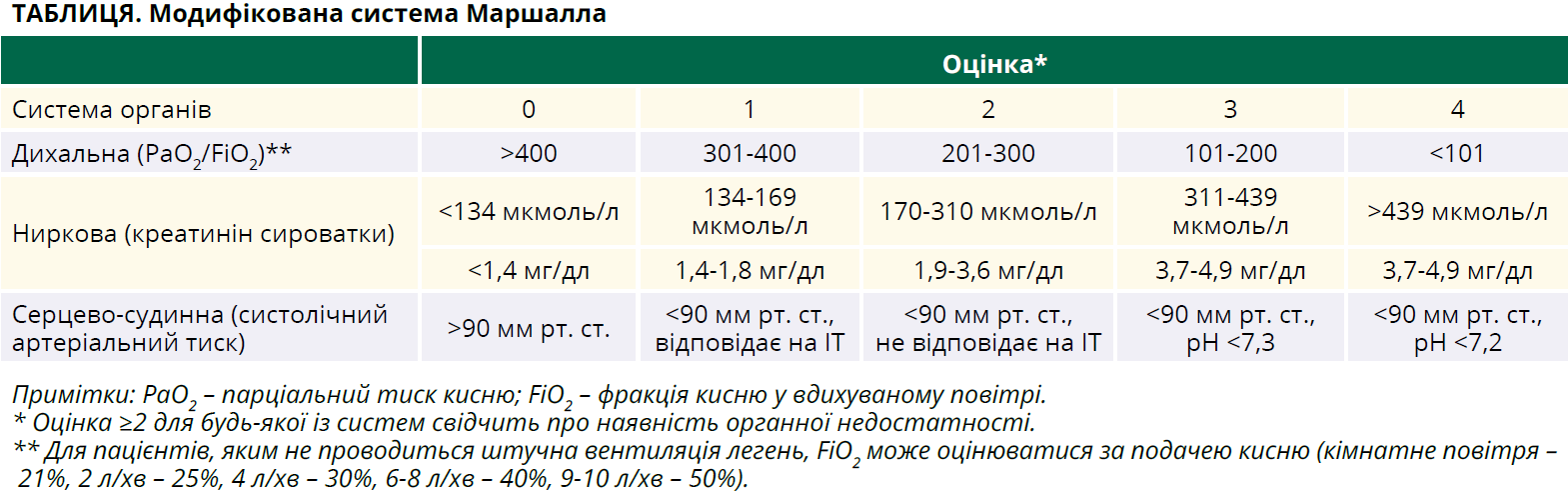
Оновлена Атлантська класифікація ГП поділяє це захворювання на два типи (інтерстиційний набряковий і некротичний) і три ступені тяжкості: незначна (без місцевих або системних ускладнень і недостатності органів); помірно тяжка (з наявністю місцевих або системних ускладнень та/або органною недостатністю, яка зникає впродовж 48 годин) і тяжка (з органною недостатністю, яка триває понад 48 годин). Інтерстиційний набряковий підтип зазвичай асоціюється з незначною тяжкістю, натомість некротичний панкреатит переважно відзначається в пацієнтів із помірно тяжким або тяжким перебігом хвороби. В аспекті органної недостатності слід оцінити стан трьох систем органів (дихальної, сечовидільної та кардіоваскулярної) за модифікованою системою Маршалла (табл.).
Для прогнозування тяжкості та планування лікування застосовують численні шкали. Оцінка за більш ранніми системами, як-от Ренсона чи Імрі-Глазго, має проводитися впродовж 48 годин після госпіталізації, що виходить за межі перших 12-24 годин стаціонарного лікування – критичного періоду, протягом якого виникає більшість випадків недостатності органів.
Шкала APACHE (The Acute Physiology and Chronic Health Examination) II, яка включає оцінку 12 рутинних фізіологічних показників, була розроблена для прогнозування тяжкості перебігу хвороби
та смертності в критично тяжких пацієнтів відділень інтенсивної терапії. Цю шкалу активно використовують у разі ГП, але вона є складною та громіздкою, що обмежує її застосування.
Шкалу BISAP (The Bedside Index for Severity in Acute Pancreatitis) було розроблено для прогнозування госпітальної смертності. За наявності кожного з перелічених нижче критеріїв протягом перших 24 годин після госпіталізації додається 1 бал: азот сечовини у крові >25 мг/дл, психічні розлади, ССЗВ, вік >60 років, наявність плеврального випоту. Смертність пацієнтів з оцінкою 0 балів становить <1%, з оцінкою 5 балів – 22%. За даними когортного дослідження, оцінка за BISAP ≥3 бали асоціюється з підвищеним ризиком органної недостатності та некрозу ПЗ.
Стратегія ІТ
ІТ є стандартом лікування ГП будь-якої тяжкості, оскільки дає можливість усунути гіповолемію та забезпечити належний внутрішньосудинний об’єм і, відповідно, адекватну перфузію тканин. Особливо важливою є підтримка гідратації на ранніх фазах хвороби, оскільки це дає змогу запобігти каскаду подій, що призводять до некрозу ПЗ.
Ретроспективне дослідження показало, що рання ІТ асоціювалася з меншою частотою ССЗВ й органної недостатності через 72 години. І навпаки, гемоконцентрація – маркер гіповолемії – асоціюється з розвитком некротичного панкреатиту й органної недостатності. Утім, станом на сьогодні вид інфузійного розчину, швидкість уведення, загальний об’єм і цілі ІТ чітко не визначені.
ІТ рекомендована всім пацієнтам із ГП будь-якої тяжкості. У багатоцентровому ретроспективному дослідженні за участю 1097 пацієнтів із тяжким панкреатитом інфузія >6 л розчинів упродовж перших 24 годин достовірно асоціювалася зі зниженням смертності. Слід зауважити, що таке лікування може мати обмеження, пов’язані з перевантаженням рідиною. У більшості досліджень ІТ критеріями виключення виступали анамнез хвороб нирок, серцева недостатність >ІІ класу за класифікацією Нью-Йоркської асоціації серця (NYHA), хронічне захворювання легень, що потребувало оксигенотерапії, активна гостра інфекція, гіпер- і гіпонатріємія, гіперкаліємія. Такі пацієнти потребують індивідуалізованого лікування та ретельного моніторингу.
Розчинами вибору для регідратації є ізотонічні кристалоїди, до яких належать фізіологічний розчин (ФР) і збалансовані/буферизовані кристалоїди. ФР і Рінгер-лактатний розчин (РЛР) є найчастішими засобами першої лінії при ГП. Уміст хлору у ФР (154 мекв/л) є вищим, аніж у РЛР (109 мекв/л) і плазмі крові людини (94-111 мекв/л), тому інфузія ФР зазвичай спричиняє гіперхлоремічний метаболічний ацидоз. Гіперхлоремія зменшує швидкість кровоплину в нирках і перфузію кори нирок, підсилює запалення нирок і може спричиняти їх гостре ушкодження. Метааналіз Zhou та співавт. включав 4 рандомізовані контрольовані дослідження, котрі порівнювали РЛР і ФР. Було виявлено, що в групі РЛР ризик помірно тяжкого / тяжкого панкреатиту був удвічі нижчим, окрім того, ці пацієнти рідше потребували госпіталізації до відділення інтенсивної терапії та мали локальні ускладнення (перипанкреатичний випіт або некроз, панкреонекроз, псевдоцисти ПЗ). Загалом сучасна доказова база доводить переваги збалансованих кристалоїдних розчинів над ФР. Натомість застосування колоїдів (гідроксиетилкрохмалю – ГЕК) слід уникати, оскільки ці розчини не дають переваг у рівні смертності та потенційно підвищують ризик органної недостатності. За даними великого контрольованого дослідження, використання ГЕК в умовах відділення інтенсивної терапії асоціювалося зі збільшенням застосування нирковозамісної терапії.
Доведених переваг не має й розчин людського альбуміну. Застосування цього розчину не лише не зменшує госпітальну смертність, а й асоціюється з більшою тривалістю стаціонарного лікування та лікування у відділенні інтенсивної терапії.
Швидкість та об’єм інфузії
Хоча значна частка рекомендацій схиляють лікарів до ранньої агресивної ІТ, оптимальний об’єм і швидкість інфузії досі є дискутабельними питаннями. Станом на сьогодні період ранньої ІТ скорочено до 4-6 годин після звернення до лікарні. Велике багатоцентрове дослідження Singh і співавт. продемонструвало, що рання ІТ в об’ємі >1 л у перші 4 години асоціювалася з достовірно меншою потребою в подальших лікувальних заходах, аніж ІТ <0,5 л. Інші автори розрахували, що при нетяжкому панкреатиті в перші 48 годин слід увести 3,7 л розчинів, а при тяжкому – 5,6 л. Агресивнішої ІТ потребують молоді пацієнти, особи з високим гематокритом, високим рівнем глюкози крові, оцінкою системної запальної відповіді ≥2 й анамнезом зловживання алкоголем.
Із 2009 р. результати досліджень практично одностайно демонструють, що агресивна ІТ (10-15 мл/кг/год) асоціюється з більшою смертністю та частотою ускладнень (дихальної недостатності, абдомінального компартмент-синдрому, сепсису), ніж ІТ у режимі 5-10 мл/кг/год. Масштабне рандомізоване контрольоване дослідження WATERFALL, яке включало пацієнтів із нетяжким панкреатитом, порівнювало ІТ у режимі болюс 20 мл/кг + інфузія 3 мл/кг/год і болюс 10 мл/кг (лише за умови гіповолемії) + інфузія 1,5 мл/кг/год. Агресивний режим ІТ асоціювався з утричі вищою частотою перевантаження рідиною (20,5% проти 6,3%) та відсутністю будь-яких переваг. Утім, оскільки остаточні високоякісні докази відсутні, різні рекомендації радять різні режими ІТ при ГП. Американський коледж гастроентерології рекомендує вводити 250-500 мл/год у перші 12-24 годин лікування. Японські рекомендації радять на ранніх стадіях ГП вводити інфузійні розчини в об’ємі 150-600 мл/год для пацієнтів із шоком і дегідратацією та 130-150 мл/год – для осіб без дегідратації. Оновлені японські рекомендації радять застосовувати агресивну ІТ, але не вказують чітких цифр об’єму розчинів.
З іншого боку, Американська гастроентерологічна асоціація та Міжнародна асоціація панкреатології / Американська панкреатологічна асоціація радять застосовувати ІТ відповідно до встановлених цільових показників. Як стартову швидкість уведення рекомендовано використовувати 5-10 мл/кг/год.
Загалом на підставі наявних доказів автори огляду рекомендують застосовувати помірковану стратегію ІТ, розпочинаючи введення РЛР зі швидкістю 1,5 мл/кг/год у перші 24-48 годин. Перед цим пацієнтам із помірно тяжким або тяжким панкреатитом, гіповолемією, ознаками дегідратації, гострим ушкодженням нирок або несприятливими предикторними чинниками (рівнем азоту сечовини крові >25 мг/дл або гематокритом ≥44%) доцільно ввести болюс розчину в режимі 10-20 мл/кг протягом 1-2 годин.
Цілі та моніторинг
Метою ІТ є корекція гіповолемії та покращення перфузії тканин і органів для зменшення ускладнень. Пацієнти з панкреатитом потребують регулярної оцінки волемії для балансування ризиків перевантаження об’ємом і, навпаки, гіповолемії. З цією метою застосовуються визначення гематокриту, азоту сечовини крові, рівнів креатиніну та лактату.
Підвищення азоту сечовини є маркером тяжкого перебігу хвороби, а його зниження порівняно з вихідним рівнем свідчить про покращення ниркової перфузії й адекватну ІТ. Оскільки гемоконцентрація є несприятливим процесом, доцільно підтримувати гематокрит на рівні <44%.
В осіб із тяжким панкреатитом і недостатністю органів потрібний інвазивний моніторинг волемії, наприклад, за допомогою тесту з пасивним підніманням ніг. Міжнародна асоціація панкреатології / Американська панкреатологічна асоціація радять застосовувати для контролю ІТ ≥1 з таких цільових показників: 1) неінвазивні клінічні цільові показники (частота серцевих скорочень <120/хв, середній артеріальний тиск – 65-85 мм рт. ст., об’єм сечі >0,5-1 мг/кг/хв; 2) інвазивні клінічні показники (варіабельність ударного об’єму, внутрішньогрудний об’єм крові); 3) біохімічні показники (гематокрит на рівні 35-44%).
Висновки
ІТ є основним методом лікування ГП. Новою парадигмою цього методу є неагресивна ІТ, яка передбачає першопочаткове введення РЛР до досягнення цільових показників: середнього артеріального тиску ≥65 мм рт. ст. й об’єму виділеної сечі ≥0,5 мл/кг/год. Доказова база для вибору оптимальної стратегії подальшої ІТ наразі недостатня. Адаптувати об’єм ІТ можна за допомогою визначення гематокриту в динаміці з підтримкою цільового показника <44%.
Література
Yaowmaneerat T., Sirinawasatien A. Update on the strategy for intravenous fluid treatment in acute pancreatitis. World J. Gastrointest. Pharmacol. Ther. 2023; 14 (3): 22-32. doi: 10.4292/wjgpt.v14.i3.22.