Комбінація альверину/симетикону при синдромі подразненого кишківника: патогенетичні впливи та доказовість
Автор: Ігор Миколайович СКРИПНИК, доктор медичних наук, проректор із науково-педагогічної роботи та післядипломної освіти, професор кафедри внутрішньої медицини № 1 Полтавського державного медичного університету, президент ГО «Українська гастроентерологічна асоціація», член Комітету національних асоціацій Європейської гастроентерологічної асоціації
Основні характеристики та патогенетичні механізми синдрому подразненого кишківника
Синдром подразненого кишківника (СПК) – це функціональний розлад, що відзначається появою болю в животі, пов’язаного з дефекацією та/або зміною випорожнень (закреп, діарея) [1]. СПК характеризується хронічним перебігом і відсутністю специфічних маркерів. Діагноз установлюється на підставі Римських критеріїв ІV (2016) за відсутності «червоних прапорців»: поява симптомів після 50 років; прогресивне погіршення симптомів; незрозуміла втрата апетиту або схуднення; нічна діарея; сімейний анамнез раку товстої кишки, целіакії чи запальних захворювань кишківника; кров у калі або мелена; нез’ясована етіологія залізодефіцитної анемії; абдомінальна пухлина; асцит; лейкоцитоз; лихоманка [2].
Основним симптомом є біль у животі, який може бути постійним або періодичним і виникає не менш ніж 1 раз на тиждень. Зазвичай біль локалізується внизу живота чи в лівому нижньому квадранті. Біль може бути різким, спастичним, але практично ніколи не будить пацієнта вночі. Біль посилюється після їди та пов’язаний із дефекацією – може посилюватися або зменшуватися. У разі діареї випорожнення водянисті або напіврідкі; частота випорожнень збільшується, їм передують швидкі позиви до дефекації; вказані симптоми зазвичай виникають після їди, у відповідь на стрес або вранці. При закрепах частота випорожнень знижується. Кал твердий, із грудками, дефекація утруднена чи супроводжується відчуттям неповного випорожнення. Деякі пацієнти відзначають чергування періодів діареї та закрепу. Інші можливі симптоми: здуття живота, слиз у калі, нудота, блювання, печія [1].
Найсучаснішим інструментом діагностики СПК є критерії Римського консенсусу IV (2016): рецидивний біль у животі, що виникає в середньому ≥1 день на тиждень упродовж останніх 3 місяців за наявності ≥2 із таких критеріїв: 1) біль, пов’язаний із дефекацією, котра посилює або зменшує його; 2) біль, пов’язаний зі зміною частоти випорожнень; 3) біль, пов’язаний зі зміною зовнішнього вигляду калу. Важливо, щоб симптоми спостерігалися принаймні 6 місяців до встановлення діагнозу. За Римськими критеріями IV СПК класифікується на 4 підтипи (рис. 1) [3].
Дані щодо поширеності СПК дуже варіабельні – від 1,1 до 45% [4]. Результати Глобального дослідження Римського фонду вказують, що за умови використання критеріїв Римського консенсусу IV поширеність СПК істотно нижча порівняно з критеріями Римського консенсусу ІІІ: 4,1% проти 10,1% у 26 країнах, де проводилося інтернет-опитування, та 1,5% проти 3,5% у 7 країнах, де опитування проводилося вдома [5].
Від СПК частіше потерпають жінки молодого та середнього віку (співвідношення жінки : чоловіки сягає 2-2,5:1) [6]. Цей стан асоціюється з депресією, зниженням працездатності та якості життя, потребою частого звернення по медичну допомогу, значними економічними витратами [7].
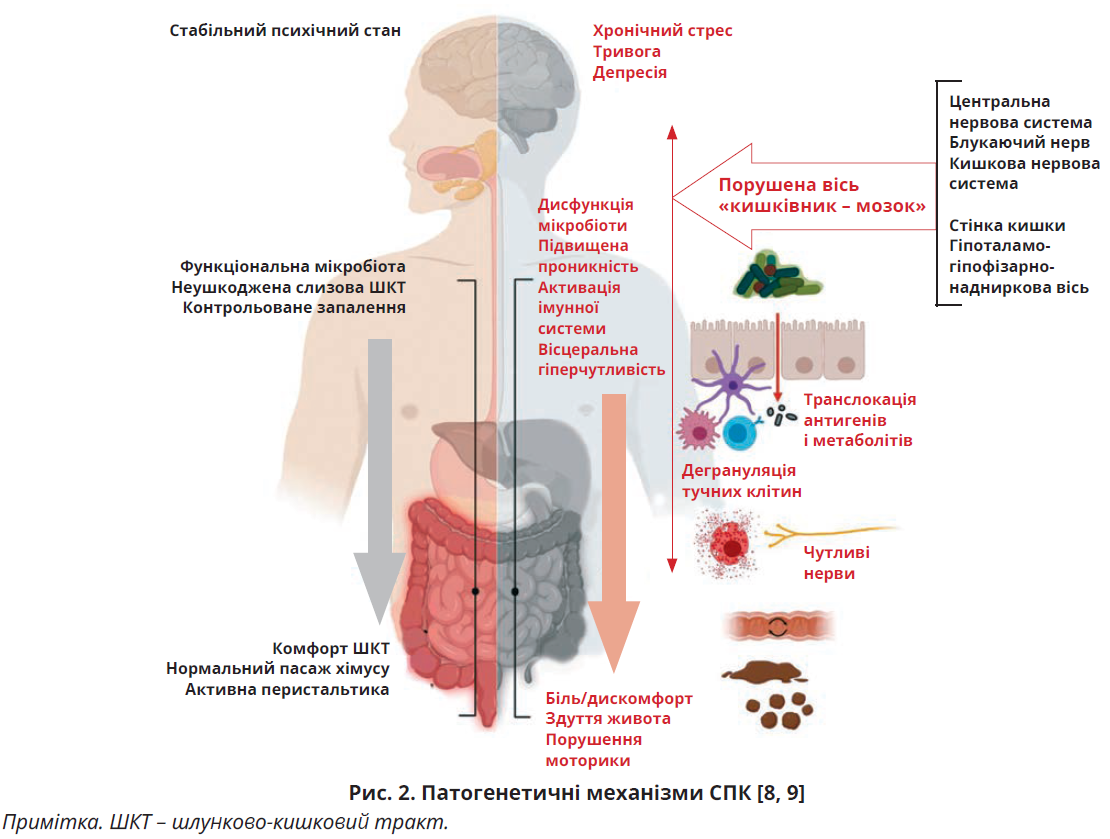
Патофізіологія СПК багатофакторна та недостатньо вивчена. Важливе значення мають генетичні, психологічні, дієтичні, гормональні й запальні чинники та склад кишкової мікробіоти (рис. 2) [8, 9].
Дисфункція осі «кишківник – мозок». Основним каналом зв’язку між мозком і кишківником, а також кишковою мікробіотою є блукаючий нерв. Разом із симпато-адреналовою системою він становить вегетативну нервову систему. Симпато-адреналова система та гіпоталамо-гіпофізарно-наднирникова вісь відповідають за реакцію на стрес. Зниження парасимпатичної або підвищення симпатичної активності часто спостерігається в осіб з СПК та може спричинити спотворення вегетативних рефлексів, надмірну чутливість до шлунково-кишкових стимулів і порушення моторики [9].
Зміна сприйняття фізіологічних подразників.
У кишківнику больові рецептори містяться в м’язовій стінці. Отже, притаманний СПК біль найчастіше зумовлений спастичним скороченням м’язів кишки або розтягненням кишки внаслідок метеоризму. Серед регуляторів моторної функції кишківника найбільше значення має серотонін-5-гідрокситриптофан (5-НТ). Серотонін також є нейротрансмітером, який впливає на настрій і психічний стан, бере участь у регуляції функції судин. Активність серотоніну реалізується через 5-НТ-рецептори.
У відповідь на хімічне або механічне подразнення кишки, наприклад унаслідок транзиту хімусу або зміни тиску в просвіті кишки, серотонін вивільняється з ентерохромафінних клітин у кров, потім потрапляє в просвіт кишки, де всмоктується. У тонкій кишці серотонін стимулює скорочення циркулярних м’язів протягом першої манометричної фази, що надалі активує швидкі моторні комплекси та запускає перистальтику; в товстій кишці серотонін викликає фазові скорочення, котрі забезпечують моторику. Серотонін здатний активувати вагусні рефлекси – перистальтичні, секреторні та судинорозширювальні [10].
Поріг чутливості больових рецепторів здатна знижувати низка медіаторів – гістамін, серотонін, простагландини, лейкотрієни. Проте серотонін вважається основним медіатором гіпералгезії при СПК. Посилене вісцеральне сприйняття фізіологічних подразників спостерігається у 20-60% пацієнтів з СПК [11]. Гіперчутливість до механічного розтягнення кишківника притаманна пацієнтам з СПК-Д та позитивно корелює з тяжкістю симптомів [12]. Знижене вісцеральне сприйняття мають близько 20% пацієнтів з СПК (частіше з СПК-З), причому ступінь нечутливості корелює з метеоризмом [13].
Порушення транзиту в товстій кишці виникає в 10-20% пацієнтів з СПК-З і СПК-ЗД, а в пацієнтів з СПК-Д – у 25-45% випадків [14, 15]. Проте навіть у пацієнтів із нормальним транзитом можлива аномальна моторика натще та після їди [16]. Пацієнти з СПК-З демонструють знижену моторику, менше високоамплітудних скорочень товстої кишки та затримку транзиту, тоді як у пацієнтів з СПК-Д моторика підвищена, амплітуда поширення скорочень вища, транзит прискорений. Час проходження калових мас товстою кишкою обернено корелює з консистенцією та частотою випорожнень [15]. Суб’єктивні симптоми болю в животі, здуття живота, метеоризму не корелюють із транзитом товстою кишкою, але об’єктивне збільшення окружності живота прямо корелює з часом проходження кишківником та обернено – з консистенцією калу [17]. Високоамплітудні скорочення в пацієнтів з СПК-Д пов’язані з болем у животі. Рівень серотоніну зазвичай високий у пацієнтів з СПК-Д та низький – у пацієнтів з СПК-З [18, 19].
Запалення слизової оболонки виникає внаслідок пошкодження епітеліального бар’єра, дисбіозу, стресу й імунної відповіді. Після епізоду інфекційного гастроентериту іноді виникає СПК [20].
Для пацієнтів з СПК притаманне збільшення кількості тучних клітин у товстій і тонкій кишках [21, 22].
Тяжкість і частота абдомінального болю корелює з наявністю активованих тучних клітин у безпосередній близькості від нервових закінчень у слизовій оболонці кишківника [23]. Підвищена проникність у пацієнтів із постінфекційним СПК та СПК-Д корелює з вісцеральною чутливістю й тяжкістю симптомів [24, 25].
Зміни кишкового мікробіому внаслідок інфекції або застосування антибіотиків асоціюються з виникненням СПК [20, 26]. Склад кишкового мікробіому відіграє важливу роль у процесах моторики травного тракту, вісцеральної чутливості, кишкової проникності та консистенції калу. Внаслідок життєдіяльності мікроорганізмів у просвіті кишки постійно утворюється невелика кількість газів, які є фізіологічним стимулятором скорочення гладких м’язів кишки й формування перистальтичної хвилі, результатом якої є акт дефекації та відходження надлишку газів. За наявності спазму м’язів кишка втрачає нормальну перистальтичну активність, що зменшує відходження газів. Накопичення газів збільшує тиск у просвіті кишки, замикаючи хибне коло посилення болю [27]. Бактерійна інфекція збільшує кишкову проникність, що спричиняє проникнення харчових антигенів із подальшою активацією в травному тракті імунної відповіді, опосередкованої IgE, що призводить до вивільнення гістаміну, зміни моторики та вісцеральної гіперчутливості [28].
Роль спазмолітиків у лікуванні СПК
У зв’язку з тим, що СПК суттєво погіршує якість життя пацієнтів, основною метою лікування є контроль симптомів [29]. Настанови Британського гастроентерологічного товариства рекомендують призначати як засоби першої лінії терапії спазмолітики в разі домінування болю або змішаних симптомів [7]. Спазмолітики зменшують асоційований з СПК біль шляхом пригнічення скоротливості стінки кишки та протидіють розладам випорожнень, збільшуючи час транзиту товстою кишкою. Існує декілька незалежних механізмів міорелаксації гладких м’язів травного тракту: 1) блокування рецепторів або каналів, які відповідають за транспорт іонів Са2+; 2) блокування активності 5-НТ-рецепторів, зокрема підтипів, які переважають у травному тракті, – 5-HT1, 5-НТ3, 5-НТ4 та 5-НТ7, що обмежує небажані впливи, пов’язані з блокуванням інших типів серотонінових рецепторів; 3) блокування ферменту фосфодіестерази, яка відповідає за енергетичне забезпечення скорочення, розщеплюючи цАМФ [30]. Спазмолітики, які поєднують декілька механізмів дії, зазвичай демонструють кращий терапевтичний ефект.
M.A. Martínez-Vázquez і співавт. провели систематичний огляд і метааналіз даних 23 рандомізованих контрольованих клінічних досліджень, які стосувалися застосування спазмолітиків як монотерапії або в комбінації з іншими засобами для полегшення симптомів СПК. Загалом включено 2585 пацієнтів. Досліджуваними спазмолітиками були альверину цитрат, альверину цитрат / симетикон, гіосцин, дицикломін, мебеверин, отилоній, пінаверію бромід, пінаверію бромід / симетикон, тримебутин, феноверин. За оцінкою пацієнтів, усі спазмолітики мали перевагу над плацебо або відсутністю лікування; проте статистичної значущості досягли лише отилоній і комбінація альверину/симетикону. Вказані засоби також істотно зменшували суб’єктивне відчуття болю в животі порівняно з плацебо. Проведений дослідниками метааналіз підтвердив достовірне покращення загального стану та зменшення абдомінального болю під впливом отилонію й комбінації альверину/симетикону (рис. 3). Окрім того, вказані препарати продемонстрували найкращі показники NNT (number needed to treat) – кількості пацієнтів, яку необхідно пролікувати для досягнення результату принаймні в одного з них (рис. 3). Варто відзначити значну варіабельність показників NNT як для препаратів, що загалом використовуються при СПК (від 4 до 20), так і для спазмолітиків (від 3 до 25). Спазмолітики всіх класів були безпечними [31].
Роль комбінації альверину/симетикону в лікуванні СПК
Як зазначалося вище, посилене сприйняття вісцерального болю часто асоціюється з гіперчутливістю кишківника до розтягнення та стійким запаленням низької інтенсивності. Гіперчутливість до розтягнення пов’язана з підвищеною проникністю кишкової стінки, що може спричиняти локальне запалення та надмірну чутливість нервових закінчень. Альверину цитрат пригнічує захоплення гладком’язовими клітинами кальцію, модулюючи тонус гладких м’язів порожнистих органів травного тракту. Крім того, альверину цитрат впливає на моторну функцію й чутливість кишківника шляхом пригнічення кальцій-залежної та кальцій-незалежної збудливості нейронів й інактивації кальцієвих каналів L-типу гладком’язових клітин.
На експериментальних моделях продемонстровано також антиноцицептивні властивості альверину, опосередковані антагоністичним впливом на рецептори 5-HT1A. Отже, альверину цитрат має подвійний механізм дії. На відміну від блокаторів Ca2+-каналів (пінаверію бромід, отилонію бромід) альверину цитрат добре всмоктується й ефективно діє як у верхніх, так і в нижніх відділах травного тракту. Крім того, альверину цитрат не проникає крізь гематоенцефалічний бар’єр, що мінімізує ймовірність низки небажаних ефектів [32].
Симетикон – поверхнево-активна сполука з властивостями піногасника, що знижує поверхневий натяг бульбашок газу в травному тракті та спричиняє їх розрив. Вивільнені гази поглинаються стінками кишки або виводяться назовні завдяки перистальтиці. Крім того, симетикон зменшує проникність кишкової стінки, що запобігає транслокації антигенів і бактерій, виникненню патологічних імунних реакцій і запалення [33].
У клінічних випробуваннях симетикон продемонстрував здатність зменшувати газоутворення та здуття живота, знижувати інтенсивність післяопераційного болю й диспепсії. Зазначені механізми пояснюють клінічну ефективність комбінації альверину/симетикону щодо симптомів СПК.
Синергізм дії альверину й симетикону продемонстровано в дослідженні, проведеному L. Bueno та співавт. В експерименті на щурах дослідники з’ясовували вплив симетикону на проникність стінки та пов’язану з нею гіперчутливість товстої кишки, а також порівнювали вплив на вісцеральний біль альверину й симетикону окремо та в комбінації. При застосуванні в дозі 100 мг/кг симетикон достовірно зменшував штучно індуковане підвищення проникності стінки кишки через 6 годин після застосування. У разі введення більшої дози (200 мг/кг) зменшення проникності утримувалося навіть через 24 години (рис. 4). Пероральне застосування симетикону в дозі 200 мг/кг також достовірно зменшувало стрес-індуковану вісцеральну гіперчутливість у відповідь на розтягнення товстої кишки [34].
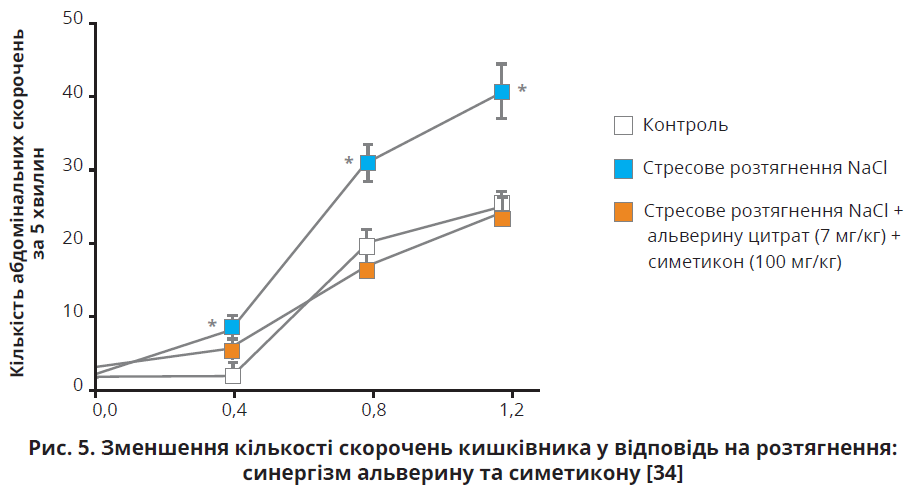
Пероральне застосування альверину в дозі 10 мг/кг достовірно зменшувало кількість абдомінальних скорочень при розтягненні кишківника на 1,2 мл (із 33,9±3,5 до 21,1±2,2 скорочення за 5 хвилин). Поєднання альверину цитрату в дозі 7 мг/кг із симетиконом у дозі 100 мг/кг достовірно зменшувало гіперчутливість товстої кишки (рис. 5) [34].
Важливо, що аналогічного ефекту не спостерігалося за умов окремого застосування обох препаратів у вказаних дозах. Отже, альверину й симетикону притаманна синергетична дія, котра забезпечує повне усунення вісцерального болю, штучно індукованого розтягненням кишки. Дози альверину й симетикону, які використовувалися в дослідженні, відповідають дозуванню в препараті Метеоспазміл з урахуванням метаболічного коефіцієнту. Автори дійшли висновку, що симетикон зменшує стрес-індуковане підвищення проникності стінки товстої кишки, протидіючи надходженню в кишківник патогенів, токсинів, бактерій і знижуючи гіперчутливість до розтягнення. Альверину цитрат, діючи безпосередньо на чутливі нервові закінчення, зменшує стрес-індуковану гіперчутливість механорецепторів. Комбінація ефектів обох активних речовин має синергетичну дію щодо зменшення вісцеральної гіперчутливості, що зумовлює її ефективність у лікуванні функціональних захворювань на кшталт СПК [34].
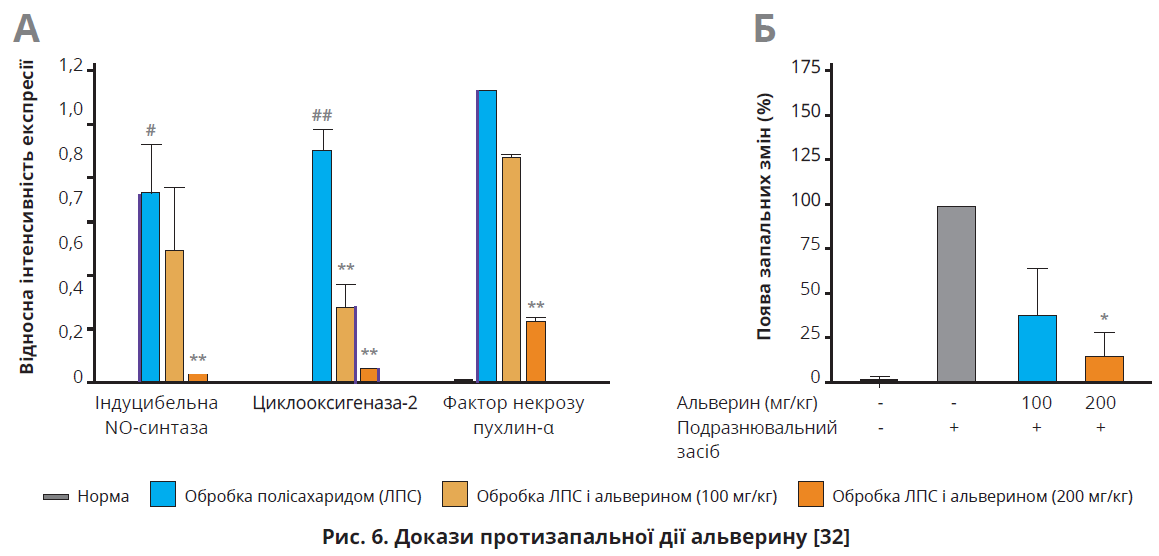
Одним із патофізіологічних механізмів СПК є запалення. Фізіологічне запалення – один із механізмів уродженого імунітету, що протидіє різноманітним патогенам. Проте тривале некероване запалення спричиняє надмірне вивільнення запальних медіаторів, здатних погіршувати виживання, індукувати канцерогенез і поліорганну недостатність. Потужним активатором макрофагального запалення є ендотоксин грамнегативних бактерій – ліпополісахарид (ЛПС), під дією якого макрофаги експресують інтерлейкін-1, -6 та -12 і фактор некрозу пухлин-α. C.Y. Lee та співавт. оцінювали вплив альверину на пригнічення запальної відповіді в активованих ЛПС макрофагах in vitro та в моделі гострого гастриту в мишей in vivo. Встановлено, що ЛПС індукує синтез оксиду азоту (NO) в макрофагах, натомість альверин дозо- та часозалежно блокує цей процес, не демонструючи цитотоксичності. Результати полімеразної ланцюгової реакції в реальному часі вказують, що альверин пригнічує експресію низки прозапальних генів: індуцибельної NO-синтази, циклооксигенази-2 та фактора некрозу пухлин-α на рівні до 90% (рис. 6А). Подальші молекулярні дослідження з’ясували, що протизапальна дія альверину реалізується через специфічне пригнічення ядерного фактора κB та Src-кінази – нерецепторної білкової тирозинкінази, яка бере участь у транскрипції генів, адгезії клітин, клітинному метаболізмі, проліферації та регуляції процесів уродженого імунітету. Зв’язуючись із SH2-доменом Src-кінази, альверин перешкоджає її фосфорилюванню й активації, обмежуючи запальну відповідь.
У моделі гострого гастриту in vivo альверин дозозалежно зменшував розмір виразкових дефектів, знижував кровоточивість і почервоніння шляхом пригнічення експресії прозапальних генів (рис. 6А) [32].
Отже, альверину притаманний широкий спектр протизапальних ефектів, зумовлених впливом на біохімічні каскади ядерного фактора κB (механізм, притаманний глюкокортикоїдам і нестероїдним протизапальним препаратам). Зважаючи на те, що ядерний фактор κB бере участь у фізіологічних процесах, зокрема диференціації епітелію та рості клітин, тривале системне застосування інгібіторів κB може спричинити значні побічні ефекти. Проте альверин пригнічує лише індуковане патогенами функціонування цього каскаду, не впливаючи на його фізіологічні функції, що унеможливлює небажані ефекти. Автори дійшли висновку, що альверин є потужним протизапальним засобом із меншою кількістю побічних ефектів, аніж у інших інгібіторів ядерного фактора κB [32].
Дослідження in vivo продемонструвало анксіолітичні ефекти альверину. Він діє на серотонінергічну систему, тож зазначені ефекти, ймовірно, включають антагонізм рецепторів 5-HT1A, що відкриває перспективи в лікуванні тривожних розладів із незначними побічними ефектами, як порівняти зі звичайними анксіолітиками. Це може бути корисно для пацієнтів з СПК, оскільки неврологічний і психологічний чинники відіграють у цьому захворюванні не останню роль [33].
У пацієнтів з СПК часто спостерігаються зміни кишкового мікробіому, у зв’язку з чим для лікування запропоновано застосування пробіотиків. У різних дослідженнях пробіотики демонструють різну ефективність. Отож оптимальна комбінація видів і штамів мікроорганізмів є індивідуальною.
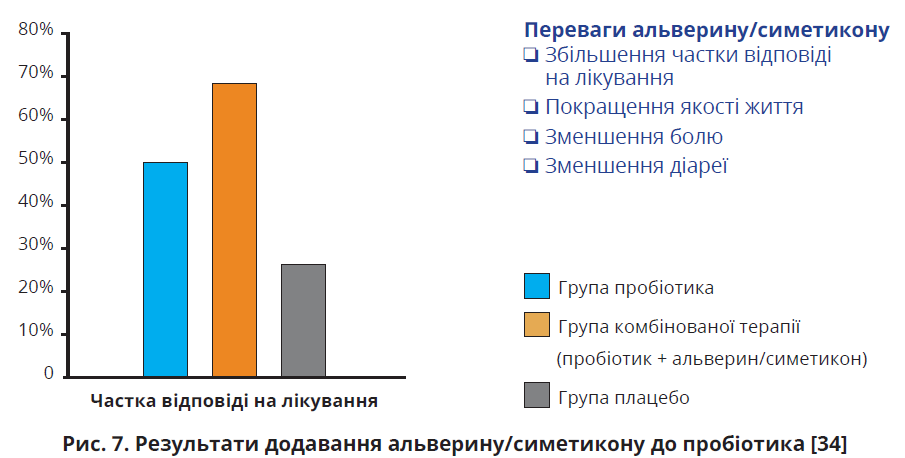
У рандомізованому сліпому плацебо-контрольованому клінічному дослідженні 55 пацієнтів з СПК-Д та СПК-ЗД було розподілено на три групи: пробіотик (Lactobacillus plantarum CECT 7484, L. plantarum CECT 7485 і Pediococcus acidilactici CECT2 1 раз на добу), пробіотик у поєднанні з альверином/симетиконом (60/300 мг 3 рази на добу) та плацебо. Лікування тривало 6 тижнів. Покращення якості життя, асоційоване з СПК, спостерігалося в усіх трьох групах лікування, але найвираженішого покращення досягнуто в групі комбінованої терапії. Частка відповіді на лікування також була найвищою в групі комбінованої терапії: 68,4% проти 50,0% у групі, яка отримувала пробіотик, та 16,7% у групі плацебо (рис. 7). Найпотужніше зниження інтенсивності болю відзначалося в групі комбінованої терапії (на 2,1±0,5 бала), дещо менше в групі, яка приймала пробіотик (на 1,7±0,6 бала), найменше – в групі плацебо (на 1,0±0,4 бала). Консистенція калу за Бристольською шкалою покращилася в обох групах лікування, окрім групи плацебо. Побічних ефектів, пов’язаних із лікуванням, не спостерігалося в жодній із груп [34].
Пробіотиком, що містить штами L. plantarum CETC 7484, L. plantarum CETC 7485, P. Acidilactici та який спеціально розроблено для пацієнтів з СПК, є Пробіолог СПК фармацевтичної компанії «Майолі Спіндлер» (Франція). Це єдиний засіб, пробіотичні штами якого виробляють поліфосфати, котрі підсилюють бар’єрну функцію кишкового епітелію та підтримують кишковий гомеостаз.
Це сприяє зменшенню проникності кишківника та, відповідно, нормалізації випорожнень [35]. Окрім того, здатність зазначених штамів до продукування великої кількісті коротколанцюгових жирних кислот забезпечує протизапальний ефект, а також сприяє абсорбції натрію й води, утворенню слизу та зменшенню частоти дефекації.
За даними плацебо-контрольованих рандомізованих досліджень, Пробіолог СПК зменшує вісцеральну гіперчутливість, суттєво покращує якість життя, а також є безпечним та ефективним засобом щодо зменшення симптомів непереносимості лактози [36, 37].
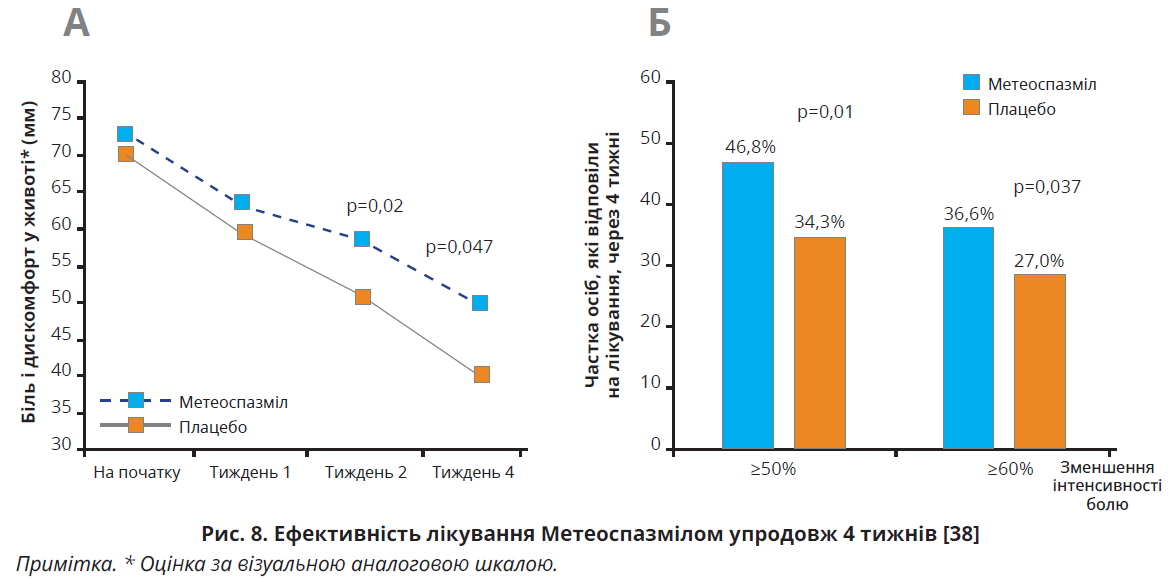
Тривалий прийом комбінації альверину/ симетикону достовірно зменшує біль і дискомфорт у животі в пацієнтів з СПК незалежно від його типу. Такого висновку дійшли T. Wittmann і співавт., провівши рандомізоване подвійне сліпе плацебо-контрольоване дослідження в 17 центрах Угорщини та Польщі. Учасниками були 412 пацієнтів з СПК (середній вік – 46,2±13,9 року, 71,4% жінок, інтенсивність болю в животі – 60 мм за візуальною аналоговою шкалою), яких рандомізували до групи Метеоспазмілу (альверину цитрат 60 мг / симетикон 300 мг) або плацебо, які приймали тричі на добу. Через 4 тижні Метеоспазміл продемонстрував значно кращу ефективність щодо зменшення болю/дискомфорту в животі: середня оцінка за візуальною аналоговою шкалою в групі Метеоспазмілу становила 40,0 мм, у групі плацебо – 50,0 мм; р=0,047 (рис. 8А). Наприкінці періоду лікування в групі Метеоспазмілу на терапію відповіли 46,8% осіб, що значно більше, ніж у групі плацебо, – 34,3%; р=0,01 (рис. 8Б) [38].
На початку дослідження діарею або закреп мали 84% пацієнтів. Аналіз підтипу СПК, проведений авторами дослідження на підставі щоденників пацієнтів, виявив, що 23% учасників мали тип СПК-З, 22% – СПК-Д, хоча встановити підтип СПК за щоденником доволі складно. Основною скаргою пацієнтів був сильний біль або дискомфорт, що згідно з даними літератури частіше вказує на СПК-ЗД. Після 4 тижнів лікування кількість пацієнтів, які повідомляли про домінування закрепу за останні 7 днів, у групі Метеоспазмілу знизилася від 45 (21,9%) до 29 осіб (14,1%), а в групі плацебо – з 51 (25%) до 23 осіб (11,3%). Кількість пацієнтів, які повідомляли про діарею, на тлі прийому Метеоспазмілу зменшилася від 45 (21,9%) до 18 осіб (8,8%), на тлі прийому плацебо – від 47 (23%) до 32 осіб (15,7%). Поширеність побічних ефектів істотно не відрізнялася в групі Метеоспазмілу (17,9%) і групі плацебо (24,4%). Побічні ефекти, пов’язані з лікуванням, спостерігалися лише в 3,4 та 5,9% осіб відповідно. Автори дійшли висновку, що пероральний прийом Метеоспазмілу тричі на добу протягом 4 тижнів достовірно зменшує біль і дискомфорт у животі в пацієнтів з СПК незалежно від його типу [38].
Лікування «на вимогу». З іншого боку, перебіг СПК зазвичай циклічний: симптоми виникають періодично (наприклад, раз на тиждень) і в середньому тривають 2-5 днів [39]. Циклічність зумовлює доцільність терапії «на вимогу» під час симптоматичних періодів, що дає змогу знизити витрати на лікування. Ефективність комбінації альверину/симетикону в такому режимі вивчали P. Ducrotte та співавт.
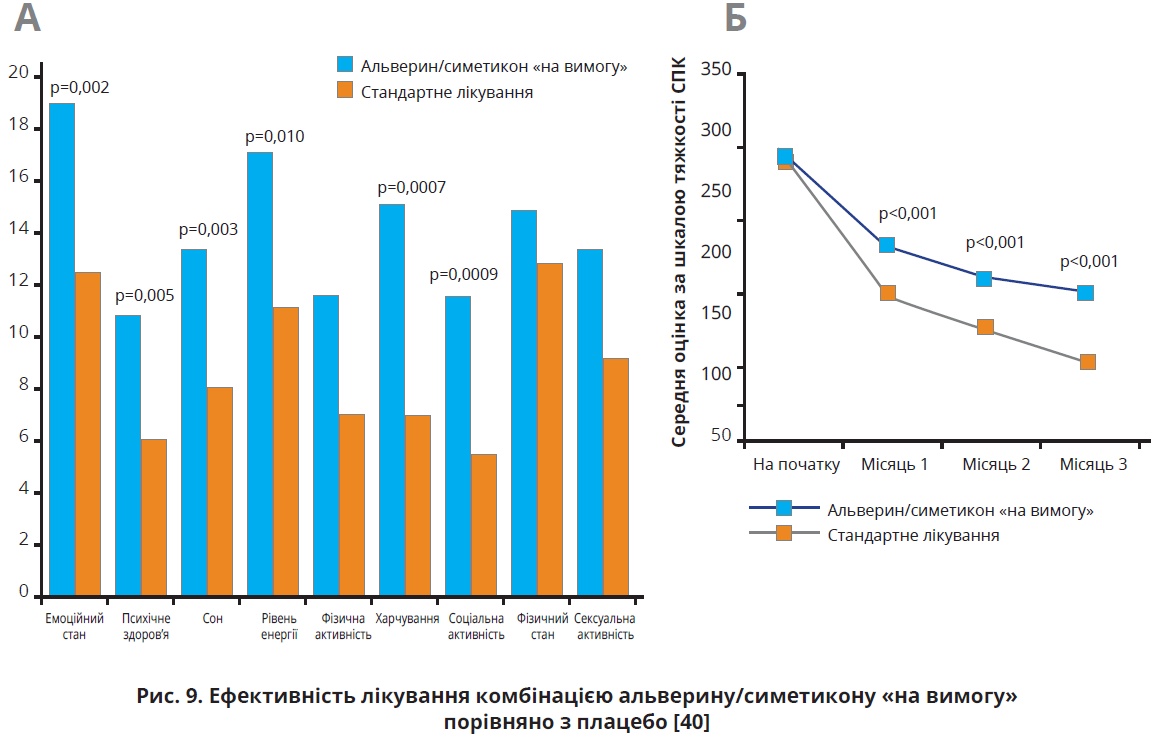
у 6-місячному дослідженні за участю 436 пацієнтів з СПК (середній вік – 54,4 року; 73,4% жінок). Учасників рандомізували на групи лікування комбінацією альверин 60 мг / симетикон 300 мг 1 капсула тричі на добу впродовж періоду абдомінального болю (n=222) або інших видів лікування на розсуд лікаря в режимі постійної терапії (n=214). Пацієнти з групи альверину/симетикону приймали препарат 75,0% днів упродовж І місяця, 54% днів упродовж ІІ-ІІІ місяців і 45% днів упродовж IV-VI місяців. Під час періоду лікування учасники в середньому приймали 2,8 капсули на добу. На думку авторів, активна участь пацієнтів у контролі власних симптомів (прийом «на вимогу») сприятливо впливає на перебіг хвороби. У групі інших видів лікування 58,4% учасників приймали один препарат, 30,8% – комбінацію двох препаратів, 8,9% – комбінацію трьох препаратів; 93,8% пацієнтів цієї групи приймали щонайменше один спазмолітик. Знеболювальних засобів потребували 4,8% пацієнтів групи звичайного лікування та лише 1,4% пацієнтів групи альверину/симетикону. Учасники групи стандартного лікування також частіше потребували психотропних препаратів (27,9% проти 18,9% у групі альверину/симетикону). Оцінювання якості життя, пов’язаної з СПК, виявило достовірно більше покращення в групі альверину/симетикону: на 13,8±1,1 проти 8,4±1,2 бала.
У пацієнтів, які отримували альверин/симетикон, спостерігалося більш значуще покращення за 6 показниками шкали оцінки якості життя: емоційний стан, психічне здоров’я, якість сну, загальний рівень енергії, харчування та соціальна активність (рис. 9А). Тяжкість симптомів СПК зменшилася в обох групах лікування (рис. 9Б), проте зниження інтенсивності скарг було вираженішим у групі альверину/симетикону (на 170,0 проти 110,7 бала в іншій групі). Зниження тяжкості симптомів корелювало з покращенням якості життя [40].
Через 6 місяців терапії в групі альверину/симетикону частіше фіксувалися позитивна відповідь на лікування та досягнення ремісії (58,6 проти 35,9% та 37,7 проти 16,0% відповідно). Абдомінальний біль зменшився в 76,1% пацієнтів із групи альверину/симетикону та в 59,2% пацієнтів групи стандартного лікування. Здуття живота зменшилося в 76,6 та 57,0% пацієнтів відповідно. Крім того, значно рідше фіксувалася депресія: оцінку за шкалою Гамільтона >10 мали 5,5% учасників групи альверину/симетикону проти 12,8% у групі стандартного лікування. Щонайменше один побічний ефект спостерігався в 40,5% учасників групи альверину/симетикону та в 41,0% осіб із групи стандартного лікування, проте тяжких побічних ефектів не зафіксовано. Важливо, що пацієнти, які приймали альверин/симетикон, витрачали на лікування вдвічі менше. Автори дійшли висновку, що стратегія довготривалого лікування СПК комбінацією альверину/симетикону в режимі «на вимогу» є ефективною для застосування в рутинній клінічній практиці, оскільки зменшує вираженість симптомів і покращує якість життя пацієнтів [40].
На фармацевтичному ринку України комбінація альверину цитрату / симетикону представлена препаратом Метеоспазміл фармацевтичної компанії «Майолі Спіндлер» (Франція). Кожна капсула містить 60 мг альверину цитрату та 300 мг симетикону; препарат призначається по 1 капсулі 2-3 рази на добу за 20-30 хвилин до прийому їжі.
Висновки
- СПК – поширене функціональне захворювання, що асоціюється не лише з набридливими симптомами (біль, здуття живота, діарея, закреп), а й із депресією, зниженням працездатності та якості життя, потребою частого звернення по медичну допомогу та значними економічними витратами.
- Комбінація альверину цитрату / симетикону (Метеоспазміл) застосовується в Європі з 1990 року для лікування функціональних розладів травного тракту й має достатню доказову базу щодо зменшення болю, покращення загального стану, функціональної активності та якості життя в пацієнтів з СПК. Установлено також протизапальний ефект альверину та здатність симетикону потенціювати основні терапевтичні впливи альверину завдяки синергетичній дії.
- Комбінація альверину цитрату / симетикону (Метеоспазміл) у дозі 1 капсула 2-3 рази на добу є безпечною та високоефективною для лікування варіантів СПК з больовим синдромом, її можна використовувати як для тривалого контролю симптомів, так і для лікування в режимі «на вимогу», а також разом із пробіотиками. Застосування Метеоспазмілу є економічно ефективним методом лікування, що істотно зменшує витрати пацієнта.
Література
- Drossman D.A., Tack J. Rome Foundation clinical diagnostic criteria for disorders of gut-brain interaction. Gastroenterology. 2022; 162 (3): 675-679.
doi: 10.1053/j.gastro.2021.11.019. - Black T.P., Manolakis C.S., Di Palma J.A. “Red flag” evaluation yield in irritable bowel syndrome. J. Gastrointestin. Liver Dis. 2012; 21 (2): 153-156.
- Rome IV Diagnostic Criteria for disorders of gut-brain interaction. Rome Foundation 2016. Available at: https://theromefoundation.org/rome-iv/rome-iv-criteria.
- Lovell R.M., Ford A.C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis. Clin. Gastroenterol. Hepatol. 2012; 10 (7): 712-721.e4.
doi: 10.1016/j.cgh.2012.02.029. - Sperber A.D., Bangdiwala S.I., Drossman D.A., et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome Foundation Global Study. Gastroenterology. 2021; 160 (1): 99-114.e3. doi: 10.1053/j.gastro.2020.04.014.
- Kim Y.S., Kim N. Sex-gender differences in irritable bowel syndrome. J. Neurogastroenterol. Motil. 2018; 24 (4): 544-558. doi: 10.5056/jnm18082.
- Vasant D.H., Paine P.A., Black C.J., et al. British Society of Gastroenterology guidelines on the management of irritable bowel syndrome. Gut. 2021; 70: 1214-1240.
- Carco C., Young W., Gearry R.B., Talley N.J., McNabb W.C., Roy N.C. Increasing evidence that irritable bowel syndrome and functional gastrointestinal disorders have
a microbial pathogenesis. Front. Cell. Infect. Microbiol. 2020; 10: 468. doi: 10.3389/fcimb.2020.00468. - Tang H.Y., Jiang A.J., Wang X.Y., Wang H., Guan Y.Y., Li F., Shen G.M. Uncovering the pathophysiology of irritable bowel syndrome by exploring the gut-brain axis: a narrative review. Ann. Transl. Med. 2021; 9 (14): 1187. doi: 10.21037/atm-21-2779.
- Bornstein J.C. Serotonin in the gut: what does it do? Front. Neurosci. 2012; 6: 16. doi: 10.3389/fnins.2012.00016.
- Sanger G.J., Chang L., Bountra C., et al. Challenges and prospects for pharmacotherapy in functional gastrointestinal disorders. Therap. Adv. Gastroenterol.
2010; 3: 291-305. doi: 10.1177/1756283X10369922. - Simrén M., Törnblom H., Palsson O.S., et al. Visceral hypersensitivity is associated with Gi symptom severity in functional Gi disorders: consistent findings from five different patient cohorts. Gut. 2018; 67: 255-262. doi: 10.1136/gutjnl-2016-312361.
- Agrawal A., Houghton L.A., Lea R., et al. Bloating and distention in irritable bowel syndrome: the role of visceral sensation. Gastroenterology. 2008; 134: 1882-1889.
doi: 10.1053/j.gastro.2008.02.096. - Camilleri M., McKinzie S., Busciglio I., et al. Prospective study of motor, sensory, psychologic, and autonomic functions in patients with irritable bowel syndrome.
Clin. Gastroenterol. Hepatol. 2008; 6: 772-781. doi: 10.1016/j.cgh.2008.02.060. - Törnblom H., Van Oudenhove L., Sadik R., et al. Colonic transit time and IBS symptoms: what’s the link? Am. J. Gastroenterol. 2012; 107: 754-760. doi: 10.1038/ajg.2012.5.
- Ravi K., Bharucha A.E., Camilleri M., et al. Phenotypic variation of colonic motor functions in chronic constipation. Gastroenterology. 2010; 138: 89-97.
doi: 10.1053/j.gastro.2009.07.057. - Agrawal A., Houghton L.A., Reilly B., et al. Bloating and distension in irritable bowel syndrome: the role of gastrointestinal transit. Am. J. Gastroenterol. 2009; 104: 1998-2004
doi: 10.1038/ajg.2009.251. - Houghton L.A., Atkinson W., Lockhart S., et al. Sigmoid-colonic motility in health and irritable bowel syndrome: a role for 5-hydroxytryptamine. Neurogastroenterology & Motility. 2007; 19: 724-731. doi: 10.1111/j.1365-2982.2007.00943.x.
- Atkinson W., Lockhart S., Whorwell P.J., et al. Altered 5-hydroxytryptamine signaling in patients with constipation- and diarrhea-predominant irritable bowel syndrome. Gastroenterology. 2006; 130: 34-43. doi: 10.1053/j.gastro.2005.09.031.
- Klem F., Wadhwa A., Prokop L.J., et al. Prevalence, risk factors, and outcomes of irritable bowel syndrome after infectious enteritis: a systematic review and meta-analysis. Gastroenterology. 2017; 152: 1042-1054. doi: 10.1053/j.gastro.2016.12.039.
- Burns G., Carroll G., Mathe A., et al. Evidence for local and systemic immune activation in functional dyspepsia and the irritable bowel syndrome: a systematic review. Am. J. Gastroenterol. 2019; 114: 429-436. doi: 10.1038/s41395-018-0377-0.
- Robles A., Perez Ingles D., Myneedu K., et al. Mast cells are increased in the small intestinal mucosa of patients with irritable bowel syndrome: a systematic review
and meta‐analysis. Neurogastroenterology & Motility. 2019; 31: e13718. doi: 10.1111/nmo.13718. - Barbara G., Stanghellini V., De Giorgio R., et al. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome.
Gastroenterology. 2004; 126: 693-702. doi: 10.1053/j.gastro.2003.11.055. - Zhou Q., Zhang B., Verne N.G. Intestinal membrane permeability and hypersensitivity in the irritable bowel syndrome. Pain. 2009; 146: 41-46. doi: 10.1016/j.pain.2009.06.017.
- Piche T. Tight junctions and IBS – the link between epithelial permeability, low-grade inflammation, and symptom generation? Neurogastroenterology & Motility.
2014; 26: 296-302. doi: 10.1111/nmo.12315. - Villarreal A.A., Aberger F.J., Benrud R. Use of broad-spectrum antibiotics and the development of irritable bowel syndrome. WMJ. 2012; 111: 17-20.
- Bhattarai Y., Muniz Pedrogo D.A., Kashyap P.C. Irritable bowel syndrome: a gut microbiota-related disorder? Am. J. Physiol. Gastrointest. Liver Physiol. 2017; 312: G52-62. doi: 10.1152/ajpgi.00338.2016.
- Aguilera-Lizarraga J., Florens M.V., Viola M.F., et al. Local immune response to food antigens drives meal-induced abdominal pain. Nature. 2021; 590: 151-156. doi: 10.1038/s41586-020-03118-2.
- Barraza-Ortiz D.A., Pérez-López N., Medina-López V.M., Minero-Alfaro J.I., Zamarripa-Dorsey F., Fernández-Martínez N.D.C., Llorente-Ramón A., Ramos-Aguilar G.A. Combination of a probiotic and an antispasmodic increases quality of life and reduces symptoms in patients with irritable bowel syndrome: a pilot study. Dig. Dis.
2021; 39 (3): 294-300. doi: 10.1159/000510950. - Brenner D.M., Lacy B.E. Antispasmodics for chronic abdominal pain: analysis of North American treatment options. Am. J. Gastroenterol. 2021; 116 (8): 1587-1600.
doi: 10.14309/ajg.0000000000001266. - Martínez-Vázquez M.A., Vázquez-Elizondo G., González-González J.A., Gutiérrez-Udave R., Maldonado-Garza H.J., Bosques-Padilla F.J. Effect of antispasmodic agents, alone or in combination, in the treatment of irritable bowel syndrome: systematic review and meta-analysis. Rev. Gastroenterol. Mex. 2012; 77 (2): 82-90. doi: 10.1016/j.rgmx.2012.04.002.
- Lee C.Y., Kim H.G., Park S.H., Jang S.G., Park K.J., Kim D.S., Kim J.H., Cho J.Y. Anti-inflammatory functions of alverine via targeting Src in the NF-κB pathway. Biomolecules. 2020; 10 (4): 611. doi: 10.3390/biom10040611.
- Gupta D., Radhakrishnan M., Kurhe Y. Anxiolytic-like effects of alverine citrate in experimental mouse models of anxiety. Eur. J. Pharmacol. 2014; 742: 94-101.
doi: 10.1016/j.ejphar.2014.08.033. - Daelemans S., Peeters L., Hauser B., Vandenplas Y. Recent advances in understanding and managing infantile colic. F1000Res. 2018; 7: F1000. Faculty Rev-1426.
doi: 10.12688/f1000research.14940.1. - Alcántara C., Coll-Marqués J.M., Jadán-Piedra C., et al. Polyphosphate in Lactobacillus and its link to stress tolerance and probiotic properties. Front. Microbiol.
2018; 9: 1944. doi: 10.3389/fmicb.2018.01944. - Lorenzo-Zúñiga V., Llop E., Suárez C., Alvarez B., et al. I.31, a new combination of probiotics, improves irritable bowel syndrome-related quality of life. World J. Gastroenterol. 2014; 20 (26): 8709-8716. doi: 10.3748/wjg.v20.i26.8709.
- Cano-Contreras A.D., Minero Alfaro I.J., Medina López V.M., et al. Efficacy of i3.1 probiotic on improvement of lactose intolerance symptoms: a randomized, placebo-
controlled clinical trial. J. Clin. Gastroenterol. 2022; 56 (2): 141-147. doi: 10.1097/MCG.0000000000001456. - Wittmann T., Paradowski L., Ducrotté P., Bueno L., Andro Delestrain M.C. Clinical trial: the efficacy of alverine citrate / simeticone combination on abdominal pain / discomfort in irritable bowel syndrome – a randomized, double-blind, placebo-controlled study. Aliment. Pharmacol. Ther. 2010; 31 (6): 615-624.
- Guilera M., Balboa A., Mearin F. Bowel habit subtypes and temporal patterns in irritable bowel syndrome: systematic review. Am. J. Gastroenterol. 2005;
100 (5): 1174-1184. doi: 10.1111/j.1572-0241.2005.40674.x. - Ducrotte P., Grimaud J.C., Dapoigny M., Personnic S., O’Mahony V., Andro-Delestrain M.C. On-demand treatment with alverine citrate / simeticone compared with standard treatments for irritable bowel syndrome: results of a randomised pragmatic study. Int. J. Clin. Pract. 2014; 68 (2): 245-254. doi: 10.1111/ijcp.12333.