Клінічне застосування шлункових антисекреторних препаратів у дітей із гастроезофагеальною рефлюксною хворобою: оповідальний огляд
Переклала й адаптувала канд. мед. наук Тетяна Можина
Гастроезофагеальний рефлюкс (ГЕР) є дуже поширеним у дитячій популяції, особливо в немовлят віком до 3 місяців, яким притаманні щоденні епізоди зригування [1]. Зазвичай ГЕР минає спонтанно в 95% немовлят у віці 12-14 місяців [2] і спричиняє неінтенсивні симптоми або взагалі не провокує їх (функціональний ГЕР), але в деяких дітей може розвинутися симптоматична гастроезофагеальна рефлюксна хвороба (ГЕРХ) [3]. Маніфестація ГЕРХ у дітей відрізняється від такої в дорослих і значно варіює залежно від вікової групи, що ускладнює діагностику та лікування цієї хвороби. Найпоширенішими симптомами в дітей першого року життя є зригування, блювання, відмова від їжі, кашель і дратівливість. У дітей раннього віку (1-6 років) спостерігаються відрижка, абдомінальний біль, відмова від їжі, тоді як у дітей віком понад 6 років домінують зригування або блювання, кашель, епігастральний біль, печія [4].
Фармакологічне лікування не варто призначати немовлятам із функціональним ГЕР. Отже, належна диференційна діагностика між ГЕР і ГЕРХ, що ґрунтується на надмірній частоті або тривалості рефлюксів, має вирішальне значення в уникненні надмірного застосування антисекреторних препаратів (АСП).
Протягом останніх 20 років рекомендації щодо лікування ГЕР і ГЕРХ у немовлят змінилися. У 2001 р. АСП запропоновано як спосіб лікування та полегшення симптомів, загоєння слизової оболонки за наявності ГЕРХ [5]. У 2009 р. Північноамериканське (North American Societies of Pediatric Gastroenterology Hepatology and Nutrition, NASPGHAN) і Європейське товариство дитячої гастроентерології, гепатології та харчування (European Societies of Pediatric Gastroenterology Hepatology and Nutrition, ESPGHAN) опублікували клінічну практичну настанову з діагностики й лікування рефлюксу в дітей і підтвердили цей підхід [6]. Зовсім нещодавно представлено оновлення цих рекомендацій, яке зроблено на підставі систематичного огляду медичної літератури та думок експертів й опубліковано після проведення 3-денної консенсусної наради. Підхід, який нині слід застосовувати в повсякденній практиці, відрізняється від такого в попередній настанові (2009) в деяких моментах:
- зосередження на зменшенні використання АСП, коли це можливо, з коротким емпіричним 4-8-тижневим використанням інгібіторів протонної помпи (ІПП) або антагоністів гістамінових рецепторів 2 типу (АH2Р);
- додавання двох алгоритмів лікування типових симптомів: один – для немовлят до 1 року життя, другий – для дітей старшого віку та підлітків;
- поява рекомендації щодо 2-4-тижневого випробування гідролізованої білкової суміші перед призначенням АСП немовлятам [7].
Окрім того, починаючи з 2010 р. з’явилися докази низької ефективності ІПП, потім почали накопичуватися дані щодо їхніх потенційних побічних дій [8-10]. Тому опубліковано різні клінічні настанови й рекомендації з діагностики та лікування ГЕР/ГЕРХ: більшість із них не радять медикаментозне лікування ГЕР, тоді як рекомендації щодо ведення хворих на ГЕРХ не завжди чіткі, а часто навіть суперечливі. Деякі настанови пропонують лікування АН2Р або ІПП [11], інші рекомендують застосовувати ці препарати в межах клінічних досліджень [12], а треті не рекомендують їх використання в немовлят через обмежену ефективність і потенційні ризики [13].
Доступні варіанти лікування ще зазнали значних змін у квітні 2020 р., коли Європейське агентство з лікарських засобів (European Medicines Agency, ЕМА) рекомендувало призупинити в країнах ЄС продаж усіх лікарських засобів, що містять ранітидин, через ризик канцерогенності [14]. Така обмежена доступність ефективних і безпечних АСП ускладнює розроблення доказових і зведених рекомендацій із лікування ГЕРХ у дітей.
Методи
Пошук літературних джерел здійснювали за допомогою баз даних MEDLINE, PubMed, Embase. Розглядали лише статті, опубліковані англійською мовою, з використанням таких ключових слів: шлункові АСП, АH2Р, ІПП, ранітидин, ГЕРХ, немовля, дитина. Знайдені дослідження оцінювали, аналізуючи їхні назви й анотації, щоб відібрати релевантні для огляду. У підсумку в огляд включено 33 оригінальні дослідження, 25 оглядових статей і декілька інших релевантних публікацій.
Фармакологічні можливості при ГЕРХ у дітей
Лікування ГЕРХ спрямоване на полегшення симптомів і запобігання ускладненням. Для лікування легких симптомів застосовується консервативний підхід, який передбачає корекцію позиції тіла та дієти. У разі складних проблем часто потрібне лікування АСП [7, 12], тоді як хірургічне втручання необхідне у випадках, резистентних до фармакотерапії.
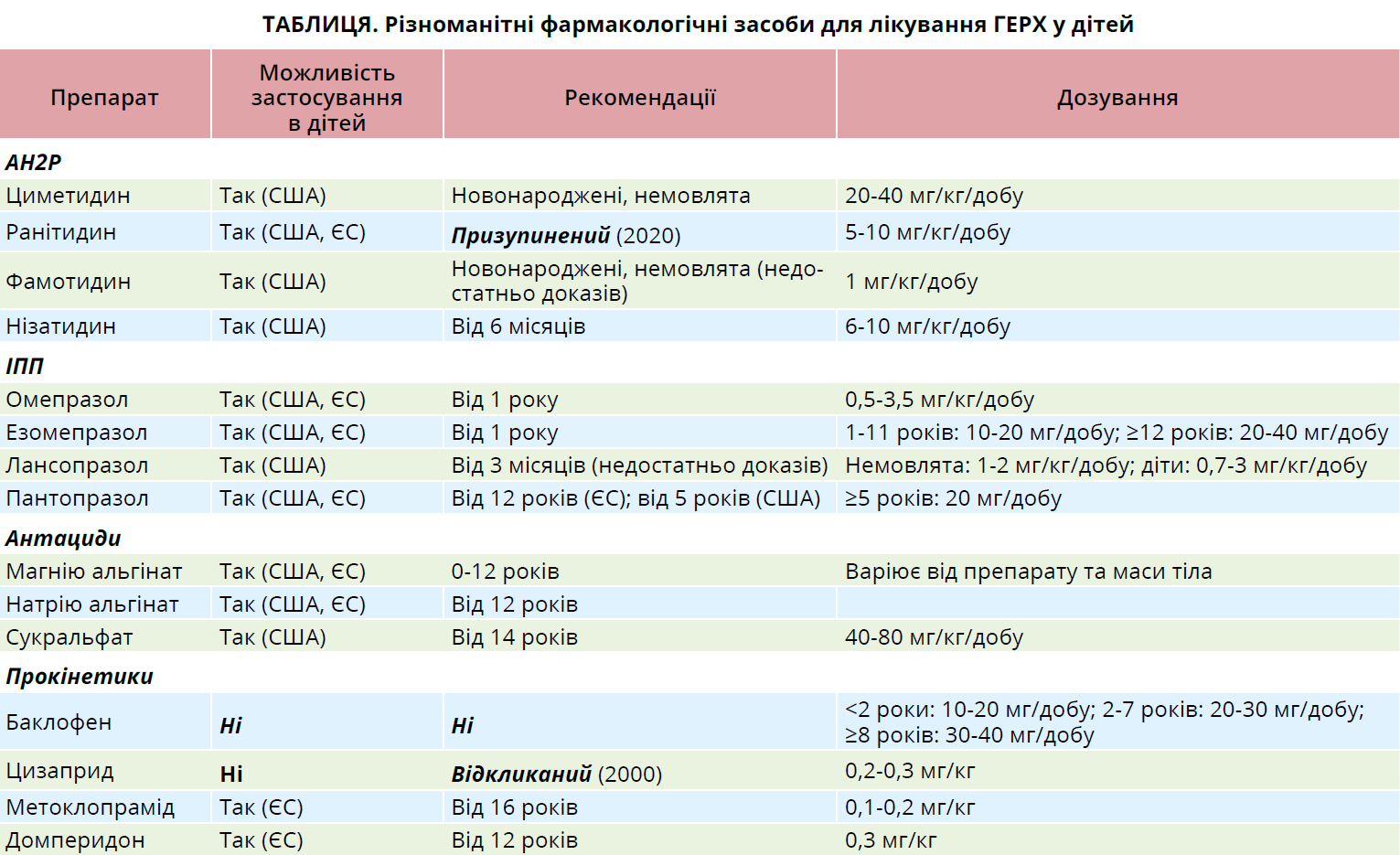
Існують різні підходи до фармакотерапії ГЕРХ у дітей (табл.). АН2Р пригнічують секрецію шлункової кислоти шляхом блокування Н2-рецепторів на парієтальних клітинах шлунка та застосовуються в дітей старшого віку й підлітків, незважаючи на те що вони менш ефективні, ніж ІПП, у нівелюванні симптомів і загоєнні езофагіту [15, 16].
Основним недоліком АН2Р є виникнення тахіфілаксії, що серйозно обмежує їх довготривале використання [17]. При застосуванні АН2Р у невідповідно високих дозах вони здатні спричинити в деяких немовлят головний біль, дратівливість, сонливість [18]. Окрім того, прийом цих препаратів (особливо циметидину) асоційований із високим ризиком ураження печінки [19], гінекомастії [20].
Традиційно в більшості країн використовують такі АН2Р, як циметидин, ранітидин, фамотидин і нізатидин; останні два препарати дозволені для використання в педіатричній популяції в США, але не в Європі. Із 2019 р. Управління з контролю продуктів харчування та лікарських засобів США (FDA) виявило збільшення рівня N-нітрозодиметиламіну (NDMA), яке значно перевищувало допустиму межу споживання, в багатьох партіях ліків, включаючи ранітидин. Це призвело до масового відкликання декількох препаратів і занепокоєння серед пацієнтів і лікарів, зважаючи на те що NDMA класифікують як імовірно канцерогенну речовину для людини. NDMA може утворюватися в результаті розпаду самого ранітидину, особливо після закінчення терміну придатності, хоча він також може утворюватися в організмі при застосуванні препарату. Як попередження у квітні 2020 р. і FDA, й EMA звернулися до фірм-виробників із проханням вилучити з продажу всі рецептурні та безрецептурні ранітидиновмісні препарати [21, 22], оскільки концентрації NDMA можуть зростати з часом, якщо ліки зберігаються за кімнатної температури, досягаючи таким чином небезпечних концентрацій [14].
ІПП блокують активність Na+/K+-АТФази, яка є фінальним етапом секреції соляної кислоти парієтальними клітинами, їх використання в педіатричній популяції значно зросло протягом останнього десятиріччя [23]. Зокрема, ІПП виявилися найефективнішими препаратами в дітей віком понад 1 рік, але їхню ефективність у лікуванні ГЕР у новонароджених і немовлят чітко не доведено, оскільки більшість доступних досліджень були відкритими та неконтрольованими [24].
Тому пацієнтам цієї вікової групи ІПП варто призначати тоді, коли існують докази патологічного впливу повторюваних кислотних рефлюксів та/або езофагіту [25]. ІПП не індукують тахіфілаксію та придатніші для довготривалої терапії [26]. У Північній Америці ІПП, дозволеними для застосування в дітей від 1 року, є омепразол, езомепразол, лансопразол, пантопразол і рабепразол. У Європі єдиним препаратом, дозволеним для застосування в дітей віком понад 1 рік, є омепразол, тоді як езомепразол і пантопразол дозволені для призначення дітям від 12 років. Разом зі збільшенням кількості призначень ІПП немовлятам і дітям зростає занепокоєння щодо їхньої безпеки [24]. В огляді Cohen і співавт. [27] підкреслюється, що в 34% дітей, які отримували ІПП, розвиваються побічні ефекти, включаючи головний біль, нудоту, діарею та запор. Окрім того, тривале застосування ІПП асоційоване з виникненням гастроінтестинальних і респіраторних інфекцій, харчової алергії, дефіцитом вітамінів групи В, гіпомагніємією та зростанням ризику хронічного захворювання нирок [28].
Антациди являють собою групу лікарських засобів, які можна використовувати для нейтралізації шлункової кислотності в стравоході або шлунку, зменшення печії та загоєння езофагіту [17]. Існує невелика кількість доказів доцільності застосування цих препаратів у педіатричній популяції [29]. Безпека й ефективність антацидів, як-от альгінати, сукральфат, сполуки алюмінію, недостатньо досліджені в педіатрії [17]. Застосування цього класу препаратів може призвести до побічних ефектів, включаючи підвищення сироваткових концентрацій магнію, кальцію й алюмінію [30].
Доведено, що в дітей альгінати значно зменшують кількість епізодів рефлюксу та зменшують симптоматику [31, 32]. У 2018 р. опубліковано клінічну практичну настанову щодо ГЕР у дітей, у якій NASPGHAN та ESPGHAN зазначають, що прийом альгінатів може дещо зменшити такі ознаки ГЕР, як регургітація, блювання, хоча неясно, чи призводить застосування цих лікарських засобів у немовлят із ГЕР до виникнення побічних ефектів [7].
У педіатрії прокінетичні засоби використовуються протягом багатьох років як препарати першого вибору для лікування симптомів рефлюксу. Нещодавні дослідження встановили, що баклофен знижує ймовірність рефлюксу та покращує спорожнення шлунка в дорослих, але педіатричних досліджень із цього приводу немає. Крім того, повідомлялося про велику кількість побічних ефектів, пов’язаних із прийомом баклофену, тому його зазвичай не рекомендують. Цизаприд ефективно посилює перистальтику та сприяє спорожненню шлунка [7], але у 2000 р. він видалений із ринку в більшості країн через його серцеву токсичність. Прийом інших прокінетичних засобів, як-от домперидон і метоклопрамід, пов’язаний із невеликою кількістю побічних ефектів, але вони використовуються нині дещо рідше, їх не варто призначати як перший етап лікування. У 2014 р. EMA заявило, що метоклопрамід протипоказаний дітям віком до 1 року, його слід застосовувати як засіб другої лінії терапії лише при нудоті та блюванні, які виникають після оперативного втручання або хіміотерапії; отже, застосування метоклопраміду при ГЕРХ є недоцільним. Стосовно домперидону: його ректальні форми протипоказані дітям із масою тіла <35 кг, а єдиними дозволеними показаннями є нудота та блювання.
Нарешті, немає жодних наукових доказів доцільності призначення еритроміцину та бетанехолу з метою лікування ГЕР і ГЕРХ [7]. Літературних даних щодо їх застосування в педіатричній популяції недостатньо, відсутні надійні докази на користь застосування прокінетиків у дітей із ГЕРХ [6, 7, 33].
Схеми призначення АСП
Різні дослідження надають інформацію щодо схем призначення АСП, які застосовуються при ГЕР і ГЕРХ у дітей, протягом останніх декількох років.
У ретроспективному дослідженні аналізували вибірку дітей, які перебували в неонатальних відділеннях інтенсивної терапії в 43 педіатричних лікарнях у США, шляхом отримання інформації з бази даних PHIS за період із січня 2006 р. по березень 2013 р. У сформованій когорті немовлят (n=122 002) 28 989 (23,8%) пацієнтів отримували АH2Р або ІПП. Надзвичайно недоношені та доношені діти з ГЕРХ або вродженими вадами серця найчастіше отримували АСП: медіана постнатального віку для першого призначення ліків становила 10 днів, середня тривалість фармакотерапії – 15 діб. Немовлята, які отримували лікування, здебільшого народилися доношеними (≥37 тижнів гестації) або глибоко недоношеними (35-36 тижнів гестації). Протягом періоду дослідження спостерігали таку тенденцію до застосування АH2Р/ІПП: призначення АН2Р зменшилося на 23,1% у 2006 р. до 12,9% у 2013 р., тоді як використання ІПП зростало з 2006 по 2010 р. (із піком у 12,2%), а потім знизилося
до 7,9% у 2013 р. [34].
В іншому ретроспективному дослідженні проаналізовано призначення ІПП й АH2Р новонародженим і немовлятам у США протягом 2003-2008 рр. на підставі інформації, отриманої з баз даних Premier Perspective Inpatient Hospital Database (в якій зберігаються дані майже з 500 лікарень) і PharMetrics Patient-Centric Database (амбулаторні хворі). Хоча протягом періоду дослідження FDA не схвалило використання жодного ІПП у дітей до 1 року, ІПП часто призначали поза показаннями новонародженим, немовлятам в умовах стаціонару й дещо рідше амбулаторним пацієнтам. Протягом 5-річного періоду кількість стаціонарних хворих, які отримували ІПП, збільшилася, тоді як відсоток пацієнтів, які приймали АН2Р, зменшився. Що стосується амбулаторних пацієнтів, то серед новонароджених і дітей раннього віку зі встановленим діагнозом ГЕРХ 8,2% хворих отримували ІПП. Найпоширенішим ІПП, що застосовувався як у стаціонарних, так і в амбулаторних умовах, був лансопразол [23].
У Європі підходи до лікування ГЕРХ у дітей досліджувалися шляхом аналізу структурованих анкет, які заповнювали 567 європейських педіатрів з 11 країн (Португалія, Іспанія, Бельгія, Нідерланди, Німеччина, Італія, Словенія, Сербія, Македонія, Греція, Литва). Лише 1,8% педіатрів вели пацієнтів відповідно до чинних рекомендацій, тоді як 45,8% лікарів діагностували ГЕРХ на основі клінічних симптомів, без проведення специфічних тестів, незважаючи на вік дитини. Крім того, 67% педіатрів вважали ІПП основним засобом для лікування ГЕРХ, 36,2% із них лікували неускладнену рецидивну регургітацію цими препаратами в немовлят віком менш як 1 рік, а 16,6% вважали, що АН2Р перевершують ІПП. Не було виявлено суттєвої різниці в дотриманні рекомендацій серед педіатрів із різних країн, що взяли участь у дослідженні [38].
Дані щодо ефективності та безпеки АСП
Небагато відомо щодо ефективності та безпеки АСП у дітей. Педіатричні дослідження, в яких порівнюють ефективність і безпеку різних препаратів для лікування ГЕРХ, характеризуються невеликим розміром вибірки, відсутністю контролю та ненадійними кінцевими точками.
Стосовно ефективності: дослідження, проведені в неонатальній популяції, не продемонстрували покращення клінічних симптомів ГЕРХ після призначення АСП [42-44], оскільки ці симптоми мали тенденцію до самостійного зникнення з часом [45]. Тому в настановах застерігають від використання АСП у новонароджених [6, 46], а Американська академія педіатрії (American Academy of Pediatrics, AAP) визначає ці препарати як необов’язкові засоби для лікування неонатальної популяції [47].
Систематичний огляд, заснований на даних 23 рандомізованих контрольованих досліджень (1598 пацієнтів, розподілених на 3 групи: діти від 1 року, немовлята до 1 року, діти всіх вікових груп), оцінював найважливіші класи препаратів, що використовуються для лікування ГЕРХ у дітей. Результати дослідження показали, що ІПП ефективні в нівелюванні типових проявів ГЕРХ, а АН2Р (переважно ранітидин) можуть бути підхожою альтернативою; не отримано доказів здатності ІПП й АН2Р зменшувати в немовлят такі неспецифічні симптоми, як плач, блювання, дратівливість, зригування за відсутності доведеного рефлюкс-езофагіту або ускладнень [48]. Ці слабкі докази ефективності АСП у дітей віком до 1 року підкреслюють й інші автори [8, 49, 50].
Стосовно безпеки АСП: не завжди зрозуміло, яка несприятлива подія дійсно пов’язана з прийом медикаментів, а яка – із самим захворюванням. У пацієнтів із ГЕРХ важко визначити, чи пов’язаний епізод блювання / абдомінальний біль із прийомом ліків або ГЕРХ [27].
Деякі дослідження припускають, що застосування АСП для лікування ГЕРХ може погіршити безпеку [51] та збільшити ризик респіраторних і гастроінтестинальних інфекцій [3, 28]. Зокрема, в дітей з ослабленою імунною системою супресія соляної кислоти пов’язана з підвищенням частоти нозокоміальної кандидемії [52].
В амбулаторних картках 16 077 дітей із Великої Британії, отриманих із бази даних THIN, які потім були розподілені на три когорти залежно від фармакотерапії (езомепразол, інші ІПП або АH2Р),
не виявлено жодних наслідків із погляду безпеки в групі езомепразолу. Частота виникнення небажаних ефектів була вищою в групі АH2Р порівняно з ІПП (193 проти 92 подій). У всіх дітей найпоширенішими побічними діями були гастроентерит (34,4%), судоми/напади (27%) та пневмонія (18,6%) [41].
У ретроспективному обсерваційному післяреєстраційному дослідженні порівнювали безпеку ІПП у дітей, які приймали езомепразол, інші ІПП або АН2Р. У когорті з 23 470 дітей 2820 маленьких пацієнтів отримували езомепразол, 13 818 – інші ІПП, 6832 дитини – АН2Р. Загалом 504 пацієнти (2%) госпіталізовані у зв’язку з виникненням небажаних явищ (n=762), включаючи гастроентерит, судоми/напади, пневмонію, гострий інтерстиційний нефрит, затримку росту, ангіоневротичний набряк і тромбоцитопенію. Вірогідні відмінності між когортами зафіксовано лише стосовно затримки розвитку [53].
Висновки
Лікування ГЕР у немовлят має спочатку включати нефармакологічний підхід, заснований на комбінації зміни вигодовування та позиційної терапії. Зміна вигодовування не пов’язана з ризиком або витратами, тому її слід розглядати до того, як буде прийнято рішення про застосування більш дорогих або ризикованих утручань.
Якщо наявні ознаки та симптоми ГЕРХ у дітей старшого віку або підлітків, педіатр може розпочати діагностичне застосування ІПП протягом 4-8 тижнів і спостерігати за відповіддю пацієнта. Немає доказів на користь емпіричної терапії ІПП у немовлят із метою діагностики ГЕРХ. На думку експертів, ІПП або АН2Р не слід застосовувати в дітей із позастравохідними симптомами (зазвичай респіраторними) за винятком випадків типових симптомів ГЕРХ та/або за наявності результатів діагностичних тестів, що підтверджують ГЕРХ [7].
АН2Р діють швидше, ніж ІПП, тому вони можуть бути кращим варіантом у разі раптової епізодичної печії або кислотного рефлюксу. Однак існують докази низької якості на підтримку ефективності та безпеки АН2Р у дітей, тому ці препарати варто призначати обережно та виключно за підтвердженої кислотозалежної ГЕРХ [64]. Нарешті, призупинення ЕМА реєстрації ранітидину через підозру в канцерогенності ще більше ускладнило терапію ГЕРХ у немовлят.
ІПП виявилися найефективнішими препаратами в дітей від 1 року, тоді як їхня ефективність у лікуванні ГЕРХ у новонароджених/немовлят чітко не доведена. Ці АСП не зумовлюють феномену тахіфілаксії, забезпечують стійкіше пригнічення синтезу соляної кислоти, мають простіший режим дозування, можуть бути застосовані протягом тривалого часу, але демонструють вищу частоту побічних ефектів порівняно з ранітидином. У більшості випадків побічні ефекти пов’язані зі змінами шлункового рН, що призводить до респіраторних і шлунково-кишкових інфекцій, особливо в дітей з ослабленою імунною системою. Нарешті, залишаються сумніви щодо довгострокових ефектів ІПП, а також профілю безпеки цих препаратів за тривалого застосування.
Ґрунтуючись на наведених літературних даних, можна зробити висновок, що існує переконлива причина для обмеження емпіричного застосування кислотосупресивної терапії в дітей [65]. Належна диференційна діагностика між ГЕР і ГЕРХ дуже важлива з цього погляду.
Подальші дослідження мають бути спрямовані на розроблення нових АСП із доведеною ефективністю та добрим профілем безпеки для лікування ГЕРХ у дітей, особливо новонароджених і немовлят.
Література
Cuzzolin L., et al. Clinical use of gastric antisecretory drugs in pediatric patients with gastroesophageal reflux disease: a narrative review. Transl. Pediatr. 2023; 12 (2): 260-270. doi: 10.21037/tp-22-401.
Освітньо-практичний журнал Gastro Practice №1 2023р.