Кишкова мікробіота й антибіотикотерапія неонкологічних захворювань гепатобіліарної системи та панкреатичної залози
Автор: Ігор Миколайович СКРИПНИК, доктор медичних наук, професор, президент ГО «Українська гастроентерологічна асоціація», проректор із науково-педагогічної роботи та післядипломної освіти, професор кафедри внутрішньої медицини № 1 Полтавського державного медичного університету
Мікробіота кишківника є ключовим учасником підтримки балансу в складних взаємозв’язках гепатобіліарної системи та підшлункової залози. Вона виконує як метаболічну, так й імунологічну функцію, впливаючи на гомеостаз усього організму та патогенез широкого спектра хвороб (від незлоякісних до онкопатології).
Хронічні хвороби печінки та розлади підшлункової залози в підсумку можуть призвести до дисбалансу мікробіоти кишківника зі шкідливими наслідками для здоров’я. Натомість гармонізація кишкової мікробіоти за допомогою антибіотиків має перспективні терапевтичні можливості навіть за неінфекційних захворювань.
Мікробіом і замкнене коло дисбіозу
Жовчовивідна система та система ворітної печінкової вени є магістралями, що з’єднують печінку й підшлункову залозу з кишківником і його складною мікробною спільнотою (кишкова мікробіота), роль якої в підтримці здоров’я людини та патогенезі низки хвороб продовжує досліджуватися.
Поняття мікробіоти нещодавно розвинулося в складний «мікробіом», який включає геном мікроорганізмів та їх взаємодію із середовищем.
Дисбіоз, тобто дисбаланс у цій складній системі, може призвести до зміненої місцевої імунної відповіді та бути залученим до патогенезу захворювань через запальні опосередковані механізми [1, 2].
Зокрема, дисбіоз визнано характерною ознакою хвороби в пацієнтів із цирозом печінки: мікробіота їхнього кишківника демонструє зменшення розмаїття, відносну надмірну експресію патогенів і втрату деяких ключових таксонів. Наприклад, кількість представників відділу Bacteroidetes зменшено на користь Fusobacteria та Proteobacteria. Суттєво зростає кількість патогенних бактерій Enterobacteriaceae, Streptococcaceae та Veillonellacea, тоді як представництво корисних бактерій (Bifidobacteria та Faecalibacterium prausnitzii) зменшується [6-12].
Спостерігається «замкнене коло»: дисбіоз кишківника супроводжує прогресування цирозу печінки, посилюючись у пацієнтів із декомпенсацією, що, своєю чергою, пролонгує та поглиблює ураження печінки [13, 14].
Роль кишкової мікробіоти в нейрозапаленні
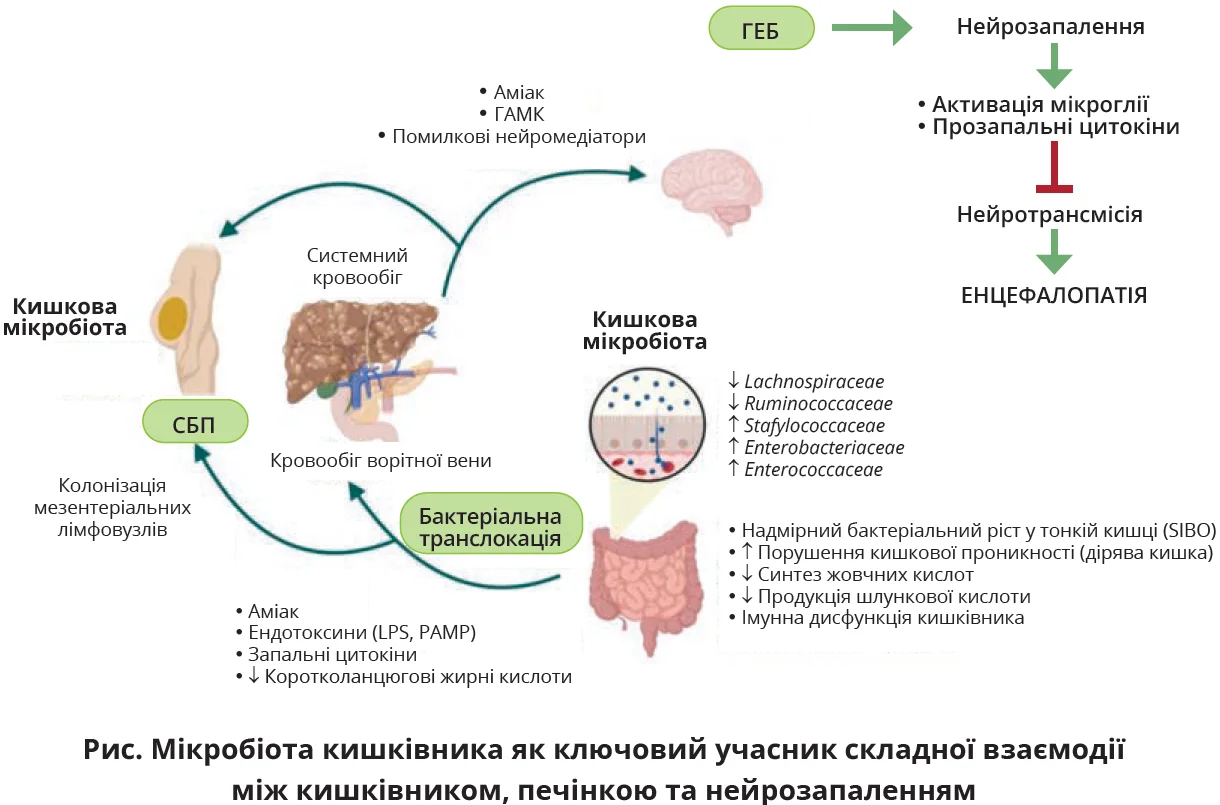
Мікробіота кишківника є ключовим учасником складної взаємодії між кишківником і печінкою, що відповідає патогенезу ускладнень цирозу печінки, як-от печінкова енцефалопатія (ПЕ) та спонтанний бактеріальний перитоніт (СБП).
У пацієнтів із цирозом печінки «синдром надлишкового бактеріального росту в тонкій кишці» (SIBO) знижує пул вторинних жовчних кислот, рівнів імуноглобуліну А та протимікробних пептидів, таким чином активуючи імунні відповіді слизової оболонки й визначаючи запалення кишківника та порушення цілісності кишкового епітелію [30, 31]. Крім того, внаслідок SIBO підвищується кишкова проникність. Цей стан, який називають «дірявою кишкою», спричиняє перенесення патогенних бактерій та їхніх метаболітів із просвіту кишківника в кров [32]. Транслоковані бактеріальні продукти та метаболіти, які називаються патогенно-асоційованими молекулярними моделями, транспортуються до печінки через ворітну вену та провокують вивільнення прозапальних цитокінів (інтерферону, фактора некрозу пухлин-α й інтерлейкінів). Останні знижують експресію білків щільного з’єднання в гематоенцефалічному бар’єрі (ГЕБ), змінюють експресію рецепторів ГЕБ і транспортні шляхи, руйнують цереброваскулярні ендотеліальні клітини й активують астроцити до запального реактивного стану.
Усі ці механізми порушують цілісність і збільшують проникність ГЕБ, тим самим визначаючи нейрозапальну відповідь у мозку на системне запалення [37, 38]. Нейрозапалення характеризується активацією мікроглії та продукцією прозапальних цитокінів у головному мозку, що перешкоджає нейротрансмісії, впливає на функції нейронів
та індукує набряк мозку низького ступеня в поєднанні з гіперамоніємією [39] (рис.).
Іншим важливим учасником розвитку мінімальної ПЕ (яка є початковим етапом розвитку енцефалопатії, що не має неврологічних симптомів із маніфестацією когнітивних порушень) є ендотоксемія. Пацієнти з цирозом печінки та мінімальною ПE характеризуються підвищенням рівня представників родини клостридій (Veillonellaceae та Eubacteriaceae), а також посиленням ендотоксемії через порушення кишкового бар’єра [48, 49].
Стратегії лікування ПЕ
Сучасні терапевтичні стратегії лікування мінімальної ПE ґрунтуються на корекції кишкової мікробіоти, метою якої є зміна її складу, пригнічення росту патогенних бактерій і зменшення продукції та всмоктування аміаку. При цьому основним агентом є лактулоза – синтетичний дисахарид, який не всмоктується. Вона здатна скорочувати час контакту між умістом просвіту та слизовою оболонкою кишківника, а також знижувати рН товстої кишки, створюючи несприятливе середовище для бактерій, що продукують уреазу, як-от Streptococcus salivarius, а також сприяти росту корисних сахаролітичних бактерій (Bifidobacterium і Lactobacillus), зменшенню поглинання аміаку [53].
Як вторинна профілактика на додаток до лактулози рекомендується застосування антибіотиків. Неоміцин, ванкоміцин, ампіцилін і метронідазол є основними агентами, які досліджувалися в умовах явної ПЕ. На жаль, побічні ефекти, як-от нефротоксичність, ототоксичність і периферична нейропатія, разом із ризиком індукції бактеріальної резистентності обмежують їх використання в клінічній практиці [54-56]. Водночас докази їхньої ефективності щодо явної ПЕ обмежені. Отже, тривале застосування зазначених антибіотиків не рекомендується.
Деякі клінічні випробування для лікування ПЕ використовували нітазоксанід, новий антибіотик широкого спектра дії та протипаразитарний засіб, з активністю проти анаеробів і хорошим профілем безпеки, порівнянним із рифаксиміном; але даних щодо його ефективності досі немає [57, 58].
Рифаксимін, пероральний напівсинтетичний антибіотик із мінімальною абсорбцією, спрямований проти β-субодиниці бактеріальної РНК-полімерази, з широким спектром дії проти аеробних і анаеробних грампозитивних і грамнегативних бактерій, є єдиним рекомендованим засобом у цій ситуації [59].
Ефективність рифаксиміну
Рифаксимін сприяє позитивним еубіотичним модифікаціям у кишковій екосистемі, збільшуючи популяції Bifidobacterium, Lactobacillus і Faecalibacterium prausnitzii. Він продемонстрував протизапальні властивості, а також ефективність щодо зменшення бактеріальної вірулентності та мікробної транслокації з кишківника [60].
За даними багатоцентрового рандомізованого подвійного сліпого плацебо-контрольованого дослідження в пацієнтів із цирозом печінки з рецидивною явною ПЕ, 90% з яких також отримували лактулозу, рифаксимін істотно зменшив частоту госпіталізацій і рецидивів ПE протягом 6 місяців, при цьому не було зафіксовано суттєвих відмінностей між групою рифаксиміну та плацебо щодо побічних ефектів. Ці результати стали підґрунтям для схвалення застосування рифаксиміну при ПЕ Управлінням США з контролю продовольства та медикаментів (FDA) [61].
Метааналіз 12 рандомізованих контрольованих досліджень щодо лікування ПЕ виявив, що ефективність рифаксиміну була еквівалентною ефективності традиційних пероральних антибіотиків (неоміцину або паромоміцину) та лактулози, але з кращим профілем безпеки. Що стосується вторинних результатів, то в пацієнтів, які приймали рифаксимін, спостерігалися значне покращення електроенцефалограми та ступеня ПE, нижчі рівні аміаку, а також зменшення астериксису (гіперкінезу, що виявляється мимовільними рухами кисті, які повторюються в неправильному ритмі) та покращення когнітивних функцій [62].
Рифаксимін модулює функцію кишкової мікробіоти, підвищуючи сироваткові рівні довголанцюгових жирних кислот і проміжних продуктів метаболізму вуглеводів, знижуючи сироваткові прозапальні цитокіни (фактор некрозу пухлин-α, інтерлейкін-1β та -6) [41, 63].
Окрім того, рифаксимін зменшує ендотоксемію й гіперамоніємію, спричинену підвищенням активності глутамінази тонкої кишки та зниженням рівня глутаміну в кишківнику. Це сприяє зменшенню кількості бактерій, що продукують аміак, як-от Clostridium і Streptococcus, і модуляції бактеріальних метаболітів [41, 64, 65].
Рифаксимін у запобіганні розвитку та рецидиву СБП у пацієнтів із цирозом печінки
СБП є найпоширенішою інфекцією, яка спостерігається в пацієнтів із прогресивним цирозом печінки й асцитом, будучи важливою причиною гострого декомпенсованого цирозу, з однорічною смертністю в 66% пацієнтів [16].
Клінічні й експериментальні дослідження показали, що пригнічення росту кишкової грамнегативної аеробної флори знижує частоту СБП у пацієнтів із цирозом [81]. Саме тому настанови Американської та Європейської асоціацій із вивчення захворювань печінки рекомендують антибіотикопрофілактику для запобігання розвитку СБП та його рецидиву [82-85].
Застосування 4-тижневої схеми лікування рифаксиміном у дозі 1200 мг/добу значно знижувало кількість нейтрофілів у пацієнтів із цирозом печінки та стерильним асцитом через істотне зниженням бактеріального ендотоксину в плазмі [88]. За даними досліджень, використання рифаксиміну значно зменшує кількість поліморфноядерних клітин
в асцитичній рідині та сприяє зниженню частоти СБП на 72% у пацієнтів із цирозом печінки [90].
Рифаксимін також перевершує норфлоксацин у запобіганні бактеріальній транслокації та СБП і здатний модулювати середовище прозапальних і протизапальних цитокінів крові в пацієнтів із СБП [91, 95].
Метааналіз 13 рандомізованих контрольованих досліджень за участю 1742 пацієнтів показав, що рифаксимін перевершує норфлоксацин, а також норфлоксацин із триметопримом/сульфаметоксазолом порівняно з плацебо щодо зниження частоти СБП. Крім того, рифаксимін отримав найвищу оцінку щодо зниження ризику смерті/трансплантації [94].
Антибіотикотерапія первинного склерозивного холангіту
Первинний склерозивний холангіт (ПСХ) – це імуноопосередковане хронічне холестатичне захворювання печінки, ознаками якого є запалення, фіброз і руйнування внутрішньо- та позапечінкових жовчних проток, що може призвести до цирозу печінки. У більшості випадків це пов’язано із запальними хворобами кишківника. Запалення проток може спричиняти звуження загальних жовчних проток і більших за розміром внутрішньопечінкових проток, які перешкоджають відтоку жовчі, зумовлюючи суперінфекції.
ПСХ зі стриктурами потребує частого використання антибіотиків через холангіт [144, 145]. Лікування домінувальних стриктур жовчних шляхів полягає в дилатації за допомогою ендоскопічної ретроградної холангіопанкреатографії. Через високий ризик контамінації жовчі та розвитку суперінфекції під час процедури рекомендується антибіотикопрофілактика (особливо у випадках, коли повне дренування малоймовірне, або пацієнт має цироз печінки й асцит) [146-149].
Було проведено кілька досліджень для оцінки використання антибіотиків у лікуванні ПСХ із суперечливими результатами. Антибіотики, що не всмоктуються, як-от рифаксимін, паромоміцин, неоміцин і пероральний ванкоміцин, використовувалися з основною метою зменшення запальних елементів і потенційних патогенів у мікробіоті кишківника. Натомість антибіотики, що всмоктуються, як-от метронідазол, долають кишковий бар’єр для досягнення терапевтичних концентрацій у сироватці та жовчі, таким чином діючи як на кишківник, так і на жовч.
Загалом використання антибіотиків може відігравати певну роль у лікуванні ПСХ. Проте ідеальна схема, дозування та тривалість лікування антибактерійними препаратами при ПСХ досі остаточно не встановлені. Отже, для підтвердження цих багатообіцяльних результатів потрібні більша кількість пацієнтів, використання даних гістопатології
та клінічних результатів, а також триваліший період спостереження.
Висновки
- Гепатобіліарна система та підшлункова залоза є складним механізмом із тісно взаємопов’язаними функціями, центром якого є кишкова мікробіота.
- Кишковий мікробіом виконує метаболічні й імунологічні функції, що як впливають на гомеостаз окремих організмів, так і зумовлюють виникнення широкого спектра неінфекційних захворювань.
- Корекція кишкової мікробіоти за допомогою антибіотиків є новаторською стратегією зі значними терапевтичними можливостями навіть
за неінфекційних захворювань. - Рифаксимін сприяє позитивним еубіотичним модифікаціям у кишковій екосистемі. Він продемонстрував ефективність у терапії ПЕ, запобіганні розвитку та рецидивуванню СБП, а також є перспективним агентом у лікуванні ПСХ.
Література
Di Vincenzo F., et al. Gut microbiota and antibiotic treatments for the main non-oncologic hepato-biliary-pancreatic disorders. Antibiotics (Basel). 2023; 12 (6): 1068. doi: 10.3390/antibiotics12061068.