Інфекція Helicobacter pylori: динамічний процес від діагностики до лікування
Переклала й адаптувала канд. мед. наук Тетяна Можина
Протягом останніх 40 років дедалі більше уваги приділяється бактерії Helicobacter pylori (Hp), яка колонізує шлунок людини. Ця бактерія являє собою грамнегативну паличку з джгутиками; рівень інфікування нею в деяких популяціях сягає 80-90%. Поширеність Hp у різних країнах світу значно варіює; в країнах, що розвиваються, вона досягає найвищого рівня: в дорослого населення Африки – ≥80%, Латинської Америки – 63,4%, Азії – 54,7% (Smith et al., 2018). Згідно з останніми даними майже 589 млн (44,2%) мешканців материкового Китаю інфіковані Hp (Ren et al., 2022). Мінімальні показники поширеності Hp зафіксовано в Північній Америці – 37,1%.
Різноманітні захворювання асоційовані з інфікуванням Hp, особливо патологія шлунково-кишкового тракту (ШКТ). З’ясування патогенних властивостей і механізмів інфікування Hp має вирішальне значення для ефективного лікування Hp-асоційованих уражень ШКТ. У цьому огляді розглянуто Hp-асоційовані захворювання, патогенетичні механізми, чинники вірулентності, методи діагностики та схеми ерадикації бактерії.
Клінічні захворювання
Патологія шлунка
Відомо, що інфекція Hp асоціюється з розвитком різноманітних уражень ШКТ, як-от гастрит, виразкова хвороба, лімфома слизової оболонки шлунка, рак шлунка. Гастрит, також відомий як хронічний гастрит, характеризується хронічним запаленням слизової оболонки шлунка. Інфекція Hp є однією з надзвичайно поширених причин хронічного гастриту. Fatema та співавт. (2015) обстежили 80 пацієнтів із диспепсією та хронічним гастритом; серед них 67 (83,8%) були інфіковані Hp, тоді як 13 (16,2%) не мали ознак інфікування. Завдяки особливостям будови та ферментативним властивостям Hp здатна виживати в кислому середовищі шлунка; вона має специфічні чинники вірулентності, які підвищують ризик розвитку захворювань шлунка, впливаючи на різні клітинні білки, що регулюють запальні реакції в організмі хазяїна (Kim and Wang, 2021). Umit і співавт. (2009) виявили, що наявність цитотоксин-асоційованого антигену А (CagA) у штамів Hp асоціюється з тяжчим перебігом гастриту. Генотипи Hp суттєво відрізняються між популяціями в різних регіонах; наприклад, більша поширеність VacA, CagA+ та BabA2- генотипів спостерігається в пацієнтів із хронічним гастритом на півдні Мексики (Atrisco-Morales et al., 2018).
Рак шлунка є ступінчатим процесом, він прогресує поступово від нормальної слизової оболонки, поверхневого гастриту, атрофічного гастриту до кишкової метаплазії та/або атипової гіперплазії. Інфікування Hp відіграє значну роль у розвитку раку шлунка. Попередні дослідження встановили, що її частка в некардіальному раку шлунка в усьому світі зросла із 74,7 до 89,0%.
Позашлункові захворювання
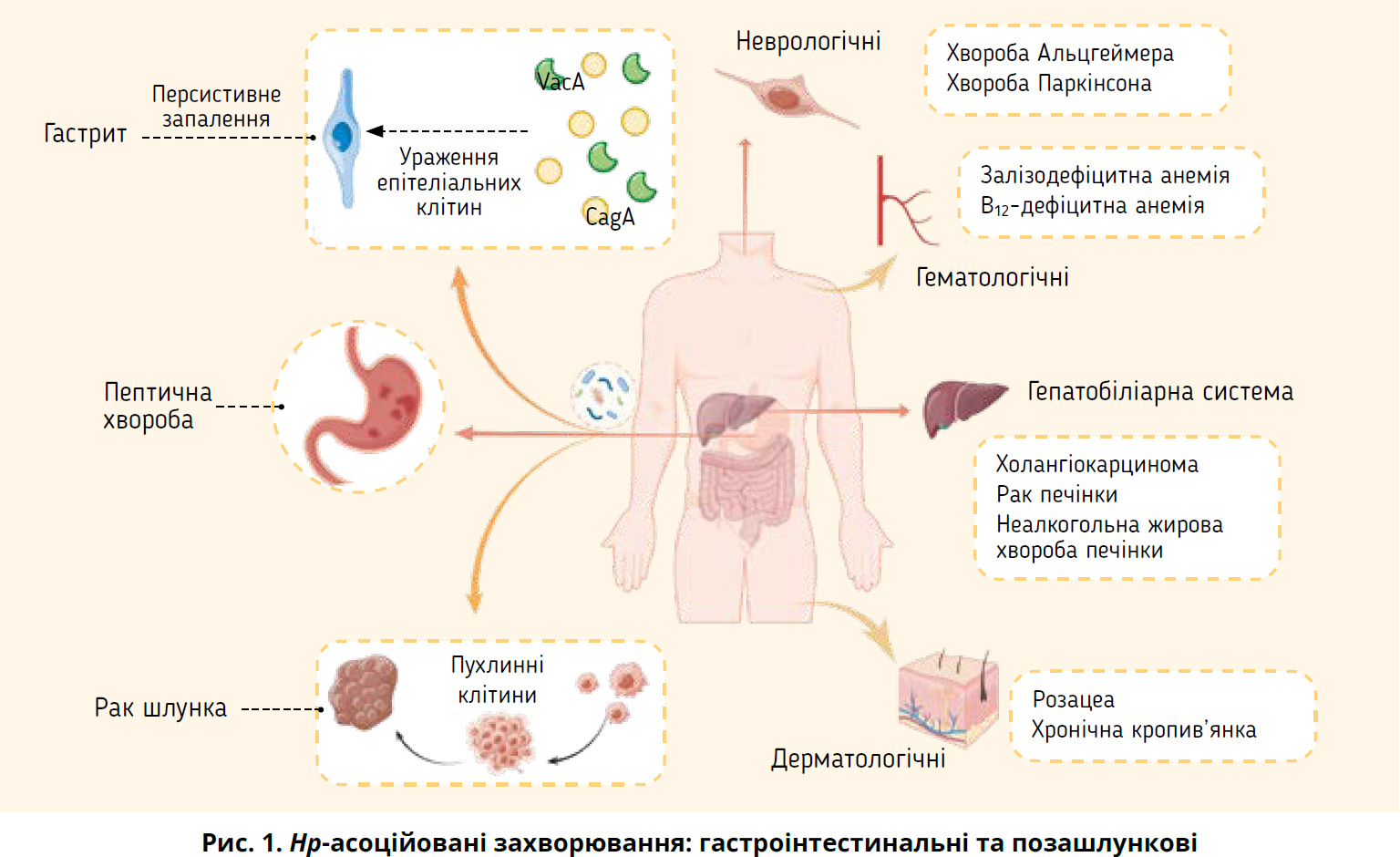
У численних дослідженнях виявлено, що інфекція Hp не лише спричиняє патологію шлунка, але й асоційована з дерматологічними, гематологічними, неврологічними та гепатобіліарними захворюваннями (рис. 1) (Beydoun et al., 2018; Dardiotis et al., 2018). Зростає доказова база здатності Hp підвищувати ризик розвитку колоректального раку (Zhuang et al., 2022; Guo et al., 2023). Аналіз даних великих когортних досліджень різноманітних популяцій продемонстрував, що інфікування VacA-серопозитивними штамами Hp асоціюється з підвищеним ризиком колоректального раку (Butt et al., 2019).
З інфекцією Hp пов’язані декілька дерматологічних захворювань, включаючи розацеа, хронічну кропив’янку, червоний плескатий лишай, атопічний дерматит тощо. Розацеа – це складне шкірне захворювання, що характеризується надмірним запаленням і судинною дисфункцією на обличчі. Сучасна література приділяє особливу увагу зв’язку між інфікуванням Hp і виникненням розацеа (Utaş et al., 1999; Szlachcic, 2002).
Незрозуміла залізодефіцитна анемія (ЗДА) та дефіцит вітаміну В12 також пов’язані з інфекцією Hp.У Пакистані аналізували поширеність ЗДА у хворих з анемією й інфекцією Hp: виявлено 112 випадків анемії, спричинених Hp, включаючи 42 випадки ЗДА (37,5%) (Rahat and Kamani, 2021). Доведено, що в дорослих, у яких раніше встановили діагноз ЗДА невідомої етіології, часто діагностують інфекцію Hp. Метааналіз підтвердив, що ерадикація Hp здатна зменшити анемію та покращити рівень заліза в пацієнтів із ЗДА, інфікованих Hp, особливо в осіб із помірною/тяжкою анемією (Yuan et al., 2010).
Недостатність вітаміну В12 є ще одним гематологічним станом, пов’язаним з інфекцією Hp.
Є докази, що персистивна інфекція Hp може призводити до неврологічних захворювань: наприклад, хвороби Альцгеймера, хвороби Паркінсона, розсіяного склерозу та синдрому Гієна – Барре. Хвороба Альцгеймера – це нейродегенеративне захворювання, що спричиняє прогресивне когнітивне порушення. Існує тісний зв’язок між серопозитивністю Hp та смертністю від хвороби Альцгеймера в чоловіків (Beydoun et al., 2018).
Патогенез
Колонізація
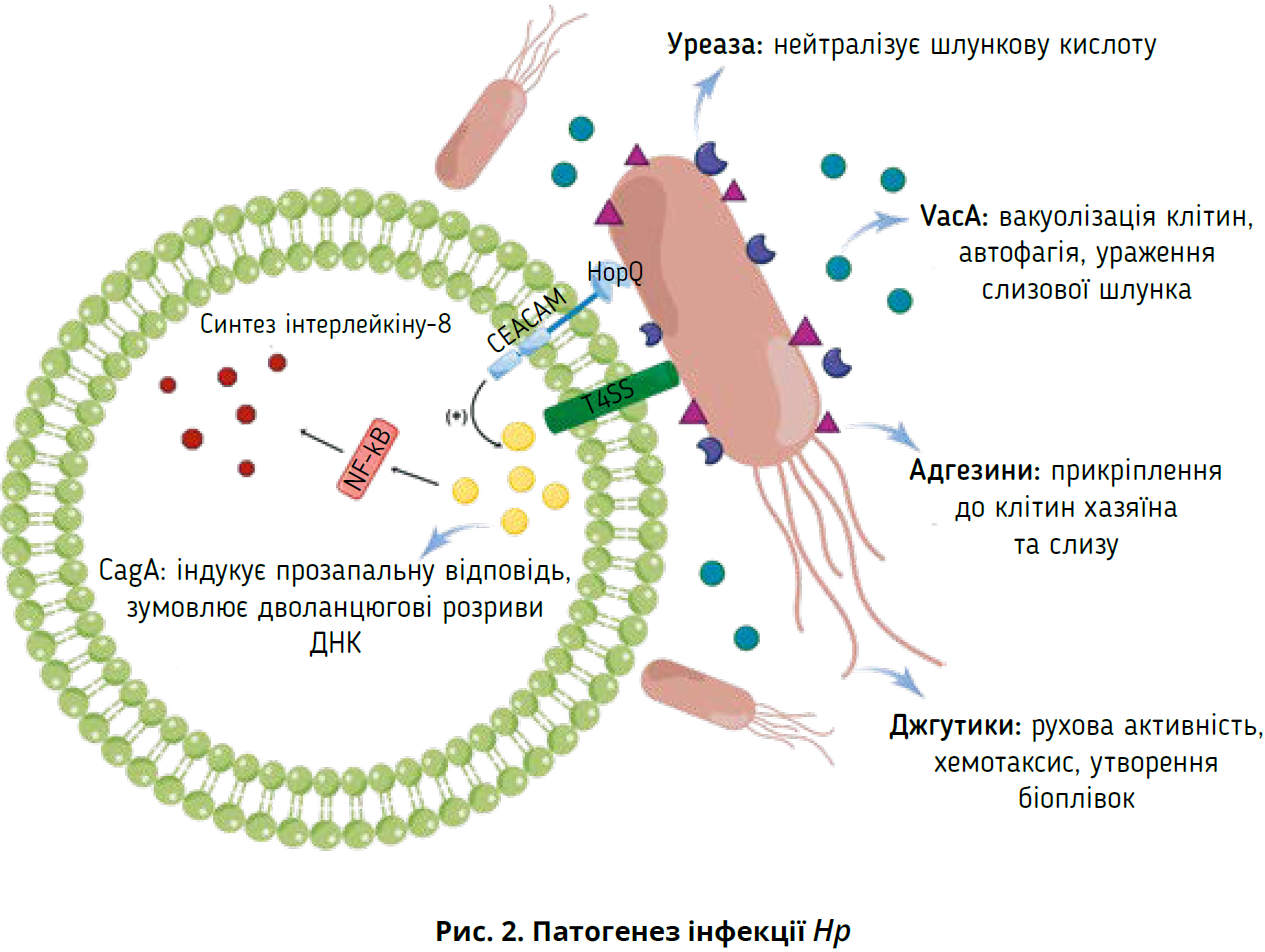
Задля успішної колонізації та розвитку інфекції бактерія Hp повинна мати здатність протистояти кислому середовищу шлунка та прикріплятися до клітин організму хазяїна. Сечовина, цитоплазматичний фермент, значною мірою відповідає за кислотостійкість Hp. Завдяки каталізу вона регулює рН шлункового середовища, перетворюючи сечовину на вуглекислий газ і аміак. Достатня кількість іонів нікелю має бути присутньою в шлунку для забезпечення повноцінного функціонування однієї молекули активної уреази. Низький рівень нікелю призводить до зниження виживання Hp та колонізації через відсутність активації уреази. Продемонстровано, що прозапальні властивості уреази зумовлюють перетворення ендотеліальних клітин на активні форми кисню, які спричиняють інфікування Hp (de Jesus Souza et al., 2019). Окрім сильного зв’язку з такими захворюваннями, як гастрит і пептична виразка, встановлено зв’язок між уреазою Hp та позашлунковими захворюваннями (наприклад, хвороба Альцгеймера), що пояснюються прозапальною активністю уреази, активацією імунної системи, які спричиняють нейрозапалення й тау-фосфорилювання (Uberti et al., 2022). Використання інгібіторів уреази для пригнічення функції уреази вважають потенційно перспективною стратегією ерадикації Hp.
Рухливість джгутиків є ефективним способом проникнення Hp у шар шлункового слизу; джгутики здатні забезпечувати різні режими руху для полегшення колонізації залежно від середовища, в якому перебувають бактерії (рис. 2). Моторна відповідь джгутиків, яка забезпечує обертання джгутика задля руху, відіграє ключову роль у виживання бактерій у різних середовищах (Tan et al., 2021). Окрім рухових функцій, джгутики сприяють утворенню біоплівки. Біоплівки – це адгезивні агрегати мікроорганізмів, укладені в гідратований матрикс позаклітинних полімерних речовин. Вони захищають бактерії від антибіотиків і агресивних середовищ. Доведено, що Hp здатна модифікувати свій фенотип при вирощуванні в біоплівці, змінюючи свій метаболізм і видозмінюючи форму джгутиків (органели руху) в адгезивні структури (Hathroubi et al., 2020).
Більшість штамів Hp містять VacA, дифузний пороутворювальний екзотоксин, який індукує утворення вакуоль в еукаріотичних клітинах. Наукове співтовариство, що займається вивченням Hp, надало більш точний і всебічний опис генотипів VacA. Нині ідентифіковано різні генотипи VacA, а саме: s1, s2, i1, i2, i3, m1, m2 та m3 (El Khadir et al., 2020). У клітинах GES-1 VacA може спричиняти пошкодження мітохондрій, змінюючи мітохондріальний мембранний потенціал, що призводить до PINK1/Parkind-залежної мітофагії (Wang et al., 2022c).
Чинники вірулентності можуть взаємодіяти та впливати один на одного. Штами VacA s1, наприклад, також несуть CagA, тоді як майже всі CagA-негативні штами несуть менш вірулентний генотип VacA s2/m2 (Šterbenc et al., 2019). VacA діє як костимулятор фосфорилювання CagA; він також може чинити синергічний вплив і сприяти накопиченню CagA в епітеліальних клітинах шлунка під час інфікування Hp (Ansari and Yamaoka, 2020). Одночасне виявлення декількох чинників вірулентності підвищує ризик шлункових захворювань.
Діагностична стратегія
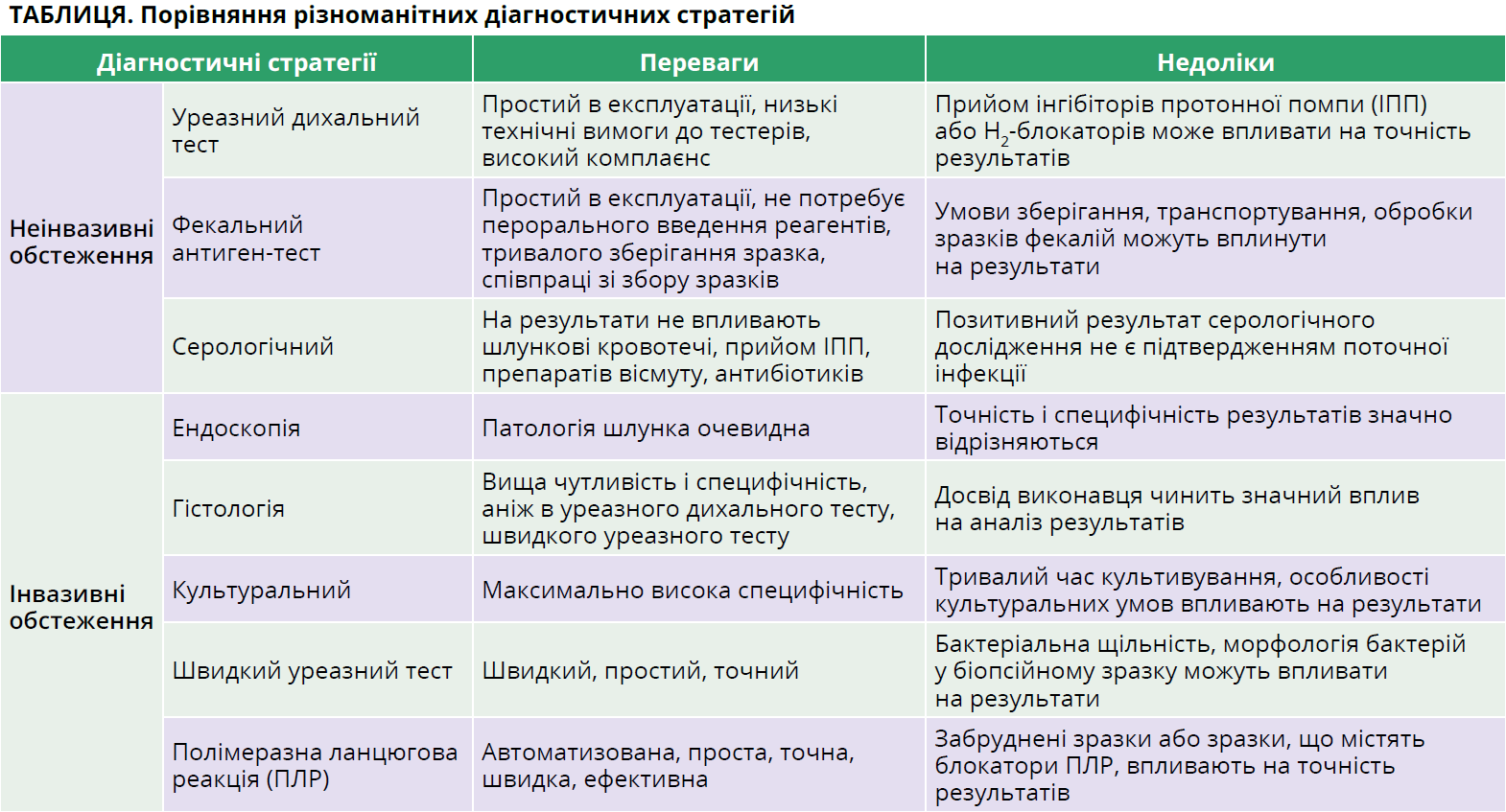
Точність діагностування Hp є важливою частиною боротьби з інфекціями, спричиненими цією бактерією, яка може значно покращити здоров’я населення. Залежно від потреби в проведенні ендоскопії методи виявлення Hp поділяють на інвазивні та неінвазивні (табл.).
Лікування
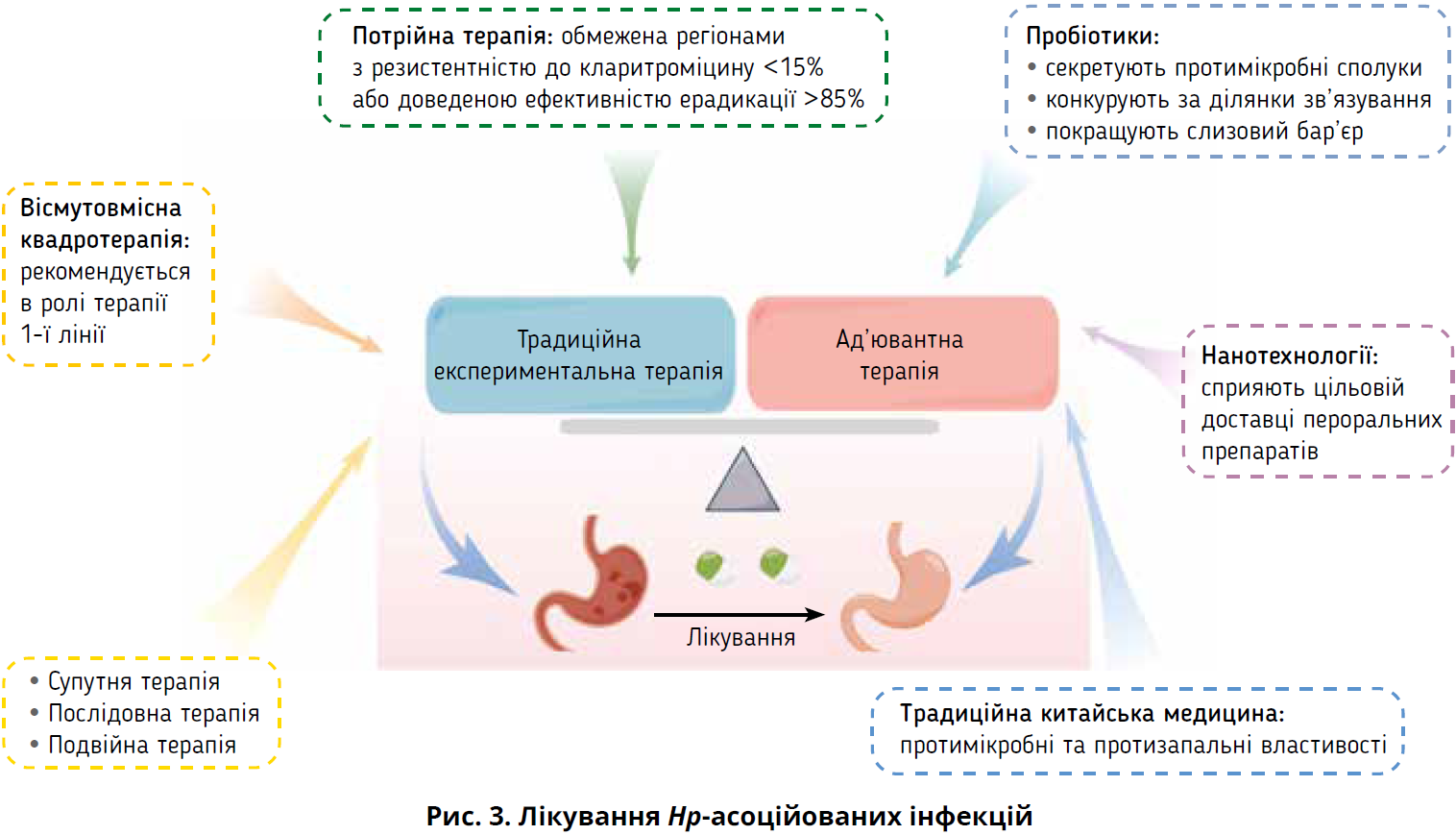
Потрійна терапія
Стандартна потрійна терапія є однією з найпоширеніших терапевтичних схем, які застосовуються для ерадикації Hp; вона складається з ІПП та двох антибіотиків. Зазвичай призначають ІПП (омепразол, лансопразол, пантопразол, рабепразол, езомепразол); часто використовують такі антибіотики, як амоксицилін, кларитроміцин, левофлоксацин, метронідазол. Здебільшого стандартна потрійна терапія триває 10-14 днів до повної ерадикації Hp. Зростання антибіотикорезистентності ускладнило ерадикацію Hp, особливо через резистентність до кларитроміцину, і потрійна терапія кларитроміцином не може більше бути доцільною емпіричною терапією 1-ї лінії (Malfertheiner et al., 2022). Слід, однак, зазначити, що в регіонах із низькою резистентністю до кларитроміцину потрійну терапію призначають як схему 1-ї лінії. Дослідження стверджують: незважаючи на незадовільну ефективність стандартної потрійної терапії, потрійна терапія вонопразаном (вонопразан, амоксицилін, кларитроміцин) дає змогу досягти високих показників ерадикації – >90%, а потрійна терапія езомепразолом (левофлоксацин, езомепразол, кларитроміцин) має найвищий рівень ефективності ерадикації цв західних країнах (Rokkas et al., 2021). Вонопразан – це новий калієвий конкурентний блокатор із кращою кислотопригнічувальною здатністю.
Вісмутовмісна квадротерапія
У регіонах із високим рівнем резистентності до кларитроміцину (>20%) як ерадикаційна терапія 1-ї лінії Hp рекомендується вісмутовмісна квадротерапія (Malfertheiner et al., 2022). Зазвичай її складають ІПП, вісмут і два антибіотики. Вісмут захищає слизову оболонку та чинить бактерицидну дію на Hp, пригнічуючи деякі її ферменти: уреазу, фумаразу, алкогольдегідрогеназу, фосфоліпази (Alkim et al., 2017). Короткостроковий профіль безпеки вісмуту є відмінним і не спричиняє лікарської резистентності. Пілера, капсула «три в одному» з вісмуту калію цитратом, метронідазолом, тетрацикліном, нещодавно стала доступною для спрощення процесу прийому препаратів. Вісмуту калію цитрат можна замінити вісмутом пектином (Cao et al., 2021). Найчастіше рекомендованим антибіотиком у вісмутовмісній квадротерапії є тетрациклін, який набуває значної популярності завдяки своїй ефективності та безпеці. Попередні дослідження довели, що 10-денний курс вісмутовмісної квадротерапії дає змогу досягти 95% ефективності ерадикації Hp у дітей із високим рівнем комплаєнсу (Dutta and Phull, 2021). Найефективнішим варіантом терапії 1-ї лінії для пацієнтів з алергією на пеніцилін визнано 10-14-денну вісмутовмісну квадротерапію. Ефективність і частота виникнення побічних ефектів за 14-денному курсу вісмутовмісних препаратів порівнянна з такими за 10-денного курсу вісмутовмісних препаратів (Dutta and Phull, 2021).
Супутня, послідовна та подвійна терапія
Три схеми супутньої, послідовної та подвійної терапії мають назви, які відповідають способу прийому відповідних препаратів (наприклад, послідовне або комбіноване застосування). У дослідженнях, проведених у М’янмі, ефективність і переносимість послідовної терапії визнані зіставними з такими комбінованої терапії (Myint et al., 2020). Одночасний прийом чотирьох препаратів (ІПП, трьох антибіотиків) під час супутньої терапії, яку часто називають «безвісмутною квадротерапією», дає змогу досягти результатів, порівнянних з іншими видами терапії, або навіть перевищити їх. Іспанська консенсусна нарада підтримала використання безвісмутної квадротерапії як 1-ї лінії (Gisbert et al., 2022). Проте складні схеми прийому ліків, які застосовуються при послідовній і супутній терапії, здатні збільшити поширеність антибіотикорезистентності в усьому світі. Супутня терапія (ІПП, метронідазол, кларитроміцин, амоксицилін) визнана неефективною за наявності подвійної резистентності до кларитроміцину/метронідазолу, необхідно припинити її широке застосування до впровадження тестів для визначення чутливості або до появи препаратів-замінників (Graham et al., 2018).
ІПП й амоксицилін становлять подвійну терапію. Дослідження, проведене в Японії, в місцевості з високим рівнем резистентності до кларитроміцину, довело, що застосування подвійної терапії, яка включала вонопразан (20 мг) і амоксицилін (750 мг 2 р/добу), асоціювалося із задовільними показниками ерадикації Hp та комплексної клінічної ефективності; вони виявилися зіставними з результатами, досягнутими на тлі потрійної терапії із застосуванням вонопразану. Подвійна терапія, що застосовувалася в цьому дослідженні, включала одночасний прийом вонопразану й амоксициліну (Suzuki et al., 2020). Високодозова подвійна терапія, котра передбачає застосування високих доз і більшу частоту прийому препаратів, розроблена для подальшого покращення ефективності ерадикації Hp.
За даними нещодавно опублікованого метааналізу, високодозова подвійна терапія є найефективнішим методом лікування інфекції Hp, оскільки вона спричиняє найменше побічних ефектів (Zhu et al., 2020). Модифікована подвійна терапія із застосуванням високих доз і частим прийомом визнана настільки ж ефективною та безпечною, як вісмутовмісна квадротерапія, а також дешевшою (Yang et al., 2019).
Висновки
У цій статті наведено всебічний огляд нещодавніх досліджень інфекції Hp, який охоплює сім різних напрямів. Незважаючи на значний прогрес у розумінні хвороби від моменту її відкриття, подальше вивчення механізмів, які лежать в її основі, є вкрай необхідним. Поширеність ізолятів Hp значно варіює в різних регіонах, що потенційно може впливати на тяжкість клінічних проявів. Важливо з’ясувати, які чинники вірулентності переважають у кожній конкретній місцевості, щоб визначити нові мішені для терапевтичного втручання. Для клінічної діагностики Hp потрібен більш точний, менш інвазивний, простіший метод. Через зростання антибіотикорезистентності Hp потрібно зосередити увагу на механізмах виникнення інфекції, розробленні вакцин, дослідженні нових ефективних методів терапії та лікарських засобів.
Література
Sun Q., et al. Helicobacter pylori infection: a dynamic process from diagnosis to treatment. Front. Cell. Infect. Microbiol. 2023 Oct 19. doi: 10.3389/fcimb.2023.1257817.