Фармакотерапія хронічного й епізодичного закрепу: оптимальний вибір у коротко- та довготривалій перспективі
Підготувала канд. мед. наук Тетяна Можина
Пацієнти, які звертаються до лікаря зі скаргами на закреп, прагнуть досягти очікуваного полегшення негайно. Неприємні фізичні відчуття, що переплітаються з тривожним нетерпінням, провокують появу імпульсивного прагнення лише одного – позбутися неприємного стану якнайшвидше. Нетерпіння змушує шукати миттєві рішення: в аптеці купуються ліки, які «працюють швидко» або «точно подіють уже сьогодні», стираючи з поля зору ймовірність того, що закреп може повернутися (і не один раз) і стати причиною інших вагомих проблем зі здоров’ям.
Окрім наслідків, які лежать на поверхні, – суттєвого зниження якості життя, соціальної працездатності [34], погіршення когнітивних здібностей [43] і значного зростання економічного тягаря [21], закреп збільшує ймовірність розвитку інфаркту міокарда на 14% [38], будь-якого інсульту – на 41%, ішемічного інсульту – на 50% [39]. Закреп навіть погіршує прогноз у хворих з гострою серцевою недостатністю [17] та гострим ішемічним інсультом [40], зумовлює повторні госпіталізації через погіршення серцевої недостатності [32]. Через такі невтішні дані «звичайний» закреп визнано важливим захворюванням, яке згідно з Міжнародною класифікацією хвороб 10-го перегляду має власний окремий код – К59.0 [1]. Саме тому пошукам оптимального розв’язання проблеми хронічного закрепу присвячено різноманітні міжнародні практичні настанови. Переважна більшість з них починає непростий шлях вирішення цього питання з наведення дефініції хронічного закрепу.
Хронічний та епізодичний закреп: яка різниця?
Нерідко складності виникають іще при спробі визначення самого поняття закрепу, адже одні пацієнти мають на увазі рідкісний акт дефекації, другі – відчуття неповного випорожнення, а треті підкреслюють надмірні зусилля під час спорожнення кишківника. Найсучаснішу дефініцію наводить Японська гастроентерологічна асоціація, котра визначає закреп як «стан, що характеризується однією чи обома з таких ознак: затримка калу, який мав би бути виведений з товстої кишки, що призводить до появи грудкуватих або твердих випорожнень і зниження частоти спонтанних випорожнень; та/або відчуття розчарування під час дефекації, яке супроводжується надмірним напруженням, відчуттям неповного випорожнення, аноректальною обструкцією й утрудненням дефекації» [26].
При цьому підкреслюється, що хронічний закреп являє собою «патофізіологічний стан, за якого тривалий закреп заважає повсякденному життю та може спричинити різноманітні хвороби» [26], а поняття «хронічний» продовжують визначати згідно з IV Римськими критеріями – «кожний симптом почався ≥6 місяців тому та зберігається протягом останніх 3 місяців» [31].
Водночас Римська робоча група запропонувала консенсусний документ (2024), у якому розглядає проблему епізодичного закрепу, визначаючи його як «наявність принаймні 1 функціональної ознаки закрепу (зменшення частоти випорожнень, натужування, грудкуваті або тверді випорожнення, відчуття неповного випорожнення чи аноректальної обструкції) за відсутності тривожних ознак або симптомів, яка виникає нечасто, з нерегулярною періодичністю, але є досить неприємною, щоби спонукати пацієнта звернутися по допомогу» [8]. Отже, головним критерієм діагностування епізодичного закрепу є наявність неприємних відчуттів, які змушують пацієнта вдаватися до активних дій, тоді як тривалість існування скарг суворо не регламентується.
Найбільш схильні до виникнення закрепів жінки, особи похилого та старечого віку, а також пацієнти, які мають психосоціальні й поведінкові особливості, генетичну схильність, часто піддаються впливу стресових факторів, мають дисбіотичні зміни мікробіоти, порушення імунної системи, дисфункцію кишкової моторики, низьку рухову активність.
Положення вищезазначених рекомендацій, а також інших міжнародних фахових настанов одностайно наголошують на потребі ретельного виключення симптомів тривоги [8, 9, 26, 36]. Відсутність крові в калі, незрозумілої втрати маси тіла, анемії, нічних симптомів, лихоманки, сильного болю разом з необтяженим сімейним анамнезом з колоректального раку, запальних захворювань кишківника, поліпів кишківника, негостра поява перелічених змін, відсутність пальпаторних змін, які свідчать на користь аноректального утворення, дають змогу підтвердити функціональний (первинний або вторинний) характер закрепу та призначити фармакотерапію епізодичного чи хронічного закрепу без додаткового лабораторно-інструментального обстеження.
Фармакотерапія
Сучасні підходи до лікування хронічного й епізодичного закрепу ґрунтуються на декількох стовпах, які передбачають призначення як немедикаментозних заходів, так і медикаментозної терапії. Ведення пацієнтів із хронічним закрепом спрямоване на досягнення та тривале підтримання повного спонтанного випорожнення, тобто випорожнення без надмірного подразнення, котре не супроводжується будь-якими утрудненнями, ректальною/анальною обструкцією або залишковим калом, а також відбувається з частотою не менш ніж 3 дні на тиждень без твердого/рідкого калу [23]. Фармакологічна підтримка пацієнтів з епізодичним закрепом має подібні цілі – забезпечення швидкого випорожнення та подальше нормалізування моторної функції кишківника. Отже, лікування як хронічного, так й епізодичного закрепу доцільно розглядати крізь призму коротко- та довготривалої перспективи.
-
Короткострокова перспектива: оптимальний засіб – поліетиленгліколь (макрогол)
Важлива заповідь у веденні пацієнтів із хронічним або епізодичним закрепом, яка полягає в модифікації способу життя з корекцією раціону харчування, збільшення кількості споживання рідини, часто не дає змоги забезпечити швидке та повне спорожнення кишківника. Тому терапією першої лінії є призначення осмотичних проносних засобів – погано або взагалі не всмоктуваних речовин, які при надходженні в кишківник підвищують внутрішньопросвітний осмотичний градієнт, забезпечуючи секрецію води й електролітів у просвіт кишківника, що сприяє пом’якшенню калу та його евакуації [44]. Одним з найбільш досліджених, ефективних і безпечних засобів із цієї групи є поліетиленгліколь (ПЕГ); його друга назва – макрогол. Ця неабсорбувальна макромолекула утримує водневі зв’язки з молекулами води й утримує рідину в порожнині товстої кишки, тим самим розм’якшуючи кал, збільшуючи його об’єм і забезпечуючи безперешкодне випорожнення [3].
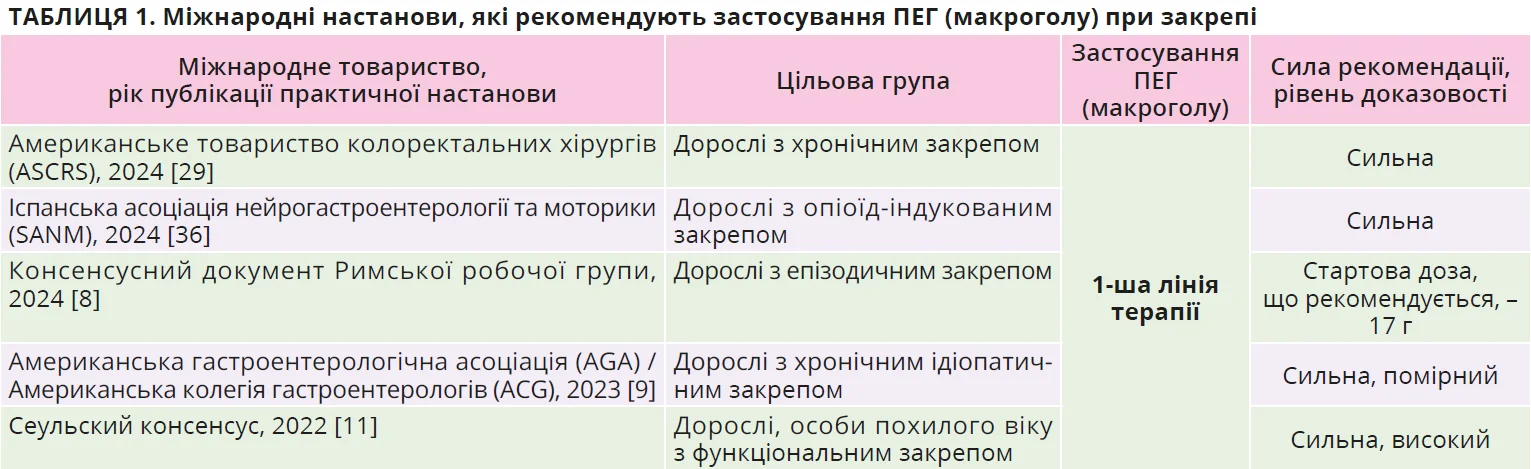
Макрогол є найвивченішим проносним засобом, який довів свою ефективність і перевагу над плацебо [30], тегасеродом [15], прукалопридом [12]. Управління США з контролю продовольства та медикаментів (FDA) високо оцінило результативність і добрий профіль безпеки макроголу та схвалило його застосування для лікування хронічного й епізодичного закрепу [8]. Ефективність і безпеку застосування ПЕГ підтверджено результатами багатьох рандомізованих клінічних досліджень, систематичних оглядів і метааналізів; зважаючи на опубліковані доказові дані, міжнародні товариства рекомендують використовувати саме його як терапію 1-ї лінії в лікуванні хронічного й епізодичного закрепу (табл. 1).
Макрогол визнано безпечним проносним засобом для застосування в осіб похилого віку, при цьому він довів свою безпеку як за короткотривалого (3 місяці), так і за довготривалого (близько 6 місяців) використання [28].
-
Довгострокова перспектива: терапія, що модулює мікробіом
Після досягнення спорожнення кишківника завдяки ПЕГ потрібно створити умови для самостійного функціонування кишківника шляхом відновлення та нормалізування кишкового мікробіому. Тому надзвичайно багатообіцяльним компонентом тривалого лікування закрепів вважають застосування пребіотиків і пробіотиків.
Пребіотик інулін
Інулін, типовий і найвивченіший пребіотик, являє собою розчинне харчове волокно, яке міститься в цикорії. Як будь-який пребіотик, інулін стійкий до переварювання та всмоктування в тонкій кишці, але піддається ферментації в товстій кишці. Він забезпечує відновлення кишкової мікробіоти, стимулюючи зростання корисних бактерій, переважно біфідобактерій; така властивість відома як «біфідогенний» ефект [41]. Інулін посилює вироблення коротколанцюгових жирних кислот – КЛЖК (бутират), які взаємодіють з імунними клітинами через G-білкові рецептори, сприяючи виникненню протизапальної дії [5]. Інулін здатний безпосередньо впливати на імунні й епітеліальні клітини, посилюючи бар’єрну функцію кишківника та модулюючи імунітет [5].
Метааналіз підтверджує здатність інуліну збільшувати частоту випорожнень (95% довірчий інтервал (ДІ) 0,04-1,34), покращувати консистенцію випорожнень, зменшувати час проходження калових мас кишківником, зменшувати твердість випорожнень [13]. Інулін не тільки стимулює ріст корисних біфідобактерій, лактобактерій [33, 37], поліпшує бар’єрну функцію кишківника [37], але й має додаткові переваги. Він покращує ліпідний обмін, сприяє зниженню ваги та рівня глікемії, пригнічує експресію прозапальних факторів і покращує функціонування гастроінтестинальної імунної системи [24], поліпшує засвоєння кальцію та збільшує щільність кісткової тканини [6], нормалізує випорожнення кишківника та зменшує прояви депресії (рис. 1).
Ґрунтуючись на даних доказової медицини, Група експертів з дієтичних продуктів, харчування й алергії Європейського агентства з безпеки харчових продуктів (EFSA) переконливо констатувала: «Інулін із цикорію сприяє підтримці нормальної дефекації шляхом збільшення частоти випорожнень в дозі не менше 12 г на добу» [18]. FDA, враховуючи унікальні фізико-хімічні та поживні властивості інуліну, схвалила його застосування як харчового волокна для покращення цінності продуктів [7]. Чинні практичні настанови також підтримують застосування інуліну з лікувальною метою: «Харчові волокна ефективно покращують симптоми хронічного закрепу, скорочуючи час проходження їжі товстою кишкою та збільшуючи частоту випорожнень» [11].
Пробіотики
Корекція кишкового мікробіому за допомогою пробіотичних штамів є другою необхідною частиною довготривалого забезпечення оптимальної роботи кишківника. Метааналіз 17 досліджень довів, що приймання пробіотиків пов’язане зі зниженням часу кишкового транзиту (зважена середня різниця (ЗСР) 0,93; 95% ДІ 0,47-1,40; р=0,0001), поліпшенням консистенції калових мас (ЗСР 0,38; 95% ДІ 0,05-0,70; р=0,023) та покращенням результатів запитальника Patient Assessment of Constipation Symptom (ЗСР -0,28; 95% ДІ від -0,45 до -0,11; р=0,001) [16].
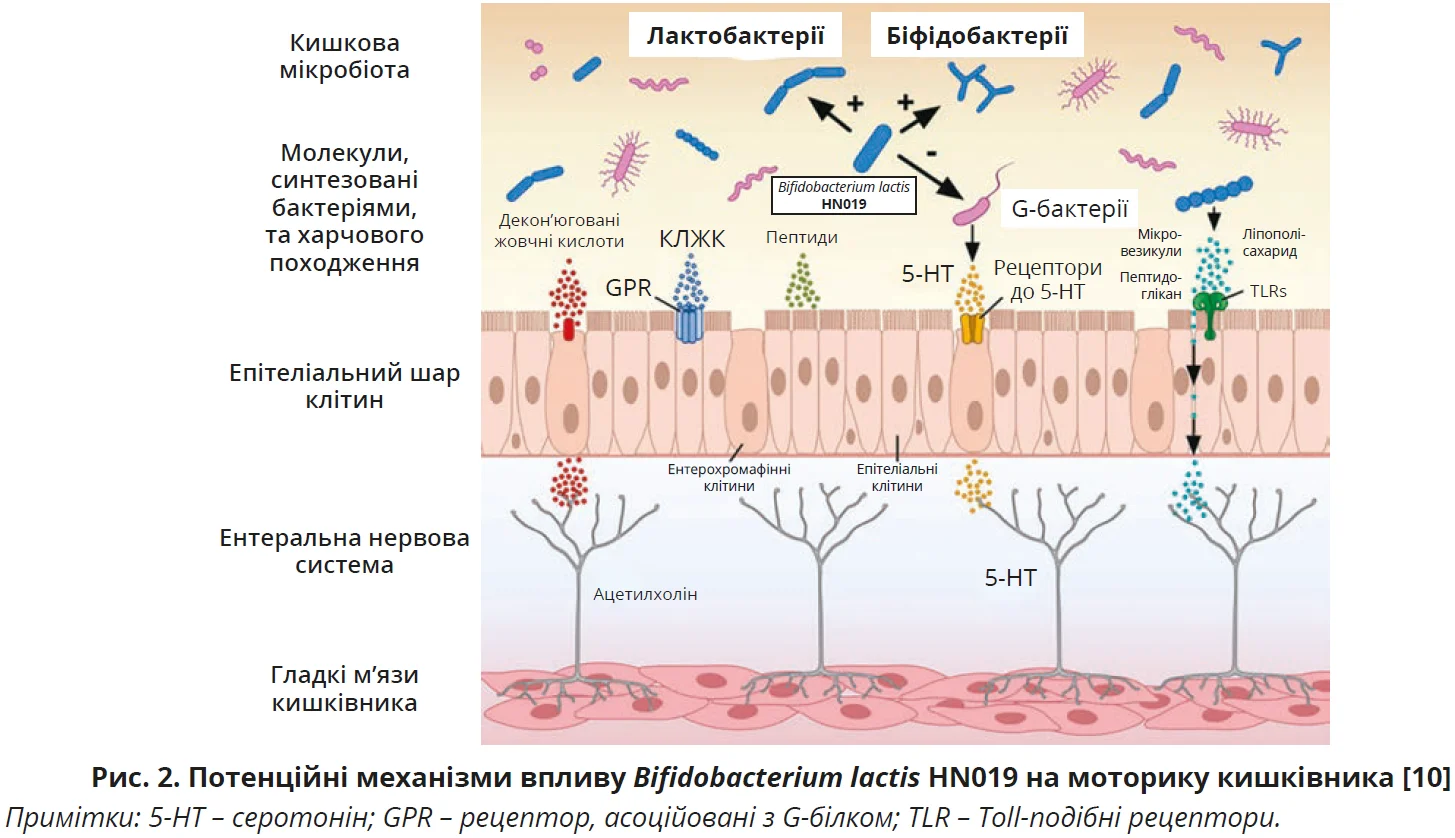
Водночас терапевтичний ефект пробіотиків строго залежить від штаму пробіотичних бактерій [11]. Найбільшу результативність у лікуванні закрепів продемонстрували штами Bifidobacterium lactis – вони забезпечують достовірне зростання частоти дефекації порівняно з іншими штамами [4, 42]. Серед значного різноманіття виду B. lactis найбільшу доказову базу має штам B. lactis HN019: різноманітні дослідження підтверджують, що B. lactis HN019 скорочує час проходження їжі кишківником і збільшує частоту дефекації при функціональному закрепі, ймовірно, шляхом модуляції осі «кишківник – мозок – мікробіота» за допомогою КЛЖК, отриманих унаслідок мікробної ферментації (рис. 2) [10]. Крім цього, B. lactis HN019 підтримує цілісність кишкового бар’єра, сприяючи зростанню експресії зонуліну та підтримуючи нормальну функцію щільних з’єднань; B. lactis HN019 також конкурує й елімінує потенційні патогени за допомогою різних механізмів, регулюючи імунний захист організму [14]. B. lactis HN019 забезпечує сприятливі зміни кишкової мікробіоти, збільшуючи кількість лакто- та біфідобактерій, пригнічуючи певні грамнегативні бактерії (G-бактерії) (рис. 2) [10]. Похідні B. lactis HN019, нейротрансмітери та модулятори харчового походження, як-от декон’юговані жовчні кислоти, КЛЖК, серотонін, взаємодіють з рецепторами, що експресуються в епітеліальному шарі клітин, впливають на аферентні нейрони в ентеральній нервовій системі та покращують регулювання моторики товстої кишки (рис. 2) [10].
Цікаво, що поліпшення дефекації відбувається на тлі застосування як низьких, так і високих доз B. lactis HN019. У подвійно сліпому рандомізованому плацебо-контрольованому дослідженні доведено, що 28-денне приймання B. lactis HN019 значно підвищує частоту дефекацій у хворих з функціональним закрепом з початково низькою частотою випорожнень кишківника (≤3 дефекації на тиждень), причому зазначене покращення відбувається при застосуванні як високих (1×1010 КУО), так і низьких (1×109 КУО) доз пробіотика: частота дефекацій збільшується на 2,0±1,97 та 1,65±2,72 випорожнення відповідно [25].
Оновлені положення практичної настанови «Пробіотики та пребіотики», яку презентує Всесвітня гастроентерологічна організація (WGO), підтримують доцільність застосування B. lactis HN019 у лікуванні функціонального закрепу [20]. FDA надала штаму B. lactis HN019 статус GRAS, підкреслюючи його загальновизнану безпеку; китайські спеціалісти схвалюють його використання в харчових продуктах, призначених для годування малюків і харчування дорослих [10].
Синбіотики
Останнім часом різноманітні міжнародні товариства віддають перевагу застосуванню синбіотиків: наприклад, WGO окремо наголошує на доведеній ефективності багатокомпонентних синбіотиків, до складу яких входить інулін [20]. Нового значення набуває концепція переважного застосування синбіотиків від Міжнародної наукової асоціації пробіотиків і пребіотиків (ISAPP), у якій підкреслюється доцільність використання комплементарних засобів, складові частини котрих – пробіотичні штами та пребіотики – потенціюють дію один одного, не тільки покращуючи гастроінтестинальну мікробіоту, але й впливаючи на позакишкові мікробні екосистеми [27]. Згідно зі стратегією, запропонованою ISAPP, поєднання пребіотика інуліну та пробіотика B. lactis HN019 можна вважати надзвичайно доцільним, адже таку комбінацію можна розглядати не лише як комплементарний синбіотик (пробіотик і пребіотик діють незалежно один від одного), а і як синергічний синбіотик (пребіотик використовується не тільки коменсальними бактеріями, котрі мешкають у кишківнику, але й самим пробіотичним штамом, що значно підвищує ефективність засобу).
Оптимальна стратегія корекції хронічного й епізодичного закрепу
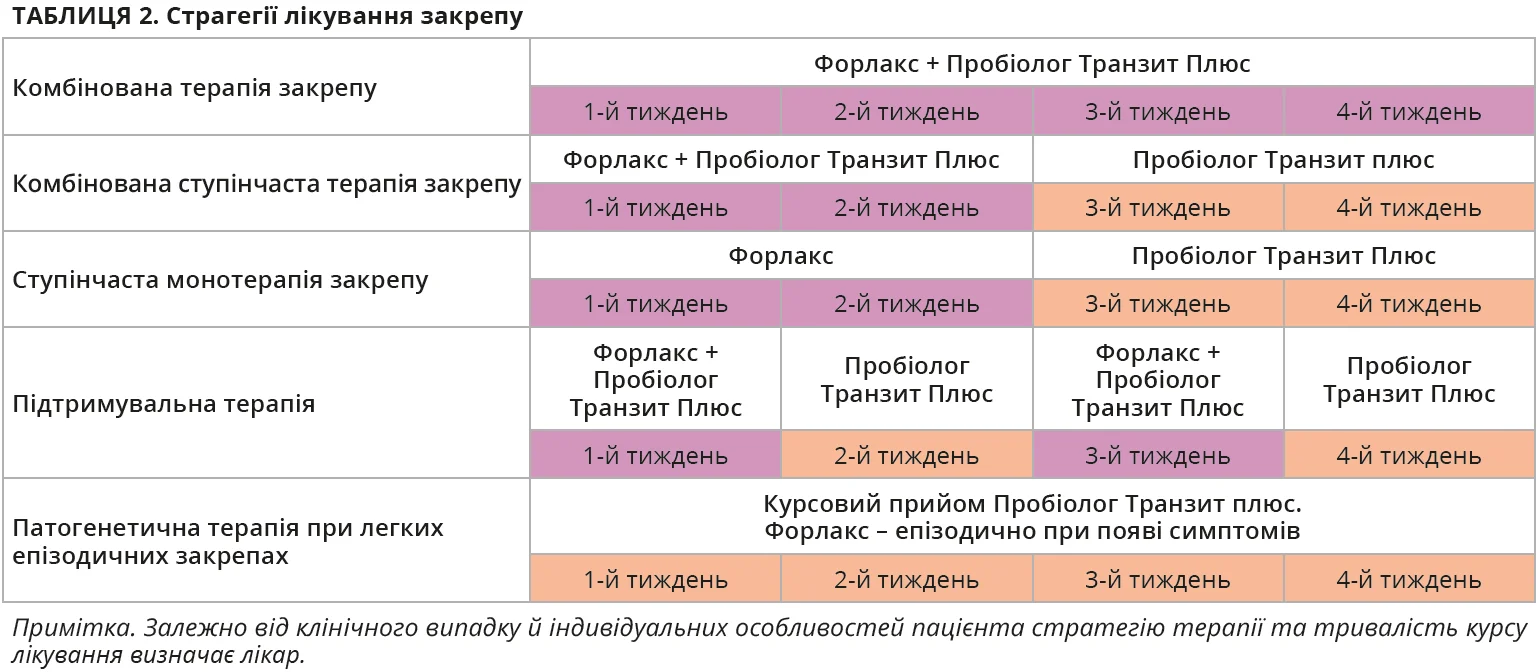
Оптимальним способом відновлення спорожнення кишківника в осіб із хронічним або епізодичним закрепом вважають поєднання засобів, які забезпечують коротко- та довготривалий вплив на моторну функцію кишківника (табл. 2). Із цією метою пропонують застосовувати дві стратегії: одночасне призначення ПЕГ (макроголу) та синбіотика [19, 22] чи покроковий підхід – досягнення спорожнення кишківника завдяки прийманню ПЕГ (макроголу) з подальшим його скасуванням і призначенням синбіотика, який дає змогу нормалізувати спорожнення кишківника й запобігти виникненню закрепів у найближчому майбутньому [35].
Прикладом оптимального тандему можна вважати комбіноване застосування ПЕГ (макрогол 4000, відомий на вітчизняному ринку під торговою назвою Форлакс) і синбіотика, що містить інулін із цикорію та B. lactis HN019 (Пробіолог Транзит Плюс). Короткотривале застосування Форлакс (10-20 г на добу) дає змогу досягти швидкого клінічного ефекту та забезпечити спорожнення кишківника протягом 24-48 годин від моменту приймання препарату [3]. Одночасне або наступне приймання синергічного синбіотика Пробіолог Транзит Плюс (інулін із цикорію 12 г; B. lactis HN019 – 2×109 КУО) сприятиме відновленню кишкового мікробіоценозу та подальшій нормалізації моторної функції кишківника протягом тривалого часу [3]. Обидва препарати мають схожий спосіб застосування: перед вживанням уміст кожного пакетика слід розчинити в склянці води (Форлакс, Пробіолог Транзит Плюс) або додати до таких готових негарячих страв, як сік, кисломолочні напої, сир натуральний білий (Пробіолог Транзит Плюс). Зазвичай Форлакс рекомендують уживати 1 раз на добу, вранці, тоді як Пробіолог Транзит Плюс доцільно застосовувати вранці та ввечері під час або безпосередньо перед їдою [2, 3]. Тривалість застосування ПЕГ (Форлакс) з метою нормалізації спорожнення кишківника, відповідно до положень деяких міжнародних документів, може бути досить довгою та становити близько 3-6 місяців [28]. Пробіолог Транзит Плюс призначений для коротшого застосування: автори рандомізованого контрольованого дослідження довели доцільність і безпеку використання штамів B. lactis HN019 протягом 28 діб [25].
Висновки
Хронічний та епізодичний закреп є поширеною клінічною проблемою, з якою часто стикаються лікарі-практики. Лікування хронічного закрепу ґрунтується на комплексному підході, який не обмежується лише рекомендаціями щодо модифікації дієти, способу життя, а передбачає також призначення оптимальної фармакотерапії з урахуванням моторної функції кишківника та змін кишкового мікробіоценозу. Оптимальною фармакотерапією як хронічного, так і епізодичного закрепу може бути призначення засобів, які дають змогу нормалізувати спорожнення кишківника в коротко- та довготривалій перспективі. Одночасне або послідовне призначення осмотичного проносного засобу ПЕГ (Форлакс) разом із синбіотиком, який містить інулін, B. lactis HN019 (Пробіолог Транзит Плюс), забезпечує, відповідно, досягнення швидкого проносного ефекту та тривалої антиконстипаційної дії завдяки різному й синергічному механізму дії обох препаратів.