Екзокринна недостатність підшлункової залози та кишковий мікробіом за раку підшлункової залози: ціль для майбутніх діагностичних тестів і терапії?
Переклала й адаптувала канд. мед. наук Ольга Королюк
Вважається, що в пацієнтів із раком підшлункової залози бактерії в кишківнику та в пухлині відіграють важливу роль у рості пухлин та їхній чутливості до хіміотерапії. Встановлено, що екзокринна недостатність підшлункової залози (ЕНПЗ) поширена в пацієнтів із раком підшлункової залози й асоціюється з гіршими результатами. І навпаки, замісна терапія панкреатичними ферментами (ЗТПФ) може покращити виживання таких пацієнтів. Причини цього не цілком зрозумілі. Можливо, ЕНПЗ несприятливо впливає на склад кишкового та пухлинного мікробіомів, тоді як ЗТПФ сприяє їх нормалізації. Якщо ці припущення відповідають дійсності, відкриваються перспективи для розроблення нових діагностичних тестів і методів лікування одного з найнесприятливіших видів раку – раку підшлункової залози.
ВСТУП
-
Мікробіота людини
Мікробіота – це термін, який використовується для опису близько 100 трильйонів мікроорганізмів, присутніх в організмі кожної людини [1-3]. Секвенування бактеріального геному нового покоління надає можливості вивчення взаємодії між мікробіотою та макроорганізмом [4-7]. Сучасні методи включають профілювання на рівні організму шляхом секвенування гена 16S рРНК або складніше профілювання на рівні гена за допомогою метагеномного або метатранскриптомного секвенування [4-7]. Крім вивчення складу мікробних популяцій, секвенування дає можливість зрозуміти функції різних видів мікроорганізмів, їхні можливі впливи на метаболічні й імунні процеси господаря [4-8].
-
Кишковий мікробіом
Мікробіом – це популяція мікроорганізмів у поєднанні з їхніми генами в певній системі організму. Наприклад, мікробна популяція в кишківнику називається кишковим мікробіомом [1-3]. Продемонстровано, що кишковий мікробіом відіграє ключову роль у модулюванні метаболічної й імунної функцій господаря, виникненні та прогресуванні запальних захворювань кишківника й коло ректального раку [9-14]. Останні дані підкреслюють функціональну роль кишкового мікробіому у визначенні ефективності та токсичності хіміотерапевтичних засобів, які використовуються для лікування раку [15]. Крім того, кишковий мікробіом пов’язаний із прогресуванням певних позакишкових станів, зокрема хронічних захворювань печінки й аденокарциноми протоків підшлункової залози (АППЗ) [16-19]. Що стосується механізмів позакишкових впливів, то, ймовірно, відбувається транслокація бактерій та їхніх метаболітів через портальний кровообіг, мезентеріальні лімфатичні вузли або безпосередньо через системи жовчних і панкреатичних протоків [20-22].
-
Аденокарцинома протоків підшлункової залози
Незважаючи на прогрес у лікуванні багатьох злоякісних пухлин, АППЗ залишається однією з провідних причин смерті від раку в усьому світі; показники 5-річної виживаності в пацієнтів цієї когорти стабільно нижче 10% [23-25]. Причинами несприятливого прогнозу є: 1) виявлення АППЗ на пізніх стадіях, коли уражено прилеглі великі судинні структури, що перешкоджає радикальній операції; 2) наявність на момент діагностики віддалених метастазів, здебільшого в печінку через портальний дренаж підшлункової залози [26-29]. Сучасні міжнародні практичні настанови не рекомендують резекцію АППЗ у разі метастазів у печінку [30-34]. Якщо ж можна виконати резекцію пухлини, то 5-річна виживаність може досягти 30% за умови проведення системної терапії [35]. Навіть за виконання хірургічної резекції існує висока ймовірність рецидиву [36]. Впродовж 2 років після резекції й ад’ювантної терапії первинної АППЗ у 75% пацієнтів виникають рецидиви [23, 37, 38]. Отже, ця хвороба потребує нових діагностичних і терапевтичних цілей. Кишковий мікробіом може виявитися однією з найперспективніших цілей для майбутніх методів лікування.
-
Зміни в кишковому мікробіомі в пацієнтів з АППЗ
Нещодавнє дослідження виявило зміни в кишковому мікробіомі на ранніх стадіях АППЗ [19]. Імовірно, кишковий мікробіом відіграє активну роль у прогресуванні АППЗ, оскільки виявлено відмінності в його складі в пацієнтів із короткостроковим і довгостроковим виживанням, причому більша різноманітність мікробіому асоціювалася зі сприятливішим прогнозом [39].
-
ЕНПЗ у разі раку підшлункової залози
ЕНПЗ визначають як недостатню секрецію панкреатичних ферментів і бікарбонатів для підтримки нормального травлення [40]. Встановлено, що ЕНПЗ поширена в пацієнтів із раком підшлункової залози та погіршується з часом. Нещодавнє проспективне когортне дослідження використовувало 13C-змішаний тригліцеридний дихальний тест для дослідження поширеності ЕНПЗ у 254 пацієнтів, які очікували на панкреатодуоденектомію за онкологічними показаннями. Поширеність ЕНПЗ у цій когорті становила 32,8% [41]. Проведений у 2016 році систематичний огляд виявив 4 дослідження, в яких оцінювали ЕНПЗ перед операцією шляхом визначення фекальної еластази-1. Середня поширеність ЕНПЗ становила 44% (діапазон – 42-47%) [42]. Механізмами ЕНПЗ є зниження секреції ферментів унаслідок наявності пухлини, а також зниження доставки й активації ферментів унаслідок обструкції протоки підшлункової залози, що перешкоджає пасажу панкреатичного соку у дванадцятипалу кишку [43]. Після панкреатодуоденектомії також спостерігається значне порушення фізіологічних механізмів, які контролюють секрецію підшлункової залози [44, 45].
За відсутності лікування ЕНПЗ суттєво порушує якість життя та спричиняє низку несприятливих симптомів: часті або невідкладні позиви на дефекацію, здуття живота, діарея, метеоризм, жирні випорожнення, втрата апетиту, блювання [46, 47]. Як наслідок, порушується травлення, що призводить до мальабсорбції, недоїдання та дефіциту альбуміну, преальбуміну, трансферину, ліпопротеїнів, жиророзчинних вітамінів, кальцію, магнію, цинку, тіаміну та фолієвої кислоти [48, 49]. Клінічно ЕНПЗ асоціюється з підвищеним ризиком остеопорозу, саркопенії та серцево-судинних подій [50-52].
У разі раку підшлункової залози саркопенія асоціюється зі збільшенням періопераційної смертності та зниженням загальної виживаності. Існує багато нервових і гормональних чинників, які впливають на саркопенію при раку підшлункової залози.
Багато з них взаємодіють із кишковим мікробіомом [53, 54]. Установлено також, що ЕНПЗ збільшує тривалість госпіталізації, післяопераційні ускладнення та витрати після резекції підшлункової залози [55, 56]. Імовірно, що ЕНПЗ унаслідок АППЗ істотно змінює кишковий мікробіом. Краще розуміння цих змін може відкрити можливості для ідентифікації нових діагностичних і терапевтичних цілей.
-
Замісна терапія панкреатичними ферментами
ЗТПФ полягає в пероральному застосуванні капсул, які містять синтетичні травні ферменти – ліпазу, протеазу й амілазу. Лікування ЕНПЗ за допомогою ЗТПФ покращує якість життя та збільшує виживаність пацієнтів із раком підшлункової залози, зокрема й неоперабельним [57-60]. Тому Національний інститут здоров’я та вдосконалення догляду Сполученого Королівства (NICE) та спеціалізовані настанови 2021 року рекомендують ЗТПФ для пацієнтів із раком підшлункової залози без необхідності отримання позитивних результатів діагностичних тестів [61, 62]. Механізми сприятливих впливів ЗТПФ не цілком зрозумілі, але зменшення мальабсорбції дає пацієнтам змогу переносити фізіологічно складне лікування – велику резекцію підшлункової залози та/або хіміотерапію [63, 64]. Дуже важливим є засвоєння жиророзчинних вітамінів. Наприклад, вітамін D модулює функцію стромальних клітин, зокрема фібробластів, у пацієнтів з АППЗ [65]. Дефіцит вітаміну D асоціюється з нижчими рівнями виживання при поширеному раку підшлункової залози [66].
-
ЕНПЗ та кишковий мікробіом
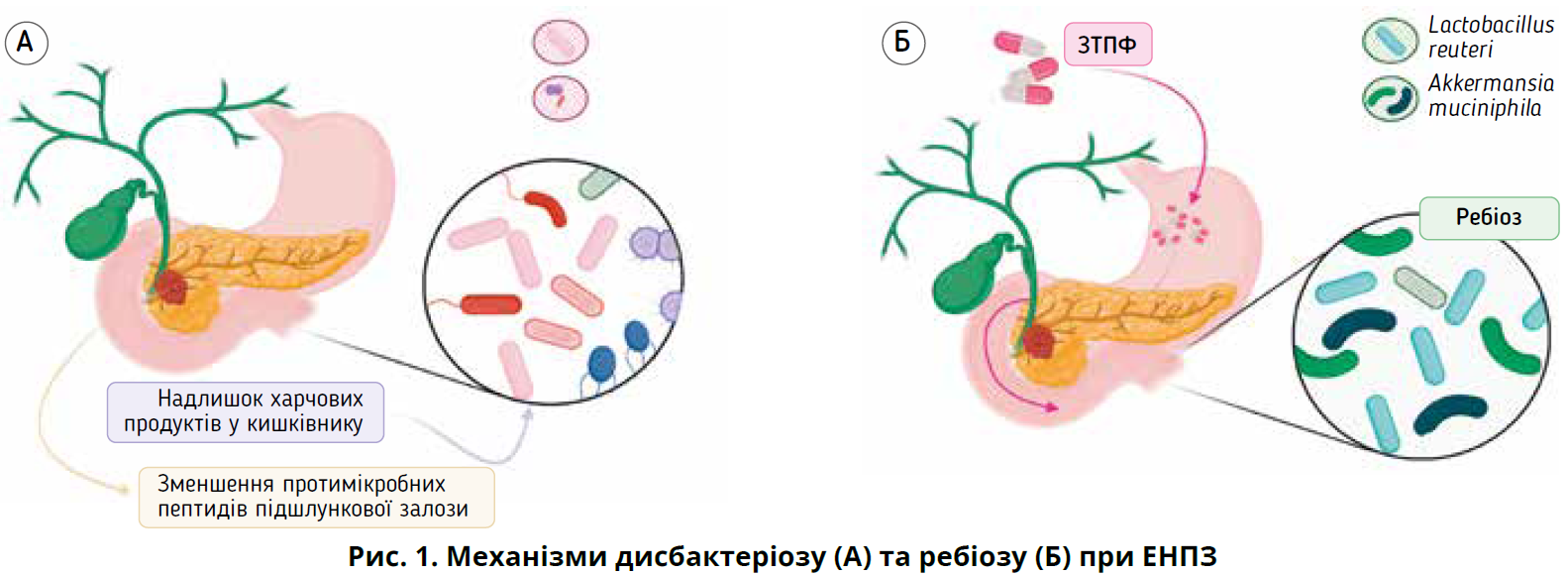
Вважається, що ЕНПЗ призводить до змін у складі кишкового мікробіому, тобто дисбактеріозу, що характеризується дисбалансом у різноманітності мікробіому [67-70]. Розуміння взаємозв’язків між мікробіомом та ЕНПЗ може допомогти в пошуку нових діагностичних і терапевтичних цілей, що покращить результати в пацієнтів з АППЗ.
Останні дані вказують на роль кишкового мікробіому в етіології та прогресуванні АППЗ, а також пов’язують зміни в кишковому мікробіомі з клінічними результатами та відповіддю на лікування [19, 20, 39, 71-73].
Взаємодія між екзокринною функцією підшлункової залози та кишковим мікробіомом
-
Вплив ЕНПЗ на кишковий мікробіом
Установлено, що ЕНПЗ поширена в пацієнтів із раком підшлункової залози. З’являються нові докази того, що екзокринна функція підшлункової залози тісно пов’язана зі складом кишкового мікробіому [67-69]. Є повідомлення про відмінності в кишковому мікробіомі в пацієнтів з ЕНПЗ, зокрема зменшення альфа-різноманітності, надмірний ріст бактерій
у тонкій кишці та втрата «корисних» бактерій [67-69].
У великому популяційному дослідженні за участю понад 1700 пацієнтів порівнювали склад кишкового мікробіому, визначеного методом секвенування гена 16S рРНК зразків калу, з функцією підшлункової залози, оціненою за рівнем фекальної еластази-1. Установлено, що зміни у складі кишкового мікробіому тісніше корелювали з екзокринною функцією підшлункової залози, ніж такі показники, як вік пацієнта, харчові чинники, діабет або куріння. Автори дійшли висновку, що екзокринна функція підшлункової залози є найважливішим чинником макроорганізму, який бере участь у формуванні кишкового мікробіому [67]. Тому ймовірно, що пацієнти з раком підшлункової залози, насамперед пацієнти з ЕНПЗ, також матимуть порушення кишкового мікробіому (рис. 1A) [19].
-
Регуляція кишкового мікробіому підшлунковою залозою
У підшлунковій залозі дорослої людини є три основні типи клітин: 1) ацинарні клітини, які виробляють травні ферменти; 2) епітеліальні клітини протоків, які виробляють багату на бікарбонат рідину, що транспортує травні ферменти в кишківник та оптимізує рН для функціонування ферментів; 3) клітини острівців Лангерганса, які виконують ендокринну функцію, виробляючи гормони, зокрема глюкагон та інсулін [74, 75]. В одному великому дослідженні вивчали роль ацинарних та епітеліальних клітин. Функцію ацинарних клітин оцінювали кількісно за допомогою імунохімічного аналізу фекальної еластази-1; функцію епітеліальних клітин – за допомогою стимульованої секретином магнітно-резонансної холангіопанкреатографії. Результати показали, що функція ацинарних клітин тісніше пов’язана зі складом кишкового мікробіому, ніж функція клітин протоків [67].
Ацинарні клітини виробляють багато різних продуктів, тому була спроба визначити, які саме продукти впливають на склад кишкового мікробіому.
Встановлено, що секрети підшлункової залози мають бактеріостатичну активність проти звичайних бактеріальних патогенів і фунгістатичну дію на Candida albicans [79]. Однак у собак указана функція зберігалася після пригнічення травних ферментів; імовірно, травні ферменти не є основними чинниками, які регулюють кишкову флору [67, 79]. Крім травних ферментів, підшлункова залоза виробляє протимікробні пептиди [67, 80-82]. Зокрема, кателіцидини – невеликі протеолітично активовані пептиди, які продемонстрували активність проти бактерій, грибків і деяких вірусів [83]. Дослідження на мишах показали, що споріднений із кателіцидином протимікробний пептид відіграє важливу роль у регуляції кишкового мікробіому. Генетичні модифікації, що знижували рівні утворення цього пептиду в підшлунковій залозі мишей, спричиняли фатальний ріст бактерій у кишківнику [81]. Проте дослідження за участю людей не підтвердило різниці в рівнях цього протимікробного пептиду у фекаліях пацієнтів з ЕНПЗ та в здорових осіб із групи контролю, що може пояснюватися труднощами з відбором зразків [67]. З’ясовані функції екзокринних продуктів підшлункової залози узагальнено в таблиці.
Інший можливий механізм впливу ЕНПЗ на кишковий мікробіом полягає в надлишку продуктів харчування в кишківнику, що призводить до надмірного росту домінантних бактерій [70]. Зокрема, підвищена доступність складних вуглеводів у пацієнтів з ЕНПЗ через знижену травну активність може діяти як субстрат для певних популяцій кишкового мікробіому [67].
-
Зміни кишкового мікробіому через ЕНПЗ за різних захворювань
Важливо розуміти вплив на кишковий мікробіом різної патології, що призводить до ЕНПЗ, наприклад хронічного панкреатиту або раку підшлункової залози. Хронічний панкреатит – одна з основних причин ЕНПЗ, що асоціюється зі змінами кишкового мікробіому [68-70, 84]. Проте хронічний панкреатит часто спричинений надмірним курінням або алкоголем, які самостійно здатні змінювати кишковий мікробіом. Нещодавнє дослідження вивчало кишковий мікробіом пацієнтів із хронічним панкреатитом за допомогою секвенування гена 16S рРНК порівняно з відповідною популяцією здорових осіб групи контролю. Встановлено, що хронічний панкреатит призводив до зменшення різноманітності мікробів і збільшення кількості патогенних бактерій незалежно від екзокринної функції, яка оцінювалася шляхом визначення фекальної еластази-1 [68]. Отже, зміни кишкового мікробіому при хворобах підшлункової залози пов’язані не лише з ЕНПЗ.
Поки що дані про зміни кишкового мікробіому в пацієнтів із раком підшлункової залози обмежені. Ймовірно, в цій когорті також існує декілька чинників, які впливають на склад кишкового мікробіому, крім ЕНПЗ. Наприклад, у багатьох пацієнтів із раком підшлункової залози виникає ракова кахексія, що характеризується системним запаленням і виснаженням харчування [53]. Виявлено зв’язки між раковою кахексією та кишковим мікробіомом [85, 86].
Тому зміни в кишковому мікробіомі в пацієнтів із раком, імовірно, відрізнятимуться від змін у пацієнтів із хронічним панкреатитом, навіть у разі супутньої ЕНПЗ. Для з’ясування та розуміння змін у разі різних захворювань потрібні подальші дослідження.
-
Вплив ЗТПФ на кишковий мікробіом
Отож ЕНПЗ асоціюється з дисбактеріозом кишкового мікробіому та низкою подальших несприятливих ефектів. Тому бажано визначити стратегії, які могли б пом’якшити шкідливий вплив ЕНПЗ на кишковий мікробіом і повернути його до здоровішого стану. Одним із логічних методів у пацієнтів із раком підшлункової залози може бути ЗТПФ, яку часто не призначають, незважаючи на рекомендації британських практичних настанов призначати ЗТПФ усім пацієнтам із раком підшлункової залози [61, 62]. На тваринних моделях показано, що ЗТПФ нормалізує зміни в мікробіомі, спричинені ЕНПЗ: збільшується кількість корисних бактерій (Akkermansia muciniphila, Lactobacillus reuteri); зменшується кількість видів, пов’язаних із дисбактеріозом (Prevotella, Proteobacteria) [87, 88].
Нормалізація складу мікробіому – «ребіоз» (рис. 1Б) – зменшує запалення кишківника, покращує симптоми, пов’язані з ЕНПЗ, та запобігає зниженню харчування [69, 88]. Відповідно, ЗТПФ може бути додатковим механізмом покращення якості життя та виживання пацієнтів із раком підшлункової залози (рис. 2) [57-60]. Дослідження на тваринах свідчать, що кишковий мікробіом тварин, які отримували ЗТПФ, усе ще відрізняється від здорових тварин групи контролю [89]. Тому потрібні подальші дослідження для оцінки того, якою мірою ЗТПФ нормалізує кишковий мікробіом у пацієнтів із раком підшлункової залози та чи сприяє це покращенню клінічних результатів.
Вплив кишкового мікробіому в пацієнтів із раком підшлункової залози
-
Кишковий мікробіом і клінічні результати при раку підшлункової залози
Встановлено зв’язки між складом мікробіому та клінічними результатами в пацієнтів з АППЗ. За допомогою секвенування гена 16S рРНК продемонстровано відмінності у складі кишкового мікробіому в пацієнтів із короткостроковим і довгостроковим виживанням [21, 39]. За допомогою метагеномного секвенування видалених пухлин виявлено збільшення чисельності Acinetobacter у високоагресивному «базальноподібному» підтипі АППЗ [90]. Проте за відсутності механістичного розуміння ці висновки залишаються асоціативними, а не причинними.
-
Позакишкові ефекти кишкового мікробіому
Показано, що в пацієнтів із хворобами підшлункової залози наслідки дисбактеріозу кишкового мікробіому поширюються за межі кишкового тракту. При гострому та хронічному панкреатиті частою проблемою є колонізація панкреонекрозу та накопичень рідини патогенними бактеріями. Доведено, що в пацієнтів із хронічним панкреатитом зменшується кількість корисних видів бактерій (Faecalibacterium, Fusicatenibacter) [68, 91-93]. Вважається, що ці види бактерій відіграють протизапальну роль у товстій кишці та забезпечують кишковий бар’єр шляхом утворення коротколанцюгових жирних кислот і лактату, що зменшує ймовірність позакишкової транслокації патогенних бактерій [91-94]. Отже, зміни кишкового мікробіому можуть бути безпосередньо пов’язані з тяжкістю хвороби [68, 95].
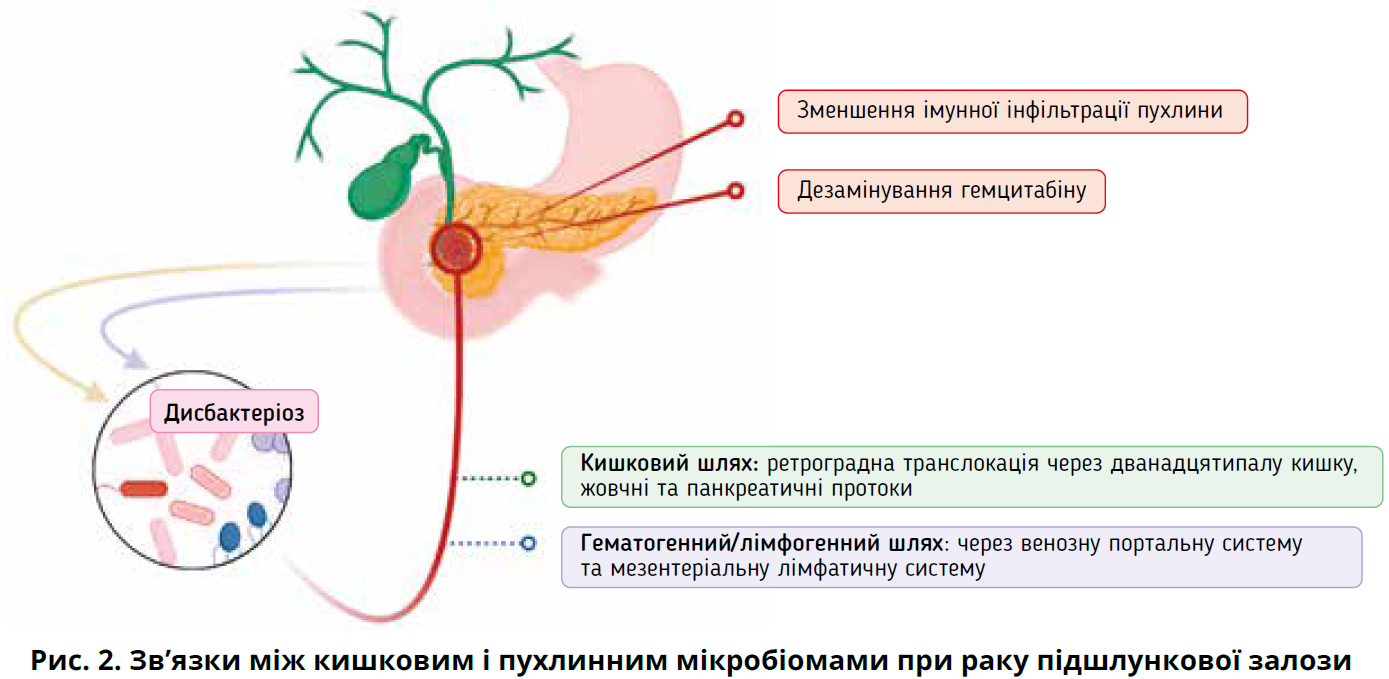
Важливо, що в пацієнтів із раком підшлункової залози сама пухлина містить популяцію бактерій – пухлинний мікробіом, який може впливати на прогноз АППЗ [21, 39, 73, 96-98]. Кишковий мікробіом впливає на склад пухлинного мікробіому при раку підшлункової залози [39]. Точний механізм цього процесу обговорюється, але можливі шляхи включають ретроградну транслокацію з кишківника через дванадцятипалу кишку та жовчні/підшлункові протоки, поширення з портального кровообігу або мезентеріальних лімфатичних вузлів (рис. 2) [20-22]. Важливість пухлинного мікробіому викликає дедалі більший інтерес [96, 99]. Установлено, що він диференціює різні фенотипи раку підшлункової залози та впливає на клінічні результати [39, 90]. Наприклад, деякі пухлини підшлункової залози колонізовані гамма-протеобактеріями, які мають ізоформу цитидиндезамінази, що метаболізує гемцитабін у неактивну форму, підвищуючи хіміорезистентність пухлини та зменшуючи ефективність лікування [21, 100, 101]. Нещодавнє велике когортне дослідження продемонструвало докази клінічної користі модулювання пухлинного мікробіому. Застосування антибіотиків перед, під час і після хіміотерапії покращувало виживання пацієнтів із метастатичною АППЗ [102]. Цікаво, що покращення спостерігалося лише в пацієнтів, які отримували гемцитабін, але не фторурацил. Отож опосередкована бактеріями резистентність до гемцитабіну переважає в пацієнтів з АППЗ і може бути мішенню для майбутньої терапії [20].
-
Пухлинний мікробіом та імунна інфільтрація
Іншим можливим шляхом впливу пухлинного мікробіому на прогноз АППЗ є місцева імуносупресія, що прискорює онкогенез [103-106]. Продемонстровано зв’язок між пухлинним мікробіомом та імунною інфільтрацією пухлини зі збільшенням кількості CD8+ Т-клітин після абляції пухлинного мікробіому антибіотиками. Крім того, перенесення відібраних бактерій із тканини АППЗ прискорило канцерогенез [103]. Це підкреслює можливість того, що покращення кишкового мікробіому за допомогою ЗТПФ може впливати на клінічні результати в пацієнтів з АППЗ. Цей зв’язок мають детально вивчити майбутні дослідження.
Діагностичні та терапевтичні застосунки для кращого розуміння кишкового мікробіому в пацієнтів із раком підшлункової залози
-
Використання досліджень кишкового мікробіому для діагностики ЕНПЗ
Зміни в мікробіомі при ЕНПЗ можна діагностувати за допомогою секвенування кишкового мікробіому в зразках калу. Частоту ЕНПЗ перед операцією важко оцінити, а ідеального діагностичного тесту поки що не існує. Точними методами вважаються секретиновий тест і коефіцієнт поглинання жиру; проте ці методи доволі дорогі та неприємні. Для рутинного використання підходить фекальна еластаза-1, але тест має низьку чутливість за легкої ЕНПЗ [107]. У разі раку підшлункової залози для діагностики ЕНПЗ традиційно використовуються комбінація симптомів, про які повідомляє пацієнт, і визначення фекальної еластази-1. Проте після резекції підшлункової залози підвищується співвідношення фекального жиру до фекальної еластази-1, що знижує чутливість тесту [107, 108]. Багатообіцяльним діагностичним інструментом стає 13С-змішаний тригліцеридний дихальний тест, але витрати та час виконання обмежують його використання лише спеціалізованими дослідницькими центрами [109, 110]. Отже, кількісна оцінка та детальне вивчення змін мікробіому відкриють нові діагностичні перспективи в пацієнтів з ЕНПЗ.
-
Титрування ЗТПФ
Зважаючи на труднощі діагностики ЕНПЗ у клінічній практиці, моніторинг відповіді на ЗТПФ є ще складнішим. Хоча NICE рекомендує розглянути можливість ЗТПФ для всіх пацієнтів після резекції підшлункової залози [61, 62], доволі складно визначити, чи отримує пацієнт правильну дозу. Можливість кількісної оцінки змін у кишковому мікробіомі під час лікування ЗТПФ у пацієнтів з ЕНПЗ дала би змогу відстежувати довгострокові тенденції на тлі терапії та корегувати дози.
-
Позитивний вплив ЗТПФ на мікробіом кишківника
За допомогою трансплантації фекальної мікробіоти від пацієнтів із короткостроковим і довгостроковим виживанням до мишей досягнуто модулювання пухлинного мікробіому, що впливало на ріст пухлини [39]. Якщо ЗТПФ здатна нормалізувати склад кишкового мікробіому пацієнтів із раком підшлункової залози, це могло би позитивно вплинути на пухлинний мікробіом. Як указувалося вище, чисельність Acinetobacter асоціювалася з агресивними «базальноподібними» пухлинами [90].
На тваринній моделі у свиней кількість Acinetobacter у кишковому мікробіомі зменшувалася після ЗТПФ [87]. Потенційна здатність ЗТПФ модулювати кишковий і пухлинний мікробіоми може бути важливим визначальним чинником клінічного результату та заслуговує на ретельніше дослідження.
-
Напрями подальших досліджень і висновки
Цілком імовірно, що кишковий мікробіом пацієнтів із раком підшлункової залози й ЕНПЗ демонструє глибокий дисбактеріоз, що може покращуватися або нормалізуватися під впливом ЗТПФ. Проте для остаточних висновків потрібні подальші дослідження, спрямовані на з’ясування конкретних змін, які відбуваються в пацієнтів із раком підшлункової залози й ЕНПЗ. Імовірно, в цій когорті зміни кишкового мікробіому відрізнятимуться від змін у пацієнтів із доброякісними причинами ЕНПЗ, як-от муковісцидоз або хронічний панкреатит. Важливо також дослідити, чи кишковий мікробіом пацієнтів із раком підшлункової залози й ЕНПЗ нормалізується під впливом ЗТПФ. Потрібно визначити, чи добавки пробіотиків або трансплантація фекальної мікробіоти впливають на склад кишкового мікробіому та дають користь пацієнтам із раком підшлункової залози [111].
Варто вивчити та зрозуміти наслідки дисбактеріозу кишкового мікробіому в пацієнтів із раком підшлункової залози й ЕНПЗ. Майбутні дослідження мають бути спрямовані на порівняння кишкового та пухлинного мікробіомів у цій когорті залежно від наявності чи відсутності ЕНПЗ. Потрібно додатково дослідити взаємодію між кишковим мікробіомом та імунною системою в цій когорті шляхом оцінки стану периферичного імунітету до та після лікування ЗТПФ. Окрім того, можна порівняти імунну інфільтрацію пухлини після резекції з кишковим мікробіомом за ступенем екзокринної функції та/або залежно від застосування ЗТПФ. Шляхом моніторингу відповіді на неоад’ювантну хіміотерапію за допомогою рівнів Ca19-9, радіологічної відповіді або оцінки регресії пухлини резектованих зразків варто дослідити, якою мірою кишковий мікробіом впливає на хіміочутливість у пацієнтів із раком підшлункової залози та чи мають на це вплив ЕНПЗ та ЗТПФ.
Установлено, що за відсутності лікування ЕНПЗ несприятливо впливає на пацієнтів із раком підшлункової залози, а ЗТПФ покращує клінічні результати. Ймовірно, це пов’язано з покращенням харчового статусу, що дає змогу більшій кількості пацієнтів пройти фізіологічно складне лікування. Проте, можливо, застосування ЗТПФ для корекції ЕНПЗ у цій когорті покращує склад кишкового мікробіому, що може модулювати пухлинний мікробіом, безпосередньо впливаючи на ріст пухлини та якість імунної відповіді. Вивчення впливу ЕНПЗ та ЗТПФ на кишковий мікробіом пацієнтів із раком підшлункової залози дуже важливе для відкриття нових перспектив діагностики та лікування цієї хвороби.
Література
Halle-Smith J.M., Hall L.A., Powell-Brett S.F., Merali N., Frampton A.E., Beggs A.D., Moss P., Roberts K.J. Pancreatic exocrine insufficiency and the gut microbiome in pancreatic cancer: a target for future diagnostic tests and therapies? Cancers (Basel). 2023 Oct 25; 15 (21): 5140. doi: 10.3390/cancers15215140.
PMID: 37958314; PMCID: PMC10649877.